过度疲劳状态下运动性猝死大鼠甲状腺功能的变化
钱 钰,李 华,殷维瑶
过度疲劳状态下运动性猝死大鼠甲状腺功能的变化
钱 钰1,李 华2,殷维瑶2
目的:为研究过度疲劳状态下大鼠甲状腺功能的变化情况,进一步探索“心源性”运动性猝死与甲状腺功能的关系。方法:将130只雄性SD大鼠,随机抽取7只作为空白对照组,其余大鼠进行力竭性负重游泳训练至过度疲劳,对运动性猝死大鼠即刻取材进行以下测定:1)甲状腺组织常规H.E.染色;2)ELISA检测血清三碘甲状腺原氨酸(甲状腺素,T3)、四碘甲状腺原氨酸(甲状腺素,T4)、促甲状腺激素(TSH)含量3、免疫组化方法检测心肌凋亡与凋亡抑制因子Bax与Bcl-2的含量。结果:运动性猝死组大鼠甲状腺滤泡淡染,细胞间质疏松,部分滤泡胶质出现大量空泡;猝死组血清中T3、T4含量明显高于对照组(P<0.05),且显著低于疲劳组(P<0.01),TSH含量明显高于对照组(P<0.05),且显著低于疲劳组(P<0.01);免疫组化可见过度疲劳状态下大鼠心脏组织Bax蛋白含量升高,具有统计学意义(P<0.05),大鼠心脏组织Bcl-2蛋白含量明显降低,具有非常显著的统计学意义(P<0.01)。结论:1)长期大强度运动导致过度疲劳,甲状腺形态结构发生病理性改变;2)过度疲劳不断累积导致甲状腺功能紊乱,TSH、T3、T4分泌异常,从而引起机体运动过程中代谢紊乱、能量供应不足并器官衰竭,可能诱发运动性猝死;3)运动性猝死是多器官多系统交互作用的结果,甲状腺功能紊乱引起心脏结构功能改变可能诱发“心源性”运动猝死。
运动性猝死;甲状腺滤泡;过度疲劳;糖酵解
1 材料和方法
1.1 实验材料
纯种雄性SD大鼠130只,购自成都达硕生物科技有限公司,SPF级,4月龄,每笼6只,标准啮齿类动物饲料喂养,自由摄食、饮水,动物房室内温度20℃~28℃,相对湿度55%~65%,自然光照。保持动物房安静、通风。每天上午换清洁饮水、填食、打扫鼠笼,并对笼具底盘和大鼠的排泄物进行终末处理。
1.2 实验分组
随机抽取7只大鼠为空白对照组(N组),其余大鼠按要求进行负重游泳训练,游泳训练至大鼠放入水缸游泳1次休息后再次放入即下沉时实验结束,疲劳造模达到超量恢复负叠加状态后第3个36 h训练后随机处死7只大鼠作为疲劳组(C组)*36 h超量恢复区间是指以1周为训练单元,按照小-中-大-小-中-大双周期训练模式,机体机能各项指标均出现超量恢复的最佳时间段为36 h左右。,在疲劳造模达到超量恢复负叠加状态后每次训练过程中或训练结束24 h内出现的死亡的大鼠(排除因呛水死亡的大鼠)记为运动性猝死组(D组)。
1.3 动物模型的建立
实验组大鼠先在50×50×100 cm的透明玻璃缸中进行适应性负重游泳1周,水温为31℃±2℃,室温控制在21℃~23℃,相对湿度为40%~60%,水深为大鼠(身长+尾长)×1.5倍,逐步增加负重到大鼠体重的12%并连续游泳2 min以上;第2周按照殷劲等[18]的糖酵解供能运动疲劳模型进行疲劳造模,负重为大鼠体重的12%,大鼠按大(每组4次)中(每组3次)小(每组2次)运动量游泳,每天上、下午各两组,次间休息5 min,组间休息15 min;大鼠每次游泳的时间以大鼠游至鼻孔沉入水面下为准[18]。造模结束后大鼠按每36 h 1次大运动量(2组,每组4次,负重12%体重)进行游泳,当游至第7个36 h后大鼠的运动能力恢复呈现负叠加状态,恢复能力逐渐下降,疲劳不断积累[17]。在第7个36 h的游泳周期后实验人员轮流在实验室值守,游泳训练至大鼠放入水缸游泳1次休息后再次放入即下沉时实验结束;在运动中或运动后24 h之内发现死亡的大鼠(排除因呛水死亡的大鼠)即刻取材并归为运动性猝死组(D组)。整个实验过程中共出现5例运动性猝死大鼠(表1)。

表 1 大鼠游泳训练安排Table 1 Swimming Training Rats Arrangement
1.4 标本的采集
即刻取猝死大鼠股动脉混合血5~8 ml,静置30 min后, 3 000 rpm/min离心15 min,取上清液用于T3、T4、TSH检测。之后,仰卧位沿颈部正中线纵行切开约2 cm,完全摘除大鼠甲状腺与心脏组织,冷生理盐水冲洗后,滤纸吸干,置于10%中性甲醛溶液中固定,用于制作切片[35]。空白对照组大鼠先用0.3%戊巴比妥钠溶液以40 mg/kg腹腔注射麻醉,用同样的方法先取血制备血清,然后迅速取出完整的甲状腺组织置于10%中性甲醛溶液中固定24 h,固定2 h后更换1次溶液。
1.5 切片与血清检测
1.5.1 常规 HE染色
取出在10%中性甲醛溶液中固定好的甲状腺组织,用流水冲洗残留的固定液;沿横断面从正中将腺体切下之后依次放入70%,80%,90%,95%,无水酒精中脱水;脱水之后用二甲苯透明,浸蜡,包埋于石蜡中,蜡块置于4℃冰箱中待用。从冰箱中取出包埋好的蜡块,沿横截面连续作4 μm切片。经二甲苯、梯度酒精脱蜡至水,苏木素-伊红染色,封片后在光镜下观察甲状腺滤泡上皮细胞形态结构及细胞间质的变化。
1.5.2 血清酶联免疫检测T3、T4、TSH
采用双抗体酶联免疫吸附试验(ELISA),往预先包被大鼠甲状腺T3、T4、TSH捕获抗原的包被微孔中依次加入待测样本血清、不同浓度的标准品、辣根过氧化物酶(HPR)标记的检测抗体,经过37℃恒温箱温育60 min后彻底洗涤。用底物TMB显色,TMB在过氧化物酶催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的大鼠甲状腺T3、T4、TSH呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),计算出样品浓度。
生化指标分别在成都体育学院附院检验科和四川大学华西医院实验医学科生化室检测。
1.5.3 免疫组化
取出在10%中性甲醛溶液中固定好的心脏组织,用流水冲洗残留的固定液;切除心尖部分后取心脏左心室依次放入70%、80%、90%、95%,无水酒精中脱水;脱水之后用二甲苯透明,浸蜡,包埋于石蜡中,蜡块置于4℃冰箱中待用。从冰箱中取出包埋好的蜡块,沿额状面连续作4 μm切片。采用免疫组化SP(streptavidin-peroxidase,SP)染色法标记Bax与Bcl-2的表达情况。所使用的一抗为大鼠Bax与Bcl-2单克隆抗体浓缩0.1 ml(购自美国abcam公司)。将Bax与Bcl-2的两张切片依次经脱蜡至水,PBS液冲洗,3% H2O2室温孵育,PBS液冲洗,5%正常羊血清封闭,滴加一抗4℃孵育24 h,滴加二抗37℃孵育10 min,滴加链霉菌抗生物蛋白-过氧化物酶溶液孵育,PBS液冲洗,DAB显色,自来水流水冲洗、苏木素复染,梯度酒精脱水、二甲苯透明、树胶封片。上述免疫组化染色结束后通过光镜观察、采图,使用Image pro-Plus图像分析软件分析Bax、Bcl-2蛋白表达情况。
1.6 统计学方法

2 结果
2.1 甲状腺HE染色结果
HE 染色结果显示,N组滤泡上皮细胞排列紧密,未见异常;C组可见部分滤泡淡染,而D组除部分滤泡淡染,还可见细胞间质疏松,部分滤泡胶质出现大量空泡(图1)。
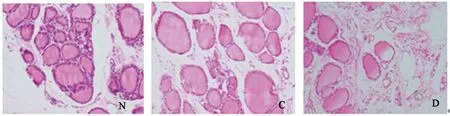
图 1 疲劳组(C)、猝死组(D)、与空白对照组(N)甲状腺滤泡细胞的形态学比较(200 K)Figure 1. Fatigue Group(C), Sudden Death Group(D), Blank Control Group(N),Thyroid Follicular Cells Comparative Morphological(200X)
2.2 血清T3、T4检测结果
血清检测结果显示(表2、表3),C组与D组血清中T3、T4含量均高于N组(图2、图3),其中,D组较C组含量有所降低。与N组相比,D组T3、T4含量显著升高(P<0.05),具有统计学意义。

表 2 大鼠血清检测结果显示T3含量的组间差异Table 2 Serum Test Results Showed that the Content of the Group Differences between T3
注:*与N组比较,P<0.05,下同。

表 3 大鼠血清检测结果显示T4含量的组间差异Table 3 Serum Test Results Showed that the Content of the Group Differences between T4
注:**与N组比较,P<0.01,下同。

图 2 N组、C组、D组血清中T3含量变化趋势Figure 2. Group C,N,D,T3 Serum Content Gradually Decreasing Trend
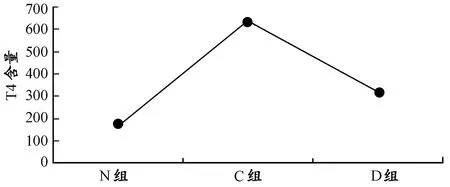
图 3 N组、C组、D组血清中T4含量变化趋势Figure 3. Group C,N,D,T4 Serum Content Gradually Decreasing Trend
2.3 血清TSH检测结果
血清检测结果显示(表4), N组血清中TSH含量较低,C组与D组血清TSH含量较高(图4)。同时,C组较N组显著升高(P<0.05),D组血清中TSH的含量低于C组,与N组相比显著升高(P<0.05)。

表 4 大鼠血清检测结果显示TSH含量的组间差异Table 4 Serum TSH Test Results Showed Levels between-group Differences

图 4 N组、C组、D组血清中TSH含量的变化趋势Figure 4. Group N,C,D Trends in Serum Levels of TSH
2.4 免疫组化检测心肌组织Bax、Bcl-2表达量
2.4.1 Bax促进细胞凋亡基因表达量变化
由图6可见,N组的Bax阳性表达较C组与D组弱,SPSS软件处理后如表5统计结果显示,与空白对照组相比,猝死组D组大鼠心脏组织Bax蛋白含量明显升高,具有非常显著的统计学意义(P<0.01),疲劳组C组大鼠心脏组织Bax蛋白含量升高,具有统计学意义(P<0.05);3组之间的表达量呈递增关系(图5)。

表 5 大鼠心肌组织Bax蛋白表达量Table 5 Bax Protein of Cardiac Muscle Test

图 5 N组、C组、D组Bax蛋白表达均值图Figure 5. Bax Protein of Cardiac Muscle Test in N、C、D Group
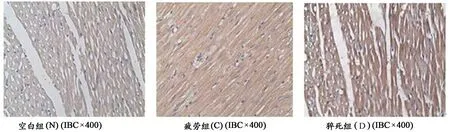
图 6 大鼠心肌组织Bax表达免疫组化染色(400×)Figure 6. Cardiac Muscle Bax Protein of Immunohistochemistry Stain in Rats
2.4.2 Bcl-2抑制细胞凋亡基因表达量变化
由表6统计结果显示,与空白对照组相比,疲劳组、猝死组大鼠心脏组织Bcl-2蛋白含量明显降低,呈递减趋势(图7),具有非常显著的统计学意义(P<0.01)。由图8可见,N组的Bcl-2阳性表达较C组与D组高。
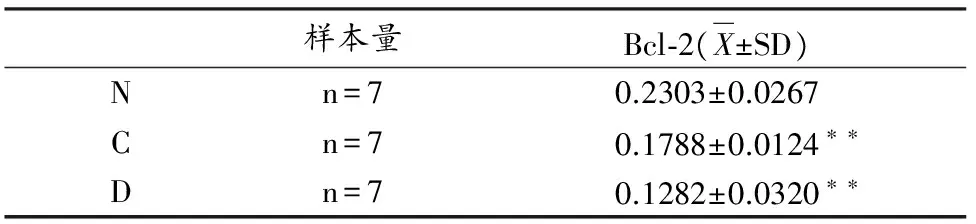
表 6 大鼠心肌组织Bcl-2蛋白表达量Table 6 Cardiac Muscle Bcl-2 Protein Tests
3 分析与讨论
3.1 甲状腺滤泡细胞形态结构的变化
甲状腺是人体最大的内分泌腺。甲状腺由约3百万个直径为15~500 μm的滤泡所组成,滤泡腔内充满胶状质[11]。甲状腺激素TH由滤泡上皮细胞合成,在甲状腺球蛋白(TG)上形成的甲状腺激素在滤泡腔内以胶状质的形式储存,可以保证机体的代谢需求[5]。

图 7 N组、C组、D组Bcl-2蛋白表达均值图Figure 7. Average of Bcl-2 Protein Tests in N、C、D Group Tests
由实验猝死组甲状腺滤泡上皮细胞HE染色结果可见,猝死组D组出现滤泡淡染,胶质空泡。甲状腺滤泡由单层上皮细胞围成,滤泡上皮细胞合成的TG和活性碘释放入滤泡腔内,形成碘化甲状腺球蛋白(即胶体)贮存在腔内,机体需要时,上皮细胞再摄取腔内的胶质,促使碘化甲状腺球蛋白分解成为甲状腺素,从细胞基部释放入血[6]。大鼠剧烈运动时刺激甲状腺,甲状腺上皮细胞滤泡腔内碘化甲状腺球蛋白大量分解,生成甲状腺激素,促进代谢,增加产热和耗氧,为运动提供能量[1]。因此,在运动过程中甲状腺激素分泌会不断增加,但随着长时间大强度运动的继续,伴随着疲劳的产生,一方面储存在滤泡腔内的碘化甲状腺球蛋白被大量分解,转化为甲状腺素,血液中甲状腺素含量升高;另一方面被分解的球蛋白没有得到及时补充,导致滤泡腔内胶质空泡形成[4]。说明了过度疲劳导致运动性猝死的过程中,甲状腺细胞结构遭到严重破坏,碘化甲状腺球蛋白被大量分解引起甲状腺激素分泌增加[21]。甲状腺激素分泌的大量增加,进一步导致机体能量代谢紊乱,加重疲劳。
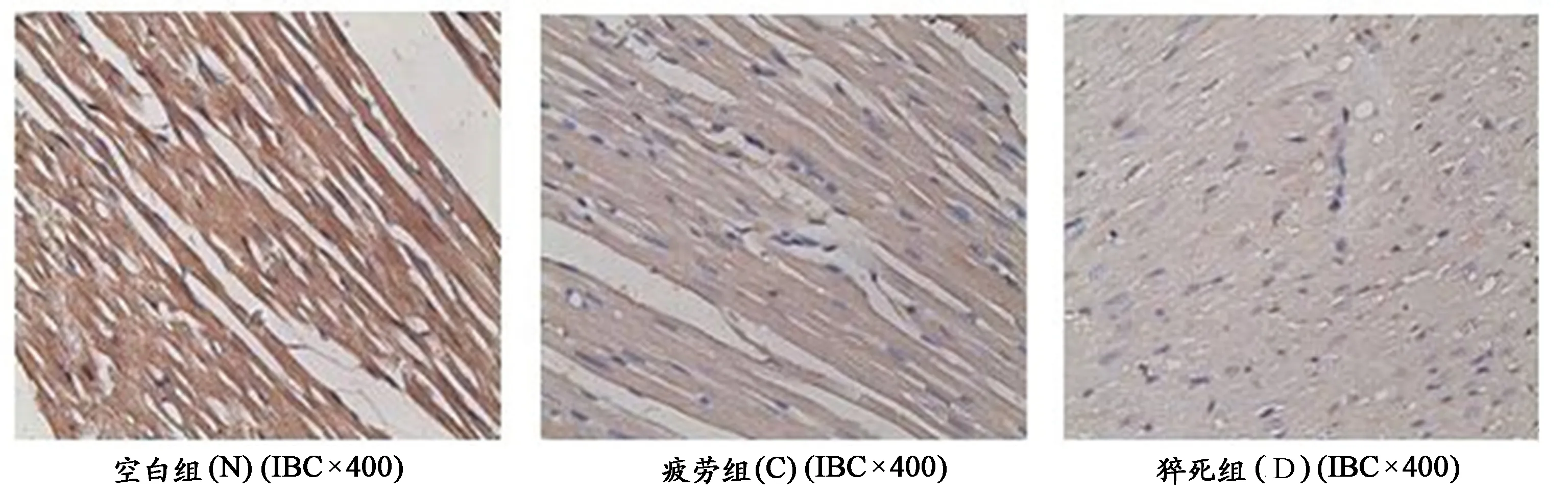
图 8 大鼠心肌组织Bcl-2表达免疫组化染色(400×)Figure 8 Cardiac Muscle Bcl-2 Protein of Immunohistochemistry Stain in Rats
3.2 血清甲状腺素T3、T4的变化
剧烈运动过程中,机体各器官、组织耗氧量迅速增加以提供运动时所需要的能量[12]。甲状腺分泌的TH可以加速线粒体的呼吸,提高大多数组织的耗氧量,促进Na+-K+-ATP酶活性,增加产能。在运动过程中增加产热量的TH主要是T4,据测量,1 mgT4可增加产热1 000 kCal,其效果十分显著[34]。同时,T3、T4均可促进糖、脂肪、蛋白质、电解质等物质代谢。使糖的代谢速率加快,加速糖的吸收、利用,以及糖原的合成与分解,加速脂肪代谢,增加蛋白质合成,为各个器官系统正常运作提供物质保障[16]。运动员甲状腺功能的改变被认为是一种耐受能力的适应性机制,这种适应性机制可使能量的摄取和消耗趋于平衡[19]。本实验模型是以糖酵解供能为主的大强度运动训练,在运动过程中,需要消耗大量能量,运动刺激TH分泌增加,加快糖、蛋白质等物质的消耗,为机体提供能量[32]。在短时间剧烈运动的过程中,机体处于无氧状态,糖无氧酵解产生大量乳酸,随着T3、T4浓度增加,糖无氧酵解增强,使乳酸大量聚集,从而导致酸碱失调,pH下降。pH下降是H+浓度的客观反映,H+浓度升高,抑制了钙活化原肌凝蛋白的ATP酶,使肌肉收缩能力下降,出现疲劳[35]。然而pHH值降低时,磷酸果糖激酶的活性被抑制,从而使机体获取能量出现障碍。同时pHH值降低,使磷酸化酶b转化成磷酸化酶a被抑制,而磷酸化酶a是糖酵解的关键酶,因此糖代谢出现障碍[10]。进一步引起机体代谢紊乱。由于代谢紊乱,酸性物质大量生成,碱性物质被大量消耗,反过来抑制H+浓度的排出,引起器官、系统酸中毒,甚至器官衰竭[28]。
T3、T4还能促进体内蛋白质代谢,蛋白质代谢以氨基酸为核心,氨基酸在代谢过程中经过联合脱氨作用,产生大量的毒性物质氨,而剧烈运动时快肌纤维在短时间内剧烈收缩,氧化糖酵解纤维产生大量的氨,运动越剧烈快肌糖酵解纤维募集越多,氨的生成就越多[27,29]。当血氨浓度升高后,使糖酵解的速率减少50%,乳酸生成增加,同时降低了丙酮酸的利用和减少摄氧量,使机体能量代谢受到严重影响[30]。高浓度的T3还抑制蛋白质的合成,蛋白质一方面被大量消耗,一方面合成被抑制,进一步加重了组织、细胞能量供应障碍[33]。同时,氨的增加反过来抑制肌纤维张力,出现疲劳,血氨升高可以引起疲劳已被证实。实验结果显示,疲劳组和猝死组的甲状腺滤泡上皮细胞发生形态学改变,猝死组有明显的病理性改变,导致甲状腺激素分泌异常,疲劳组其血清中T3、T4含量较空白对照组显著升高,因此,过度疲劳引起的代谢紊乱导致甲状腺结构和功能的改变,而甲状腺结构和功能的改变又进一步影响糖、脂肪、蛋白质的正常代谢,使疲劳进入负叠加状态,机体出现代谢障碍[24]。猝死组T3、T4含量低于疲劳组,说明了机体代谢障碍对甲状腺结构功能造成不可逆的影响,TH分泌减少,加重组织、器官衰竭,最后出现猝死。
此外,对于剧烈运动致过度疲劳出现运动性猝死,“心源性”运动性猝死更为多见,而心脏是甲状腺激素最重要的靶器官[8]。TH可使心率增快,心收缩力增强,心输出量和心作功增加[15]。TH中的T3、T4还可直接作用心脏血管平滑肌,扩张冠状动脉。在甲状腺中T4由两个二碘甲腺原氨酸(DIT)合成,T3除了一部分直接由一个DIT和一个MIT(一碘甲腺原氨酸)合成外,大部分由T4转化,因为T4的主要代谢途径是转化为T3。因此,当甲状腺结构功能发生异常改变时,最直接影响的是T4的合成[16],而T4浓度的改变又进一步影响T3含量。高浓度的T4会促进T4向T3转化,T3 可增加心肌细胞腺苷酸环化酶的活性,使第二信使cAMP 生成增加,并以cAMP 为媒介物进行信息传递,激活与心肌收缩有关的蛋白质,增强心肌的收缩力[21]。研究发现,甲状腺激素不但可与心肌细胞核内受体结合,调节心肌细胞中与增强心肌收缩有关的特异性基因表达,还可通过心肌细胞膜和肌浆网完成对心肌的急性作用[22]。有研究认为甲状腺激素的运动性变化,对机体心肌有不良影响。力竭运动时,甲状腺激素升高可引起血清中T4含量的增加并大量转化为T3,造成微管蛋白磷酸化,引起心肌损伤。当T3水平升高时,大量的ATP分解供能,导致心肌能源耗竭,继而引起心力衰竭,同时线粒体产生更多的氧自由基造成对心肌造成损害[2]。
由此可见,甲状腺激素代谢的变化在心功能调节中具有重要作用[9]。力竭运动可造成心肌损伤而导致运动性疲劳发生的事实已被证实[13]。本实验的疲劳组和猝死组中,甲状腺滤泡细胞形态机构的病理学改变导致T4分泌增加并大量转化为T3,直接或间接影响了与心肌收缩有关的信号分子的正常表达,甲状腺激素作用于心脏,使心肌代谢加速,心肌缺氧和营养物质缺乏,甚至出现心力衰竭[3]。过度疲劳导致T3、T4合成与分泌增加,导致甲状腺激素的增加,影响了心肌细胞的正常功能,致使动脉管壁过分舒张,增加心脏负荷,可能是产生运动性猝死的原因之一。
3.3 血清TSH的变化及其影响
促甲状腺激素(TSH)由垂体的促甲状腺细胞合成和分泌。TSH可迅速诱导甲状腺细胞-胶质界面产生伪足,加速甲状腺球蛋白(TG)的吸收,使胶质含量减少。TSH的分泌受下丘脑TRH细胞分泌的TRH(促甲状腺释放激素)调节,TRH可以促进腺垂体TSH细胞的功能。TRH由焦谷氨酸-组氨酸-脯氨酰胺组成,通过cAMP-PK系统而发挥生物学作用。TRH神经元接受中枢神经系统其他部位的调控,这些部位的神经元将环境刺激与TRH神经元网络起来,并借TRH神经元与腺垂体建立神经-体液调节联系。当受到外界刺激时,例如运动、寒冷刺激,信息传递到中枢神经系统神经后,一方面传递到下丘脑,另一方面又立即传递到附近的TRH神经元,使TRH分泌增多,进而增加TSH的分泌,血T3、T4随之升高[26]。在病理情况下,原发性的甲状腺激素分泌减少会反过来影响TSH的合成与分泌。当血液中游离的T4降低时,T4与TSH细胞核特异性受体的结合量减少,产生“兴奋性蛋白”,导致TSH的合成与释放增加[20],同时对TRH的反应性降低。
本实验结果显示,猝死组D组血清TSH含量高于N组,由HE染色可观察到D组甲状腺滤泡细胞产生胶质空泡,其原因可能是TSH分泌增加促进了TG分解所致。实验结果发现,C组与D组血清中TSH含量均高于N组,可能是由于运动刺激导致下丘脑分泌的促甲状腺释放激素(TRH)增多,进而增加TSH的分泌,T4随之升高[23]。TSH 的作用是促进TH 的合成与释放。力竭运动可刺激下丘脑释放TSH 增多,TSH 促进甲状腺激素分泌增加[21],TSH的分泌一方面受到TRH的正反馈调节,另一方面受T4对TSH细胞的负反馈调节,实验结果显示,剧烈运动刺激甲状腺导致T3、T4合成与分泌增加,高浓度的T3、T4对TSH产生负反馈调节作用抑制垂体释放TSH,因此TSH含量又逐渐降低。T4的负反馈和TRH的兴奋作用是相互拮抗、相互制约的,共同调节TSH的释放量[5]。
3.4 心肌细胞Bax、Bcl-2蛋白表达的变化
力竭运动导致机体过度疲劳时,由于运动负荷过大,超过机体的承受能力,会导致器官受损。心脏损伤是最常见的力竭性器官损伤之一,可以表现为心肌细胞凋亡基因、心肌形态结构、心脏生化、心脏电生理等方面[14]。过度疲劳时心脏损伤会导致心肌酶异常、心律失常、心功能降低,出现运动性猝死。心肌细胞过度凋亡是心肌细胞损伤的方式之一,应激导致的心肌细胞损伤与细胞过度凋亡有关[33]。有研究发现,运动性心脏肥大的早期发生心肌细胞凋亡,随后凋亡现象消失出现肥大。因此可以认为,由运动刺激引起的心肌肥大,可能与心肌细胞发生凋亡,随后进入细胞增殖有关。心律失常和完全传导阻滞的突然发生会导致猝死,James认为心肌细胞凋亡参与了窦房结、房室结、希氏束的形态重建过程,重建不完全或重建过度造成的传导阻滞异位残留或破坏是引起心律失常和传导阻滞的重要原因[7]。
Bcl-2和Bax蛋白,分别具有抑制和促进细胞凋亡的功能,在细胞凋亡的调控发生中发挥重要的调节作用。分布于线粒体外膜上的Bcl-2蛋白通过稳定线粒体膜,防止线粒体内促进凋亡相关蛋白泄漏至胞质及阻断Ca+从内质网释放,使依赖Ca+的核酸内切酶活性降低等途径阻断细胞凋亡[31]。Bax为Bcl-2相关蛋白,可与抗凋亡蛋白Bcl-2形成异源二聚体,抑制Bcl-2的作用,从而能促进细胞凋亡,因此,Bax是细胞凋亡的重要调控基因。
研究结果显示,猝死组心肌Bax蛋白表达量较空白组显著增加,而Bcl-2蛋白表达量显著降低。说明过度疲劳状态下大鼠心肌细胞凋亡速率加快,细胞凋亡出现心肌梗塞,随后在梗塞区出现细胞纤维溶解坏死。细胞凋亡虽然能清除损伤或坏死的细胞,对保持细胞自身稳态有一定的积极作用,但心肌是终末分化的细胞,不具增殖能力,其凋亡必然导致心肌细胞数量的减少。运动中,心腔血液充盈增加,心输出量加大,心肌细胞受到的牵张加剧,心肌组织相对平时缺血缺氧,引起细胞凋亡。长期过度运动,机体处于过度疲劳负叠加状态,心肌细胞凋亡增加,可能是早期运动性心肌损伤的机制之一[25]。
4 结论
糖酵解供能下大鼠剧烈运动致过度疲劳时,甲状腺形态结构发生改变,引起甲状腺功能的剧烈变化,导致T3、T4分泌显著增加,从而出现机体疲劳时的代谢紊乱,破坏机体的内环境稳态,同时引起心肌细胞的功能异常,而机体的物质和能量代谢紊乱以及心脏功能的异常,加速心肌细胞的凋亡,反过来进一步加重疲劳,可能导致器官衰竭,同时对心脏造成不可逆的病理性改变,从而诱发运动性猝死。因此,初步推测甲状腺滤泡上皮细胞的病理学改变及T3、T4分泌异常升高可能是导致运动性猝死的原因之一。对于甲状腺结构功能异常与“心源性”猝死的关系还有待进一步研究。
[1]陈灏珠.实用内科学[M].北京:人民卫生出版社,1998:1027-1028.
[2]陈筱春,文质君,朱梅菊.Bcl-2、Bax和Caspase-8在大运动量大鼠心肌组织中表达及壳寡糖的干预作用[J].中国体育科技,2008,44(5):117-120.
[3]陈元武.剧烈运动对人体代谢的影响[J].湖北体育科技,1994,53(4):32-35.
[4]迟素敏,裴建明,刘亚莉,等.内分泌生理学[M].西安:第四军医大学出版社,2006:170-173.
[5]段玉斌,马恒.内分泌生理学[M].西安:第四军医大学出版社,2006:177-178.
[6]何天培,顾景范,高兰兴.牛磺酸对应激大鼠甲状腺激素代谢的影响[J].营养学报,1998,20(4) :413- 415.
[7]黄宛.临床心电图学[M].北京:人民卫生出版社,1998:1-25.
[8]黄先玫,康曼丽.甲状腺素与心血管疾病[J].国外医学(心血管疾病分册),2009,27(4) :199- 201.
[9]经承学,周春.猝死与遗传代谢病[J].实用儿科临床杂志,2010,25(8):537-539.
[10]经承学.遗传代谢病[J].实用儿科临床杂志,2007,22(8):567-568.
[11]李豪侠,吴晓强.老年恶性肿瘤患者血清甲状腺激素检测的意义[J].浙江中西医结合杂志,2006,16(7):415-418.
[12]钱宁,杨艳宁.有机酸代谢障碍的研究进展[J].中国优生与遗传杂志,2003,11(4):6-8.
[13]徐昕,高崇玄,张丽申,等.我国运动猝死调查研究[J].中国运动医学杂志,2009,18(2):99-102
[14]朱磊,刘洪珍.运动性猝死的原因及其干预[J].中国临床康复,2005,9(8):169-172.
[15]王晓伟,曹雪滨,侯聪聪,等.某战区作训人员力竭性心脏损伤的临床研究[J].中国中西医结合急救杂志,2013,20(5):270-274.
[16]谢敏豪,冯伟权,严翊.运动内分泌学[M].北京:北京体育大学出版社,2008:84-87.
[17]殷劲,蒋丽,刘钦龙.超量恢复的运动生理研究进展[M].成都:电子科技大学出版社,2012:47-63.
[18]殷劲,岳建兴,周进,等.糖酵解供能运动后“超量恢复区间”的研究[J].成都体育学院学报,2007,33(4):88-91.
[19]张洪海,钱风雷,王晨.运动与甲状腺激素反应研究进展[J].体育科研,2008,29(2)31-35.
[20]张镜如,乔健天.生理学[M].北京:人民卫生出版社,1997:387-393.
[21]张钧,童昭岗,黄叔怀.力竭运动对甲状腺激素代谢的影[J].西安体育学院学报,2012,19(1):24-26.[22]张 钧,许豪文,黄叔怀,等.力竭运动对大鼠心肌线粒体游离钙及磷脂酶A2的影响[J].中国运动医学杂志,2008,17(1):26-27.[23]ADACHI A S,KURACHI Y.Stem cells by promoting new myocardial angiogenesis and repair the scar[J].Circ Res ,2010,107(7):913-916.
[24]ANFDISEN J,MOORE V D,CLINE J M,etal.Mitochond rial trifunctional protein defects:Molecular basis and novel therapeutic app roaches[J].Curr Drug Targets Immune Endocr Metab Disord,2005,5(1):27-40.
[25]ANGLE B,BURTON B K.Risk of sudden death and acute life- threaten ingevents in patients with glutaric acidemia type[J].Mol Genet Metab,2008,93(1):36-39.
[26]BURACK R,EDOARDS R H T,GRUN,etal.The response to exercise before and afer treatment of myxedema with thyroxine[J].Pharm Exp Ther,2000,176(2):212-218.
[27]CARACCIO N,SANSONE C,LAUGHLIN M H,etal.Muscle meta bolism and exercise tolerance in sub clinical hypothyroidism:a controlled trial of levothyroxine [J].Clin Endocrinol Metab,2005,90(7):4057-4062.
[28]GYGAX M J,ROULET P E,MEAGHER V K,etal.Sudden unexpected death in an infant with L-2-hydroxyglu taricaciduria[J].Eur J Pediatr,2009,168(8):957-962.
[29]HEALD D E.Influence of ammeniu ions on mechanical and electrophysiological response of skeletal muscle[J].AM J Physical.1975,229(6):1174-1175.
[30]HOLTZHANSEN L M,NOAKE T D.The prevalence and significanceof post- exercisehypotension ultramarathon runners[J].Med Sci Sports Exerc,1995,189(27):1595-1599.
[31]JAMES T N.Congenital disorders of cardiac rhythm and conduction[J].Cardiovase Elcctrophysiol,2003,4(6):702-704.
[32]MCALLISTER R M,SANSONE J C,LAUGHLIN M H.Effects of hyperthyroidism on muscle blood flow during exerise in the rat[J].Am J Physiol,1999,268(2):330-335.
[33]MERTENS H J,HEINERMAN M J,EVERS J L.The expression of apoptosis-related proteins Bcl-2 and Ki67 in endometrium of ovulatory menstrual cycles[J].Gynecol Obstet,2012,53(4):224-230.
[34]MOGUL H R,PETERSON S,WEINSTEIN B I,etal.Long-term(2-4 year)weight reduction with metformin plus carbohydrate-modified diet in euglycemic,hyperinsulinemic,midlife women(Syndrome W)[J].Heart Dis,2003,5(6):384-392.
[35]TERJUNG R L.Plasma thyroxine and thyroid stimulating hormone levels during sub maximal exercise in human[J].Am J Physiol,1971,220(6):1840-1845.
Changes of Rat Thyroid Function Related to Sudden Death under Overfatigue
QIAN Yu1,LI Hua2,YIN Wei-yao2
Objective:To study the changes of thyroid function of exercise related sudden death in rats under overfatigue and explore the relationship between the exercise “cardiac”sudden death and thyroid function preliminarily.Methods:Total 130 male SD rats were used in the experiments.7 rats were randomly selected as negative control group.The rest 123 rats were trained continuously with exhaustive loaded-swimming exercises to achieve the over fatigue state.The training cycle was 36 hours.Collect the rats suffering sudden death during and after exercise within 24 hours and drew their materials immediately for further measurement as follows.1) Observe the morphological and structural changes of thyroid tissue by H.E staining 2) Detect the level of serum thyroid stimulating hormone(TSH) and thyroid hormone(T3、T4) by ELISA.3) Immunohistochemical to detection the content of myocardial apoptosis gene(Bcl-2) and pro-apoptotic genes(Bax).Results:Compared with the fatigue group and negative control group,sudden death group showed apparent histological and biochemical changes as follows.:1) Exercise sudden death group rat thyroid follicular lightly stained,stromal cells loose,some follicular colloid large number of vacuoles.2) The level of serum T3,T4 in fatigue group and sudden death group increased dramatically compared with negative control groups.(P<0.05),the sudden death group just a little bit lower than fatigue group.3)The level of serum TSH in sudden death group was slightly higher than negative control group(P<0.05)and lower than that in fatigue group.4) In group C,D,Bax protein content showed a progressive increase trend,compared with the N group were significant differences(P<0.05):in group C,D,Bcl-2 protein content showed a decrease trend,compared with the N group,the difference was very significant(P<0.01).Conclusions:1) long-term high-intensity training,conduce to over fatigue,thyroid morphology and structure occurs pathological changes.2) fatigue accumulate caused thyroid dysfunction,the lever of serum TSH,T3,T4 content anomaly,may be one of the causes of movement induced sudden death.3) The results indicate that sudden death was a result of interaction of many systems,turbulence of thyroid caused cardiac structural and functional alteration may induce to “cardiac” sudden death.
exercisesuddendeath;thyroidfollicular;fatigue;glycolysis
1002-9826(2016)06-0092-07
10.16470/j.csst.201606015
2015-09-10;
2016-06-29
四川省科技计划项目(2014SZ0158)。
钱钰(1990-),女,硕士,主要研究方向为疲劳发生机制与消除手段,E-mail:676609747@qq.com;李华(1969-),女,副教授,博士,硕士研究生导师,主要研究方向为人体组织胚胎学,E-mail:lihau_scu@scu.edu.cn;殷维瑶(1988-),女,在读博士研究生,主要研究方向为生殖内分泌,E-mail:791083068@qq.com。
1.成都体育学院 运动医学系,四川 成都 610041;2.四川大学,四川 成都 610041 1.Chengdu Sports University,Chengdu 610041,China;2.Sichuan University,Chengdu 610041,China.
G804.7
A

