8周游泳运动干预对肥胖小鼠血管内皮功能的改善及其炎症机制
唐东辉,刘润芝,李 娟,衣雪洁
8周游泳运动干预对肥胖小鼠血管内皮功能的改善及其炎症机制
唐东辉1,刘润芝1,李 娟2,衣雪洁3
目的:通过研究运动干预后肥胖小鼠血液、血管内皮致炎和抗炎相关细胞因子的水平及相关调控蛋白表达的变化,从运动抗炎症的角度揭示运动改善肥胖相关血管内皮功能障碍的机制。方法:SPF级雄性断乳C57BL/6小鼠40只,随机分为正常对照组(NC,n=10)、肥胖对照组(OC,n=10)和肥胖运动干预组(OE,n=11),采用高脂饮食诱导肥胖模型后,对OE组小鼠进行8周游泳运动干预(6次/周,60min/次)。运动干预后检测小鼠血清网膜素(Omentin)、肿瘤坏死因子-α(TNF-α)、胰岛素(Insulin)、空腹血糖(GLU);并采用免疫组化及RT-PCR技术检测主动脉内皮AMPK、TNF-α、eNOS的蛋白及mRNA表达,透射电镜观察小鼠主动脉内皮细胞的形态学改变。结果:1)与NC比较,OC小鼠血清Omentin水平显著降低(P<0.01);与OC比较,OE小鼠血清Omentin水平上升,差异显著(P<0.01);此外,与NC比较,OC小鼠血清TNF-α、GLU、Insulin显著升高(P<0.01),而与OC比较,OE小鼠上述指标显著降低(P<0.01)。2)血清Omentin水平与体重(r=-0.69,P<0.01)、血清TNF-α(r=-0.63,P<0.01)、胰岛素抵抗指数(r=-0.64,P<0.01)均呈负相关关系。3)与NC比较,OC小鼠主动脉AMPK、eNOS表达降低(P<0.01),TNF-α表达上调(P<0.01);与OC相比,OE小鼠主动脉AMPK、eNOS表达上调(P<0.01),TNF-α表达下降(P<0.01)。4)OC小鼠存在主动脉内皮细胞损伤,而OE小鼠主动脉内皮细胞损伤得到缓解。结论:8周游泳运动干预可有效降低肥胖小鼠体重,减轻慢性炎症反应,缓解血管内皮细胞损伤;运动抑制炎症反应可能是其改善肥胖相关血管内皮功能障碍的重要机制之一。
肥胖;血管内皮功能;炎症;网膜素;运动干预
伴随着经济社会的飞速发展,肥胖已经成为困扰全球的主要流行病学问题,肥胖者通常处于一种慢性的低度炎症状态(low-grade inflammation),这在一定程度上促进了动脉粥样硬化、2型糖尿病、高血压等代谢综合症疾病的发生和发展[15,25]。血管内皮功能障碍(vascular endothelial dysfunction)被认为是多种心血管疾病的启动环节。近年的研究提示,肥胖可通过炎症途径诱发血管内皮功能障碍,增加心血管疾病风险[5]。因此,采用抗炎症的手段改善肥胖者血管内皮功能对降低心血管病风险具有重要意义。研究认为,体育锻炼对心血管系统所产生的有益效应在很大程度上归咎于其抗炎症作用[3,16]。前期研究也表明,运动干预对肥胖青少年血管内皮功能的改善与运动的抗炎症作用密切相关,但相关生物学机制尚待进一步阐明[2]。网膜素(Omentin)是近年来新发现的一个脂肪因子,具有抵抗炎症改善血管内皮功能的重要作用[19]。近年的研究发现,Omentin可能通过作用于血管内皮细胞AMPK/eNOS/NO信号通路影响血管内皮功能[12]。运动对肥胖诱导的血管内皮功能障碍的改善是否与运动通过抑制炎症信号促进血管内皮细胞AMPK/eNOS/NO信号转导有关,Omentin是否参与其中,目前鲜见报道。为此本研究以高脂饮食诱导肥胖小鼠模型,8周游泳运动干预后检测小鼠血清Omentin、TNF-α、Insulin、GLU;免疫组化及RT-PCR技术检测主动脉内皮AMPK、TNF-α、eNOS表达,透射电镜观察小鼠主动脉内皮细胞的形态学改变,从内皮炎症的角度揭示运动改善肥胖相关血管内皮功能障碍的机制。
1 材料与方法
1.1 实验动物
实验动物选用SPF级雄性断乳C57BL/6小鼠,共40只,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。分笼饲养,动物房温度维持在22℃±5℃,相对湿度维持在50%±10%,明暗交替周期为12 h,自由进食饮水。
1.2 肥胖模型的建立及实验分组
采用高脂饮食诱导肥胖模型,随机选取小鼠10只为普通饲料组,进食标准饲料;30只小鼠为高脂饮食组,进食高脂饲料,所用饲料均由北京维通利华实验动物技术有限公司提供。11周后小鼠体重超过NC组小鼠平均体重的20%,为肥胖模型成功标准。将肥胖模型小鼠随机分为肥胖运动干预组(Obese Exercise,OE,n=11)与肥胖对照组(Obese Control,OC,n=10),其中,OE大鼠采用高脂饲料喂养,并实施8周的游泳运动干预(6次/周,60 min/次);OC组小鼠进食高脂饲料,不进行游泳运动干预。
1.3 运动干预方案
运动方式采用无负重游泳训练,水温为32℃~35℃,水深50 cm。采用改进的Ploug游泳训练方案[16]。小鼠首先进行适应性训练,第1天游泳时间为20 min,第2天为35 min,第3天为50 min,第4天为60 min;此后游泳训练时间均为60 min/天、6次/周,持续训练8周。
1.4 样本采集
最后一次运动结束24 h后取材,取材前小鼠禁食12 h。采用20%戊巴比妥钠腹腔注射麻醉小鼠(7 ml/kg),测其体重、体长。眼眶静脉取血,EP管收集全血,3 500 rp/min离心10 min后,分离血清;分离主动脉,剥去表面结缔组织,在生理盐水中漂净,剪取适度长度的主动脉,滤纸吸干后分别放入戊二醛和4%的多聚甲醛固定液进行固定;剩余的组织迅速放入液氮罐中。样本采集结束后,从液氮罐中取出组织分装并转移到-80℃保存。
1.5 检测指标
1.5.1 血液生化指标
采用美国强生公司的稳豪倍易型血糖仪测定空腹血糖(GLU);血清Omentin、TNF-α、Insulin的检测采用ELISA法,操作步骤严格按试剂盒(美国R&D)说明书进行。并计算胰岛素抵抗指数:HOMA-IR=GLU×FINS/22.5。
1.5.2 血管内皮细胞形态学观察
所取主动脉组织在戊二醛固定后,再放入1%锇酸固定1 h;采用丙酮逐级脱水;环氧树脂EPON812包埋剂进行包埋,包埋后再置入烤箱中进行干燥;完成聚合后进行超薄切片,以醋酸铀和枸橼酸铅进行双染色,然后在JEM-1200EX透射电镜下观察并摄片。
1.5.3 血管内皮AMPK、TNF-α、eNOS表达的检测
免疫组织化学检测:小鼠主动脉甲醛固定后,进行石蜡包埋,蜡块休整后固定于切片机上进行切片,抗原修复后染色,采用Image ProPlus 6.0图像分析软件对蛋白的表达进行半定量分析,棕黄色为阳性表达,每片随机观察5个高倍镜视野,并取其平均值,平均光密度表示蛋白的相对表达含量。
RT-PCR检测:采用实时定量PCR技术对小鼠主动脉相应蛋白mRNA的表达进行检测,Tirzol法抽提总RNA,反转录为cDNA,进行扩增,反应结束后,以GAPDH为内参,根据公式2-ΔΔCT计算基因的相对表达量。
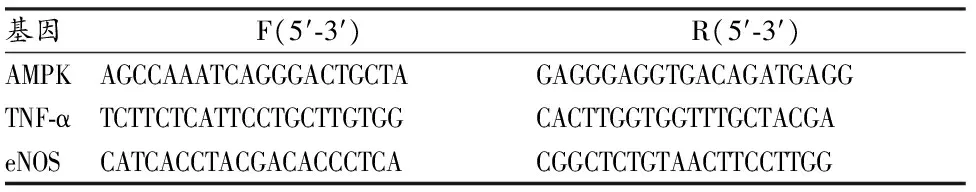
表 1 基因表达分析的引物序列Table 1 Primer Sequences for Gene Expression Analysis
1.6 数据处理
数据分析采用SPSS 18.0软件,数据的正态分布检验采用Shapiro-Wilk检验,肥胖模型建立阶段小鼠体重的组间比较采用独立样本t检验,运动干预前后小鼠体重的差异采用配对样本t检验,运动干预后组间比较采用单因素方差分析,相关分析采用皮尔逊相关分析,P<0.05作为差异显著性的判定依据。
2 结果
2.1 各组小鼠体重的变化
建模初始,普通饲料组平均体重为20.43±0.73 g,高脂饲料组平均体重为20.71±0.90 g,两组小鼠体重差异不具有显著性(P>0.05)。饲养过程中,意外死亡3只(普通组1只,高脂组2只)、高脂组剔除肥胖抵抗鼠6只。故肥胖建模成功22只,普通组9只,11周喂养后,高脂组小鼠体重高于普通组小鼠(36.92±1.53 g VS 27.76±1.86 g),差异显著(P<0.01),并符合肥胖模型建立的标准。
运动干预前,与NC(32.22±2.22 g)比较,OC(47.11±2.15 g)小鼠体重增加了46.21%,差异显著(P<0.01)。运动干预过程中,小鼠死亡4只(OE3只,OC1只)。运动干预后,与OC小鼠比较,OE小鼠体重较下降了35.14%,差异显著(P<0.01),但仍然显著高于NC(P<0.05)。
表 2 肥胖模型建立前后各组小鼠体重变化情况Table 2 Change of Mice Weight in before and after Obesity Model ±S)
注:与普通组比较,**P<0.05。
表 3 运动干预前、后各组小鼠体重比较Table 3 Comparison of Mice Weight in before and after Swimming Exercise ±S)
注:与NC相比,*P<0.05,**P<0.01;与OC相比,#P<0.05,##P<0.01;运动干预前后相比,ΔP<0.05,ΔΔP<0.01。
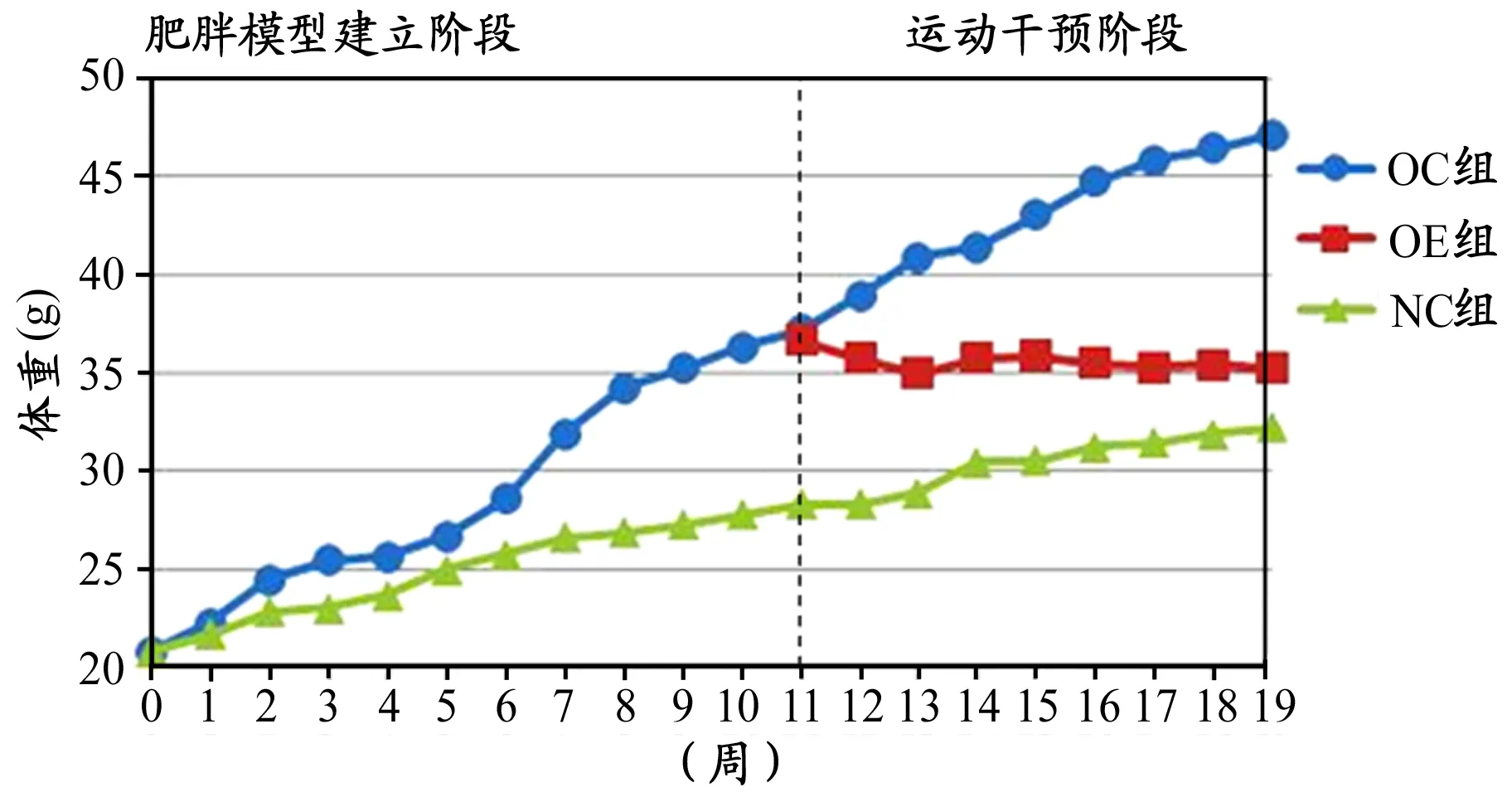
图 1 肥胖模型建立及运动干预前后各组小鼠体重变化情况Figure 1. Change of Mice Weight in before and after Exercise Intervention and Obesity Model Established
2.2 各组小鼠血液指标的比较及相关性
结果显示,与NC比较,OC小鼠血清Omentin水平降低,而TNF-α、GLU、Insulin水平升高,差异均具有非常显著性(P<0.01);与OC比较,OE小鼠血清Omentin水平升高、而TNF-α、GLU、Insulin水平降低,差异同样均具有非常显著性(P<0.01)。
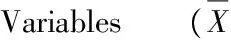
表 4 各组小鼠血液生化指标比较Table 4 Comparison of Mice Blood Biochemical ±S)
注:与NC相比,*P<0.05,**P<0.01;与OC相比,#P<0.05,##P<0.01。
本研究结果显示,小鼠血清Omentin水平与小鼠体重、血清TNF-α、HOMA-HR均为线性的负相关关系。Omentin与体重、血清TNF-α、胰岛素抵抗指数相关程度中等,相关系数r分别为-0.69(P<0.01)、-0.63(P<0.01)、-0.64(P<0.01),TNF-α与体重呈中等程度的线性正相关关系,相关系数r为0.63(P<0.01)。
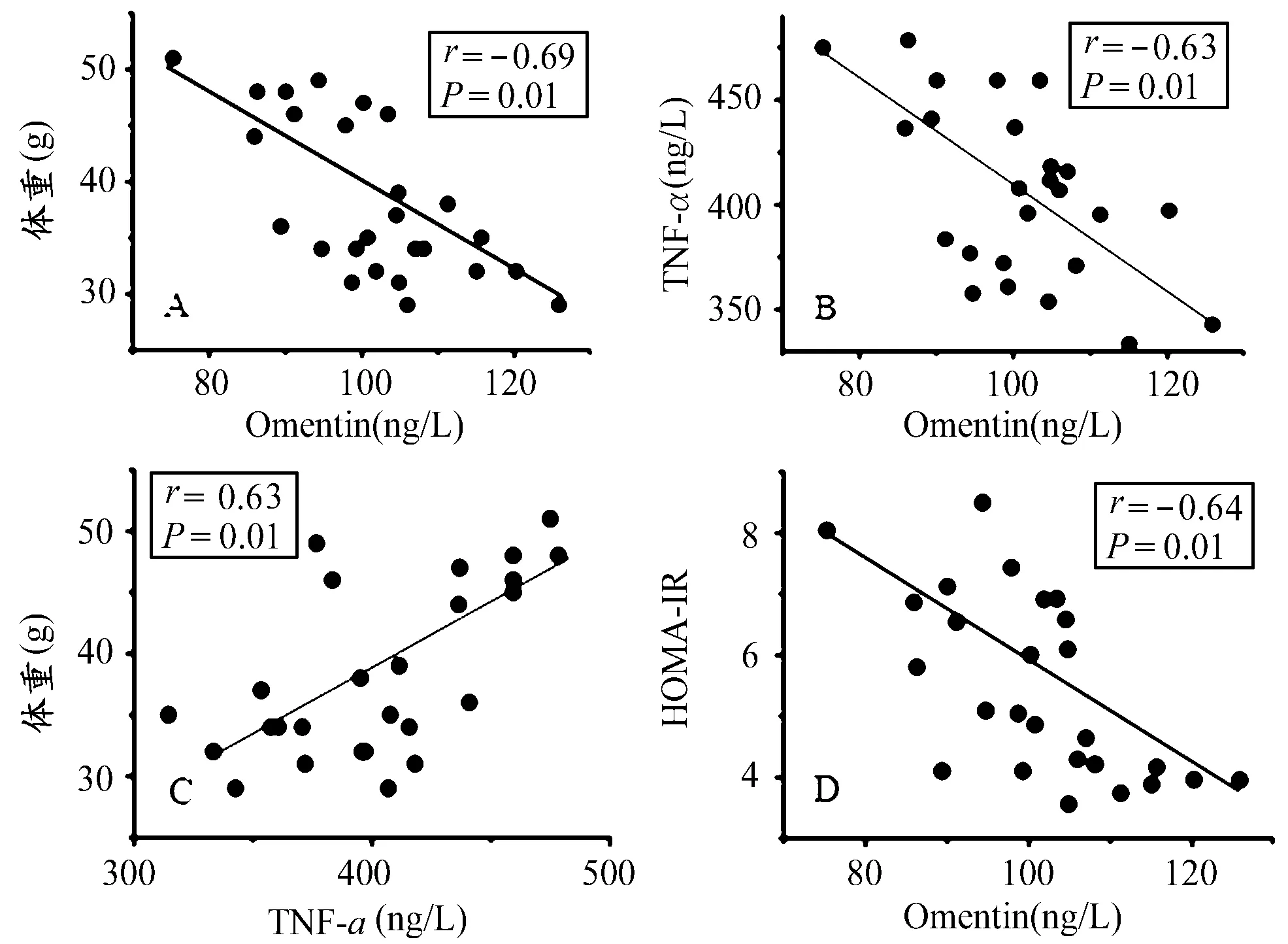
图 2 小鼠血清指标间的相关性示意图Figure 2. Correlation of the Serum Variables of Mice
2.3 各组小鼠血管形态学观察
透射电子显微镜结果显示,NC小鼠主动脉内皮细胞连续,内皮间见紧密连接,可见明显的内、中和外膜3层,中膜内有较多的平滑肌细胞,外膜内有较多的胶原纤维,弹力板清晰。OC小鼠主动脉内皮细胞的核形不规则、多切迹,胞膜局部破损,部分胞体突向管腔,基膜模糊,内皮下间隙增宽。此外,OE小鼠主动脉内皮细胞连续,内皮间见紧密连接,中和外膜分界清楚,内皮下间隙增宽,可见弹力板,中膜内平滑肌细胞和外膜内较多的胶原纤维。
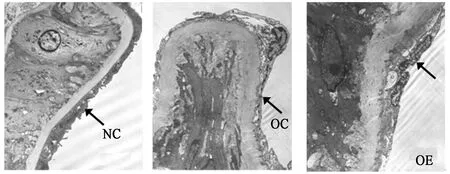
图 3 各组小鼠主动脉血管电镜图(×3000)Figure 3. Electron Microscope Photograph of Mice Aorta Vessel(×3000)
2.4 各组小鼠血管内皮AMPK、eNOS、TNF-α表达水平
免疫组化染结果显示,与NC组相比,OC小鼠主动脉内皮AMPK、eNOS表达下调(P<0.01),TNF-α表达上调(P<0.01);与OC相比,OE小鼠主动脉内皮AMPK、eNOS表达上调(P<0.01),TNF-α表达下调(P<0.01)。
图 4 各组小鼠主动脉AMPK相对表达量Figure 4. Relative Expression of AMPK Protein in Aorta of Mice
注:与NC相比,*P<0.05,**P<0.01;与OC相比,#P<0.05,##P<0.01,图5至图7同。
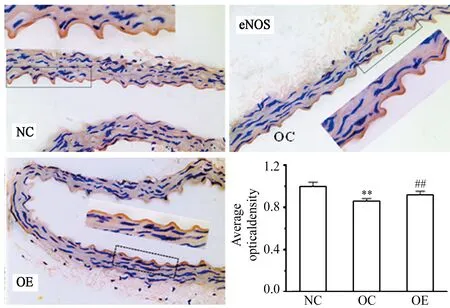
图 5 各组小鼠主动脉e NOS相对表达量Figure 5. Relative Expression of eNOS Protein in Aorta of Mice

图 6 各组小鼠主动脉TNF-α相对表达量Figure 6. Relative Expression of TNF-α Protein in Aorta of Mice
2.5 各组小鼠血管AMPK、eNOS、TNF-α mRNA表达
本研究结果显示,与NC比较,OC小鼠主动脉AMPK mRNA表达量显著降低(P<0.01),与OC比较,OE小鼠主动脉内皮AMPK mRNA表达量显著增加(P<0.05);与NC比较,OC组小鼠主动脉eNOS mRNA表达显著降低(P<0.01),与OC比较,OE组小鼠主动脉eNOS mRNA表达显著提高(P<0.05);此外,与NC比较,OC组小鼠主动脉TNF-α mRNA表达显著升高(P<0.01),与OC比较,OE组小鼠主动脉TNF-α mRNA表达显著下降(P<0.05)。
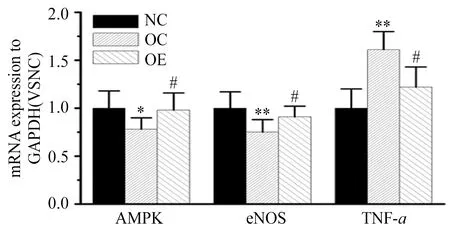
图 7 各组小鼠主动脉AMPK、eNOS、TNF-α mRNA表达水平Figure 7. Expression of AMPK,eNOS,TNF-α mRNA in Aorta of Mice
3 讨论
3.1 运动干预对肥胖小鼠体重及全身炎症水平的影响
运动干预是一种有效的体重控制手段,已有研究表明,运动干预能够通过降低体脂改善体成分并降低体重,同时还可对肥胖者糖脂代谢发挥重要的调节作用[2,3,13]。肥胖是多种心血管疾病的独立危险因素,因此,规律的运动锻炼有助于降低肥胖人群心血管疾病风险[1,14]。本研究结果发现,8周的游泳运动干预可有效降低高脂膳食诱导的肥胖小鼠体重,同时胰岛素抵抗也得到明显改善。肥胖状态下,随着脂肪的不断堆积,炎症因子在脂肪组织中的表达增加,起初是一种自我保护式的代偿反应,但由于持续的能量正平衡,脂肪组织的慢性炎症逐渐形成[22]。本研究结果也发现,肥胖小鼠血清抗炎性因子Omentin水平下调,而炎症因子TNF-α水平上调。Omentin是近年来发现的一种抗炎症因子,而TNF-α是公认的炎症因子[12,24]。因此,本研究结果提示,肥胖小鼠存在一定程度的炎症反应。研究表明,运动训练所产生的有益效应在很大程度上归咎于抗炎症作用,也有研究发现,8周的游泳运动和负重训练均可减轻大鼠体重和体脂肪,下调脂肪组织的TNF-α[18]。另有研究显示,6周的运动训练在不改变肥胖女性体重变化的情况下,仍然可使血液omentin-1水平明显增加[21]。本研究结果也显示,8周游泳运动干预后,肥胖小鼠血清Omentin水平升高,TNF-α水平降低,提示运动干预有效降低了肥胖小鼠的炎症反应。
3.2 运动干预对肥胖小鼠血管内皮功能的影响
血管内皮功能障碍是指血管内皮细胞源性舒张因子与收缩因子表达失衡而诱发的血管舒缩功能障碍,几乎与所有心血管疾病均存在重要关系[5]。肥胖诱发的血管内皮功能障碍主要表现为血管内皮细胞NO释放减少[10]。NO对维持血管张力的恒定和调节血压的稳定性具有重要作用,NO是在内皮型一氧化氮合酶(eNOS)的作用下在内皮细胞合成并释放[8,10]。本研究结果显示,肥胖小鼠血管形态学发生改变,出现内皮剥脱,内膜的平滑性、完整性遭到破坏,弹性膜不明显等现象,提示肥胖导致肥胖小鼠的血管内皮损伤。此外,肥胖小鼠血管eNOS蛋白和mRNA表达均低于正常小鼠,表明存在血管内皮功能障碍。已有研究指出,肥胖者普遍存在血管内皮功能下降的现象[10]。Deng的研究也发现,6周高脂饲料喂养的SD大鼠腹主动脉环NO生成总量明显降低,且乙酰胆碱诱发的血管舒张明显减少[8],提示6周高脂饮食即可导致肥胖大鼠血管内皮功能降低。研究表明,运动干预可有效改善肥胖者血管内皮功能。16周有氧运动、抗阻训练结合饮食控制干预,使肥胖女性的体重减轻、血流介导的血管舒张功能(Flow-mediated diameter,FMD)水平明显提高[7];8周的运动训练后,肥胖儿童的体重、皮下脂肪量虽然没有发生明显的变化,但其FMD显著提高,表明血管功能异常得到了改善[20]。本研究结果还显示,8周运动干预后,肥胖小鼠主动脉内皮细胞形态损伤得到明显改善,血管内皮eNOS及其mRNA的表达水平均提高,提示运动干预可明显改善肥胖小鼠血管内皮功能障碍。
3.3 运动干预对肥胖小鼠血管内皮炎症的影响
研究表明,炎症在肥胖相关血管内皮功能障碍的发生与发展中扮演了重要角色[5]。血管内皮细胞膜上表达有TNF-α受体,血液中的TNF-α可通过其受体启动胞内炎症信号级联反应,释放多种炎症因子,进一步放大TNF-α促炎性作用[6]。AMPK被激活后通过降低血管内皮细胞中NF-κB活性,下调黏附分子的表达,发挥抗炎作用[11]。本研究结果显示,肥胖小鼠血管内皮细胞TNF-α表达以及血管壁TNF-α mRNA表达水平显著增加,而AMPK表达以及血管壁AMPK mRNA表达水平显著降低,表明肥胖小鼠血管内皮炎症反应增强。肥胖状态下,血液中的TNF-α水平提高,通过与内皮细胞膜上的特异性受体作用,通过激活NF-κB炎症信号通路,诱发并进一步促进血管内皮细胞的炎症反应[4]。8周运动干预后,肥胖小鼠血管内皮细胞TNF-α表达和血管壁TNF-α mRNA表达均显著降低,而血管内皮AMPK表达和血管壁AMPK mRNA表达均显著升高。提示运动干预除了降低肥胖小鼠血液炎症因子水平外,还能够降低血管内皮细胞的炎症反应,而运动的抗炎作用可能是通过上调内皮细胞AMPK表达,并下调TNF-α表达而实现的。
3.4 运动干预通过抑制肥胖小鼠血管内皮炎症改善血管内皮功能的可能机制
本研究显示,8周游泳运动干预可有效抑制肥胖小鼠体重增长,降低外周血TNF-α水平,上调omentin水平,同时还可以上调血管内皮AMPK及eNOS表达,并减少TNF-α表达。已有研究认为,在胞内AMPK既可抑制NF-κB炎症信号通路减少TNF-α合成降低炎症反应,又可激活AMPK/eNOS/NO信号通路增加NO合成,改善血管内皮功能[9,17]。Omentin在这一过程中可能也发挥了一定作用。虽然目前尚未阐明Omentin进入内皮细胞的相关机制,但有研究表明外周血的Omentin可通过提高血管内皮细胞AMPK激活程度,对血管内皮细胞产生生物学效应。采用Omentin预处理20 min后,人脐静脉内皮细胞AMPK和eNOS的磷酸化水平可得到明显提高[23]。因此,本研究结果提示,运动干预可上调肥胖小鼠血液Omentin水平,Omentin作用于血管内皮细胞后,一方面抑制NF-κB炎症信号通路减少TNF-α合成降低炎症反应,另一方面增加AMPK激活上调血管内皮细胞eNOS表达促进NO释放,发挥抗炎症和增强血管内皮功能的作用。
4 结论
8周游泳运动干预可有效降低肥胖小鼠体重,减轻慢性炎症反应,缓解血管内皮细胞的损伤;运动抑制血管内皮炎症通路及促进AMPK/eNOS/NO信号转导可能是其改善肥胖相关血管内皮细胞功能障碍的重要机制之一。Omentin可能参与了运动抑制炎症反应及改善肥胖相关血管内皮功能障碍的过程。
[1]郭吟,陈佩杰,陈文鹤.4周有氧运动对肥胖儿童青少年身体形态、血脂和血胰岛素的影响[J].中国运动医学杂志,2011,30(5):426-431.[2]李娟,唐东辉,陈巍.有氧运动结合抗阻训练对男性肥胖青少年心血管功能的改善及可能机制[J].体育科学,2013,33(8):37-42.[3]ALICE S R,SHEALINNA G,JACOB B B,etal.Aerobic exercise and weight loss reduce vascular markers of inflammation and improve insulin sensitivity in obese women[J].J Am Geriatr Soc,2014,62(4):607-614.
[4]AMY R J,MILNER J J,LIZA M.The inflammation highway:metabolism accelerates inflammatory traffic in obesity[J].Immunol Rev.2012,(1):218-238.
[5]ANITA T C,KEVIN C H,CONSTADINA P,etal.Childhood obesity and cardiovascular dysfunction[J].J AM Coll Cardiol,2013,62(15):1309-1319.
[6]BAKER R G,HAYDEN M S,GHOSH S.NF-κB,inflammation and metabolic disease[J].Cell Metabolism,2011,13(1):11-22.
[7]COTIE L M,JOSSE A R,PHILLIPS S M,etal.Endothelial function increases after a 16-week diet and exercise intervention in overweight and obese young women[J].Bio Med Res Int,2014,(1):93-100.
[8]DENG G,LONG Y,YU Y R,etal.Adiponectin directly improves endothelial dysfunction in obese rats through the AMPK-eNOS Pathway[J].Int J Obes,2010,34(1):165-171.
[9]GREEN C J,PEDERSEN M,PEDERSEN B K,etal.Elevated NF-κB activation is conserved in human myocytes cultured from obese type 2 diabetic patients and attenuated by AMP-activated protein kinase[J].Diabetes,2011,60(11):2810-2819.
[10]GUPTA A K,RAVUSSIN E,JOHANNSEN D L,etal.Endothelial dysfunction:an early cardiovascular risk marker in asymptomatic obese individuals with prediabetes[J].Br J Med Med Res,2012,2(3):413-423.
[11]HATTORI Y,SUZUKI K,HATTORI S,etal.Metformin inhibits cytokine-induced nuclear factor kappa B activation via AMPactivated protein kinase activation in vascular endothelial cells[J].Hypertension,2006,47(6):1183-1188.
[12]HIDEYUKI Y,NAOYA T,MASASHI M,etal.Omentin,a novel adipokine,induces vasodilation in rat isolated blood vessels[J].Biochem Biophys Res Commun,2010,(4):668-672.
[13]HYO-BUM K.Exercise and obesity-induced insulin resistance in skeletal muscle[J].Integrative Med Res,2013,2(4):131-138.
[14]KAZUTO N,JOSE J F,KENNETH W,etal.Adipokines:A link between obesity and cardiovascular disease[J].J Cardiol,2014,63(4):250-259.
[15]KERSTYN C Z,BARRY A F,WENDY M M,etal.Impact of obesity on cardiovascular disease[J].Med Clin North Am,2011,95(5):919-937.
[16]PLOUG T,STALLKNECHT B M,PEDERSEN O,etal.Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle[J].Am J Physiol,1990,(6):778-786.
[17]SALMINEN A,HYTTINEN J M T,KAARNIRANTA K.AMP-activated protein kinase inhibits NF-κB signaling and inflammation:impact on healthspan and lifespan[J].J Molecular Med,2011,89(7):667-676.
[18]SPERETTA G F F,ROSANTE M C,DUARTE F O,etal.The effects of exercise modalities on adiposity in obese rats[J].Clinics,2012,67(12):1469-1477.
[19]TAN Y L,ZHENG X L,TANG C K.The protective functions of omentin in cardiovascular diseases[J].Clinica Chimica Acta,2015,448:98-106.
[20]WATTS K,BEYE P,SIAFARIKAS A,etal.Effects of exercise training on vascular function in obese children[J].J Pediatr,2004,144(5):620-625.
[21]WILMS B,ERNST B,GERIG R,etal.Plasma Omentin-1 Levels are Related to Exercise Performance in Obese Women and Increase Upon Aerobic Endurance Training[J].Exp Clin Endocrinol Diabetes,2015,123(3) 187-192.
[22]WINKLHOFER-ROOB B M,ROOB J M.Obesity and low-grade inflammation:bioactive dietary compounds and effects on biomarkers[J].Free Radic Biol Med,2012,53(Suppl1):10-11.
[23]YAMAWAKI H,KURAMOTO J,KAMESHIMA S,etal.Omentin,a novel adipocytokine inhibits TNF-induced vascular inflammation in human endothelial cells[J].Biochem Biophys Res Commun,2011,(2):339-343.
[24]YAN L C,CUI Z H,XIN M,etal.Expression of TNF-α protein in omental and subcutaneous adipose tissue in obesity[J].Diabetes Res Clin Pract,2008,79(2):214-219.
[25]ZUZEK C.Obesity is a disease[J].Tex Med,2014,110(1):45-48.
The Effect of 8-Week Swimming Exercise on Vascular Endothelial Function in Obese Mice and the Mechanism Related to Inflammation
TANG Dong-hui1,LIU Run-zhi1,LI Juan2,YI Xue-jie3
Objective:To examine the changes of regulatory proteins related to inflammation in serum and endothelial cell in obese mice after exercise training and investigate the mechanism of exercise training to improve vascular endothelial function.Methods:Forty SPF C57BL/6 mice were divided randomly into the following three groups:Normal Control group(NC,n=10),sedentary chow diet,Obese Control group(OC,n=10),high-fat diet,Obese Exercise group(OE,n=11),high-fat diet,OE consisted of 8 weeks of 60-min swimming sessions,6 days/week.At the end of the training protocol,Omentin,TNF-α,insulin,GLU in serum were assayed and the expression of TNF-α,AMPK,eNOS in endothelial cell was observed both at the mRNA level and the protein level by the methods of RT-PCR and immunohistochemistry,respectively.Meanwhile,the structure of aortic endothelial cells was observed by transmission electron microscopy.Results:1) The serum Omentin in OC was significantly lower than NC(P<0.01);as well as the OE group significantly increased the serum Omentin,compared with OC(P<0.01);the serum TNF-α,GLU,Insulin levels in OC group were significantly higher than OE group(P<0.01).However,they are lower in OE than in OC.2) Serum Omentin levels are negatively correlated with abdominal fat weight(r=0.72,P<0.01),serum TNF-α(r=-0.63,P<0.01),index of insulin resistance(r=-0.64,P<0.01).3) Compared with the NC group,the expression of thoracic aorta AMPK,eNOS in OC were significantly lower(P<0.01);Compared with the OC group,OE mice thoracic aorta AMPK,eNOS expression increased(P<0.01);4) The endothelial cells and the sub endothelial structure of aortic endothelium in OC group showed pathologic changes.8-week swimming exercise makes the thoracic aorta morphology improved in OE group mice.Conclusion:8-week swimming exercise can effectively reduce weight,decrease chronic inflammation and alleviate injury of vascular endothelial cell in obese mice,inhibition of inflammation may be one of the important mechanisms of exercise improving endothelial dysfunction related to obesity.
obesity;vascularendothelialfunction;inflammation;omentin;exerciseintervention
1002-9826(2016)06-0086-06
10.16470/j.csst.201606014
2015-11-12;
2016-08-12
国家自然科学基金资助项目(81472992)。
唐东辉(1964-),女,湖南宁乡人,教授,硕士,博士研究生导师,主要研究方向为体质与健康、青少年体重控制,Tel:(010)58805205,E-mail:tdh1964@bnu.edu.cn;刘润芝(1988-),女,山东黄岛人,助教,硕士,主要研究方向为运动康复治疗慢性疾病的机制研究,Tel:(0538)6237765,E-mail:rzliu@tsmc.edu.cn;李娟(1982-),女,河北滦县人,实验师,硕士,主要研究方向为运动防治肥胖的分子生物学机制,Tel:(0335)8057020,E-mail:lijuanbcg@163.com。
1.北京师范大学 体育与运动学院,北京 100875;2.燕山大学 体育学院,河北 秦皇岛 066004;3.沈阳体育学院 运动人体科学学院,辽宁 沈阳 110102 1.Beijing Normal University,Beijing 100875,China;2.Yanshan University,Qinhuangdao 066004,China;3.Shenyang Sport University,Shenyang 110102,China.
G804.7
A

