运动和罗格列酮降低ADMA的协同作用及其机制研究
景志强,刘乃丰,杨 劲
运动和罗格列酮降低ADMA的协同作用及其机制研究
景志强1,刘乃丰2,杨 劲1
目的:研究运动与罗格列酮联合对T2DM大鼠ADMA水平的影响,观察其是否存在协同效应。方法:采用高质饮食结合腹腔注射低剂量STZ的方法建立T2DM大鼠模型,将实验动物分为正常对照组、T2DM组、T2DM+运动组、T2DM+罗格列酮组和T2DM+运动+罗格列酮组,每组给予相应的干预10周。结果:罗格列酮可以降低T2DM大鼠CML(P<0.01)和ADMA(P<0.01),同时上调肝脏PPAR-γ(P<0.01)和DDAH-1(P<0.01)mRNA表达,而运动可以降低T2DM大鼠CML(P<0.01)和ADMA(P<0.05),同时上调肝脏PPAR-γ(P<0.05)和DDAH-1(P<0.01) mRNA表达;运动和罗格列酮联合干预组CML明显低于罗格列酮单独干预(P<0.01),ADMA明显低于单独运动干预(P<0.05),肝脏PPAR-γ和DDAH-1mRNA表达分别显著高于单独运动((P<0.01)和单独罗格列酮(P<0.01)干预。结论:运动和罗格列酮在降低ADMA保护血管内皮方面可能存在协同效应,其机制可能是基于AGEs/PPAR-γ/DDAH/ADMA途径。
运动;罗格列酮;协同作用;ADMA;DDAH-1;PPAR-γ
血管内皮功能异常被认为是糖尿病大血管并发症和糖尿病微血管病变的共同病理生理特征,目前研究[20]发现,一氧化氮(Nitric Oxide,NO)生物利用度降低导致的内皮功能受损在糖尿病血管并发症的发生发展中起重要作用,而导致NO生物利用度降低的主要原因是高血糖引发的氧化应激增加。机体高血糖时,蛋白质和脂质经非酶糖化生成的糖基化终产物(Advanced Glycation End-products,AGEs)明显增加[15],AGEs是糖尿病机体氧化应激的主要起源,AGEs诱导的氧化应激增加不仅可以直接导致NO的降解,还可以通过抑制二甲基精氨酸二甲胺水解酶(Dimethylarginine Dimethylaminohydrolase,DDAH)的活性(DDAH分子在具有一个活跃的半胱氨酸基团,其巯基容易被氧化失活[14]),导致非对称性二甲基精氨酸(Asymmetrical Dimethylarginine,ADMA)的代谢受阻,ADMA是内源性的一氧化氮合酶(Oxyde Nitrique Synthase,NOS)抑制剂,可以抑制NO的合成[6]。ADMA是由含精氨酸残基的蛋白质经甲基化和水解作用而生成的一种胍类物质,是人体的正常代谢产物。ADMA清除有两条途径,少部分经肾脏原型排出,绝大多数经DDAH被分解代谢,DDAH有两种亚型DDAH-1和DDAH-2,DDAH-1表达于脏脏和肾脏,DDAH-2主要表达于血管和心脏,肝脏是循环中ADMA代谢的主要器官[19,21]。近年来研究[22]发现,血浆中ADMA的蓄积与糖尿病血管并发症密切相关,ADMA不仅是一个预测心血管事件的指标,而且也是疾病进展的调节指标,具有双重作用。
临床研究已经证实,减少机体氧化应激,可以降低AGEs和ADMA的水平,对保护血管内皮起到一定作用。考虑到肝脏是ADMA的主要代谢器官,决定着血液中ADMA的水平,那么通过何种途径增加肝脏DDAH表达,进而增强代谢ADMA的能力,对于降低血液中ADMA水平,具有重要的意义。研究[16,23]发现,替米沙坦可以通过激活血管内皮的PPAR-γ,上调DDAH-2表达,对降低进入内皮细胞的ADMA起到一定作用,但是对肝脏的DDAH-1影响的研究较少。噻唑烷二酮类药物主要是通过激活肝脏和脂肪组织上的PPAR-γ途径提高胰岛素敏感性,那么提示我们此类药是否可以上调肝脏的DDAH-1表达,降低体内ADMA的水平,即通过PPAR-γ/DDAH-1/ADMA途径,对血管内皮起到保护作用?
近期也有研究[28]发现,运动可以降低血浆羧甲基赖氨酸(ε-N-carboxymethyl-lysine,CML)的水平,CML是一种具有代表新性的AGEs,那么提示我们运动是否可以通过降低糖尿病机体的AGEs,减轻氧化应激,提高DDAH活性,即通过AGEs(CML)-DDAH-ADMA途径,对血管内皮起到保护作用。2型糖尿病防治指南中明确推荐运动与药物联合应用治疗2型糖尿病,但是关于运动和药物之间的相互作用的研究较少,尤其是二者联合是否可以降低尽可能多的危险因素,是否会有一些潜在的、额外的益处(如减轻药物副作用,加强疗效等),还不是很清楚。
结合2型糖尿病防治指南,考虑到噻唑烷二酮类药物和运动可能对血管内皮都具有保护作用,但是在机制上又有差异,提示我们在效应上可能存在着协同效应。所以本研究重点探索运动与罗格列酮(噻唑烷二酮类药物)联合对糖尿病大鼠ADMA的水平影响,观察其是否存在协同效应,并进一步研究其可能的机制,为运动和药物联合治疗糖尿病如何尽可能多的降低危险因素,获取更多心血管保护效应提供理论依据。
1 材料与方法
1.1 试剂
STZ(链脲佐菌素)购自Sigma公司,临用时溶于现配的0.1 mol/L枸橼酸钠缓冲液,配成0.5%的STZ注射溶液;非对称性二甲基精氨酸,购自Sigma公司,纯度>99.0%;ε-N-羧甲基-L-赖氨酸和ε-N-羧甲基-2H2-L-赖氨酸,购自PolyPeptide Group公司,纯度>99.0%; 本实验中的引物由 Primer premier 5.0 software 软件设计而成,引物的序列分别如下:
actin F:GGGAAATCGTGCGTGACATT R:GCGGCAGTGGCCATCTC
PPAR-γ F:CGGTTGATTTCTCCAGCATTTC R:CAGGCTCTACTTTGATCGCACTT
DDAH-1 F:CCAGAAGAGTACCCAGAAAGCG R:GTTAATAAAAACGGAGCAGCAG
1.2 仪器
API3000液相串联质谱联用仪,OLYMPUS公司(日本)全自动生化分析仪,ABI荧光定量PCR仪,强生(中国)医疗器材有限公司强生稳豪型血糖仪,SIGMA 3K15高速冷冻离心机,Turbo Vap LV氮吹仪,WH-3微型涡旋混合仪,ZH-PT动物跑台(正华生物)等。
1.3 实验动物模型制备
健康SPF级雄性SD大鼠,体重100~110 g,由上海西普尔-必凯实验动物有限责任公司[SCXK(沪)2013-0016]提供。实验期间室温控制在20℃±2℃,湿度39%~43%,12 h交替照明,自由饮食、饮水。适应性喂养1周后,将大鼠按照体重随机分为2组,其中模型组(T2DM)给予高脂饲料喂养,普食组(NF)给予正常饲料喂养,记录大鼠每日摄食量及每周体重变化。
T2DM组大鼠高脂喂养4周后,禁食不禁水12 h后,一次性腹腔注射0.5%STZ(35 mg/kg)。注射STZ后,第7天,第14天,第21天检测血糖和体重,筛选第3周末血糖值高于16.67 mmol/L(300 mg/dL)的大鼠作为成功的2型糖尿病模型(T2DM)。
1.4 动物分组
将同批次的6只正常SD大鼠作为正常组(Control),将28只造模成功的T2DM大鼠按体重随机分为4组,即模型组(T2DM)、模型罗格列酮组(T2DM+Ros)、模型运动组(T2DM+Ex)和模型+罗格列酮+运动组(T2DM+Ros+Ex),每组7只。
1.5 干预方式
罗格列酮干预:将马来酸罗格列酮片剂研磨成粉末,溶于以1%CMCNa混悬液中,配置成5 mg/ml的罗格列酮混悬液,按照5 mg/kg的剂量灌胃给与予T2DM+Ros组和T2DM+Ros+Ex组大鼠,1次/日。Control,T2DM和T2DM+Ex组给予CMCNa溶液灌胃,每3天根据空腹体重情况更新灌胃剂量,持续10周。
运动干预:T2DM+Ex组和T2DM+Ros+Ex组于灌胃后3 h(药物充分吸收[18])给予跑台跑步干预,跑台坡度为0°,速度为28 m/min,时间为40 min,每跑8 min之后有30 s的休息时间[9],第1天运动时间为8 min,以后每天递增8 min,直到增加到40 min,以后维持此运动时间,每周连续运动5天,持续10周。
1.6 动物处理
为了避免急性运动的影响,于最后一次跑步结束,禁食24 h后,称重,依次用2%戊巴比妥钠50 mg/kg腹腔注射麻醉,腹主动脉取血。取2 ml注入含有EDTA(15%)的EP管,取2 ml注入EP管,静置1~2 h,4℃离心10 min,转速为3 000 r/min,分离血浆和血清,血浆用于供CML和ADMA的测定,血清用于血糖(Glucose)、甘油三酯(TG)、低密度脂蛋白(LDL)和胆固醇(TC)测定。将各组大鼠脱椎处死,75%酒精局部皮肤消毒,取肝脏左外侧叶,在预冷的1XPBS中漂洗液氮中冻好,再放到EP管中,-70℃冰箱保存,用于DDAH-1和PPAR-γmRNA检测。
1.7 指标测定
1.血清Glucose、TG,TC和LDL采用OLYMPUS公司(日本)全自动生化分析仪测定。
2.血浆CML和ADMA采用LC/MS/MS测定[13]。
3.肝脏DDAH-1和PPAR-γmRNA采用qRT-PCR测定。
1.8 统计学处理

2 结果
2.1 大鼠血清Glucose,LDL,TC和TG浓度
本实验结果显示,T2DM组血糖、LDL、TG和TC明显高于对照组(P<0.05);罗格列酮组血糖、LDL和TC明显低于T2DM组(P<0.05),其中LDL明显高于对照组(P<0.01),血糖TC和TG与对照组相比无显著性差异;运动组血糖、LDL、TC和TG明显高于T2DM组(P<0.01),其中血糖仍然高于对照组(P<0.05),LDL、TC和TG与对照组无显著性差异;运动+罗格列酮组血糖、TC、TG和LDL明显低于T2DM组(P<0.05),其中LDL低于罗格列酮组(P<0.05),与对照组相比血糖、TC、TG和LDL都无显著性差异。说明运动+罗格列酮在改善血脂方面存在着协同效应(表1和图1)。

表 1 各组大鼠血清Glucose、LDL、TC和TG水平,血浆CML和ADMA水平Table 1 The Level of Glucos,LDL,TC and TG in Serum and CML and ADMA in Plasma of Every Group
注:与Control相比:★<0.05,★★<0.01; 与T2DM组相比:▲<0.05,▲▲<0.01;与T2DM+Ros相比: *<0.05,**<0.01,与T2DM+Ex相比:☆<0.05。

图 1 各组大鼠血清Glucose(A),LDL(B),TC(C) 和TG(D)水平示意图Figure 1. The Level of Glucose(A),LDL(B),TC(C) and TG(D) in serum of Every Group 注: 与Control相比:★<0.05,★★<0.01; 与T2DM组相比:▲<0.05,▲▲<0.01; 与T2DM+Ros相比:#<0.05,##<0.01。
2.2 大鼠血浆CML和ADMA浓度
T2DM组血浆CML浓度明显高于对照组(P<0.01),罗格列酮组、运动组和运动+罗格列酮组血浆CML明显低于T2DM组(P<0.01),值得注意的是运动+罗格列酮组和运动组血浆CML也明显低于罗格列酮组(P<0.01);T2DM组血浆ADMA浓度明显高于对照组(P<0.01),罗格列酮组、运动组和运动+罗格列酮组血浆CML明显低于T2DM组(P<0.05),同样值得注意的是运动+罗格列酮组血浆ADMA明显低于运动组(P<0.05);该结果说明“运动+罗格列酮”联合干预T2DM大鼠在降低CML和ADMA方面分别优于单独运动和单独的罗格列酮干预(表1和图2)。
2.3 LDL、CML和ADMA的相关性分析
本研究结果显示,LDL与CML呈正相关(R=0.686,P<0.05),LDL和ADMA呈正相关(R=0.63,P<0.01),而CML和ADMA未呈相关(R=0.336,P>0.05,图3)。
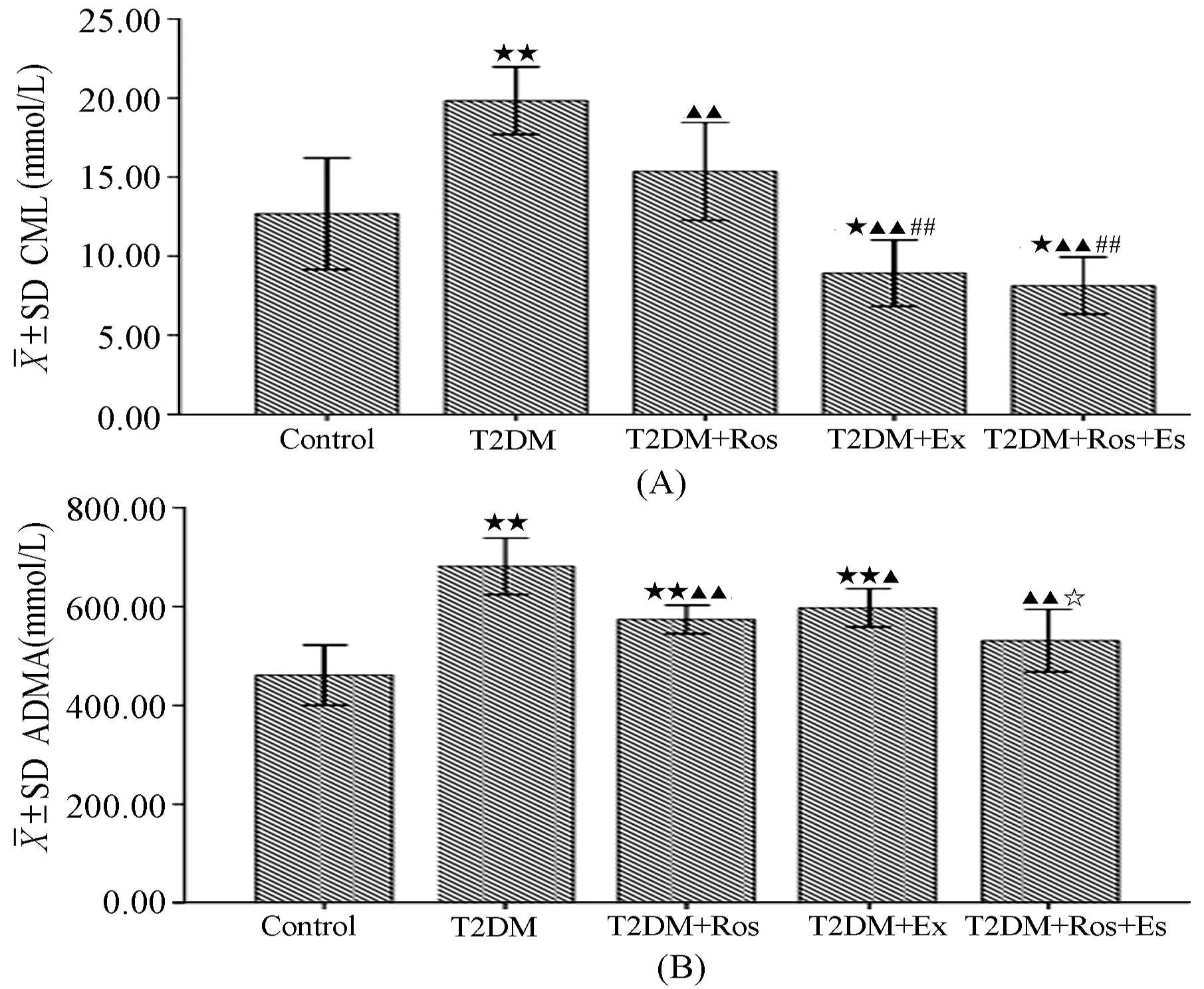
图 2 各组大鼠血浆CML(A)和ADMA(B)水平示意图Figure 2. The Level of CML and ADMA in Plasma of Every Group
注:与Control相比:★<0.05,★★<0.01; 与T2DM组相比:▲<0.05,▲▲<0.01;与T2DM+Ros相比: #<0.05,##<0.01与T2DM+Ex相比:☆<0.05,☆☆<0.01。

图 3 CML与ADMA相关(A),CML与LDL相关(B),ADMA与LDL相关(C)示意图Figure 3. The Correlation of between CML and ADMA(A),between CML and LDL(B),between ADMA and LDL(C)
2.4 大鼠肝脏DDAH-1和PPAR-γ的qRT-PCR结果

图4 组大鼠血浆PPAR-γ(A)和DDAH(B)的mRNA水平示意图Figure 4. The mRNA Level of PPAR-γ(A)and DDAH(B) in Plasma of Every Group
注:与Control相比:★<0.05,★★<0.01; 与T2DM组相比:▲<0.05,▲▲<0.01;与T2DM+Ros相比: #<0.05,##<0.01,与T2DM+Ex相比:☆<0.05,☆☆<0.01。
本实验结果显示,T2DM组肝脏PPAR-γ表达与对照组无显著性差异;罗格列酮组肝脏PPAR-γ表达明显高于对照组和T2DM组(P<0.01);运动组肝脏PPAR-γ表达明显高于T2DM组(P<0.05),但低于罗格列酮组(P<0.01);运动+罗格列酮组肝脏PPAR-γ表达明显高于对照组、T2DM组、罗格列酮组和运动组(P<0.05,图4)。
T2DM组肝脏DDAH-1表达明显低于对照组(P<0.01);罗格列酮组和运动组肝脏DDAH-1表达明显高于T2DM组(P<0.01);然而,运动+罗格列酮组肝脏DDAH-1表达高于T2DM组、运动组和罗格列酮组(P<0.01,图4)。
该结果说明“运动+罗格列酮”在降低ADMA方面表现出的协同效应,可能是基于CML/PPAR-γ/DDAH-1/ADMA通路实现的。
3 讨论
临床研究[3]显示,血浆中ADMA水平的升高与糖尿病血管并发症密切相关,是一个独立预测糖尿病心血管事件的风险因子。近年来研究[22]发现,ADMA不仅是糖尿病血管并发症的一个预测指标,而且也是疾病进展的调节指标,具有双重作用。研究[8]发现,ADMA作为NOS内源性抑制剂,其抑制NO的合成效应呈时间-剂量依赖性(IC50=1.8±0.1 μmol/L)。细胞实验[2,29]证实,外源性ADMA还可以通过加强氧化应激,诱导炎症反应。可见ADMA通过抑制NO合成,加强氧化应激,诱导炎症等多条途径,破坏血管内稳态,加速动脉粥样硬化发展。
研究[30]报道,糖尿病和胰岛素抵抗状态下,血管内皮DDAH-2的表达和活性明显降低,其可能的原因是机体高血糖时,蛋白质经非酶糖化生成的AGEs明显增加,AGEs进一步诱导的氧化应激增加,使得DDAH-2被氧化(DDAH分子在具有一个活跃的半胱氨酸基团,其巯基容易被氧化失活[14])。也有研究[7]发现,糖尿病时机体分泌的炎症因子增加,TNF-α等炎症因子可以降低内皮细胞DDAH的活性。此外,研究[24,26]发现,DDAH(-/-)的老鼠,体内ADMA水平明显增加,NO合成减小;而DDAH-1高表达的老鼠[27],ADMA水平降低,NOS表达和活性明显增加,NO水平增加,同时伴有胰岛素敏感性增加。
考虑到肝脏是ADMA的主要代谢器官[11],决定着血液中ADMA的水平,本研究发现,2型糖尿病机体肝脏DDAH-1表达也明显下降。研究[1]发现,DDAH基因在启动子区域含有PPAR-γ的结合位点,PPAR-γ激动剂可以激活DDAH,加强ADMA代谢消除;研究[16]发现替米沙坦(AngⅡ受体阻断剂,同时可以激活PPAR-γ)可以通过激活血管内皮的PPAR-γ,上调DDAH-2表达,伴随着ADMA的下降,NO的增加。同时还发现,如果阻断PPAR-γ通路,替米沙坦上调DDAH的效应也被阻止了,说明PPAR-γ在上调DDAH-2的表达上起到重要作用;本研究结果发现,罗格列酮在激活上调肝脏PPAR-γ的同时,伴随着肝脏DDAH-1表达的上调,而且血浆ADMA水平明显下降,该结果再次验证了,PPAR-γ激活剂可能会通过上调DDAH表达,进而降低ADMA,对血管内皮起到保护作用。
研究[4]报道,运动可以降低机体AGEs水平,其可能的机制是通过增加胰岛素敏感性,降低血糖,同时提高抗氧化酶系活性,加速AGEs前体(富含羰基的葡萄糖代谢中间产物甲基乙二醛和3-脱氧葡萄糖酮醛)的消除;此外,运动还可以降低醛酮还原酶(Aldose Reductase,AR)活性,减少葡糖糖经多元醇途径代谢,减轻氧化应激和减轻炎症反应,降低AGEs的产生[10]。但是运动对DDAH的影响还不是很清楚。本研究发现,运动可以上调肝脏DDAH-1的表达,同时伴有血浆CML和ADMA的降低,该结果提示,运动可能通过,降低CML(AGEs),减轻氧化应激,进而提高肝脏DDAH-1的表达,最终降低循环中ADMA水平,减少其对血管内皮的损伤。
该研究还发现,运动还可以上调肝脏PPAR-γ的表达,而有研究[12,17]发现,AGEs通过激活NF-κB,NF-κB竞争性结合PPAR-γ辅助转录因子,阻止PPAR-γ由细胞质到细胞核的移位,降低PPAR-γ的活性。所以该研究结果也提示我们,运动降低AGEs可能导致PPAR-γ表达和活性增加。
考虑到运动和罗格列酮都有降低ADMA的作用,但是机制上又不完全相同,那么推测其效应可能存在着协同。本实验结果发现“运动+罗格列酮”联合干预后,分别与单独运动和单独罗格列酮干预相比,CML和ADMA的水平进一步降低趋势,其中ADMA明显低于单独运动干预,CML明显低于单独罗格列酮干预;而且“运动+罗格列酮”联合干预组,肝脏PPAR-γ和DDAH-1表达明显分别高于单独运动组和单独罗格列酮组。说明“运动+罗格列酮”在降低CML和ADMA方面可能存在协同效应,与我们之前的推测相吻合;其机制可能是运动通过降低氧化应激,降低AGEs,上调了DDAH-1的表达,同时也上调了PPAR-γ的表达,而罗格列酮激活PPAR-γ,激活的PPAR-γ启动上调了DDAH-1的表达,因此,运动和罗格列酮在机制上存储在互补与叠加,使得二者的联合在降低ADMA,保护血管内皮方面具有协同作用(图5)。
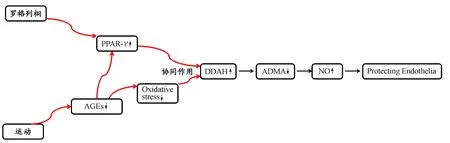
图 5 运动与罗格列酮保护血管内皮的协同机制Figure 5. Synergistic Effect of Exercise and Rosiglitazone in Protecting Vascular Endothelium
由图5可见,ADMA位于AGEs的下游,更靠近临床终点,本研究结果发现,CML和ADMA未见明显相关,该结果可能与“代谢记忆”有关[5,25],即AGEs导致的慢性代谢异常,具有遗留效应,即使血糖,CML得到很好的控制(与正常组无显著性差异),但是ADMA的水平还是明显高于正常组,很难恢复到正常。
上述研究说明DDAH/ADMA/NO途径在糖尿病血管皮内损伤中发挥着重要的作用,因此,加强DDAH活性,降低ADMA,促进NO的合成,可能是一个新的预防和治疗糖尿病血管并发症的途径,具有一定的临床前景。而且该研究结果提示我们,运动和药物联合在预防糖尿病血管并发症方面具有一些潜在的益处,存在的协同效应,后期还需要探讨运动与药物相互作用的量效关系,为更加科学合理的临床用药提供理论依据。
[1]ACHAN V,TRAN C T,ARRIGONI F,etal.all-trans-Retinoic acid increases nitric oxide synthesis by endothelial cells:a role for the induction of dimethylarginine dimethylaminohydrolase[J].Circ Res,2002,90(7):764-769.
[2]ANTONIADES C,DEMOSTHENOUS M,TOUSOULIS D,etal.Role of asymmetrical dimethylarginine in inflammation-induced endothelial dysfunction in human atherosclerosis[J].Hypertension,2011,58(1):93-98.
[3]BOGER R H,MAAS R,SCHULZE F,etal.Asymmetric dimethylarginine(ADMA) as a prospective marker of cardiovascular disease and mortality-an update on patient populations with a wide range of cardiovascular risk[J].Pharmacol Res,2009,60(6):481-487.
[4]BROWNLEE M.The pathobiology of diabetic complications:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[5]BROWNLEE M,CERAMI A,VLASSARA H.Advanced glycosylation end products in tissue and the biochemical basis of diabetic complications[J].N Engl J Med,1988,318(20):1315-1321.
[6]CLOSS E I,BASHA F Z,HABERMEIER A,etal.Interference of L-arginine analogues with L-arginine transport mediated by the y+ carrier hCAT-2B[J].Nitric Oxide,1997,1(1):65-73.
[7]EID H M,LYBERG T,AMESEN H,etal.Insulin and adiponectin inhibit the TNFalpha-induced ADMA accumulation in human endothelial cells:the role of DDAH[J].Atherosclerosis,2007,194(2):e1-8.
[8]FARACI F M,BRIAN J E J R,HEISTAD D D.Response of cerebral blood vessels to an endogenous inhibitor of nitric oxide synthase.Am J Physiol,1995,269(5 Pt 2):H1522-1527.
[9]GAREKANI E T,MOHEBBI H,KRAEMER R R,etal.Exercise training intensity/volume affects plasma and tissue adiponectin concentrations in the male rat[J].Peptides,2011,32(5):1008-1012.
[10]GU Q,WANG B,ZHANG X F,etal.Contribution of receptor for advanced glycation end products to vasculature-protecting effects of exercise training in aged rats[J].Eur J Pharmacology,2014,741:186-194.
[11]HU X,ATZLER D,XU X,etal.Dimethylarginine dimethylaminohydrolase-1 is the critical enzyme for degrading the cardiovascular risk factor asymmetrical dimethylarginine[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2011,31(7):1540-1546.
[12]HSU W H,LEE B H,HSU Y W,etal.Peroxisome proliferator-activated receptor-γ activators monascin and rosiglitazone attenuate carboxymethyllysine-induced fibrosis in hepatic stellate cells through regulating the oxidative stress pathway but independent of the receptor for advanced glycation end products signaling[J].J Agricultural Food Chemistry,2013,61(28):6873-6879.
[13]JING Z,KUANG L,LIU N,etal.LC-MS/MS for the simultaneous determination of polar endogenous ADMA and CML in plasma and urine from diabetics[J].Bioanalysis,2015,7(10):1261-1271.
[15]LU C W,XIONG Y,HE P.Dimethylarginine dimethylaminohydrolase-2 overexpression improves impaired nitric oxide synthesis of endothelial cells induced by glycated protein[J].Nitric Oxide,2007,16(1):94-103.
[14]LEIPER J,MURRAY R J,MCDONALD N,etal.S-nitrosylation of dimethylarginine dimethylaminohydrolase regulates enzyme activity:Further interactions between nitric oxide synthase and dimethylarginine dimethylaminohydrolase[J].Proceedings of the National Academy of Sci,2002,99(21):13527-13532.
[16]LUO Z,ASLAM S,WELCH W J,etal.Activation of nuclear factor erythroid 2-related factor 2 coordinates dimethylarginine dimethylaminohydrolase/PPAR-gamma/endothelial nitric oxide synthase pathways that enhance nitric oxide generation in human glomerular endothelial cells[J].Hypertension,2015,65(4):896-902.[17]MAHALI S K,MANNA S K.Beta-d-glucoside protects against advanced glycation end products(AGEs)-mediated diabetic responses by suppressing ERK and inducing PPAR gamma DNA binding[J].Biochemical Pharmacology,2012,84(12):1681-1690.[18]MUZEEB S,VENKATESH P,MULLANGI R,etal.Influence of cholestyramine on the pharmacokinetics of rosiglitazone and its metabolite,desmethylrosiglitazone,after oral and intravenous dosing of rosiglitazone:impact on oral bioavailability,absorption,and metabolic disposition in rats[J].Xenobiotica,2006,36(9):838-56.
[19]NIJVELDT R.The liver is an important organ in the metabolism of asymmetrical dimethylarginine(ADMA)[J].Clinical Nutrition,2003,22(1):17-22.
[20]PARK Y,WU J,ZHANG H,etal.Vascular dysfunction in Type 2 diabetes:emerging targets for therapy[J].Expert Rev Cardiovascular Therapy,2009,7(3):209-213.
[21]PALM F,ONOZATO M L,LUO Z,etal.Dimethylarginine dimethylaminohydrolase(DDAH):expression,regulation,and function in the cardiovascular and renal systems[J].Am J Physiol Heart Circ Physiol,2007,293(6):H3227-3245.
[22]POPE A J,KARUPPIAH K,CARDOUNEL A J.Role of the PRMT-DDAH-ADMA axis in the regulation of endothelial nitric oxide production[J].Pharmacol Res,2009,60(6):461-465.
[23]SCALERA F,MARTENS LOBENHOFFER J,BUKOWSKA A,etal.Effect of telmisartan on nitric oxide-asymmetrical dimethylarginine system:role of angiotensin II type 1 receptor gamma and peroxisome proliferator activated receptor gamma signaling during endothelial aging.Hypertension,2008,51(3):696-703.
[24]SYDOW K,MONDON C E,SCHRADER J,etal.Dimethylarginine dimethylaminohydrolase overexpression enhances insulin sensitivity[J].Arterioscler Thromb Vasc Biol,2008,28(4):692-697.
[25]TAKEUCHI M,YAMAGISHI S.Involvement of toxic AGEs(TAGE) in the pathogenesis of diabetic vascular complications and Alzheimer's disease[J].J Alzheimers Dis,2009,16(4):845-858.
[26]TANAKA M,SYDOW K,GUNAWAN F,etal.Dimethylarginine dimethylaminohydrolase overexpression suppresses graft coronary artery disease[J].Circulation,2005,112(11):1549-1556.
[27]TORONDEL B,NANDI M,KELLY P,etal.Adenoviral-mediated overexpression of DDAH improves vascular tone regulation[J].Vasc Med,2010,15(3):205-213.
[28]TSUTSUMI E,MURATA Y,SAKAMOTO M,etal.Effects of exercise on the nephron of Goto-Kakizaki rats:morphological,and advanced glycation end-products and inducible nitric oxide synthase immunohistochemical analyses[J].J Diabetes Its Complications,2015,29(4):472-478.
[29]VERESH Z,RACZ A,LOTZ G,etal.ADMA impairs nitric oxide-mediated arteriolar function due to increased superoxide production by angiotensin II-NAD(P)H oxidase pathway[J].Hypertension,2008,52(5):960-966.
[30]YUAN Q,HU C P,GONG Z C,etal.Accelerated onset of senescence of endothelial progenitor cells in patients with type 2 diabetes mellitus:Role of dimethylarginine dimethylaminohydrolase 2 and asymmetric dimethylarginine[J].Biochemical and Biophysical Res Communications,2015,458(4):869-876.
Synergistic Effect and Mechanism of Exercise and Rosiglitazone on Reducing ADMA
JING Zhi-qiang1,LIU Nai-feng2,YANG Jin1
To explore effect of exercise and Rosiglitazone on reducing ADMA,is there the presence of synergistic effect? STZ induced T2DM rats model were divided into control group,T2DM group,T2DM+Rosiglitazone group,T2DM+Exercise group,and T2DM+Rosiglitazone+ Exercise group,for 10 weeks intervention.The results show that Rosiglitazone can reduce the level of CML(P<0.01) and ADMA(P<0.01),and increase the liver ppar-gamma(P<0.01) and DDAH-1(P<0.01) mRNA expression compared with T2DM group.Exercise can reduce the level of CML(P<0.01) and ADMA(P<0.05),and increase the liver ppar-gamma(P<0.05) and DDAH-1(P<0.01) mRNA expression compared with T2DM group.Exercise and Rosiglitazone combined together reduce the level of CML significantly lower than single Rosiglitazone group(P<0.01),ADMA significantly lower than the single exercise group(P<0.05),liver ppar-gamma and DDAH -1 mRNA expression were significantly higher than exercise group(P<0.01) and Rosiglitazone group(P<0.01) separately.In conclusion,there is possible synergistic effect of exercise and Rosiglitazone on reducing ADMA,its mechanism based on AGEs/PPAR-gamma/DDAH/ADMA pathway.
exercise;Rosiglitazone;synergisticeffect;ADMA;DDAH-1;PPAR-γ
1002-9826(2016)06-0074-07
10.16470/j.csst.201606012
2016-05-24;
2016-09-09
中央高校科研基金(ZJ13076)。
景志强(1981-),男,内蒙古人,讲师,博士,主要研究方向为运动和药物相互作用,Tel:(025)86185260, E-mail:zhiqiang_jing@126.com。
1.中国药科大学,江苏 南京 210009;2.东南大学 医学院,江苏 南京 210009 1.China Pharmaceutical University,Nanjing 210009,China;2.Southeast University,Nanjing 210009,China.
G804.7
A

