8-取代-N6-甲基-4′-叠氮-阿糖腺苷类化合物的合成
郭晓河,陶 乐,李玉江,王 强,董黎红
(河南省科学院 高新技术研究中心,河南 郑州 450002)
8-取代-N6-甲基-4′-叠氮-阿糖腺苷类化合物的合成
郭晓河*,陶 乐,李玉江,王 强,董黎红
(河南省科学院 高新技术研究中心,河南 郑州 450002)
以腺苷为起始原料,依次进行碘代、成双键、叠氮化、羟基和氨基的保护、脱碘、羟基和氨基的脱保护、Dimorth 重排、8-位卤化和甲基化等反应制得8-取代-N6-甲基-4′-叠氮-阿糖腺苷类化合物,并经1HNMR、MS确证结构.
8-取代;N6-甲基;4′-叠氮;阿糖腺苷;合成
阿糖腺苷在医药领域是一种良好的抗病毒药[1-5],具有广谱抗病毒活性, 对疱疹病毒及带状疱疹病毒作用最强,对水痘带状疱疹病毒、牛痘病毒、乙肝病毒次之,对腺病毒、伪狂犬病毒和一些RNA肿瘤病毒有效也是合并开发新的抗乙肝、抗艾滋病、抗肿瘤等病的治疗药的起始原料.通过对阿糖腺苷的结构改造,期望发现新的抗病毒、抗肿瘤等活性的先导化合物,丰富核苷类化合物的化合物库.最近,越来越多的研究表明,8-取代腺苷类化合物具有良好的生物活性[6], 但是由于它们在体内易被脱氨酶水解生成肌苷类似物而失活,因此对该类化合物进行一定的结构修饰是非常必要的.合成新型结构的核苷类化合物是当前核酸药物化学中难点与热点之一.近一个世纪以来,抗病毒和抗癌症的药物治疗取得了显著成绩,开发出了很多种药物,有效的延长了患者的生命或提高了患者的生存质量,但大多数药物为细胞毒药物,选择性不高且存在耐药性问题,因此抗各类病毒和抗肿瘤的药物研究和开发仍面临巨大挑战,药物的研究依然是医药领域的重要任务之一.为了提高患者治疗的疗效,取得新的突破性进展,设计更加有效的药物是迫在眉睫的问题.
1 实验部分
1.1 仪器与试剂
质谱仪为高分辨质谱仪 Bruker micro TOF-Qii; 核磁共振波谱仪为Agilent-NMR-vnmrs400型,TMS为内标,试剂均为国产市售.
1.2 中间体与产物的合成
合成路线如图1.
1.2.1 5′-脱氧-5′-碘-腺苷(2)的合成
取腺苷(1)(26.7 g,0.1 mol)溶于吡啶(200 mL),加入三苯基膦(40.1 g, 0.15 mol),溶液冷至0 ℃,慢慢加入碘(37.4 g,0.15 mol),室温继续搅拌反应2 h,加入饱和亚硫酸钠(200 mL),乙酸乙酯萃取(3×200 mL),无水硫酸钠干燥,过滤,浓缩,得到粘稠状物加入二氯甲烷(100 mL),搅拌过夜,析出微黄色固体2(40.6 g, 90.0%).8.38(s,1H,2-H),8.16(s,1H,8-H),7.32 (br s, 2H,-NH2, D2O交换消失),5.92~5.93 (d,J=5.8Hz, 1H,1′-H), 5.60,5.49(-OH,D2O交换消失), 4.81~4.82(d, J=5.3,1H,2′-H),4.17~4.18(d,J=3.7 Hz, 1H, 3′-H), 3.99~4.00(d,J=3.4 Hz,1H,4′-H),3.45~3.64(m,2H,5′-H).MS:m/z=399.987 8(M+Na)+.
1.2.2 1-(5-脱氧-β-D-赤—戊-4-烯呋喃基)-腺嘌呤(3)的合成
取2(30.0 g,79.6 mmol),加入甲醇(250 mL),然后加入甲醇钠(17.2 g, 318 mmol),回流反应4~6 h后,冷至室温,慢慢加入稀盐酸(2 mol/L)中和至pH=7~8,乙酸乙酯萃取(6×500 mL),合并有机相无水硫酸钠干燥,过滤,减压浓缩至干,过快速柱(二氯甲烷∶甲醇=10∶1)得到白色固体3(17.1 g, 86.0%).8.38(s,1H,2-H),8.16(s,1H,8-H),7.36(brs,2H,-NH2,D2O交换消失), 6.16~6.17 (d,J=5.2 Hz,1H,1′-H), 5.70,5.56(-OH,D2O交换消失), 4.82~4.86(m,1H,2′-H), 4.71~4.73 (m,1H,3′-H), 4.21~4.31(m,2H,5′-H),MS:m/z=250.0940(M+H)+.
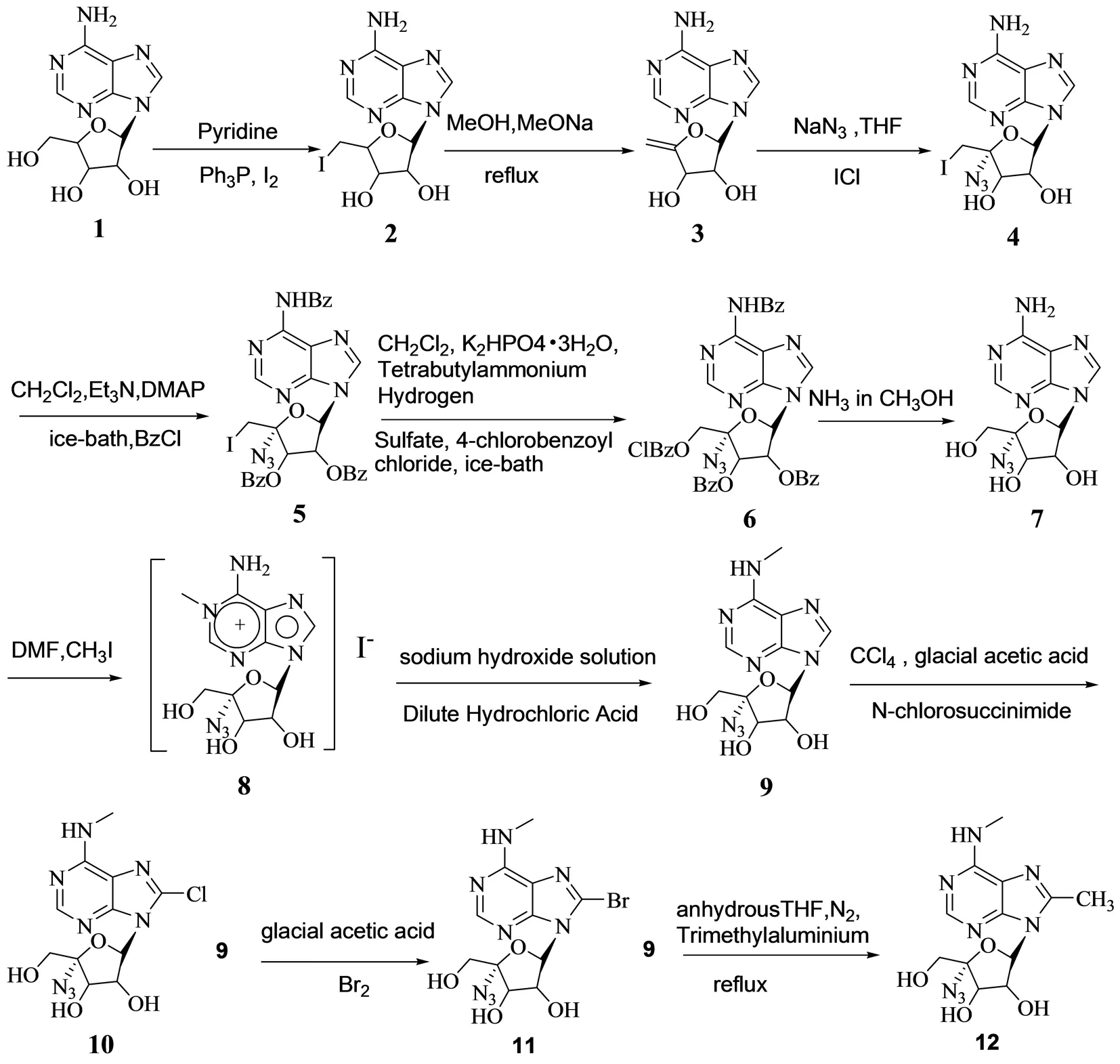
图1 10,11,12的合成路线
1.2.3 4′-叠氮-5′-脱氧-5′-碘-腺苷(4)的合成
叠氮钠(19.6 g,300.1 mmol)溶于四氢呋喃(100 mL),冰浴条件下慢慢加入氯化碘(24.4 g,150.0 mmol),反应0.5 h后,3(17.0 g,68.2 mmol)溶于四氢呋喃(200 mL)小心倒入上述反应液中,室温搅拌反应过夜,反应完全后加入饱和亚硫酸氢钠饱和溶液到上述反应液中,二氯甲烷萃取(3×300 mL),合并有机相无水硫酸钠干燥,过滤,减压浓缩至干,柱层析(体积比二氯甲烷∶甲醇∶三乙胺=100∶10∶1),得到黄色固体4(25.0 g,88.0%).8.48(s,1H,2-H), 8.17 (s,1H, 8-H), 7.36(br s,2H,-NH2,D2O交换消失), 6.17~6.19 (d,J=7.2 Hz,1H,1′-H), 6.311, 5.81(-OH, D2O交换消失), 5.14~5.15(m,1H,2′-H), 4.49~4.51(m,1H,3′-H), 3.55~3.60(m, 2H, 5′-H).MS:m/z=419.007 1(M+H)+.
1.2.4 N-苯甲酰基-2′,3′-二-O-苯甲酰基-4′-叠氮-5′-脱氧-5′-碘-腺苷(5)的合成
取4(24.0 g,57.0 mmol)溶于无水二氯甲烷(300 mL),加入三乙胺(80 mL)和DMAP(1.0 g),冰浴10 min后,滴加苯甲酰氯(48 mL),继续搅拌5 min,反应完全后,在反应液中加入饱和碳酸氢钠,二氯甲烷萃取(3×200 mL),合并有机相,无水硫酸钠干燥,过滤,减压蒸干得到5(34.0 g, 81.0 %). 8.52(s,1H,2-H), 8.20(s,1H,8-H), 7.86(br s,H,-NH,D2O交换消失), 7.42~7.63 (m,6H,-Ar), 7.27~7.40(m,3H,-Ar), 6.96~7.19(m,6H,-Ar), 6.49~6.51(d,J=6.8 Hz, 1H, 1′-H), 5.48~5.50 (m,1H,2′-H), 4.69~4.71 (m, 1H,3′-H), 3.65~3.72(m,2H,5′-H).MS:m/z= 753.067 6 (M+Na)+.
过去的10年,是我国水利事业实现跨越发展,水利公共服务水平明显提升的10年,也是公共财政对水利投入显著增长,财政支持政策逐步完善的10年。中央财政始终将支持水利改革发展作为加快转变经济发展方式的重要抓手和促进粮食稳产增产的重要措施,大幅度增加投入,完善支持政策,推动深化改革,加强资金监管,为水利事业又好又快发展提供了有力支撑。
1.2.5 N-苯甲酰基-2′,3′-二-O-4′-叠氮-苯甲酰基-5′-O-(4-氯)-苯甲酰基-β-D-呋喃基)-腺苷(6)的合成
取5(33.5 g,45.9 mmol)溶于二氯甲烷(400 mL)和水(200 mL),然后加入三水磷酸氢二钾(20.9 g,91.8 mmol),正丁基硫酸氢铵(18.7 g,55.1 mmol),对氯苯甲酸(8.6 g,55.1 mmol),冰浴条件搅拌30 min后,慢慢加入对氯过氧苯甲酸(23.8 g,136.8 mmol),室温条件下继续搅拌过夜,然后补加对氯过氧苯甲酸(11.9 g,68.4 mmol),继续搅拌6 h后,冰浴条件下小心加入饱和的亚硫酸氢钠溶液,然后继续搅拌过夜,析出白色粉末状固体,过滤,分别用水,二氯甲烷,甲醇洗涤,烘干,得到6(26.1 g,75.0%).8.65(s,1H,2-H),8.26(s,1H,8-H), 7.88(brs,H,-NH,D2O交换消失), 7.48~7.75(m,8H,-Ar), 7.35~7.49(m,3H,-Ar), 7.01~7.32 (m,8H,-Ar), 6.52~6.53(d,J=5.7,1H,1′-H), 5.52~5.54(m,1H,2′-H), 4.75~4.77 (m, 1H, 3′-H), 3.83~3.96(m,2H,5′-H).MS:m/z=781.147 9(M+Na)+.
1.2.6 4′-叠氮-腺苷(7)的合成
取6(25 g,33.0 mmol),加入半饱和氨气甲醇(300 mL),室温条件下搅拌反应2~3 d,反应完全后,减压条件下蒸干溶液,得到粘稠状液体,加入二氯甲烷继续搅拌过夜,析出大量白色固体,过滤,二氯甲烷洗涤三次,干燥,得到7(8.5 g,83.5%).8.36(s,1H,2-H),8.15(s,1H,8-H), 7.45(br s,2H,-NH2, D2O交换消失), 6.14~6.16(d,J=7.5 Hz,1H,1′-H), 6.28, 5.83(-OH,D2O交换消失), 5.11~5.13(m, 1H, 2′-H), 4.48~4.50(m,1H,3′-H), 3.53~3.59(m,2H,5′-H).MS:m/z= 331.098 2 (M+ Na)+.
1.2.7 4′-叠氮-N1-甲基-腺苷-碘酸盐(8)的合成
取7(8.0 g,26.0 mmol)溶于DMF(100 mL)和碘甲烷(10 mL),密闭40 ℃条件下搅拌反应8 h后,反应完全后,冷至室温,加入硅藻土搅拌一会,过滤,滤液加入丙酮(600 mL),冷至0 ℃过夜,析出白色固体,过滤,冷丙酮洗涤三次,烘干,得到8(9.9 g,85.1%).10.01(br s,1H,-NH,D2O交换消失), 9.20(br s,1H,-NH,D2O交换消失), 8.81(s,1H,2-H),8.73(s,1H,8-H), 6.26~6.28(d,J=6.8 Hz, 1H,1′-H), 5.86, 5.45(-OH,D2O交换消失), 5.16~5.18(m,1H,2′-H), 4.62~4.65 (m, 1H, 3′-H),3.86(s,3H,-CH3), 3.55~3.63(m,2H,5′-H).MS:m/z=323.086 5 (M+H)+.
1.2.8 4′-叠氮-N6-甲基-腺苷(9)的合成
取8(9.5 g,21.1 mmol)溶于氢氧化钠(25 mL,0.25 mol/L)溶液中,80 ℃条件下搅拌2 h后,冰浴条件下滴加稀盐酸(2 mol/L)至溶液成弱碱性,减压浓缩至干,加入二氯甲烷搅拌过夜,析出白色固体,过滤,二氯甲烷洗涤,得到9(6.0 g,88.5%).8.38(s,1H,2-H),8.17(s,1H,8-H), 7.91(br s,1H,-NH,D2O交换消失)6.15~6.17(d,J=6.5 Hz,1H,1′-H), 5.66, 5.23(-OH,D2O交换消失), 5.14~5.16(m, 1H, 2′-H), 4.65~4.67(m,1H,3′-H), 3.51~3.57(m,2H,5′-H), 2.95 (s,3H, -CH3).MS:m/z= 346.087 3(M+Na)+.
取9(1.6 g,5 mmol)溶于四氯化碳(50 mL),冰醋酸(10 mL)和醋酸钠(2.0 g),然后加入氯代琥珀酰亚胺(8.0 g,60 mmol),40 ℃条件下搅拌2~3 d,减压浓缩,柱层析(体积比二氯甲烷∶甲醇∶三乙胺=5∶1∶0.05),得到10(1.1 g, 62.0%).8.26(s,1H,2-H), 8.02(brs,1H,-NH,D2O交换消失), 6.02~6.04 (d,J=6.9 Hz,1H,1′-H), 5.83, 5.28(-OH,D2O交换消失), 5.12~5.14(m,1H,2′-H), 4.66~4.68 (m,1H,3′-H), 3.48~3.53(m,2H,5′-H), 2.98s,3H,-CH3).MS:m/z=381.582 6 (M+Na)+.
1.2.10 4′-叠氮-N6-甲基-8-溴-腺苷(11)的合成
取9(1.6 g,5 mmol)溶于冰醋酸(20 mL),加入醋酸钠(2.0 g),然后加入 溴素(10 mL),40 ℃条件下搅拌反应2~3 d,加入饱和亚硫酸钠溶液,减压浓缩,柱层析(体积比二氯甲烷∶甲醇∶三乙胺=5∶1∶0.05),得到11(1.7 g, 86.0%).8.29(s,1H, 2-H), 8.06 (br s,1H,-NH,D2O交换消失) 6.00~6.02 (d,J=7.2 Hz, 1H,1′-H), 5.89, 5.35(-OH,D2O交换消失), 5.21~5.23(m,1H,2′-H), 4.72~4.75(m,1H,3′-H), 3.55~3.67(m,2H,5′-H), 3.02 (s,3H, -CH3).MS:m/z=423.086 6 (M+Na)+.
1.2.11 4′-叠氮-N6-甲基-8-甲基-腺苷(12)的合成
取9(2.0 g, 6.3 mmol)溶于无水四氢呋喃(50 mL),氮气保护下,小心用针管注入三甲基铝(6.3 mL,2 mol/L in THF),回流反应过夜,冷却到室温,减压浓缩,柱层析(体积比二氯甲烷∶甲醇∶三乙胺=5∶1∶0.05),得到12(1.0 g, 48.0%).8.19(s,1H,2-H), 7.96(br s,1H,-NH,D2O交换消失)5.98~6.00 (d,J=6.2 Hz, 1H, 1′-H), 5.65, 5.12(-OH,D2O交换消失),4.83~4.86(m,1H,2′-H), 4.35~4.37(m,1H,3′-H),3.22~3.31(m,2H,5′-H), 2.93(s,3H, -CH3), 1.36(s,3H,-CH3).MS:m/z= 360.086 5 (M+Na)+.
2 结果与讨论
文献[7]中报道的碘代反应条件:取腺苷(1)溶于吡啶,加入三苯基膦,如果在室温下加入碘,或者加入碘速度太快,由于反应放热,副反应增多,碘代反应收率低;如果用二氧六环和吡啶做混合溶剂,由于1的溶解性较差,产率很低;我们改进了反应条件,将腺苷的吡啶溶液冷至0~5 ℃,慢慢加入碘,加完碘后室温继续搅拌反应,得到2的产率达到90.0%.
在成双键反应中,为改进实验条件,我们先按照文献[7]的方法,将2溶解到吡啶中,加入叔丁醇钾进行反应,产率达到80%,我们改进了方法,将2用甲醇溶解,加入甲醇钠,回流反应,以86.0%的产率得到3.
在8-取代-N6-甲基-4′-叠氮-阿糖腺苷类化合物的合成中,4′-位的叠氮化反应是个关键步骤,文献[7]中将一氯化碘溶解在N,N-二甲基甲酰胺中,在30 ℃搅拌溶解,由于N,N-二甲基甲酰胺的沸点较高,反应结束后减压蒸馏不太容易将N,N-二甲基甲酰胺彻底蒸完;文献[8]采用一氯化碘溶解在N,N-二甲基甲酰胺中,用叠氮化碘做叠氮试剂,因此我们改用比N,N-二甲基甲酰胺沸点低的四氢呋喃作为溶剂,低温条件下加入一氯化碘,反应结束后很容易将溶剂除去,以88%产率得到4.
在合成5时, 将4溶于无水二氯甲烷,加入三乙胺和DMAP,冰浴,加苯甲酰氯反应在进行羟基和氨基的保护,加完苯甲酰氯后,继续反应的时间不能太长也不能太短,太长了副反应增多,时间太短反应不完全,经过反复试验,找到了加完苯甲酰氯后,继续反应4~10 min较好.
我们参照文献[8]利用Dimorth 重排,合成了关键化合物8,由于在呋喃糖的4位引入了叠氮基团,产率(85.1%)比文献(产率89%)稍有降低,在合成10的步骤中,三步收率为46.7%.
3 结论
以腺苷为起始原料,依次进行碘代、成双键、叠氮化、羟基和氨基的保护、脱碘反应、羟基和氨基的脱保护、Dimorth 重排、8-位卤化和甲基化等反应,合成了未见文献报道的8-取代-N6-甲基-4′-叠氮-阿糖腺苷类化合物,其化学结构经核磁共振、高分辨率质谱分析确证,对反应条件进行了初步探讨,而对所合成化合物的抗病毒和抗肿瘤活性研究尚在进行中.
[1] MAYER A M S, GLASER K B, CUEVAS C, et al.The odyssey of marine pharmaceuticals: a current pipeline perspective [J].Trends Pharmacol Sei, 2010, 31(6): 255-265.
[2] ZOULIM F.Therapy of chronic hepatitis B virus infection:inhibition of the viral polymerase and other antiviral strategies [J].Antiviral Res, 1999, 44(1): 1-30.
[3] 张洪田, 斯崇文, 田庚善.单磷酸阿糖腺苷治疗慢性乙型肝炎研究进展[J].中华传染病杂志, 1999, 17(3): 213-215.
[4] 仉洪田, 曹光华, 崔振宇, 等.国产单磷酸阿糖腺苷治疗慢性乙型肝炎远期疗效多中心对照研究[J].临床肝胆病杂志, 2002, 18(4): 205-206.
[5] HARLO R, NORA V, ANTHONY L S, et al.N6,C8 Disubstituted adenosine derivatives as partial agonists for adenosine A1 receptors [J].J Med Chem, 1996, 39 (7): 1463-1471.
[6] 林桂椿, 刘莉, 张亮仁, 等.8-氯腺苷衍生物的合成及生物活性研究[J].合成化学, 2002, 10: 405-408.
[7] PLINIO P, FELICE D, ROCCO V, et al.First example of phosphoramidate applied to a 4′-substituted purine nucleoside (4′-azidoadenosine): conversion of an inactive nucleoside to a submicromolar compound versus hepatitis C virus [J].J Med Chem, 2007, 50(22): 5463-5470.
[8] HANS M, ROBERT M R, MARY J M, et al.Synthesis and anti-HIV activity of 4′-azido and 4′-methoxy nucleosides [J].J Med Chem, 1992, 35(8): 1440-1451.
[责任编辑:张普玉]
Synthesis of 8-substituted-N6-methyl-4′-azido-adenosine derivatives
GUO Xiaohe*, TAO Le, LI Yujiang, WANG Qiang, DONG Lihong
(High&NewTechnologyResearchCenterofHenanAcademyofSciences,Zhengzhou450002,Henan,China)
8-substituted-N6-methyl-4′-azido-adenosine derivatives were synthesized by iodination, olefinic bond reaction, azidotion, hydroxyl protection, amino protection, deiodination, hydroxy deprotection, amino deprotection, Dimorth rearrangement, 8-halogenation and 8-methylation et al from the cheap adenosine.The structures of all compounds were confirmed by1H NMR and MS.
8-substituted; N6-methyl; 4′-azido; adenosine; synthesis
2016-07-17.
河南省基础与前沿技术研究计划项目(162300410006),河南省重点科技攻关项目(152102210379).
郭晓河(1970-),女,副研究员,研究方向为有机药物化学.*
O626
A
1008-1011(2016)06-0720-05

