SlCBL1基因调控番茄果实成熟发育的分子机理
王媛花,贾思振,颜志明,冯英娜
(1 江苏农林职业技术学院,江苏镇江 212400;2 江苏现代园艺工程技术中心,江苏镇江 212400)
SlCBL1基因调控番茄果实成熟发育的分子机理
王媛花1,2,贾思振1,2,颜志明1,2,冯英娜1,2
(1 江苏农林职业技术学院,江苏镇江 212400;2 江苏现代园艺工程技术中心,江苏镇江 212400)
以番茄(SolanumlycopersicumL.)品种‘Micro Tom’为试材,从其果实中克隆得到番茄类钙调磷酸酶B基因(Tomato Calcineurin B-Like gene,SlCBL1),构建其带有报告基因的e-GFP植物表达载体,分析番茄果实中SlCBL1基因超表达与成熟发育进程的相互关系。结果显示:(1)与对照非转基因植株以及转空载植株相比,转SlCBL1基因番茄中SlCBL1基因过量表达,而且能够使番茄果实成熟期提前3~5 d,表明SlCBL1基因可促进番茄果实成熟。(2)番茄果实成熟相关基因的表达量也受到不同程度调控,其中番茄成熟过程中的色素合成基因、乙烯路径基因以及果实成熟相关转录因子都受到强烈的调控,与对照相比表达量分别上调5~10倍。研究表明,SlCBL1基因能够促进番茄果实成熟,而且通过影响色素合成基因以及果实成熟相关转录因子来调控番茄果实成熟。
番茄‘Micro Tom’;SlCBL1基因;果实发育
类钙调磷酸酶B基因(Calcineurin B-Like geneCBL)家族是一类钙感应器。CBL基因最初在拟南芥中克隆出来,同酵母中钙调磷酸酶B和动物中的神经钙调传感器非常相似,因此被命名为类钙调磷酸B[1]。后来在玉米、水稻、豌豆、大豆和大麦中也发现有CBL基因[2-3]。CBL1基因是目前CBL基因家族中研究得最多的基因,有研究推测其有可能是植物中执行Calcineurin B亚基功能的钙结合元件[4-6]。对CBL1基因的研究大多是关于该基因在非生物胁迫,包括盐、低温、ABA、干旱中的作用。近年来,多个物种中的CBL1基因已被成功分离并进行了功能验证[7-12]。研究发现CBL1基因在不同逆境胁迫与生长发育过程中呈现不同的表达模式,是植物逆境信号传导途径中的关键调控节点[13-15]。
但是,目前的研究只能够充分说明CBL1基因的功能在于调控植物的抗逆性,而CBL1基因对植物的生长发育的调控研究极少,尤其是对果实的生长发育调控研究几乎没有。因此,果实中是否有CBL1基因?如果有,基因功能是什么?是否能够调控果实的生长发育?这些问题是未来研究CBL1基因功能的一个新的方向,不仅对深入解析果实发育及成熟调控的分子机理具有参考价值,同时对深入理解植物抗逆的机理及其分子改良也具有重要的意义。
番茄(SolanumlycopersicumL.)是一种重要的园艺作物,研究番茄的果实成熟发育近年来取得了最深入系统的成果[16-18]。探讨番茄果实成熟的调控机制可为定向改善番茄果实品质提供理论依据。‘Micro Tom’是番茄的矮化突变体,它保留了普通番茄作为模式植物的基本特征,但植株矮小、生命周期更短,具有节省研究空间、缩短研究时间的巨大优势[19]。所以更易于在实验室可控环境条件下观察,可以进行大量取样记录和拍照,确定番茄果实成熟发育的进程。本研究克隆了‘Micro Tom’番茄果实基因CBL1,以番茄‘Micro Tom’为材料转CBL1基因,使CBL1基因在番茄果实中过量表达。通过转基因材料和对照果实的发育进程以及果实相关成熟基因的表达分析,探究番茄CBL1基因在果实成熟发育中的作用,为深入了解果实发育和成熟调控的分子机理提供思路。
1 材料和方法
1.1 试验材料
试验于2014年5月~2016年3月,在江苏农林职业技术学院组培中心和连栋温室进行。番茄品种‘Micro Tom’种子购买自美国Ball Horticultural Company。挑选生长饱满的种子在超净工作台用70%乙醇冲洗30 s,无菌水冲洗2次,10%次氯酸钠消毒8 min,无菌水冲洗3次,接种于1/2MS培养基中,培养番茄无菌苗,15 d以后,选取幼嫩平展的子叶用于基因转化。
转基因番茄和普通番茄栽培于蛭石和营养土混合物(1∶1)的培养钵中,栽培于温室中,温室环境温度为白天23~26 ℃,夜间15~18 ℃,相对空气湿度80%以上。培养至番茄开花时开始观察不同发育时期的番茄果实发育情况,以及取样进行后期基因表达量检测。
1.2 主要培养基配方
番茄种子培养基(1/2MS培养基):1/2MS +20 g/L蔗糖+5.5 g/L琼脂;番茄共培养培养基(MS1):MS+20 g/L蔗糖+ 5.5 g/L琼脂 +2.0 mg/L ZT +0.5 mg/L IAA;番茄筛选培养基(MS2):MS+20 g/L蔗糖+5.5 g/L琼脂 +2.0 mg/L ZT +0.5 mg/L IAA,高压灭菌,冷却至60 ℃加入75 mg/L卡那霉素、400 mg/L羧苄青霉素,分装培养瓶备用;番茄生根筛选培养基(MS3):1/2MS+20 g/L蔗糖+5.5 g/L琼脂,高压灭菌,冷却至60 ℃加入50 mg/L卡那霉素,350 mg/L羧苄青霉素,分装培养瓶备用。所有培养基pH值均调至5.8。
1.3 试验方法
1.3.1 番茄果实发育不同时期CBL1基因表达量的检测 按照‘Micro Tom’番茄果实的发育周期,在本实验室的温湿度条件管理下,果实从开花到完全成熟大约40~42 d。将‘Micro Tom’番茄果实分为小绿果(花后10~12 d)、中绿果(花后16~18 d)、大绿果(花后22~24 d)、绿白果(花后28~30 d)、白果(花后34~36 d)、白转红(花后36~38 d)、黄红果(花后38~40 d)、全红果(花后40~42 d)等8个时期。
分别提取每个时期果实的RNA,反转录为cDNA。根据NCBI数据库中的番茄SlCBL1基因序列(GenBank登录号NM_001252118.1),在Primer3Plus网站设计目的基因SlCBL1基因荧光定量的引物(表1)。采用实时荧光定量PCR(qRT-PCR)方法,检测SlCBL1基因相对表达量。qRT-PCR用ABI公司的荧光定量Steponeplus仪操作,SlCBL1基因和内标Actin基因总反应体系为10 μL,包括3.5 μL super Mix,2 μL Primer Mix (10 μmol/L),1 μL cDNA,3.5 μL无核酸污染的ddH2O,反应程序:94 ℃预变性 3 min;94 ℃变性10 s,55 ℃退火 30 s,40个循环后程序结束,用 Stepone2.3软件分析基因相对表达量。
1.3.2 目的基因克隆和表达载体构建 使用TAKARA公司的RNA提取试剂盒,提取番茄果实的RNA,反转录获得cDNA,根据NCBI数据库中的番茄SlCBL1基因序列,用DNAMAN软件设计目的基因SlCBL1基因全长引物(表1),PCR扩增获得SlCBL1基因全长序列。将SlCBL1基因正向构建于gateway系列表达载体pK7WG2D上,构建得到载体pK7WG2D-SlCBL1载体(以下简称p-SlCBL1载体)。构建好的载体转化农杆菌EHA105,穿刺保存于4 ℃冰箱,用于后续番茄的稳定转化。
1.3.3 番茄稳定转化与转基因植株鉴定 (1)稳定转化。将含质粒pK7WG2D(空载)和p-SlCBL1的农杆菌EHA105在LB培养基上(含50 mg/L SPR和50 mg/L Rif)划板,28 ℃培养2 d,挑取平板上长得好的单菌落,接种到50 mL液体LB培养基中,28 ℃、2 200 r/min 在摇床中振荡培养至OD600为0.4,常温下,5 000转离心8 min,去掉上清液,在无菌滤纸上倒扣离心管,尽量将上清液去除后用MS液体培养基悬浮沉淀菌体,振荡培养活化菌液,至菌液OD600值为0.2~0.3后备用。
将15 d叶龄的番茄组培苗,沿叶脉将叶片剪成大约3 mm2叶块。将活化好的菌液倒入剪好的叶片中,轻微摇匀,浸染30 min。倒出菌液,叶片放置于无菌滤纸上吸干表面的菌液。侵染后的叶片接种于番茄共培养基MS1中,24 ℃培养箱中黑暗共培养3 d。完成共培养的番茄叶片,接种番茄筛选培养基MS2上,使伤口与培养基充分接触,在培养室中(25±2)℃,光照培养。大约40 d左右,可分化出抗性芽,将抗性芽转入番茄生根筛选培养基MS3上生根。获得完整的抗性苗。
(2)转基因植株鉴定。载体pK7WG2D和 p-SlCBL1上均携带超强表达的绿色荧光蛋白基因(eGFP),番茄叶片切口部位长愈伤组织时,将培养瓶放在体式荧光显微镜下,抗性植株愈伤组织有明显的绿色光发出。愈伤组织分化出芽以后抗性植株的芽在荧光显微镜下发绿光,而非抗性植株发红光,可以直接将抗性植株筛选出来。将抗性植株移栽后可用体视荧光显微镜再次分别检测番茄的不同组织器官的荧光。荧光检测的同时,用PCR法检测CaM-35s启动子序列,并且用RT-qPCR方法检测目的基因SlCBL1的表达量。通过以上3种方法检测,确认基因转化成功。
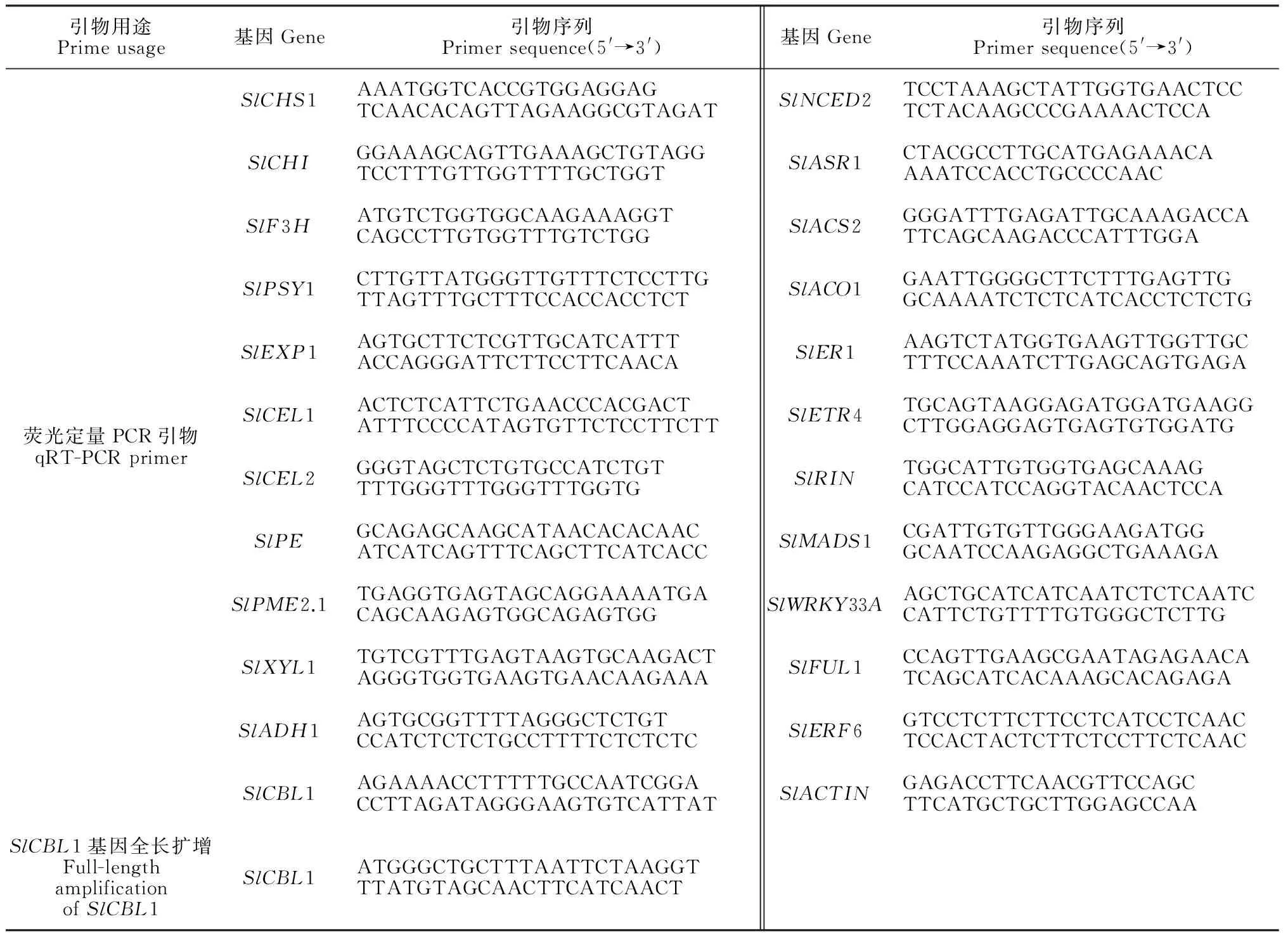
表1 实时荧光定量 PCR所用引物序列

表2 番茄果实成熟发育相关基因
1.3.4 转基因番茄的SlCBL1基因功能分析 将经检测后获得的10个转基因株系的番茄,在生根培养基中生根后移栽大田,开花结果之后收取T1代转基因种子。T1收取的种子经低温春化处理之后,同一时间将转空载、转SlCBL1基因和非转基因的种子播种于直径18 cm的育苗盆中,基质按照泥炭土和蛭石1∶1的比例混匀使用。番茄培养在白天温度25~28 ℃,夜间15~18 ℃的温室中。
(1)转基因番茄果实发育进程:观察番茄果实生长过程,从播种到开花结果,每天拍照记录,观察转SlCBL1基因番茄和空载对照以及非转基因对照的表型差异以及果实成熟时间差异。
(2)转基因番茄与成熟相关基因的表达量变化分析:用RT-qPCR方法检测转SlCBL1基因番茄与空载对照相比较,在果实发育不同3个阶段(绿果期花后22 d、白果期花后34 d、红果期花后40 d)的成熟相关基因表达量变化。共选取与番茄成熟相关的基因22个,基因名称、基因功能以及NCBI登录号见表2,qRT-PCR引物见表1。表达量按照上调下调倍数的方式,以不同颜色作为表达量上调或者下调的倍数。
1.4 数据统计分析方法
所有基因表达量采用2ΔΔCt法来计算相对表达量。番茄不同发育时期的SlCBL1基因相对表达量以第一个时期绿果期为对照。转基因番茄的22个成熟相关基因的表达量均以空载对照植株的相应基因表达量为对照。
2 结果与分析
2.1 番茄果实发育不同时期SlCBL1基因表达量的检测
番茄果实发育的8个不同时期SlCBL1基因的表达量检测显示,在绿果期SlCBL1基因表达量变化不大,基本维持在一个水平。随着果实成熟,果实向绿白期过渡时,SlCBL1基因表达量急剧上升,在果实发育至白果期时,SlCBL1基因表达量达到最高。而后,随着果实变色转红,SlCBL1基因表达量又会很快下降,到果实成熟完全变红后SlCBL1基因表达量降到最低(图1)。这个结果初步说明,在番茄果实成熟过程中,SlCBL1基因有调节成熟的作用,而且在绿果期是正向调节果实成熟的,而随着番茄果实转色变红,表达量会急剧下降。
2.2 目的基因克隆和表达载体构建
根据NCBI数据库中的番茄SlCBL1基因序列(GenBank登录号NM_001252118.1),SlCBL1全长641 bp,设计引物克隆SlCBL1基因。克隆得到的基因片段大小与慕斯基因片段大小一致(图2),对基因进行测序分析,测序结果和NCBI数据库中的SlCBL1基因序列比对后一致性为100%。为了缩短后期转基因植株的筛选检测时间,以及检测时更加便利,选择了gataway系列植物表达载体pK7WG2D。pK7WG2D载体上携带有超表达报告基因e-GFP(图2),便于后期的转基因植株的检测。
2.3 番茄稳定转化与转基因植株鉴定
本试验中用到的载体比较特殊,因此转基因周期较短。得到完整的转基因植株需要150 d左右。图3,A~D是从开始转基因、愈伤组织生长、植株生长到结果的全过程。过程中,在体式荧光显微镜下检测荧光,可以将大部分非转基因植株去除,留下荧光下绿色的植株继续做后期检测,确认转基因是否成功。图3,E~H分别是转基因植株的愈伤组织、花和果实的荧光照片。转基因成功的植株,能够在发育的不同阶段检测到荧光。图3,H中,将非转基因的果实和转基因果实放置于荧光显微镜下,非转基因果实为紫红色,而转基因植株为绿色,通过荧光检测能够初步确定转基因成功。
荧光检测后,必须通过分子检测进一步确认转基因成功。因为番茄本身有SlCBL1基因,因此选取了载体上35S启动子进行检测,检测结果显示(图4,A),转基因的10个株系,以及转空载体的1个株系中均有35S基因表达,而非转基因植株中没有表达。进一步对SlCBL1基因本身的表达量进行检测,检测结果表明(图4,B),SlCBL1基因超表达的10个转基因株系中的SlCBL1基因表达量都显著高于空载对照和非转基因植株。通过以上结果能够确认SlCBL1基因已经成功转入番茄中。

SGF.小绿果;MGF.中绿果;BGF.大绿果;GWF.绿白果;WF.白果;WRF.白转红;YRF.黄红果;RF. 全红果.图1 番茄果实不同发育阶段SlCBL1基因表达水平SGF. Small green friut;MGF. Middle green friut;BGF. Big green friut;GWF. Green white fruit;WF. White fruit;WRF. White red fruit;YRF. Yellow red fruit;RF. Red fruit.Fig.1 SlCBL1 gene expression in tomato fruits of different development stages

图2 植物表达载体pK7WG2D-SlCBL1构建过程Fig.2 Construction of plant expression vector pK7WG2D-SlCBL1

A. 侵染后的番茄叶片;B.不定芽;C.抗性植株;D.完整的转基因番茄;E.愈伤组织荧光;F.花荧光;G.小绿果荧光;H.非转基因果实和转基因果实荧光对比图3 番茄转基因过程以及绿色荧光检测A.Tomato leaf infection; B.Adventitious buds; C.Tomato resistance seedlings;D.Complete transgenic tomato;E.Callus fluorescence;F.Flower fluorescence;G.SGF fluorescence;H. Non-gmo fruit and transgenic fruits fluorescent contrastFig.3 The tomato genetically modified process and green fluorescence detection
2.4 转基因番茄的SlCBL1基因功能分析
转SlCBL1基因、转空载体以及非转基因的种子同时播种后,放置于相同环境条件下,观察果实发育。结果发现转SlCBL1基因的果实成熟更快(图5)。通过大量果实的观察发现转SlCBL1基因的果实能够比转空载和非转基因对照平均提前成熟3~5 d,该结果更进一步说明SlCBL1基因在番茄果实成熟中是起作用的,能够促进番茄果实成熟。
分析了3个不同发育时期果实中影响番茄果实成熟的22 个相关基因表达量变化,结果表明SlCBL1基因超表达对果实成熟相关基因都有不同程度的影响。其中影响最大的是对色素合成相关基因SlCHS1、SlCHI、SlF3H、SlPSY1,与对照相比,这些基因的表达量都有5~10倍或者超过10倍的上调(图6)。这说明SlCBL1基因促进番茄果实成熟首先是通过调控色素代谢相关基因完成的。除此以外,影响最明显的还有与番茄成熟相关的一些转录因子也受到强烈上调,其中SlWRKY33A和SlERF6上调也超过10倍以上。综合以上结果可以初步说明SlCBL1基因超表达会影响色素代谢基因、乙烯路径基因以及和成熟相关转录因子的表达,进而影响果实成熟。

M. DNA marker; S1~S10. 10个不同转基因株系;N-CK. 非转基因;CK. 空载对照. 图4 转基因番茄PCR和荧光定量PCR检测M. DNA marker;S1-S10. 10 different gm strains;N-CK:Non-genetically modified;CK.Empty vector controlFig.4 Transgenic tomato PCR and fluorescence quantitative PCR detection

SGF.小绿果;MGF.中绿果;BGF.大绿果;GWF.绿白果;WF.白果;WRF.白转红;YRF.黄红果;RF. 全红果.图中的转SlCBL1基因植株为株系S3图5 番茄的成熟过程对比SGF. Small green friut;MGF. Middle green friut;BGF. Big green friut;GWF. Green white fruit;WF. White fruit;WRF. White red fruit;YRF. Yellow red fruit;RF. Red fruit. SlCBL1 transgenic plant in the figure is strain S3Fig.5 Mature process of tomato

MGF.中绿果;WF.白果;RF. 全红果.图中的转SlCBL1基因植株为株系S3图6 转SlCBL1基因番茄果实成熟相关基因分析MGF. Middle Green Friut;WF. White Fruit;RF. Red Fruit. SlCBL1 transgenic plant In the figure is strain S3Fig.6 The ripe related gene analysis of tomato genetically modified with SlCBL1 gene
3 讨 论
番茄作为一种重要的园艺作物,其品质形成及成熟调控研究是近年来研究的重要问题之一。多年来,科研工作者围绕番茄果实发育及成熟机理开展了很多研究,但这些研究主要集中在激素包括乙烯、茉莉酸、水杨酸,一些多胺类物质以及相关酶类[16-19],相关研究也多针对果实发育及成熟过程中某些生理、生化过程变化的探讨上,而对果实发育及成熟调控的分子基础了解甚少。
目前已经从番茄中分离鉴定出13个CBL基因,并对它们的基因组分布、分子特征、系统进化以及顺式元件进行了分析,为研究番茄CBL的功能提供线索[31]。而尽管相关的研究很多,但是目前几乎所有关于CBL基因的研究都是研究其在抗逆中的作用,很少有研究其在果实发育及成熟调控中的作用。本研究首先分析了番茄果实发育不同阶段SlCBL1基因的表达量差异,结果表明,番茄在不同的发育阶段,表达量差异很大,说明在番茄果实成熟过程中,SlCBL1基因是起作用的。为了进一步验证SlCBL1基因在果实成熟中的作用,通过稳定转基因,将SlCBL1基因成功转入番茄品种‘Micro Tom’。对转基因番茄和对照的果实发育进程观察,初步确定SlCBL1基因超表达能够促进番茄果实发育成熟。对番茄成熟相关的22 个基因表达量分析结果也表明。SlCBL1基因超表达会影响包括色素代谢基因、成熟软化相关基因、乙烯路径基因以及与成熟相关转录因子的表达量变化。很多基因受到强烈的调控,因涉及基因较多,详细机理还有待进一步研究。
综上所述,SlCBL1在番茄中的功能除了操纵植物的抗逆性,还能够调控植物的生长和发育。番茄果实中SlCBL1基因超表达可以调控果实成熟相关基因的表达,因而操纵番茄果实的发育和成熟进程。虽然目前本研究不能够详细解释相关机理,但是对深入解析番茄果实发育及成熟调控的分子机理具有参考价值,同时对CBL基因家族的研究提供了一条新的思路。
[1] ZHU J K, LIU J, XIONG L. Genetic analysis of salt tolerance inArabidopsis[J].ThePlantCell, 1998,10(7):1 181-1 191.
[2] MARTíNEZ-ATIENZA J, JIANG X, GARCIADEBLAS B,etal. Conservation of the salt overly sensitive pathway in rice[J].PlantPhysiology, 2007,143(2):1 001-1 012.
[3] WANG M Y, GU D, LIU T S,etal.Overexpression of a putative maize calcineurin B-like protein inArabidopsisconfers salt tolerance[J].PlantMolecularBiology, 2007,65(6): 733-746.
[4] SHI S S, CHEN W, SUN W N. Comparative proteomic analysis of theArabidopsiscbl1 mutant in response to salt stress[J].Proteomics, 2011,11(24): 4 712-4 725.
[5] ALBRECHT V, WEINL S, BLAZEVIC D,etal.The calcium sensor CBL1 intergrates plant responses to abiotic stresses[J].ThePlantJournal, 2003,36(4): 457-470.
[6] CHEONG Y H, KIM KN, PANDEY G K,etal.CBL1, a Calcium sensor that differentially regulates salt,drought, and cold responses inArabidopsis[J].ThePlantCell, 2003,15(8): 1 833-1 845.
[7] 马齐军,胡大刚, 由春香,等.苹果MdCBL家族基因表达分析及MdCBL1的功能鉴定[J].园艺学报, 2014,41(6):1 053-1 062.
MA Q J, HU D G, YOU C X,etal. Classification and expression analysis of apple MdCBL family genes with a functional characterization ofMdCBL1[J].ActaHorticulturaeSinica,2014,41(6):1 053-1 062.
[8] 韩金龙, 李 慧, 丛 郁,等. 杜梨CBL1和CBL7基因对非生物逆境的响应[J].果树学报, 2014,31(4): 529-535.
HAN J L, LI H, CONG Y,etal. Comparison of twoCBLgenes on stress tolerance functions fromPyrusbetulaefolia[J].JournalofFruitScience, 2014,31(4): 529-535.
[9] 许园园, 蔺 经, 李晓刚, 等.梨CBL基因家族全基因组序列的鉴定及非生物胁迫下的表达分析[J]. 中国农业科学, 2015,48(4): 735-747.
XUY Y, LIN J, LI X G,etal.Identification and expression analysis under Abiotic Stresses of theCBLgene family in Pear[J].ScientiaAgriculturaSinica, 2015,48(4): 735-747.
[10] GAO P, ZHAO P M, WANG J,etal.Co-expression and preferential interaction between two calcineurin B-like proteinsandaCBL-interacting protein kinase from cotton[J].PlantPhysiologyandBiochemistry, 2008,46(10): 935-940.
[11] 赵晋锋, 余爱丽, 田 岗, 等. 谷子CBL基因鉴定及其在干旱、高盐胁迫下的表达分析[J]. 作物学报, 2013,39(2): 360-367.
ZHAO J F, YU A L, TIAN G,etal.Identification of CBL genes from foxtailMillet(Setariaitalic[L.]Beauv.)and Its Expression under drought and salt stresses[J].ActaAgronomicAsinica, 2013,39(2): 360-367.
[12] ZHAO J F, SUN Z F, ZHENG J,etal.Cloning and characterization of a novel CBL-interacting protein kinase from maize[J].PlantMolecularBiology, 2009,69(6): 661-674.
[13] TOKAS I,PANDEY A,PANDEY GK. Roleofcalcium-mediated CBL-CIPK network in plant mineral nutrition and abiotic stress[M].MolecularStressPhysiologyofPlants, 2013: 241-261.
[14] DRERUP M M, SCHLUCKING K, HASHIMOTO K,etal.The calcineurin B-like calcium sensors CBL1 and CBL9 together with their interacting protein kinase CIPK26 regulate theArabidopsisNADPH oxidase RBOHF[J].MolecularPlant, 2013,6(2): 559 -569.
[15] MAHS A, STEINHORST L, HAN J P,etal.The calcineurin B-like Ca2+sensors CBL1 and CBL9 function in pollen germination and pollen tube growth inArabidopsis[J].MolecularPlant, 2013,6(4): 1 149-1 162.
[16] 汪 莹, 孔俊花, 陈微微, 等. 番茄果实成熟相关转录因子的研究进展[J]. 园艺学报, 2014,41(9):1 811-1 820.
WANG Y, KONG J H, CHEN W W,etal. Fruit ripening-related transcription factors in tomato[J].ActaHorticulturaeSinica, 2014,41(9):1 811-1 820.
[17] 左进华, 陈安均, 孙爱东,等. 番茄果实成熟衰老相关因子研究进展[J]. 中国农业科学, 2010,43(13): 2 724-2 734.
ZUO J H, CHEN A J, SUN A D,etal. Research Progress on the factors related to tomato fruit ripening and senescence[J].ScientiaAgriculturaSinica, 2010,43(13): 2 724-2 734.
[18] 肖 东, 肖 阳, 蔡应繁, 等. 番茄果实成熟相关基因SlPEL和SlAPL的表达特性[J]. 作物学报, 2010,36(7): 1 135-1 142.
XIAOD, XIAOY, CAI Y F,etal. Isolation and expression of two fruit ripening related genesSlPELandSlAPLin tomato (Solanumlycopersicum)[J].ActaAgronomicaSinica, 2010,36(7): 1 135-1 142.
[19] 刘小花, 张岚岚, 朱长青, 等. Micro-Tom番茄矮化微型机制及其在植物功能基因组学研究中的应用[J]. 遗传, 2008,30(10): 1 257-1 264.
LIU X H, ZHANG L L, ZHU C Q,etal.Mechanisms for miniature dwarf characteristics of Micro-Tom tomato and its application in plant functional genomics studies[J].Hereditas, 2008,30(10): 1 257-1 264.
[20] ESPANA L, HEREDIA-GUERRERO JA, REINA-PINTO JJ,etal.Transient Silencing of CHALCONE SYNTHASE during fruit ripening modifies tomato epidermal cells and cuticle properties[J].PlantPhysiology, 2014,166(3):1 371-1 386.
[21] KANG JH, MCROBERTS J, SHI F,etal.The flavonoid biosynthetic enzyme chalcone isomerase modulates terpenoid production in glandular trichomes of tomato[J].PlantPhysiology, 2014,164(3): 1 161-1 174.
[22] KANG B S, GUQ S, TIAN P,etal.A chimeric transcript containing Psy1 and a potential mRNA isassociated with yellow flesh color in tomato accession PI 114490[J].Planta, 2014,240(5): 1 011-1 021.
[23] 雷东锋, 李剑君, 张 宴, 等. 果实成熟过程相关调控基因研究进展[J]. 西北植物学报, 2000,20(1): 149-157.
LEI D F, LI J J, ZHANG Y,etal.The latest development about regulation and controlling of fruit ripening gene[J].ActaBotanicaBoreal-OccidentaliaSinica, 2000,20(1): 149-157.
[24] ZHANG M, YUAN B, LENG P. The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit[J].JournalofExperimentalBotany,2009,60(6): 1 579-1 588.
[25] CAKIR B, AGASSE A, GAILLARD C,etal. A grape ASR protein involved in sugar and abscisic acid signaling[J].ThePlantCell, 2003,15(9): 2 165-2 180.
[26] MARGOSSIAN L J, FEDERMAN A D, GIOVANNONI JJ,etal.Ethylene-regulated expression of a tomato fruit ripening gene encoding a proteinase inhibitor I with a glutamic residue at the reactive site[J].ProceedingsoftheNational.AcademyofSciencesoftheUnitedStatesofAmerican, 1988,85 (21), 8 012-8 016.
[27] KAMIYOSHIHARA Y,IWATA M,FUKAYA T,etal.Turnover ofLeACS2, a wound-inducible1-aminocyclopropane-1-carboxylic acid synthase in tomato, is regulated by phosphorylation/dephosphorylation[J].ThePlantJournal, 2010,64 (1): 140-150.
[28] JAFARI Z, HADDAD R, HOSSEINI H,etal.Cloning, identification and expression analysis of ACC oxidase geneinvolved in ethylene production pathway[J].MolecularBiologyReports, 2013,40 (2): 1 341-1 350.
[29] LEE JM, JOUNG JG, MCQUINN R,etal. Combined transcriptome, genetic diversity and metabolite profiling in tomato fruit reveals that the ethylene responsefactorSlERF6 plays an important role in ripening andcarotenoid accumulation[J].ThePlantJournal, 2012,70(2): 191-204.
[30] ZHOU J, WANG J, ZHENG Z,etal. Characterization of the promoter and extended C-terminal domain ofArabidopsisWRKY33 and functional analysis of tomatoWRKY33homologues in plant stress responses[J].JournalExperimentalBotany, 2015,66 (15): 4 567-4 583.
[31] 刘淑梅, 王施慧, 刘明毓, 等. 番茄CBL 家族基因的鉴定和遗传进化分析[J].分子植物育种, 2015,13(10): 2 268- 2 273.
LIU S M, WANG S H, LIU M Y,etal.Identification and characterization of CBL family genes in tomato[J].MolecularPlantBreeding, 2015,13(10): 2 268-2 273.
(编辑:宋亚珍)
Molecular Mechanism ofSlCBL1 Regulation during Tomato Fruit Development
WANG Yuanhua1,2,JIA Sizhen1,2, YAN Zhiming1,2, FENG Yingna1,2
(1 Jiangsu Polytechnic College of Agriculture and Forestry, Zhenjiang,Jiangsu 212400,China; 2 Jiangsu Engineering and Technology Center for Modern Horticulture,Zhenjiang,Jiangsu 212400,China)
With tomato (SolanumlycopersicumL.) variety ‘Micro Tom’ as test materials, we cloned the tomato Calcineurin B-Like gene (SlCBL1) from ‘Micro Tom’ fruitand constructed inplant expression vector with e-GFP report gene. Then we analyzed the relationship betweenSlCBL1 gene over-expression and tomato fruit development. The results show that: (1) compared with non-transgenic plants and empty vector plant, over-expressionSlCBL1 can promote fruit mature and made tomato fruit mature for 3 to 5 days in advance. (2) The expression of tomato fruit development related genes also regulated in different degrees. Including tomatoes mature in the process of pigment synthesis genes, the path of ethylene and ripe related transcription factors have been strongly regulated, and the expression level raised about 5 to 10 times compared with control. Results show thatSlCBL1 gene can promote the fruit development, and by influencing the pigment synthesis genes and ripe related transcription factors to control tomato fruit mature.
tomato‘Micro Tom’;SlCBL1 gene;fruit development
1000-4025(2016)11-2173-09
10.7606/j.issn.1000-4025.2016.11.2173
2016-08-19;修改稿收到日期:2016-10-31
江苏农林职业技术学院院级项目(2014kj15);江苏高校品牌专业建设工程资助项目(PPZY2015B173);江苏省自然科学基金(BK20160567)
王媛花(1981-)女,博士,讲师,主要从事园艺植物分子生物学研究。E-mail:wangyuanhua0511@163.com
Q785;Q786
A

