旱麦草EtAP2基因的克隆及其对干旱胁迫的响应表达
王梦瑶,周茜萍,吕新华,冯 丽,孙 黎
(石河子大学 生命科学学院,农业生物技术重点实验室,新疆 石河子 832003)
旱麦草EtAP2基因的克隆及其对干旱胁迫的响应表达
王梦瑶,周茜萍,吕新华,冯 丽,孙 黎*
(石河子大学 生命科学学院,农业生物技术重点实验室,新疆 石河子 832003)
以旱麦草(Eremopyrumtriticeum)为实验材料,利用RT-PCR技术从旱麦草叶片中克隆了1个AP2/ERF家族基因,命名为EtAP2(GenBank登录号KX622583)。EtAP2基因含有1 128 bp开放阅读框,编码375个氨基酸,相对分子质量40.87 kD,等电点为5.36。多序列比对和进化树分析表明,该基因编码蛋白具有2个AP2保守结构域,与小麦AP2/ERF家族蛋白具有较近的亲缘关系。实时荧光定量PCR分析表明,15% PEG 6000模拟干旱胁迫可诱导EtAP2基因在根和叶中表达,且在根中对干旱胁迫的响应大于叶片。研究表明,EtAP2可能参与旱麦草对干旱逆境胁迫应答的调节。
旱麦草;EtAP2;克隆;基因表达
AP2/ERF (APETALA2/Ethylene-Responsive Factor,乙烯响应因子)是植物最大的基因家族之一,编码植物特有的转录因子。AP2/ERF超基因家族以AP2/ERF结构域为特征,该结构域由60~70个氨基酸组成,与DNA结合有关。AP2/ERF超基因家族包括AP2、RAV、DREB和ERF亚家族[1]。AP2亚家族又分为AP2和ANT组,ANT组又可细分为ANT、AIL以及PLT组[2]。AP2亚家族成员蛋白通常包含多个AP2/ERF结构域,RAV亚家族转录因子包含一个AP2/ERF结构域和B3结构域,DREB和ERF亚家族蛋白仅含有一个AP2/ERF结构域[3]。AP2/ERF基因家族成员在调节植物发育、抵御生物和非生物胁迫中起重要作用[4]。随着第二代测序技术在植物研究中的应用,AP2/ERF转录因子已在多种植物中得到鉴定,如拟南芥[5]、小麦[6]、水稻[7]和玉米[8]等。但目前为止,有关旱麦草(Eremopyrumtriticeum)AP2/ERF家族基因的鉴定和特征研究尚未见报道。
旱麦草是禾本科小麦族旱麦草属早春短生育期植物,小麦的野生近缘种,主要分布在准噶尔盆地沙区荒漠中,具有生育期短、特早熟、抗旱、耐盐、分蘖力强、抗白粉病以及光和效率高等优良性状。本研究以旱麦草为研究对象,根据前期构建的干旱胁迫下的转录组数据库,对旱麦草AP2/ERF转录因子家族成员EtAP2基因进行了克隆、序列分析和干旱胁迫下的表达特征研究,以期为后续研究该基因的功能奠定基础。
1 材料和方法
1.1 材 料
旱麦草种子由本实验室成员于2015年6月采自新疆准噶尔盆地荒漠。
1.2 方 法
1.2.1 材料的处理 2016年6月将采集的旱麦草种子种植于石河子大学生命科学学院温室。将生长2周的旱麦草幼苗用15% PEG 6000[9]分别处理0.5、1、3、6、12、24和48 h,以未处理的旱麦草幼苗为对照,取其根系和叶片样品液氮速冻后储存于-80 ℃冰箱。
1.2.2 旱麦草EtAP2基因的克隆 采用RNA prep Pure Plant Kit试剂盒(Tiangen,北京)提取旱麦草幼苗叶片总RNA,用PrimeScriptTMReverse Transcriptase(TaKaRa,大连)将总RNA反转录成cDNA。根据课题组通过旱麦草转录组测序获得的 EST 序列(GenBank登录号为KX622583),利用Primer Premier 5.0软件设计引物EtAP2-F和EtAP2-R(表1),PCR扩增该序列的开放阅读框(ORF)。PCR反应条件为:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃延伸8 min。产物回收纯化后与 pMD19-T载体连接,转化大肠杆菌Trans5α,经菌落PCR验证后送生工生物工程(上海)股份有限公司测序。
1.2.3EtAP2基因的生物信息学分析 序列比对和保守结构预测使用DNAMAN 5.0和Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行。蛋白质基本性质分析使用EXPASY(http://web.expasy.org/protparam/)相关在线工具完成。系统进化树构建使用MEGA 4.0 软件进行[10]。蛋白质三级结构使用Swiss-Model (http:/ /swissmode.l expasy.org /) 软件预测。
1.2.4 旱麦草EtAP2基因表达性分析 采用实时荧光定量PCR(qRT-PCR)技术检测EtAP2基因在干旱胁迫下的转录表达水平。基因特异引物为EtAP2-RT-F和EtAP2-RT-R,以旱麦草18S rRNA基因为内参,引物为Et18S-F和Et18S-R(表1)。按照SYBR Premix ExTaqTM试剂盒(TAKARA)说明书,在罗氏LightCycler480 PCR仪进行qRT-PCR,分析EtAP2基因相对表达量。扩增程序为:95 ℃预变性10 min,95 ℃变性10 s,56 ℃退火30 min,72 ℃延伸32 s,40个循环。每个样品做3次重复,以未处理旱麦草为对照。数据采用2-ΔΔCt法计算。
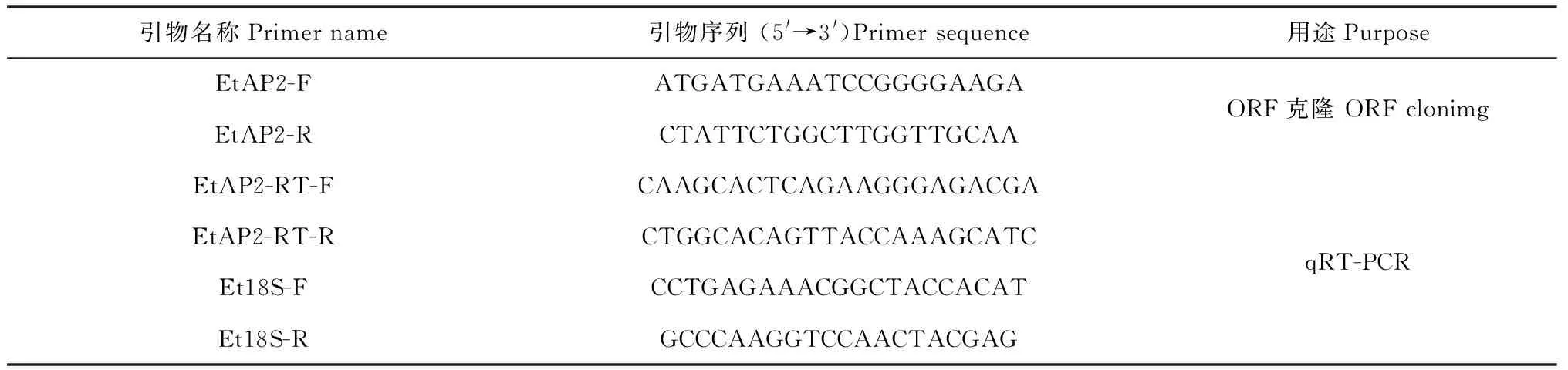
表1 本实验用到的引物
2 结果与分析
2.1 EtAP2基因克隆及序列分析
根据旱麦草转录组测序结果设计引物EtAP2-F和EtAP2-R,通过RT-PCR扩增出一个约1.1 kb片段,与预期大小相同(图1)。进一步测序分析表明,该片段含有1 128 bp开放阅读框,编码375个氨基酸(图2),Blast比对结果表明,该ORF编码的氨基酸序列与小麦TaAP2氨基酸序列相似性最高为96%,因此将该基因命名为EtAP2(GenBank登录号为KX622583)。
为了解EtAP2转录因子的生物活性及潜在功能,利用EXPASY在线分析工具ProtParam对翻译得到的EtAP2氨基酸组成和理化性质进行分析和预测。结果显示:EtAP2相对分子质量为40.87 kD,等电点为5.36,酸性氨基酸为16个,碱性氨基酸15个,脂肪族氨基酸含量占89%,而芳香族氨基酸只占6.2%。保守结构域分析发现, 该蛋白在191~262与292~354位氨基酸之间含有2个典型的AP2结构域(图3),与其他植物AP2/ERF家族转录因子的AP2保守结构域相似度较高,表明EtAP2属于AP2亚家族。AP2结合域由大约60个氨基酸组成,是非常保守的DNA结合区,在其N-端有一个碱性亲水区,具有3个反平行的β-折叠,这3个β-折叠在识别顺式作用元件中起到重要的作用[11]。利用protscale工具对EtAP2进行了亲水性和疏水性分析,结果表明,EtAP2大部分氨基酸为亲水性氨基酸,属于亲水性蛋白。
利用BlastP检索EtAP2同源蛋白,获得几个相似度较高的AP2/ERF氨基酸序列,包括小麦(Triticumaestivum,AK334560)、大麦(Hordeumvulgare,AK252982)、二穗短柄草(Brachypodiumdistachyon,XM_014901079.1)、玉米(Zeamays,NM_001138224.1)、谷子(Setariaitalica,XM_004953799.2)和短花药野生稻(Oryzabrachyantha,XM_015833886)。DNAMAN5.0比对结果(图3)表明,EtAP2转录因子与小麦AP2/ERF相似性最高(96%),与玉米的相似性较低(83%)。
2.2 EtAP2系统进化分析
为研究旱麦草EtAP2与其他植物同源蛋白之间的进化关系,通过 MEGA 4.0构建了EtAP2与小麦、水稻等物种AP2/ERF家族转录因子的系统进化树(图4)。结果表明,EtAP2转录因子在进化关系上属于AP2 /ERF家族转录因子AP2亚家族中的AIL组,与小麦、山羊草等禾本科植物的AP2蛋白聚为一类,其中与小麦AP2蛋白(AK334560)的亲缘关系最近,属于同一进化分支。
2.3 EtAP2转录因子的三级结构预测与分析
利用Swiss model程序对EtAP2进行蛋白质三级结构同源建模分析(图5),结果表明该蛋白与拟南芥AP2/ERF家族AtERF1蛋白的三级结构相似性为 44.26%。该结构中存在一个由色氨酸、丝氨酸、谷氨酸、组氨酸组成的保守序列。2个AP2结构域位于DNA的大沟中,都存在一个接头区,大概由30个氨基酸组成[12]。在与目的基因结合过程中,前一个AP2结构域与5′-C端结合,后一个与3′-N端结合[13]。
2.4 EtAP2基因在模拟干旱胁迫下的表达分析
为了研究EtAP2基因对干旱胁迫的响应,利用qRT-PCR方法检测了其在旱麦草根和叶片中的表达量(图6)。在15% PEG6000模拟干旱胁迫处理下,EtAP2在叶中的表达变化相对平缓,在0.5 h有轻微下降,1 h时轻微上升,3 h表达量最低,之后在6 h达到最高水平,为对照的1.7倍,在12~48 h呈现降-升-降的趋势。在干旱胁迫处理48 h之内,EtAP2在根中的表达量都高于对照,3 h达到最大,是对照的21倍,之后在6 h又急剧下降,直到48 h表达水平最低。这些结果表明,在干旱处理条件下,EtAP2的表达水平被显著诱导,且在根系中对干旱的响应大于叶片。
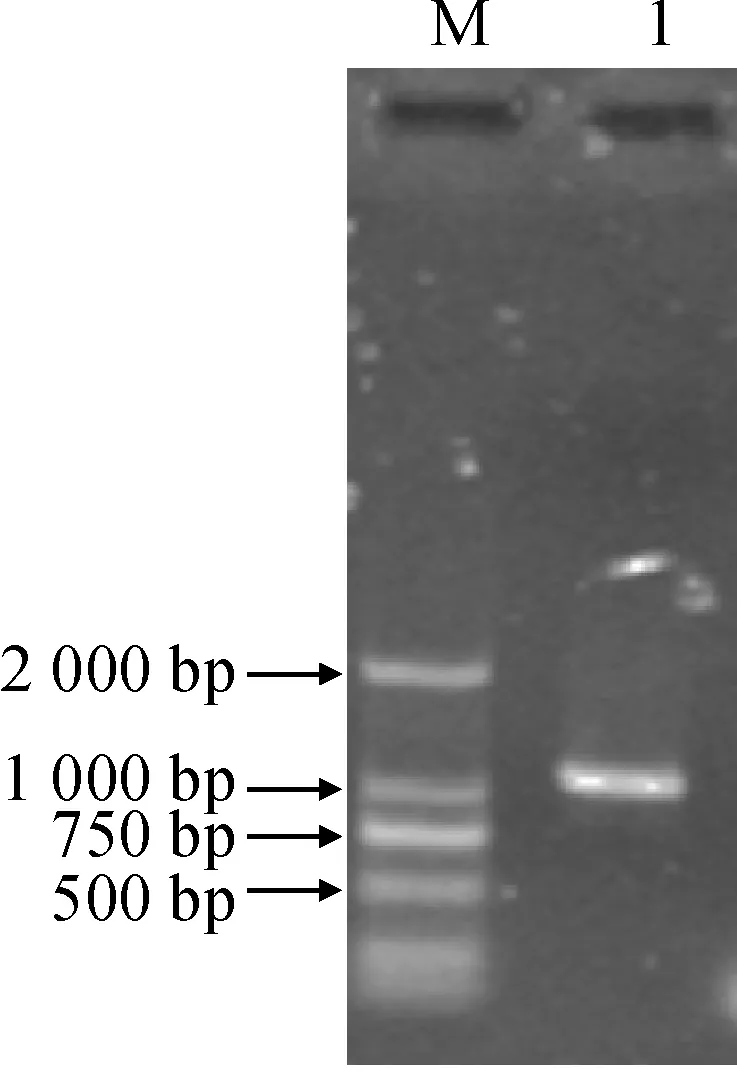
M. DL2000; 1. PCR扩增产物图1 EtAP2基因的RT-PCR扩增M. DL2000; 1. Product of PCRFig.1 RT-PCR application of EtAP2
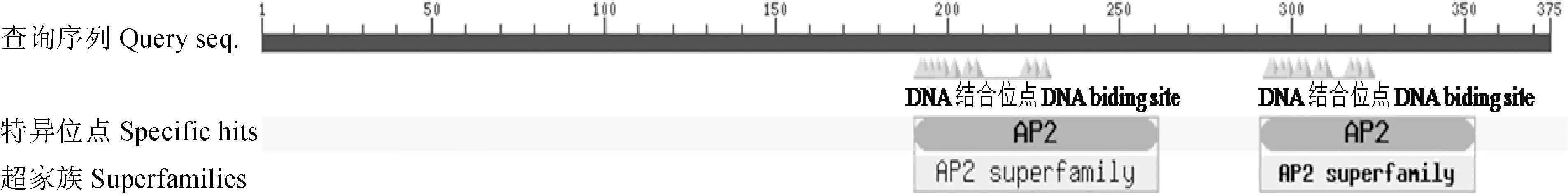
图2 EtAP2蛋白结构域分析Fig.2 Protein domain analysis of EtAP2

AK334560. 小麦;AK252982. 大麦;XM_014901079.1. 二穗短柄草;XM_015833886. 短花药野生稻;XM_004953799.2. 谷子;NM_001138224.1. 玉米图3 旱麦草EtAP2蛋白序列的多重比对AK334560. Triticum aestivum;AK252982. Hordeum vulgare;XM_014901079.1. Brachypodium distachyon;XM_015833886. Oryza brachyantha;XM_004953799.2. Setaria italica;NM_001138224.1. Zea maysFig.3 Multi-alignment of EtAP2 protein with AP2 proteins in plants

图中各节处数字表示重复1 000次Bootstrap值,括号内为氨基酸登陆号图4 旱麦草EtAP2与其他AP2蛋白的系统进化树The numbers at note represent the bootstrap values with 1 000 replicates in this figure, and the accession number of each sequence is given in the bracketFig.4 Phylogenetic analysis of EtAP2 and other plant AP2 proteins
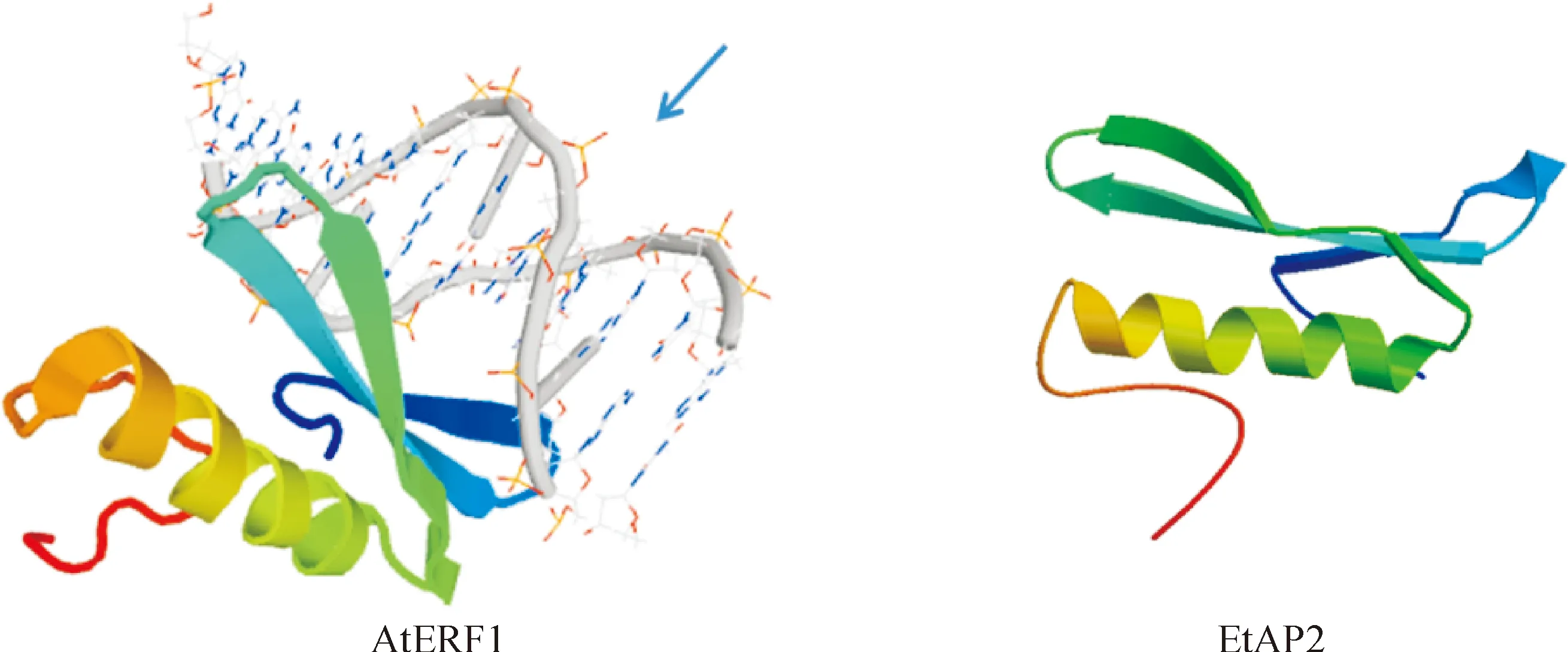
箭头所指方向为DNA分子图5 AtERF1和 EtAP2转录因子DNA结合域三维结构建模The arrow head is DNAFig.5 Three-dimensional structure modeling of DNA-binding domain of EtAP2 and AtERF1 protein
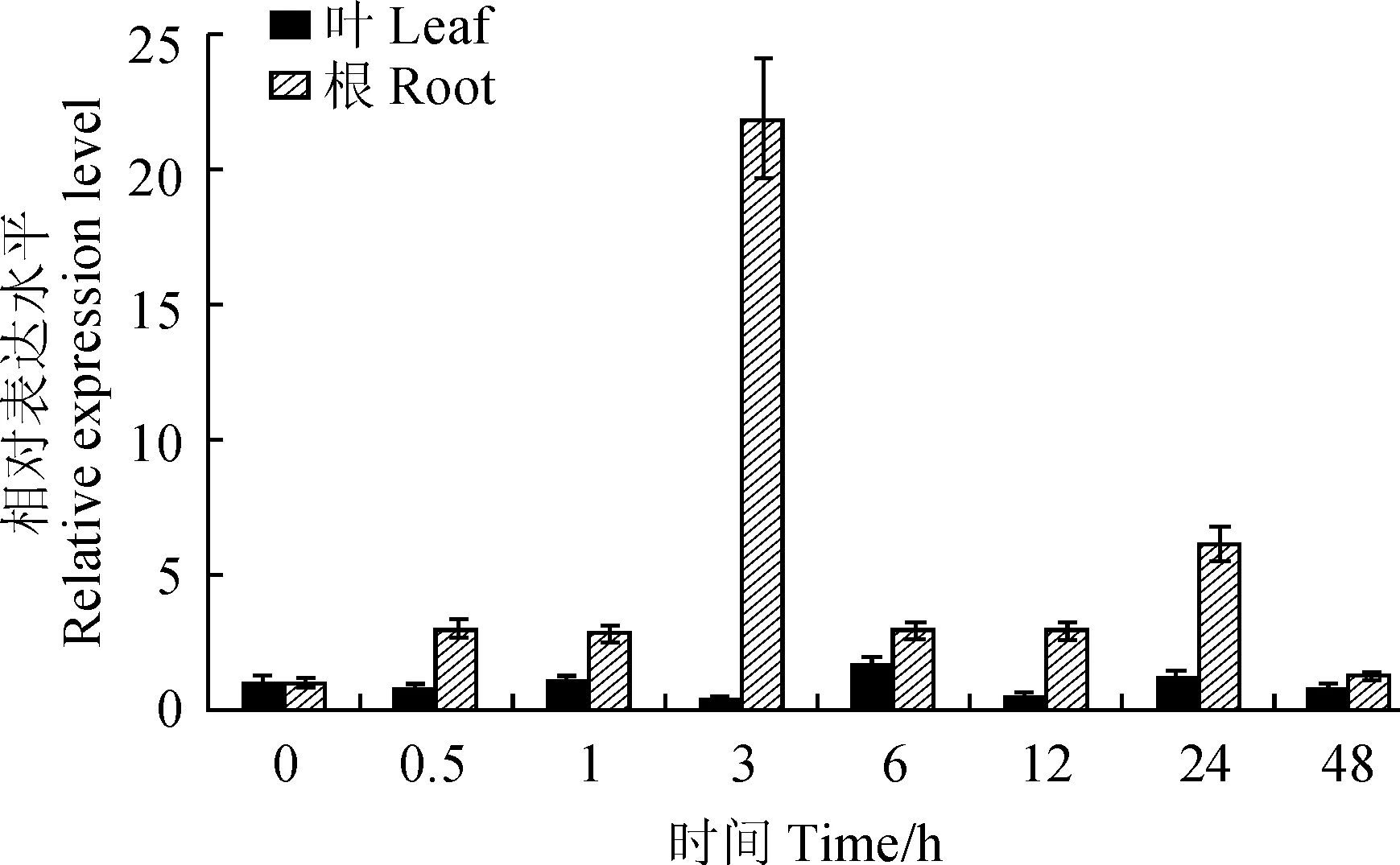
图6 EtAP2基因在模拟干旱胁迫下在旱麦草幼苗根和叶中的表达Fig.6 Expression of EtAP2 in roots and leaves of E. triticeum seedlings under simulated drought stress
3 讨 论
植物在干旱等逆境胁迫下会在生理和基因水平上进行自身调整,以适应外界环境。AP2/ERF作为重要的转录因子,在植物自身调节中起到非常关键的作用,能够快速调节植物体内相关基因的表达来提高植物对逆境胁迫的耐受性[14]。旱麦草分布在干旱、瘠薄荒漠地区,生长发育过程会受到各种非生物因素的影响,研究其抗逆相关基因并进行功能分析,有助于从分子机制上进一步了解其适应逆境的机理,同时为小麦等农作物的抗逆性状改良提供候选基因。
AP2/ERF家族是植物普遍存在的一类转录因子,广泛参与植物逆境胁迫诱导[15]。许多研究表明,过量表达某些AP2/ERF转录因子基因会增强植物的抗旱性。Dossa等[16]对芝麻进行转录组分析后,发现一个AP2si16基因,可以作为增强芝麻耐旱性的候选基因之一。Zhang等[17]从大豆中克隆一个GmERF3基因,并将其在烟草中过表达,在干旱条件下,转基因烟草中游离脯氨酸和可溶性碳水化合物的含量明显高于非转基因烟草,显著增加了烟草对干旱和高盐的耐受性。Zeng等[18]对AP2/ERF家族蛋白进行了系统分析,发现该家族蛋白主要参与植物的生长发育和对各种胁迫的应激反应,包括光形态建成,花的发育,干旱和寒冷的应激反应以及对生长素和脱落酸的敏感性等。
本研究以旱麦草为研究对象,从干旱胁迫的幼苗中克隆了EtAP2基因的cDNA,该基因编码的氨基酸序列具有AP2/ERF转录因子家族的基本特征,都含有AP2结合域。系统进化树分析结果表明,EtAP2转录因子与小麦亲缘关系最近,都属于AP2亚族。本研究中qRT-PCR分析表明,EtAP2的表达量受干旱诱导,并且在根中的表达对干旱胁迫的响应程度大于叶片,说明EtAP2基因在干旱胁迫条件下可能参与基因表达调控,可以作为小麦等农作物抗性育种重要的候选基因。这些研究将有助于了解AP2/ERF转录因子EtAP2在旱麦草逆境调控中的作用,为进一步研究和解析AP2/ERF家族其他成员的功能提供参考。
[1] WESSLER S R. Homing into the origin of the AP2 DNA binding domain [J].TrendsinPlantScience, 2005,10: 54-56.
[2] TANG M F, LI G S, CHEN M S. The phylogeny and expression pattern of APETALA2-like genes in rice [J].JournalofGeneticsandGenomics, 2007,34(10): 930-938.
[3] SAKUMA Y, LIU Q, DUBOUZET J G,etal. DNA-binding specificity of the ERF/AP2 domain of Arabidopsis DREBs, transcription factors involved in dehydration- and cold-inducible gene expression[J].BiochemicalandBiophysicalResearchCommunications, 2002,290: 998-1 009.
[4] LIU S, WANG X, WANG H,etal. Genome-wide analysis ofZmDREBgenes and their association with natural variation in drought tolerance at seedling stage ofZeamaysL [J].PlosGenetics, 2013,9(9):119-129.
[5] OHTO M A, FLOYD S K, FISCHER R L,etal. Effects of APETALA2 on embryo, endosperm, and seed coat development determine seed size inArabidopsis[J].SexualPlantReproduction, 2009,22: 277-289.
[6] ZHU X L, QI L, LIU X,etal. The wheat ethylene response factor transcription factor pathogen-induced ERF1 mediates host responses to both the necrotrophic pathogenRhizoctoniacerealisand freezing stresses[J].PlantPhysiology, 2014,164(3): 1 499-1 514.
[7] NAKANO T, SUZUKI K, FUJIMURA T,etal. Genome-wide analysis of the ERF gene family inArabidopsisand rice [J].PlantPhysiology, 2006,140: 411-432.
[8] DU H, HUANG M, ZHANG Z,etal. Genome-wide analysis of the AP2/ERF gene family in maize waterlogging stress response [J].Euphytica, 2014,198(1): 115-126.
[9] HIROSHI M, SHINJIRO Y, ATSUSHI H,etal. Dwarf and delayed-flowering 1, a novelArabidopsismutant deficient in gibberellin biosynthesis because of overexpression of a putative AP2 transcription factor [J].ThePlantJournal, 2004,37(5): 720-729.
[10] TAMURA K, DUDLEY J, NEI M,etal. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J].MolecularBiologyEvolution, 2007,24(8): 1 596-1 599.
[11] 张计育, 王庆菊, 郭忠仁. 植物AP2/ERF 类转录因子研究进展[J]. 遗传, 2012,34(7): 835-847.
ZHANG J Y, WANG Q J, GUO Z R. Progresses on plant AP2/ERF transcription factors[J].Hereditas, 2012,34(7): 835-847.
[12] RIECHMANN J L, MEYEROWITZ E M. The AP2/EREBP family of plant transcription factors [J].JournalofBiologicalChemistry, 1998, 379(6): 633-646.
[13] NOLE-WILSON S, KRIZEK B A. DNA binding properties of theArabidopsisfloral development protein AINTEGUMENTA [J].NucleicAcidsResearch, 2000,28(21): 4 076-4 082.
[14] HUIJUAN Z, YONGBO H, LEI H,etal. Arabidopsis AtERF014 acts as a dual regulator that differentially modulates immunity againstPseudomonassyringaepv.tomato andBotrytiscinerea[J].ScientificReports, 2016,6:30 251.
[15] GOLLDACK D, LI C, MOHAN H, PROBST N. Tolerance to drought and salt stress in plants: unraveling the signaling networks [J].FrontiersinPlantScience, 2014,5:151.
[16] DOSSA K, WEI X, LI D,etal. Insight into the AP2/ERF transcription factor superfamily in sesame and expression profiling of DREB subfamily under drought stress[J].BMCPlantBiology, 2016,16(1): 171.
[17] ZHANG G Y, CHEN M, LI L C,etal. Overexpression of the soybeanGmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco [J].JournalofExperimentalBotany, 2009,60(13): 3 781-3 796.
[18] ZENG L, YIN Y, YOU C,etal. Evolution and protein interactions of AP2 proteins in Brassicaceae: evidence linking development and environmental responses [J].JournalofIntegrativePlantBiology, 2016,58(6): 549-563.
(编辑:宋亚珍)
Cloning and Expression Response to Simulated Drought Stress ofEtAP2 fromEremopyrumtriticeum
WANG Mengyao, ZHOU Xiping, LÜ Xinhua, FENG Li, SUN Li*
(Key Laboratory of Agricultural Biotechnology, College of Life Sciences, Shihezi University, Shihezi, Xinjiang 832003, China)
A AP2/ERF gene was isolated fromEremopyrumtriticeumby RT-PCR method, and designated asEtAP2 (GenBank accession no. KX622583).EtAP2 contained an open reading frame (ORF) of 1 128 bp encoding 375 amino acids. The molecular mass of EtAP2 was 40.87 kDa with isoelectric point (PI) of 5.36. Multiple sequences alignment and phylogenetic analysis indicated that EtAP2 protein contained two conserved AP2 domains, which had close genetic relationship with AP2/ERF transcription factor inTriticumaestivum. Quantitative real-time PCR analysis revealed that simulated drought stress (15% PEG6000) treatment significantly induced the expression ofEtAP2, and root is more sensitive to drought stress than leaf. The results indicated thanEtAP2 might involve in response to drought stress regulation inE.triticeum.
Eremopyrumtriticeum;EtAP2; cloning; gene expression
1000-4025(2016)11-2167-06
10.7606/j.issn.1000-4025.2016.11.2167
2016-09-16;修改稿收到日期:2016-11-01
石河子大学高层次人才科研启动资金(RCZX201139)
王梦瑶(1993-),男,在读硕士生,主要从事植物分子生物学研究。E-mail:1561855244@qq.com
*通信作者:孙 黎,博士,副教授,主要从事植物分子生物学研究。E-mail: sunlishz@126.com
Q785;Q786
A

