运动改善内质网应激与肥胖相关疾病的研究进展
张 喆
运动改善内质网应激与肥胖相关疾病的研究进展
张 喆1,2
内质网(endoplasmic reticulum,ER)是重要的细胞器,内质网应激(endoplasmic reticulum stress,ERS)是指内质网由于某种原因使得其功能发生异常的一种亚细胞器病理过程。近年来,不仅内质网应激的分子机制越来越明确,还陆续发现内质网应激与运动适应、细胞高脂以及肥胖相关疾病的发病机制等密切相关。研究发现,骨骼肌的运动适应需要内质网应激,糖尿病、胰岛素抵抗等的发病机制涉及内质网应激的恶化,而运动改善肥胖相关疾病的机制亦有内质网应激的参与。
运动;内质网应激;非折叠蛋白应答;肥胖相关疾病
内质网(endoplasmic reticulum,ER)是哺乳动物细胞中重要的细胞器,分为粗面内质网(表面富含核糖体)和滑面内质网,粗面内质网的主要功能是帮助膜结合核糖体合成的蛋白质转运。光滑型内质网的功能不仅与糖脂的合成、解毒、同化作用有关,还与蛋白质和钙离子的运输密切相关,故滑面内质网与运动的关系更为密切。目前已有研究发现,内质网功能障碍与糖尿病、心脑组织缺血梗塞、退行性神经疾病等相关[19]。内质网应激( endoplasmic reticulum stress,ERS) 是指细胞ER由于某种应激因素(如热休克、线粒体钙超载等[19])使得其生理功能发生紊乱的一种亚细胞器病理过程[2]。各种各样的应激会干扰ER内环境,导致ER内非折叠蛋白及错误折叠的蛋白累积,由此引发非折叠蛋白应答(unfolded protein response,UPR)。一般认为,UPR的发生即提示了ERS的发生。
1 ERS级联反应概述
ERS的级联反应主要可分为3个动态过程,分别是:UPR、整合应激反应( integrated stress response,ISR)和内质网相关性死亡(Endoplasmic reticulum-associated degradation,ERAD)。UPR以3个跨膜感应分子{双链RNA依赖的蛋白激酶样内质网类激酶[double-standard RNA-dependent protein kinase(PKR)-like ER kinase,PERK],激活转录因子6(activating transcription factor 6,ATF6)和肌糖所需酶(inositol requiring enzyme 1 alpha,IRE1α)}分别介导3条信号通路[18]。在基础状态下,PERK与伴侣分子免疫球蛋白结合蛋白或糖调节蛋白78(immunoglobulin binding protein or glucose regulating protein 78,Bip/GRP78)结合处于非激活状态。当非折叠蛋白累积时,Bip与非折叠蛋白结合使得PERK暴露,PERK和IRE1通过自身磷酸化寡聚化激活,而ATF6转位至高尔基体进而激活[37],且ATF6和PERK主要促进ER对折叠错误蛋白的适应性应答,PERK激活后可促进位于ER外侧的真核细胞蛋白质翻译起始复合体2α( eukaryotic translation initiation factor 2α,eIF2α)磷酸化,终止蛋白合成过程[20]。磷酸化eIF2a还参与了特有应激蛋白的表达等所有后续反应,这类反应总称为IRS[2]。因此,eIF2a不仅与UPR有关,还与ISR相关,起着承上启下的作用,故eIF2a在内质网应激中的具体作用机制值得深入研究。另一个分子IRE1α则有传递生存和促凋亡信号的双重作用[6]。
当内质网应激强度超过细胞自身处理能力时,可激活特有的内质网性细胞凋亡通路[3],最终导致ERAD。此过程中,IRE1的内切核糖核酸酶活性去除了X-box结合蛋白1(X-box binding protein1,XBP1u)的内含子,产生XBP1s,XBP1s与ATF6共同启始转录,诱导ERAD相关分子的表达[25]。值得一提的是,半胱天冬酶12(caspase12)仅产生于内质网,细胞正常状态下,Bip与caspase7和caspase12形成复合体,但当内质网发生应激持续恶化时,caspase12活性增加,从内质网转运至细胞质,激活caspase9和caspase3,引发细胞凋亡[36](图1)。因此,caspase12是检测内质网应激相关凋亡的特异性指标。

图 1 内质网发生应激过程示意图Figure 1. The Process of ER Stress
2 运动通过调节内质网应激改善肥胖相关疾病
现已明确一些应激原可激活ERS,而内质网功能异常也参与了这些应激原相关疾病的发生,脂肪酸异位堆积就是其中之一[27,28]。Janikiewicz等人[21]就指出,慢性过量摄入脂肪酸会引发相关毒性产物的合成,如甘油二酯、甘油三酯和反应性氧自由基(reactive oxygen species,ROS),这些产物激活了多个分子机制,包括ERS、线粒体功能异常、自噬不足等,这些机制促进了胰岛β细胞的凋亡,进而导致二型糖尿病(type2 diabetes,T2DM)的发生。随后, Deldicque等人[10]发现,高脂饮食可打乱ER稳态,引起ERS,这与Janikiewicz等人的观点一致。该团队还指出,高脂饮食[9,10]可在骨骼肌内激活UPR,然而,如果只是通过适当增加脂类摄取来增加能量输出而不过量摄入脂类则不会引起UPR[14]。这不禁让我们推测,运动可通过改善骨骼肌UPR从而缓解脂代谢异常相关疾病的症状。不仅如此,Kanekura等人[24]在新近的研究中提出,ER膜的完整性是研究人类慢性疾病和ERS之间关系的新兴靶点。饱和脂肪酸以ER为目标,会影响ER膜的脂质分布和形态,使得ER膜的完整性被破坏,ER内容物逸出(包括钙离子),从而在β细胞引起ERS。相信该视角也将为运动促进健康的分子机制研究提供新的思路。
除了高糖高脂类应激原外,Qureshi等人[35]将小鼠的胰岛暴露于毒胡萝卜素(ERS诱导剂)中48 h,随后检测了胰岛素的释放,发现较长时间暴露于毒胡萝卜素中可抑制约90%的胰岛素释放,并且会诱导凋亡。有趣的是,Neill等人[29]的研究指出,有糖尿病倾向的小鼠的胰岛可发生异常UPR,该UPR与胰岛素释放下降和凋亡增加有关,但正常小鼠的胰岛无此现象,以上均从侧面证明了ERS参与了糖尿病的发病机制。
2.1 运动与内质网应激
2.1.1 内质网与钙离子
Deldicque等人[12]认为,维持合适的肌浆网腔内的钙离子浓度对于肌肉收缩中肌浆网释放钙离子的调节很必要,任何内质网的功能紊乱都可能损伤肌肉收缩。内质网是主要的钙离子储存单位,处于稳定状态的内质网钙离子浓度接近1 mM,与细胞外环境浓度相近,在内质网的不同区域内钙离子水平存在不均一性[38]。钙离子从内质网流出是细胞质钙离子迅速增加的一个机制。跨膜蛋白肌糖1,4,5-三羟基氨基甲烷磷酸盐受体(inositol 1,4,5-trisphosphate receptor,IP3R)是负责钙离子从内质网释放的主要因子[34],当IP3R与其特定配体IP3结合后,可诱导IP3R的开放和钙离子的外流[17]。此外,新近发现的GRP94是一种热休克蛋白90(Heat Shock Protein,HSP90)样蛋白,它对于蛋白质折叠和内质网质量控制有特殊作用,GRP94可与钙结合,因此对于内质网释放钙离子的功能很必要[26]。众所周知,运动过程中骨骼肌的收缩依赖于钙离子的浓度变化,因此,IP3R和GRP94可作为研究ER和运动之间关系的新的靶点。
越来越多的证据还表明,骨骼肌过度收缩和运动不足均可激活骨骼肌UPR,已证实耐力力竭运动在小鼠[41]和人类[22]骨骼肌内均能引起UPR。Deldicque等人[8]也指出,骨骼肌极高或极低的收缩均可激活内质网应激和非折叠蛋白效应,而反复的适度的耐力运动可保护细胞免于过度的内质网应激,改善高脂喂养小鼠的多种伴侣分子的表达(如PERK,ATF6和IRE1α)。
2.1.2 内质网应激与运动适应
关于运动与ERS间联系的机制,除了钙离子外,还有过氧化物酶体增殖活化受体γ辅助活化因子1α(αsubunit of peroxisome proliferators-activated receptor-γcoactivator-1,PGC-1α)。研究指出,UPR是一种适应性应答途径,其介导了骨骼肌运动过程中ER稳态的维持,以及骨骼肌对运动训练的适应,PGC-1α经ATF6α的共激活介导肌管和骨骼肌的UPR,并且发现ATF6α敲除的小鼠在剧烈运动后的有效恢复减弱,这表明了阻断UPR生成会影响骨骼肌对运动训练的适应;而肌肉特异性PGC-1α敲除的小鼠经去除环磷酸腺苷反应元件结合转录因子同源蛋白(CPEBP homologous protein,CHOP,该分子是凋亡转录分子)可阻断ERAD,进而部分缓解运动不耐受情况,以上均充分说明,运动的生理和生化分子适应与ERS密切相关,而PGC-1α和ATF6α是其中的关键物质[41]。
有研究指出,一定时间或强度的运动可诱导ERS,但此时ERS对机体是一种自我保护,抵抗急性或力竭运动等带来的损伤,但运动强度过高就可能引发ERAD[1]。Passos等人[31]也认为,适度运动的好处就在于能增加适应的UPR相关基因(ATF6、eIF2α)的表达,和/或降低凋亡相关基因(XBP1、Bip)的表达。但同时Passos等人[31]亦提出,运动对ERS的作用可能有组织特异性和“转化开关”的作用,该“开关”作用上调了保护和促生存应答,抑制凋亡蛋白的表达,而运动中决定UPR上调还是下调的临界点很模糊,有待验证。这不禁让我们好奇ERS在骨骼肌的运动适应中的具体作用及其机制。
Pierre等人[33]将C2C12细胞分化的肌管置于H2O2中孵育诱导氧化应激,以此来模拟肌管在运动作用下发生氧化应激的情况,4~17 h后收集肌管,发现Bip分子大量增加,提示发生了ERS。然而,UPR的3个分支在同一程度上被激活的程度并不同,eIF2α、ATF4和CHOP分子的转录水平增加,显示PERK分支被激活的程度最大;XBP1s转录水平轻微增加,XBP1u下降,提示,经H2O2处理,IRE1α有了更高的活性;而ATF6的转录活性并未改变,因此在氧化应激情况下,UPR的3个分支特定性调节的机制不明。Ogborn等人[30]在研究中则发现,18名未经训练的受试者在使用膝关节完成一次性抗阻训练后,激活了骨骼肌UPR特定渠道ATF6/IRE1α,而PERK/eIF2α/CHOP未参与。可见,骨骼肌ERS在不同运动方式或不同情况下呈现多样化现象,而UPR 3个分支通路在运动过程中的协调机制是未来运动人体科学研究领域有待解决的重要问题。
2.2 内质网应激与中枢调节
有研究指出,肥胖和营养过剩可诱导下丘脑的内质网应激[43]。胰岛素在下丘脑经IR/磷脂酰肌醇三羟基激酶/蛋白激酶B(IR/phosphoinositide-3 kinase/protein kinase B,IR/PI3K/Akt)途径下调食物摄入(food intake,FI),但这一通路在个体肥胖,发生ERS和低度炎症时受损,从而导致疾病的发生[43],推测肥胖可引起下丘脑ERS,从而使得IR/PI3K/Akt通路受损。Castro等人[7]的研究则聚焦于大脑杏仁核对胰岛素的应答以及对FI的调节,同样发现此调节依赖PI3K/Akt通路。然而,胰岛素抵抗(insulin resistance,IR)大鼠此通路受损,杏仁核磷酸化Akt降低,不能对胰岛素产生应答下调FI, ERS可能是诱导杏仁核IR的机制之一。随着运动改善脂代谢异常相关疾病的研究的深入,学者们发现,运动改善胰岛素抵抗的症状也涉及下丘脑的ERS。Flores[16]和Patterson等人[32]均发现,运动可提高大鼠下丘脑胰岛素和瘦素敏感性,虽内在的分子机制未完全明了,但已发现ERS与这一过程有关,且结合上述提及的IR/PI3K/Akt通路,我们不难推测这可能是由于运动通过改善下丘脑ERS进而缓解IR/PI3K/Akt通路的受损,从而增加胰岛素和瘦素敏感性。Kim等人[23]利用大量C57BL/6小鼠作自主跑轮运动,通过检测PERK,eIF2α,ATF6等ERS相关标志分子,研究低脂饮食/高脂饮食小鼠进行自主跑轮运动后脑区内质网应激的情况,发现自主跑轮运动的强度与下丘脑,海马和皮质的内质网应激强度有关,其中下丘脑的反应最强烈,且下丘脑对适度运动产生UPR应答,并未诱发凋亡信号,该机制可能与运动预防神经退行性疾病的保护作用有关。因此,运动通过ERS改善脂代谢相关疾病的机制研究涉及中枢对外周的调节作用。
2.3 内质网应激与炎症应答
尽管关于ERS参与肥胖相关疾病发病机制的研究不断深入,学者们对于ERS和脂代谢异常之间的联系却有不同意见,Urano等人[40]认为连接两者的纽带可能是IRE1α,但Boden等人[5]则认为ERS激活c-Jun氨基末端激酶(JNK)可能是肥胖,IR和炎症的联系。关于这点,da Luz等人[11]的观点亦与后者一致,该团队认为,肥胖诱导的ERS是肥胖激活JNK和B细胞激活的核因子Κ轻链增强子(nuclear factor Κ-light-chain-enhancer of activated B cells,NF-ΚB)的炎症应答的基础,ERS、炎症应答的不断恶化导致外周IR的出现。Ozcan[28]和Eizirik等人[15]也发现,脂肪酸堆积引起的疾病(肥胖等)伴随着炎症的发生。由此我们不难发现,炎症是ERS与肥胖相关疾病的联系中不可忽视的一环。
PERK和IRE1通路在ERS和炎症信号的连接中发挥重要作用。PERK的激活导致IΚ-B(NF-ΚB的抑制子)的表达下降,NF-ΚB激活[13]。NF-ΚB可上调炎症信号,促进白介素1β(interleukin,IL-1β)、IL-6和肿瘤坏死因子α(TNFα)的表达[39]。IRE1通路则可激活JNK和IΚ-B激酶(IΚK,降解IΚ-B,从而激活NF-ΚB),导致促炎症因子表达增加[39]。另一方面,促炎症因子可进一步诱导ERS。因此,即使是轻微的ERS也可增强炎症信号,而炎症又进一步诱导ERS,从而产生恶性循环。
基于以上基础研究,运动人体科学领域已有研究揭示了运动、ERS、肥胖相关疾病和炎症之间的关系。Passos等人[31]就认为,ERS参与运动改善脂代谢异常相关疾病与运动抗炎症有关,肥胖大鼠在经过运动训练后,其脂肪、肝脏组织中NF-ΚB和JNK的磷酸化水平均下降,而NF-ΚB是PERK的下游分子,因此,运动很可能是通过降低肥胖大鼠ERS从而下调炎症信号,进而改善肥胖大鼠症状的[11]。而da Luz等人[11]的研究则进一步指出,游泳训练降低了高脂喂养大鼠肝脏和脂肪组织的促炎症因子(JNK,IΚB和NF-ΚB)的表达。同时,运动通过下调这些组织中磷酸化的PERK和eIF2α的表达从而减缓ERS,以上研究充分说明,运动缓解脂肪酸堆积与运动通过减缓ERS从而下调炎症应答有密切关系,但以上研究主要集中于肝脏和脂肪组织,我们不禁想了解运动与ERS、炎症的关系在骨骼肌中到底如何。
此外,一些炎症效应分子在运动、肥胖相关疾病与ERS的联系中也扮演了重要角色。Martinez等人[27]认为,运动与内质网应激的联系涉及IL-6,运动可降低内质网应激效应,并以IL-6依赖的方式增加胰岛素和瘦素的活性,从而改善摄食过多和体重降低。最近又有研究提出,IL-15是循环的肌浆球蛋白,其与骨骼肌糖的摄取和利用有关,IR大鼠可出现IL-15分泌下调,其受体IL-15Rα表达下降[42]。Yang等人[42]发现,8周的跑台运动明显改善了高脂饮食诱导的IR,并逆转了IL-15和IL-15Rα的下降。为了观察IL-15是否在肌肉中直接发挥抗IR作用,Yang等人[42]将肌纤维用ERS诱导剂衣霉素(Tm)预处理后,加入IL-15,发现IL-15可显著下调Bip、GRP94和CHOP的表达,并抑制ERS。因此,跑台运动促进了IR大鼠骨骼肌IL-15和IL-15Rα的表达,并且运动增加骨骼肌胰岛素敏感性可能与IL-15对ERS的抑制作用有关。综上,我们相信,ERS与炎症信号的相互作用会是未来研究运动改善脂代谢异常相关疾病机制的关键。基于以上研究,本文做出了总结(图2)。除此之外,还有一些伴侣分子也参与其中,Abubaker等人[4]的研究首次发现,运动可以增加肥胖个体热休克蛋白40(DNAJB3/HSP40)的表达,并伴随了磷酸化JNK的下降。在细胞实验中,该团队又通过免疫共沉发现HSP40的降低与ERS的激活有关。可见,关于运动改善肥胖相关疾病的ERS机制的研究还有大量明星分子有待发掘。
3 小结与展望
在运动的适应性方面,关于运动与内质网应激的研究可初步总结以下4点:1)内质网与钙离子的释放密不可分,维持适宜的肌浆网钙离子浓度对于肌肉收缩有重要意义,在这一点上,IP3R和GRP94是较有价值的研究靶点。2)运动不足和运动过度均可引发ERS以至ERAD,但适度的耐力训练引起的ERS却是一种自我保护,不仅有利于抵抗急性运动损伤,还可能与运动预防退行性神经疾病有关。3)ERS介导了骨骼肌对运动的适应性应答,在此过程中,PGC-1α经ATF6共激活UPR这一机制发挥了重要作用。4)运动对ERS的作用可能有组织特异性和“开关”作用,而运动中决定UPR是上调还是下调的这一UPR“开关”的临界点有待验证。此外,骨骼肌ERS的3条分支通路在运动过程中的协调机制也有待揭示。
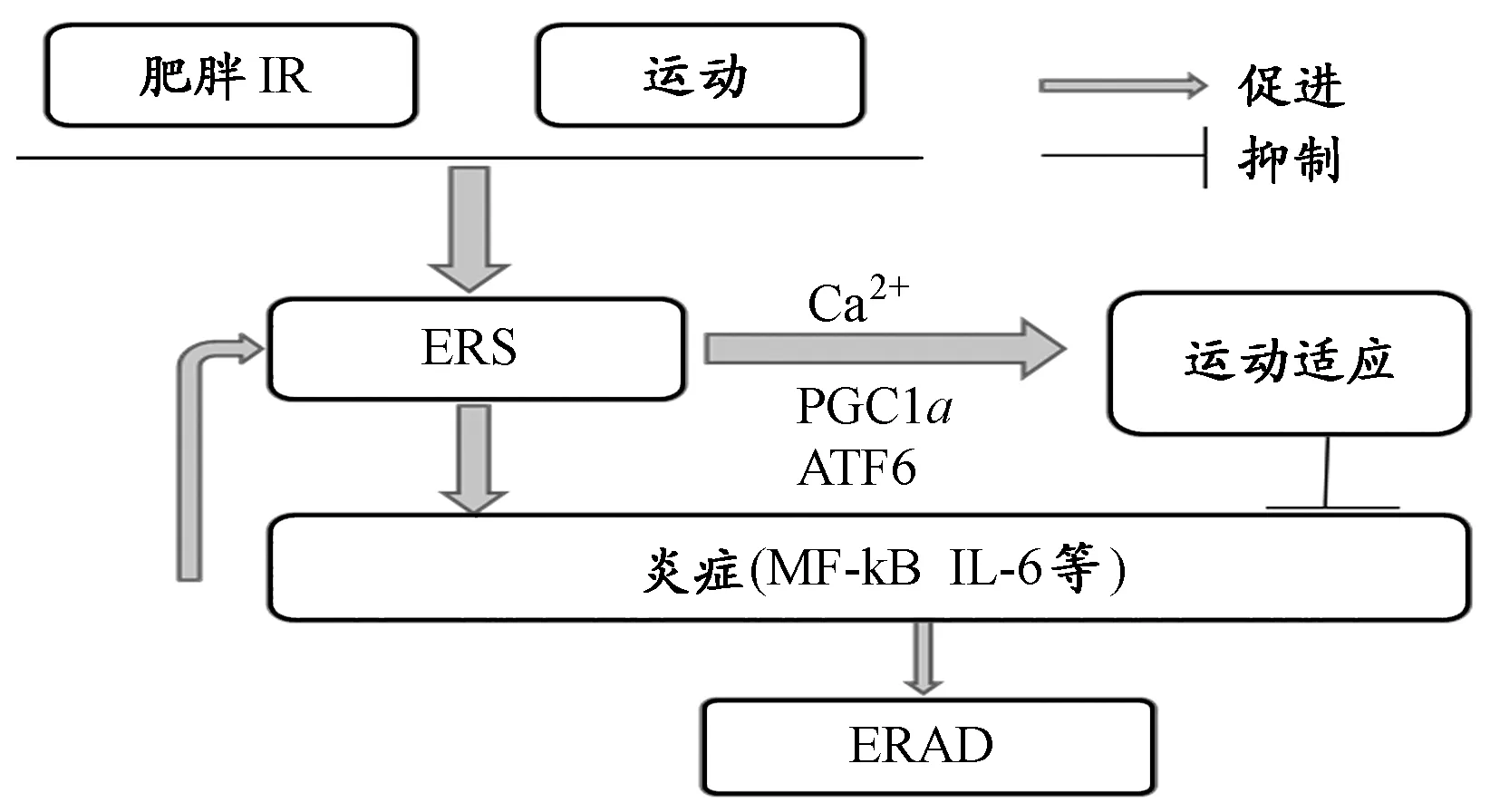
图 2 运动、肥胖相关疾病与 内质网应激(ERS)关系示意图Figure 2. The Relationship of Sports, Obesity Related Diseases and ERS
随着对内质网应激研究的不断深入,已发现内质网应激与β细胞的糖脂毒性损伤,2型糖尿病、胰岛素抵抗的发生有关。高糖高脂引起代谢异常可激活ERS,ERS增强炎症信号,而促炎症因子又反过来诱导ERS,从而产生恶性循环引发IR等情况。耐力训练产生的运动适应可改善脂代谢异常相关疾病的症状,其机制涉及ERS、下丘脑IR/PI3K/Akt通路和炎症应答。因此,我们认为,深入研究ERS与炎症信号的相互作用,以及运动通过ERS改善下丘脑IR/PI3K/Akt通路可能为运动改善IR等疾病机制的研究提供更多理论依据。此外,值得一提的是,目前此类研究大多集中于脂肪和肝脏组织,未来在骨骼肌中展开运动、ERS和肥胖相关疾病的研究很有必要。
[1]李焕春,肖国强.内质网应激和热休克与运动[J].体育学刊,2009,16(1):109-112.
[2]李载权,周爱儒,唐朝枢.内质网应激反应分子机理研究进展[J].中国生物化学与分子生物学报,2004,20(3):283-288.
[3]ARAKI E,OYADOMARI S,MORI M.Endoplasmic reticulum stress and diabetes mellitus[J].Intern Med,2003,42(1):7-14.
[4]ABUBAKER J,TISS A,ABU-FARHA M,etal.DNAJB3/HSP-40 cochaperone is downregulated in obese humans and is restored by physical exercise[J].PLOS ONE,2013,(8):e69217.
[5]BODEN G,DUAN X,HOMKO C,etal.Increase in endoplasmic reticulum stress-related proteins and genes in adipose tissue of obese,insulin-resistant individuals[J].Diabetes,2008,57(9):2438-2444.
[6]CHAKRABARTI A,CHEN A W,VARNER J D.A review of the mammalian unfolded protein response[J].Biotechnol Bioeng,2011,108(12):2777-2793.
[7]CASTRO G,AREIAS M F C,WEISSMANN L,etal.Diet-induced obesity induces endoplasmic reticulum stress and insulin resistance in the amygdala of rats[J].FEBS Open Bio,2013,(3):443-449.
[8]DELDICQUE L.Endoplasmic reticulum stress in human skeletal muscle:any contribution to sarcopenia?[J].Front Physiol,2013,(4):236.
[9]DELDICQUE L,CANI P D,DELZENNE N M,etal.Endurance training in mice increases the unfolded protein response induced by a high-fat diet[J].J Physiol Biochem,2013,69(2):215-225.
[10]DELDICQUE L,CANI P D,PHILP A,etal.The unfolded protein response is activated in skeletal muscle by high-fat feeding:Potential role in the downregulation of protein synthesis[J].Am J Physiol Endocrinol Metab,2010,299(5):E695-705.
[11]DA L G,FREDERICO M J,DA S S,etal.Endurance exercise training ameliorates insulin resistance and reticulum stress in adipose and hepatic tissue in obese rats[J].Eur J Appl Physiol,2011,111(9):2015-2023.
[12]DELDICQUE L,HESPEL P,FRANCAUX M.Endoplasmic reticulum stress in skeletal muscle:origin and metabolic consequences[J].Exerc Sport Sci Rev,2012,40(1):43-49.
[13]DENG J,LU P D,ZHANG Y,etal.Translational repression mediates activation of nuclear factor kappa B by phosphorylated translation initiation factor 2[J].Mol Cell Biol,2004,24(23):10161-10168.
[14]DELDICQUE L,VAN PROEYEN K,FRANCAUX M,etal.The unfolded protein response in human skeletal muscle is not involved in the onset of glucose tolerance impairment induced by a fat-rich diet[J].Eur J Appl Physiol,2011,111(1):1553-1558.
[15]EIZIRIK D L,CARDOZO A K,CNOP M.The role for endoplasmic reticulum stress in diabetes mellitus[J].Endocr Rev,2008,29(1):42-61.
[16]FLORES M B,FERNANDES M F,ROPELLE E R,etal.Exercise improves insulin and leptin sensitivity in hypothalamus of Wistar rats[J].Diabetes,2006,55(9):2554-2561.
[17]GIORGI C,DE STEFANI D,BONONI A,etal.Structural and functional link between the mitochondrial network and the endoplasmic reticulum[J].Int J Biochem Cell Biol,2009,41(10):1817-1827.
[18]GENTILE C L,FRYE M,PAGLIASSOTTI M J.Endoplasmic reticulum stress and the unfolded protein response in nonalcoholic fatty liver disease[J].Antioxid Redox Sign,2011,15(2):505-521.
[19]HARDING H P,RON D.Endoplasmic reticulum stress and the development of diabetes:A review[J].Diabetes,2002,51(3):S455-461.
[20]HARDING H P,ZHANG Y,RON D.Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase[J].Nature,1999,397(6716):271-274.
[21]JANIKIEWICZ J,HANZELKA K,KOZINSKI K,etal.Islet beta-cell failure in type 2 diabetes - Within the network of toxic lipids[J].Biochem Biophys Res Commun,2015,460(3):491-496.
[22]KIM H J,JAMART C,DELDICQUE L,etal.Endoplasmic reticulum stress markers and ubiquitin-proteasome pathway activity in response to a 200-km run[J].Med Sci Sports Exe,2011,43(1):18-25.
[23]KIM Y,PARK M,BOGHOSSIAN S,etal.Three weeks voluntary running wheel exercise increases endoplasmic reticulum stress in the brain of mice[J].Brain Res,2010,1317:13-23.
[24]KANEKURA K,OU J,HARA T,etal.Research resource:Monitoring endoplasmic reticulum membrane integrity in beta-cells at the single-cell level[J].Mol Endocrinol,2015,29(3):473-480.
[25]LEE J,OZCAN U.Unfolded protein response signaling and metabolic diseases[J].J Biol Chem,2014,289(3):1203-1211.
[26]MARZEC M,ELETTO D,ARGON Y.GRP94:An HSP90-like protein specialized for protein folding and quality control in the endoplasmic reticulum[J].Biochim Biophys Acta,2012,1823(3):774-787.
[27]MARTINEZ D M P,LOPEZ M."Mens sana in corpore sano":Exercise and hypothalamic ER stress[J].Plos Biol,2010,(8):1-4.
[28]OZCAN U,CAO Q,YILMAZ E,etal.Endoplasmic reticulum stress links obesity,insulin action,and type 2 diabetes[J].Sci,2004,306(5695):457-461.
[29]O'NEILL C M,LU C,CORBIN K L,etal.Circulating levels of IL-1B+IL-6 cause ER stress and dysfunction in islets from prediabetic male mice[J].Endocrinology,2013,154(9):3077-3088.
[30]OGBORN D I,MCKAY B R,CRANE J D,etal.The unfolded protein response is triggered following a single,unaccustomed resistance-exercise bout[J].Am J Physiol Regul Integr Comp Physiol,2014,307(6):R664-669.
[31]PASSOS E,ASCENSAO A,MARTINS M J,etal.Endoplasmic reticulum stress response in non-alcoholic steatohepatitis:The possible role of physical exercise[J].Metabol,2015,64(7):780-792.
[32]PATTERSON C M,BOURET S G,DUNN-MEYNELL A A,etal.Three weeks of postweaning exercise in DIO rats produces prolonged increases in central leptin sensitivity and signaling[J].Am J Physiol Regul Integr Comp Physiol,2009,296(3):R537-548.
[33]PIERRE N,BARBE C,GILSON H,etal.Activation of ER stress by hydrogen peroxide in C2C12 myotubes[J].Biochem Biophys Res Commun,2014,450(1):459-463.
[34]PARYS J B,DE SMEDT H.Inositol 1,4,5-trisphosphate and its receptors[J].Adv Exp Med Biol,2012,740:255-279.
[35]QURESHI F M,DEJENE E A,CORBIN K L,etal.Stress-induced dissociations between intracellular calcium signaling and insulin secretion in pancreatic islets[J].Cell Calcium,2015,57(5-6):366-375.
[36]RAO R V,PEEL A,LOGVINOVA A,etal.Coupling endoplasmic reticulum stress to the cell death program:role of the ER chaperone GRP78[J].Febs Lett,2002,514(2-3):122-128.
[37]RON D,WALTER P.Signal integration in the endoplasmic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol,2007,8(7):519-529.
[38]SOMLYO A P.Cell physiology:cellular site of calcium regulation[J].Nature,1984,309(5968):516-517.
[39]SOLINAS G,KARIN M.JNK1 and IKKbeta:Molecular links between obesity and metabolic dysfunction[J].Faseb J,2010,24(8):2596-2611.
[40]URANO F,WANG X,BERTOLOTTI A,etal.Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1[J].Sci,2000,287(5457):664-666.
[41]WU J,RUAS J L,ESTALL J L,etal.The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1alpha/ATF6alpha complex[J].Cell Metab,2011,13(2):160-169.
[42]YANG H T,LUO L J,CHEN W J,etal.IL-15 expression increased in response to treadmill running and inhibited endoplasmic reticulum stress in skeletal muscle in rats[J].Endocrine,2015,48(1):152-163.
[43]ZHANG X,ZHANG G,ZHANG H,etal.Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity[J].Cell,2008,135(1):61-73.
Progress of Exercise Improving Endoplasmic ReticulumStress (ERS) and Obesity-related Diseases
ZHANG Zhe1,2
The endoplasmic reticulum (ER) is an important organelle.Endoplasmic reticulum stress (ERS) is the function of ER in a certain condition of subcellular pathological abnormalities under some stressor.In recent years,scientists found out that not only the mechanism of endoplasmic reticulum stress (ERS) is more and more clear,and also the ERS are closely related to exercise adaptation,cellular hyperlipidemia,and pathogenesis of obesity related diseases.Exercise adaptation of skeletal muscle needs ERS.The pathogenesis of diabetes,insulin resistance involves deterioration of ERS.And mechanism of movement improving obesity-related diseases also refers to ERS.
exercise;ERS;unfoldedproteinresponse(UPR);obesityrelateddiseases
1002-9826(2016)02-0080-05
10.16470/j.csst.201602012
2015-05-07;
2016-01-01
青少年健康评价与运动干预教育部重点实验室建设项目(40500-541235-14203/004);青少年POWER工程协同创新中心项目(44801400/012)。
张喆(1986-),女,重庆人,在读博士研究生,主要研究方向为运动对健康作用的细胞分子机制,E-mail:397990887@qq.com。
1.青少年健康评价与运动干预教育部重点实验室,上海 200241;2.华东师范大学 体育与健康学院,上海 200241 1.Key Laboratory of Adolescent Health Assessment and Exercise Intervention,Ministry of Education,Shanghai 200241,China;2.East China Normal University,Shanghai 200241,China.
G804.5
A

