低温序批式生物反应器中Comanonas testosteroni QYY降解水中喹啉的研究
陈 瑜,贾 涛,王天竹,王洪宁,4,徐特秀,郭树君,4,邵徳武,4,刘志强,朱遂一
(1.吉林省林业勘察设计研究院,吉林 长春 130024;2.东北师范大学吉林省城市污水处理与水质保障工程技术研究中心,吉林 长春 130117;3.河北省环境地质勘查院,河北 邢台 050022;4.中石油吉林石化公司109污水处理厂,吉林 吉林 132022)
低温序批式生物反应器中Comanonas testosteroni QYY降解水中喹啉的研究
陈 瑜1,2,贾 涛2,3,王天竹2,王洪宁2,4,徐特秀2,郭树君2,4,邵徳武2,4,刘志强2,朱遂一2
(1.吉林省林业勘察设计研究院,吉林 长春 130024;2.东北师范大学吉林省城市污水处理与水质保障工程技术研究中心,吉林 长春 130117;3.河北省环境地质勘查院,河北 邢台 050022;4.中石油吉林石化公司109污水处理厂,吉林 吉林 132022)

喹啉;睾丸酮丛毛单胞菌;生物降解;低温
0 引言
喹啉是一种典型的含氮杂环有机物,其受双环稠合影响增大了空间位阻效应,同时吡啶环上的N原子降低了环上的电子云密度,妨碍了氧化酶的亲电子攻击,从而增大了其被生物降解的难度.在自然环境中,喹啉具有良好的水溶性和低生物降解性,使其成为土壤、地下水或生物处理系统的外排水中常见的一种污染物[1],特别是在垃圾填埋场、制药厂、煤焦化厂、木材保存和化石染料厂附近[2-4].一些研究显示,喹啉及其衍生物对人和动物具有一定毒性、致癌和致突变性[5],因此含喹啉的废水需要经过处理才能排放到环境中.
一些自然环境中存在的微生物,如假单胞菌[6]、红球杆菌[7]、诺卡氏菌[8]、伯克氏杆菌[9]、食酸菌[10]等具有特定的酶可用来分解水中的喹啉.刘佐才等[11]的研究报道了伯克氏杆菌在30℃和生物添加量为0.985 8 g/L的条件下,可以在2 h内完全降解水中200 mg/L的喹啉.Zhu等[12]的研究表明,通过添加1%的菌液(质量浓度为4.8 g/L),红球杆菌QL2在pH=8和30℃~40℃时,具有最佳的降解效率.受加菌量、微量元素和培养条件的影响,很难比较细菌之间的降解效率.睾丸酮丛毛单胞菌(Comamonastestosteroni)是1987年命名的一类新细菌,它可以降解环境中的甾体,因而吸引了众多学者的广泛关注.到目前为止,已有2株细菌被报道可以分解水中的喹啉,如C.testosteroniQ10[13]可以利用喹啉为单一碳源和能源生长,最佳条件是pH=8和30℃;另外,C.testosteroni63[14]能够降解喹啉和多种喹啉衍生物.上述利用单菌分解水中喹啉的研究,多采用摇瓶培养来分析细菌对有机物的去除效率.在摇瓶培养系统中,细菌的氧利用效率和摇瓶的水力条件均不同于污水处理装置,相关现象难以直接解释细菌在装置中对有机物的降解过程.
本文通过向序批式活性污泥法反应器(sequence batch reactor,SBR)中投加C.testosteroniQYY的方法,分析了单一细菌在反应器中生长和营养摄取的过程.实验分析了装置中溶解氧、pH、生物量等变化的规律,检测了中间产物2-羟基喹啉(2-hydroxyquinoline,2-HQ)的生成与降解过程,并结合氨氮和总有机碳(total organic carbon,TOC)的变化探讨了喹啉在SBR中的降解机制.
1 材料与方法
1.1 试剂与培养基
实验室用的喹啉和2-HQ为分析纯,购置于阿拉丁试剂有限公司;甲醇和乙腈为色谱纯,购置于Sigma公司;牛肉膏蛋白胨培养基(beef extract peptone medium,BEP)购置于北京川布兰公司.其余试剂为化学纯,由国药化学试剂有限公司提供.实验室用水为超纯水.
实验室用的无机盐培养基(mineral salt medium,MSM)成分为:Na2HPO4·12H2O 4.26 g/L,KH2PO42.65 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.02 g/L和微量元素1 mL.微量元素成分如下:FeCl2·4H2O 1.5 g/L,NiCl2·6H2O 0.024 g/L,CoCl2·6H2O 0.19 g/L,CuCl2·2H2O 0.002 g/L,MnSO4·H2O 0.061 g/L,Na2MoO4·2H2O 0.024 g/L,ZnCl20.07 g/L,H3BO30.006 g/L.
1.2 降解菌的筛选与16S rRNA鉴定
细菌来源于吉林某化工企业废水处理车间的活性污泥,筛选过程如下:将5 mL混合液接种于含200 mL培养基的三角瓶中,在25℃,200 r/min条件下培养24 h后,接种到新培养基中继续培养;经过3次驯化培养后,培养基的颜色逐渐变成粉红色.采用平板划片法分离培养基中的细菌.参照王培明等[15]的方法,采用PCR通用引物F27(AGAGTTTGATCATGGCTCAG)和R1492(TACGGTTACCTTGTTACGACTT)对已分离的细菌DNA进行PCR扩增后,将获得的PCR产物纯化并提交上海生工进行序列测定,通过BLAST比对分析已获得细菌的同源性.
1.3 SBR装置的启动与运行
实验使用的SBR装置有效容积为1 L,底部曝气(0.2 L/min)并增设搅拌装置(100 r/min).在启动阶段,向装置中依次加入1 L含100 mg/L喹啉的MSM和50 mLD(600)=0.5的菌液,在(10±1)℃条件下,开启曝气和搅拌装置.装置运行周期为曝气13 h,搅拌2 h,沉淀9 h.间隔时间取样分析.
1.4 分析方法
分别采用溶解氧测定仪(Multi 340i,WTW)和pH计(PHS-3C,雷磁)分析水中溶解氧浓度和pH值;采用总有机碳测定仪(TOC-L CPH,日本岛津)测定进水和出水的TOC值;采用紫外-可见光分光光度计(T-6,普析通用)在波长600 nm下测定的吸光度值来对应表示水中细菌的相对数量;采用离子色谱仪(883型,瑞士万通)测定水中氨氮、硝酸盐和亚硝酸盐的浓度.按照Zhi等[16]方法先对细菌进行脱水处理,表面喷银后用场发射扫描电镜(FE-SEM,美国FEI)观察,仪器加速电压为200 kV.采用液相色谱仪(LC-20A,日本岛津)分析水中喹啉和2-HQ的浓度,条件如下:流动相V(乙腈)∶V(水)=60∶40,流量1 mL/min,进样量5 μL,紫外检测器波长设置为273 nm,2-HQ和喹啉的保留时间分别设置为2.4 min 和3.6 min.利用SDS-PAGE仪(Mini-PROTEAN,美国Bio-rad)分析细菌经BEP和喹啉诱导后蛋白谱带的信息,步骤如下:配置D(600)=3的菌悬液40 mL,用超声波细胞粉碎机(JY96,宁波新芝),在冰浴条件下间隔2 s超声处理90 min;样品放入浓缩胶中,在120 V下开始电泳;电泳完成后染色12 h,脱色3 h后拍照.
2 结果与讨论
2.1 细菌形貌
在缺少微量元素,如氨基酸、维生素等条件下,本次实验所筛选的细菌可以利用喹啉为唯一碳源、氮源和能源生长.图1显示,该菌为杆状,长3~5 μm,直径约0.4 μm,外形与部分已鉴定的假单胞菌[6]、红球杆菌[12]等相似.提取该菌株DNA,经过PCR扩增后,在1 500 bp处获得一个明亮条带,如图2所示.利用试剂盒切胶回收,并纯化后测序,得到细菌的16S rRNA序列.将序列提交到Genbank,获得登录号为KM246901.1,命名为QYY.进一步通过Blast比对后发现,该细菌与Genbank上多株睾丸酮丛毛单胞菌的相似度达99%,与C.testosteroniTM062,CNB-2和KZ-OAIFI的进化距离接近.其中TM062和KZ-OAIFI来源于动物组织.而CNB-2已被证实具有降解环境中苯甲酸、苯酚等的能力[17].由此推测,细菌QYY能够适应各种环境条件,并具有降解水中多种有机物的能力.
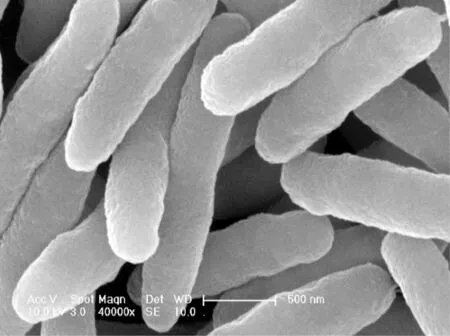
图1 细菌的SEM图

图2 喹啉降解菌的16S rRNA基因扩增电泳图
2.2 低温喹啉降解情况
一些文献显示,在细菌降解喹啉过程中,水溶液的颜色会发生变化,如红球菌QL2降解喹啉时,溶液先变粉红,然后变成暗红色[12];而C.testosteroniQ10降解时,溶液又从粉红色变成黄色[18].本次实验中,水溶液大约从8 h开始颜色由无色变成粉红色,反应11 h后逐渐变成浅绿色,最后经过24 h反应后变成墨绿色.由于初始加菌量、培养基成分和培养条件不同,无法对比相关文献中的细菌对喹啉的降解效率.图3显示了随着水中喹啉逐渐被细菌分解,2-HQ质量浓度逐渐增大.当运行时间达到13 h时,水中喹啉被完全去除,而2-HQ质量浓度达到了42.8 mg/L;再经过0.5 h降解,2-HQ的浓度才达到最大值51.4 mg/L.2-HQ的生成量滞后于喹啉的分解,这表明水中喹啉的去除是经过2个步骤完成的:喹啉首先被细菌的胞外聚合物捕获吸附到细菌表面[19],然后在氧化还原酶的作用下在2-位发生生物催化反应将喹啉转化为2-HQ.从图3可以看出,当水中喹啉被完全去除后,2-HQ质量浓度才逐渐降低,这表明细菌QYY优先分解水中喹啉,然后再分解初级产物2-HQ.然而,在8 h时喹啉去除率超过50%,而2-HQ质量浓度在8 h时才开始出现迅速增大趋势,由于2-HQ是喹啉生物降解的初级产物,意味着8 h后才出现喹啉的大量生物降解,而在8 h前喹啉的去除主要以细菌吸附为主,这明显区别于摇瓶培养条件,也暗示了充足氧条件下细菌对水中有机物具有良好的吸附效果.此外,从图3可以看出在水中喹啉和2-HQ去除的同时,总有机碳含量逐渐下降,但2-HQ去除阶段总有机碳下降显著快于喹啉去除阶段,这也表明了细菌QYY优先分解水中喹啉.
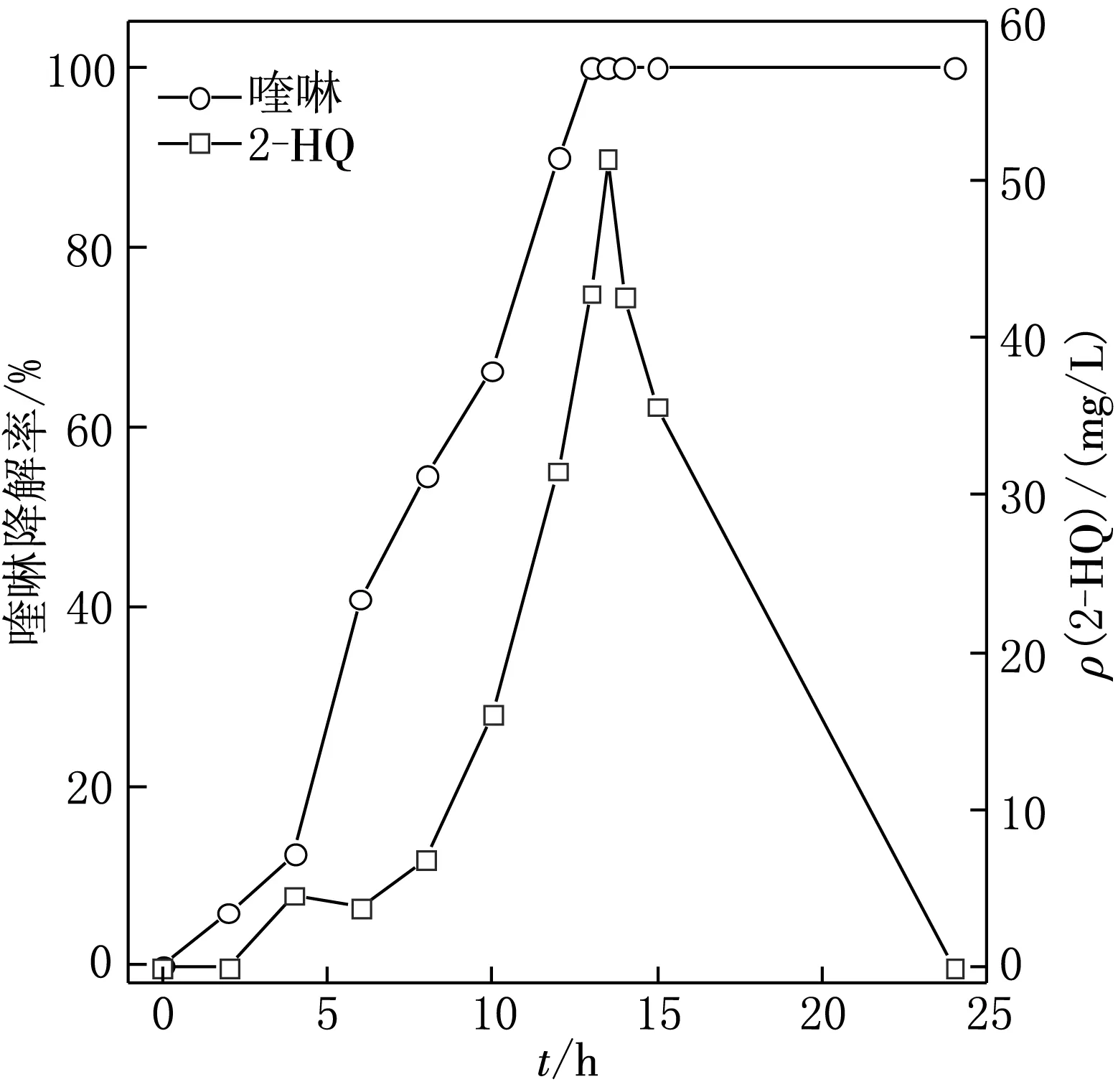
图3 喹啉降解效率和初级降解产物2-HQ生成量

图4 细菌QYY的生长(以D(600)计)和溶液总有机碳含量
与摇瓶培养实验不同[15],水中喹啉的分解并没有严格对应细菌的对数生长期.由图4可见,细菌生长的迟缓期为8 h,在8 h后细菌进入对数生长期.对比图2中喹啉去除率和2-HQ质量浓度的变化,可以发现从反应器运行初始时刻开始,就出现了喹啉的分解和2-HQ的生成.可见反应器中的细菌能够更好地适应环境条件,并分解水中的有机物.此外,在反应13.5 h后,细菌开始降解2-HQ并继续生长,细菌的D(600)值也继续增大(见图4),这表明细菌可以利用2-HQ为碳源和能源进行生长,这不同于一些报道中显示的2-HQ对喹啉降解菌有抑制效应[12].

图5 喹啉降解过程中溶解氧、pH值和氨氮浓度的变化
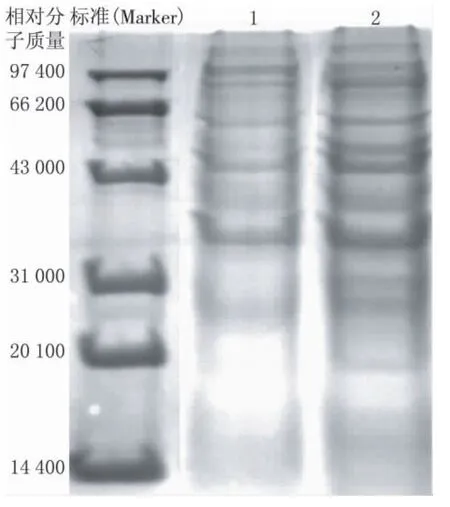
1为BEP培养基,2为无机盐喹啉培养基图6 细菌的蛋白电泳图
图5显示了SBR中细菌分解喹啉时溶解氧、pH值和氨氮浓度的变化情况.如图5所示,受SBR中持续曝气影响,水中溶解氧浓度在初始阶段没有明显变化,但是pH值出现V型变化趋势.初始时刻pH值降低,主要受胁迫条件下细菌释放有机酸的影响.图5(b)显示了在初始4 h内溶液中氨氮离子浓度迅速增大,这说明死亡细菌分解和喹啉降解释放的氨离子浓度逐渐增加,导致pH值出现上升趋势.持续曝气8 h后,溶解氧浓度和pH均出现下降趋势,结合图3和图4可以发现,从8 h开始2-HQ质量浓度迅速增大,同时D(600)值也迅速增加,这表明细菌通过分解水中喹啉获取碳源和能源来合成自身细胞的过程中,消耗了大量的氧并释放有机酸.反应13 h后停止曝气,此时水中喹啉已经被完全降解,细菌以2-羟基喹啉为基质继续生长,同时pH值和溶解氧持续下降,显示细菌可以在低氧条件下继续生殖.另外,图5(b)显示了在水中喹啉分解阶段,氨氮浓度逐渐增加,说明喹啉被细菌分解,其吡啶环上的氮原子被转化为氨氮.但在本次实验中,并未检测到硝酸盐或亚硝酸盐的生成,说明细菌QYY不能氧化氨氮为硝态氮.对比水中喹啉和2-HQ的分解和氨氮的生成过程可以发现,在喹啉快速被生物降解期间,氨氮的产量非常少,这表示在细菌分解喹啉过程中,其初期步骤并不是从氮的脱除开始的,暗示细菌QYY分解水中喹啉可能遵循5,6-二羟基-2(1H)喹诺酮途径[20].
2.3 喹啉降解菌的降解蛋白分析
由图6可见,与泳道1(BEP培养基)相比,喹啉诱导时泳道2的条带数目多且清晰,存在2条新的蛋白条带,分别位于相对分子质量为31 000和50 500处.由于降解喹啉并不是细菌维持生长必需的生命活动,在适合生长条件下,如BEP培养基中,可以不表达降解喹啉的功能.因此,细菌QYY经过喹啉诱导后,产生相应的酶来分解水中喹啉,由此表达了参与喹啉降解的重要蛋白.如果将该蛋白进一步纯化并经二维电泳分析,有可能获得控制喹啉降解的生物信息学信息,揭示微生物降解喹啉时的遗传进化机制.
3 结论
本文从石化废水处理厂的活性污泥中筛选出了1株睾丸酮丛毛单胞菌QYY(登录号:KM246901.1),能够在缺少微量营养条件下以喹啉为唯一碳源、氮源和能源生长.在序批式活性污泥法反应器中,用该细菌降解喹啉时,溶液颜色经历透明—粉红—浅绿—墨绿的变化过程.在持续充氧条件下,水中喹啉的去除与细菌的对数生长期并没有良好的对应关系.充氧有助于提高细菌对水中喹啉的吸附效果,其去除过程遵循先吸附后降解的规律,且优先分解喹啉再分解初级产物2-羟基喹啉,最终将喹啉分子中吡啶环上的氮原子转化为氨氮而不能持续转化为硝态氮.细菌QYY降解喹啉过程中需要消耗氧,在分解喹啉的过程中会生成酸性中间产物降低水的pH值.细菌QYY的降解酶由底物喹啉诱导,不同于细菌利用牛肉膏蛋白胨培养基生长所需的酶.
[1] LU Y,YAN L,WANG Y,et al.Biodegradation of phenolic compounds from coking wastewater by immobilized white rot fungus Phanerochaete chrysosporium[J].Journal of Hazardous Materials,2009,165:1091-1097.
[2] FETZNER S.Bacterial degradation of pyridine,indole,quinoline,and their derivatives under different redox conditions[J].Applied Microbiology and Biotechnology,1998,49:237-250.
[3] SIMS G K,O’LOUGHLIN E J,CRAWFORD R L.Degradation of pyridines in the environment[J].Critical Reviews in Environmental Science and Technology,1989,19:309-340.
[4] MUELLER J G,CHAPMAN P J,PRITCHARD P H.Creosote-contaminated sites.Their potential for bioremediation[J].Environmental Science & Technology,1989,23:1197-1201.
[5] VOIE E LA,DOLAN S,LITTLE P,et al.Carcinogenicity of quinoline,4-and 8-methylquinoline and benzoquinolines in newborn mice and rats[J].Food and Chemical Toxicology,1988,26:625-629.
[6] BAI Y,SUN Q,ZHAO C,et al.Quinoline biodegradation and its nitrogen transformation pathway by aPseudomonassp.strain[J].Biodegradation,2010,21:335-344.
[7] O’LOUGHLIN E J.Isolation,characterization,and substrate utilization of a quinoline-degrading bacterium[J].International Biodeterioration & Biodegradation,1996,66:107-118.
[8] SHUKLA O.Microbiological transformation and biodegradation of quinoline:isolation and characterization of quinoline-degrading bacteria and identification of early intermediates[J].Biological Memoirs,1987,13:115-131.
[9] WANG J L,WU W Z,ZHAO X.Microbial degradation of quinoline:kinetics study withBurkholderiapicekttii[J].Biomed Environ Sci,2004,17:21-26.
[10] MIETHLING R,HECHT V,DECKWER W D.Microbial degradation of quinoline:kinetic studies withComamonasacidovoransDSM 6426[J].Biotechnology and Bioengineering,1993,42:589-595.
[11] 刘佐才,全向春,韩利平,等.喹啉的生物降解动力学[J].物理化学学报,2000,16:663-666.
[12] ZHU S N,LIU D Q,FAN L,et al.Degradation of quinoline byRhodococcussp.QL2 isolated from activated sludge[J].Journal of Hazardous Materials,2008,160:289-294.
[13] CUI M,CHEN F,FU J,et al.Microbial metabolism of quinoline byComamonassp[J].World Journal of Microbiology and Biotechnology,2004,20:539-543.
[14] SCHACH S,TSHISUAKA B,FETZNER S,et al.Quinoline 2-oxidoreductase and 2-oxo-1,2-dihydroquinoline 5,6-dioxygenase fromComamonastestosteroni63.The first two enzymes in quinoline and 3-methylquinoline degradation[J].FEBS Journal,1995,232(2):536-544.
[15] 王培明,霍明昕,朱遂一,等.低温喹啉降解菌的筛选及降解性能[J].环境工程学报,2013,34:154-158.
[16] ZHI G,SUI YI Z,YANG Y,et al.Novel porous polyethersulfone beads as matrix to immobilizeComamonastestosteronisp.bdq06 in quinoline biodegradation[J].Chemical Research in Chinese Universities,2015,31(4):645-650.
[17] NI B,ZHANG Y,CHEN D W,et al.Assimilation of aromatic compounds byComamonastestosteroni:characterization and spreadability of protocatechuate 4,5-cleavage pathway in bacteria[J].Applied Microbiology and Biotechnology,2013,97:6031-6041.
[18] CUI M,CHEN F,FU J,et al.Cometabolic biodegradation of quinoline’s derivatives by a quinoline-degrading bacteria:Comamonassp.strain Q10[J].The Journal of General and Applied Microbiology,2003,49:351-355.
[19] 王文军,王文华,张学林,等.生物膜及其各种组分对4-氯酚化合物的吸附特征[J].环境科学,2001,22:19-24.
[20] SUN Q,BAI Y,ZHAO C,et al.Aerobic biodegradation characteristics and metabolic products of quinoline by aPseudomonasstrain[J].Bioresource Technology,2009,100:5030-5036.
(责任编辑:方 林)
Biodegradation of quinoline by Comamonas testosteroni QYY in sequence batch reactor at low temperature
CHEN Yu1,2,JIA Tao2,3,WANG Tian-zhu2,WANG Hong-ning2,4,XU Te-xiu2,GUO Shu-jun2,4,SHAO De-wu2,4,LIU Zhi-qiang2,ZHU Sui-yi2
(1.Jilin Institute of Forestry Survey and Design,Changchun 130022,China;2.Jilin Engineering Research Centre for Municipal Wastewater Treatment and Water Quality Protection,Northeast Normal University,Changchun 130117,China;3.Hebei Survey Institute of Environmental Gelogy,Xingtai 050022,China;4.No.109 Wastewater Treatment Plant,Petrochina Jilin Petrochemical Company,Jilin 132022,China)
A rod-shaped aerobe,capable of degrading quinoline without micronutrient was isolated from active sludge of a petro-chemical wastewater treatment plant and later identified asComamonastestosteroniQYY(Genbank No.KM246901).The strain was inoculated as a sole bacterium for quinoline degradation into a sequence batch reactor at (10±1)℃.The results show thatC.testosteroniQYY assembled quinoline in water prior to its initial products 2-hydroxyquinoline and converted the N atom in the pyridine ring of quinoline into ammonia nitrogen rather than nitrate or nitrite.In the reactor,the quinoline removal was irrelevant to the exponential growth period ofC.testosteroniQYY and gradually decreased dissolved oxygen concentration from 8 mg/L to 2.4 mg/L,followed by releasing some acidic intermediates of quinoline degradation to reduce the pH value of water.Moreover,some key enzymes for quinoline degradation were induced by adding quinoline into MSM,which was different with that induced by beef extract peptone medium.
quinoline;Comamonastestosteroni;biodegradation;low temperature
1000-1832(2016)04-0132-06
10.16163/j.cnki.22-1123/n.2016.04.028
2016-06-23
国家水体污染控制与治理科技重大专项课题(2014ZX07201-011-004-2);国家自然科学基金资助项目(51108069,51478096);吉林省自然科学基金资助项目(20140520151JH).
陈瑜(1981—),女,硕士,工程师,主要从事水污染控制研究;通讯作者:朱遂一(1982—),男,博士,副教授,主要从事污水处理与资源化研究.
X 172 [学科代码] 610·1020
A

