金纳米簇的制备、表征及对玉米种子萌发的影响
窦润芝,陈 静,杨中州,由婷婷,高 翔,王 丽
(东北师范大学遗传与细胞研究所,吉林 长春 130024)
金纳米簇的制备、表征及对玉米种子萌发的影响
窦润芝,陈 静,杨中州,由婷婷,高 翔,王 丽
(东北师范大学遗传与细胞研究所,吉林 长春 130024)
选用模式植物玉米为研究材料,初步评估了金纳米簇在植物中的安全性.结果表明:金纳米簇对玉米种子发芽率没有影响,50~400 mg/L的金纳米簇能够促进发芽期间玉米幼苗根和芽的生长.通过切片观察了金纳米簇在玉米幼苗细胞和组织中的吸收情况,发现金纳米簇能够进入玉米根尖脱落细胞以及根部皮层细胞.另外,通过电感耦合等离子体原子发射光谱(ICP-AES)测定了金纳米簇在玉米幼苗中的吸收量,证实了金纳米簇未从玉米根部向地上运输.
金纳米簇;玉米种子萌发;吸收;运输
纳米材料是指在三维空间中至少有一个维度的尺寸处于1~100 nm之间或由小于100 nm的基本单元组成的材料[1-2].随着纳米科学与技术的快速稳步发展,纳米材料已经广泛应用于农业、医药、食品、化妆品、日用品等众多领域中[3-5].然而在生产、使用和处理等过程中纳米材料会不可避免地被传播到生态环境当中,可能对生物体和生态环境造成不可预知的影响,因而纳米材料的环境行为及其毒性效应已经引发研究人员的广泛关注[6-8].
金纳米簇(AuNCs)是一种新型的荧光纳米材料,通常由几个到100个金原子组成,尺寸小于2 nm[9].它们具有荧光强度大、毒性低、水溶性良好、生物相容性高等优点[9-10],因而在生物传感和生物成像等方面应用广泛[11].目前关于金纳米簇在细胞中的吸收和毒性研究仅在动物细胞中有报道[12-13],而对于金纳米簇在植物中的吸收和毒性研究尚未见报道.
本文选用USEPA(美国环境保护署)推荐的研究农药和有毒物质生态效应的模式植物玉米为对象,通过观察金纳米簇对玉米早期萌发和生长的影响,探究了金纳米簇在植物中的安全性,并通过切片观察及等离子体原子发射光谱(ICP-AES)测定研究了金纳米簇在玉米细胞和组织中的吸收情况,为金纳米簇在植物中的应用提供了理论基础.
1 实验部分
1.1 金纳米簇的制备、纯化与表征
实验制备和盛装试剂的玻璃容器均用王水浸泡处理并洗净晾干.金纳米簇的制备参照Xie等[14]的方法:将50 mL的氯金酸(HAuCl4)水溶液(10 mmol/L,37℃)加入到50 mL的牛血清白蛋白(BSA)水溶液(50 mg/L,37℃)中,搅拌5min后加入5 mL的氢氧化钠(NaOH)水溶液(1 mol/L),37℃水浴反应12 h.将制得的金纳米簇14 000 r/min离心30 min,取上清加入到透析袋(截留相对分子质量为14 000)中透析4 d,之后用孔径为0.22 μm的微孔滤膜过滤除菌,4℃放置备用.利用JEOL JEM-2100F高分辨透射电子显微镜(HR-TEM,日本电子株式会社)、Nano Measure软件、Zetasizer Nano ZS激光粒度仪(马尔文仪器有限公司,英国)、Cary Eclipse荧光分光光度计(瓦里安公司,美国)及Thermo Nanodrop 1000分光光度计(Nanodrop,美国)检测金纳米簇的粒径大小、ζ电势、荧光以及紫外可见吸收光谱.
1.2 金纳米簇对玉米的暴露处理及其对萌发期玉米的影响
玉米种子(郑单958,北京德农种业有限公司)先用70%乙醇处理2 min,再用无菌水清洗5次.将不同质量浓度的金纳米簇(50,100,200,400 mg/L)以5 mL/皿的量加入到培养皿中(含单层滤纸),每个培养皿均匀地放入10粒种子,每个处理3个重复,空白对照用超纯水处理.将培养皿放置于人工气候室中,设定温度为25℃,湿度为80%,光照为24 h黑暗.分别统计不同浓度金纳米簇处理的玉米种子每天的发芽数,以及金纳米簇处理第5天玉米的根长、芽长和鲜重.
1.3 玉米根部细胞压片、组织切片及荧光显微观察
暴露结束后,将玉米根用超纯水冲洗,切取根尖(约0.5 mm长)进行压片处理并在Nikon Eclipse 80i荧光显微镜(尼康公司,日本)下观察.同时取根部成熟区用5%琼脂糖包埋,利用LEICA VT1000 S振动切片机(徕卡公司,德国)制作横切切片.
1.4 样品消解及组织中金元素含量的ICP-AES测定
暴露结束后,将玉米幼苗切分成根和芽两部分,分别用自来水冲洗并在超纯水中超声5 min;用超纯水洗净并吸干水分,105℃杀青15 min,70℃烘干至恒重.
将烘干的样品磨成粉末,取干样0.05 g置于100 mL锥形瓶中,向其中加入5 mL浓硝酸(HNO3),用保鲜膜封口,浸泡过夜,每个浓度3个重复.把锥形瓶转移到电热板上,120℃加热1 h后,加1 mL王水浸泡1 h;之后将其置于65℃烘箱中继续溶解1 h.将瓶内液体吸出定容至1.5 mL,利用ICP-AES(Aodigy型,利曼公司,美国)检测金元素含量.空白设置:加等量的浓硝酸,操作同样品.
1.5 分析方法
实验数据统计分析采用软件SPSS 19.0,用ANOVA(analysis of variance,Tukey-HSD检验法)进行差异显著性检验(P<0.05).
2 结果与分析
2.1 金纳米簇的表征
制备的金纳米簇在高分辨透射电子显微镜(HR-TEM)下呈圆球形颗粒,平均粒径为(2.05±0.41)nm(见图1a,b).金纳米簇在紫外-可见范围内并没有特征的吸收峰(见图1c),利用荧光分光光度计检测得的荧光光谱显示金纳米簇在480 nm激发下于638 nm处有吸收峰(见图1c),且在紫外灯(365 nm)下呈鲜红色(见图1d).利用Zetasizer Nano ZS激光粒度仪测得金纳米簇的ζ电势为(-14.70±0.96) mV,表明金纳米簇带负电荷.

a金纳米簇的HR-TEM图像;b金纳米簇的粒径分布图;c金纳米簇的UV-Vis吸收(黑线)及荧光光谱(红线,激发波长为480 nm);d日光和紫外灯(365 nm)下的金纳米簇
2.2 金纳米簇对玉米萌发的影响
不同质量浓度的金纳米簇处理玉米种子5 d后的形态见图2a.以玉米根长超过2 cm作为发芽标准[15],发现 50~400 mg/L的金纳米簇对玉米的发芽率没有影响.统计金纳米簇处理玉米5 d后的根长和芽长发现,100,200,400 mg/L的金纳米簇对玉米根的伸长有促进作用,与对照相比分别增加了18.37%,20.87%和18.26%(见图2b);而4个质量浓度(50,100,200,400 mg/L)的金纳米簇对芽的伸长均有促进作用,与对照相比分别增加了21.19%,24.86%,21.19%和22.60%(见图2c).
通过分析金纳米簇处理玉米5 d后根与芽的鲜重发现,所有浓度的金纳米簇对根的鲜重均没有影响(见图2d);但对芽的鲜重有促进作用,与对照相比50,100,200,400 mg/L的金纳米簇处理玉米5 d后芽的鲜重分别增加了11.88%,20%,15%和24.38%(见图2e).
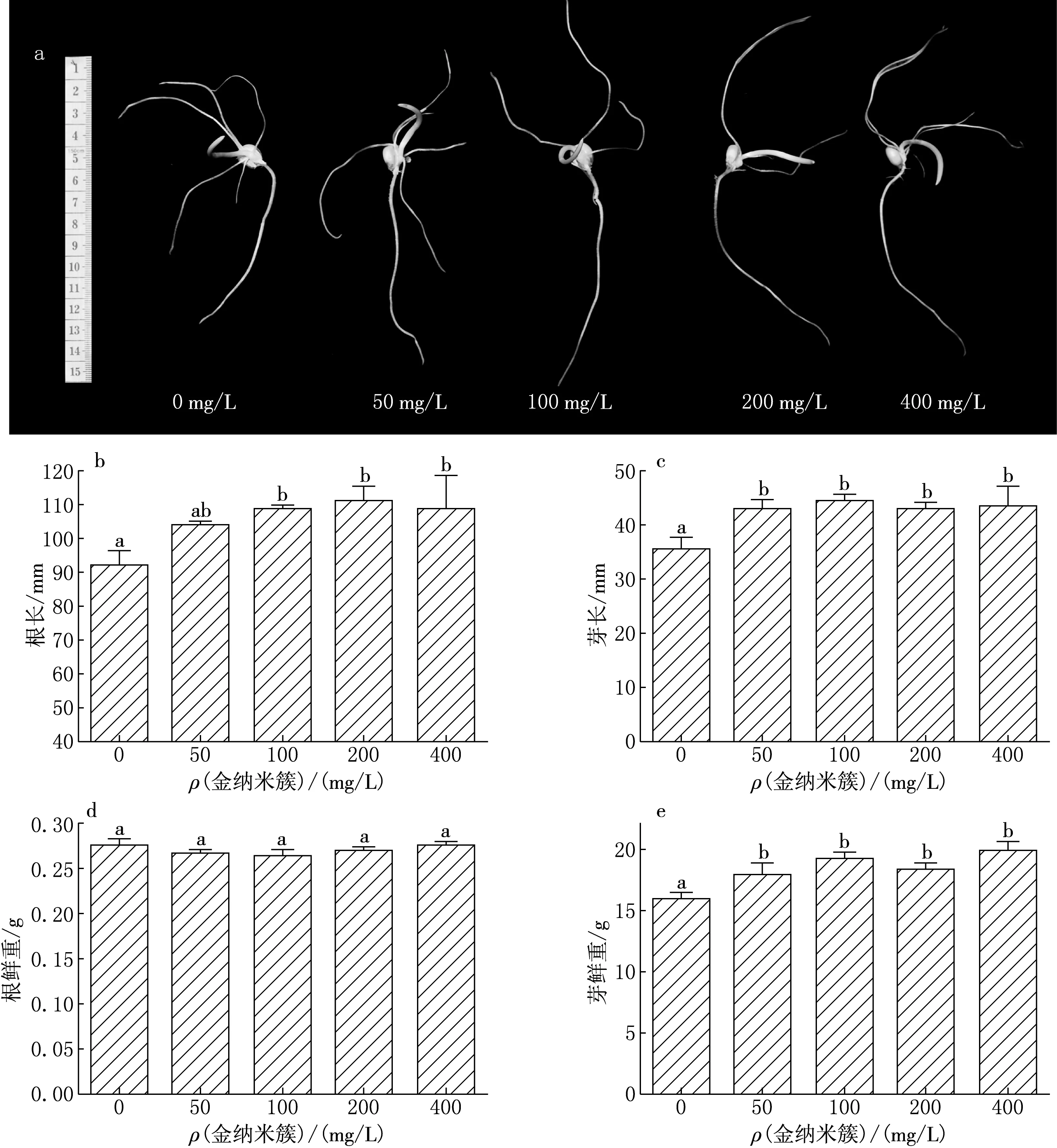
a不同质量浓度金纳米簇处理玉米种子5 d后的形态;b根长;c芽长;d根鲜重;e芽鲜重
2.3 玉米对金纳米簇的吸收及运输
2.3.1 玉米幼根压片及切片
分别对超纯水和400 mg/L金纳米簇处理第三天的玉米幼根根尖(约0.5 mm)进行压片,发现400 mg/L 金纳米簇处理后的玉米根尖脱落细胞中存在红色荧光物质(见图3a,b),说明金纳米簇可以穿透玉米细胞的细胞壁和细胞膜,进入根尖脱落细胞内.同时我们对玉米幼根进行横切,在金纳米簇处理的玉米根成熟区的皮层细胞中也观察到了少量红色荧光物质(见图3c,d),说明金纳米簇能够进入玉米根部.
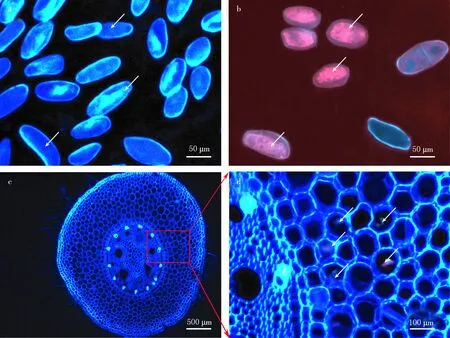
a超纯水处理的玉米第3天的根部细胞压片(40×物镜);b 400 mg/L金纳米簇处理的玉米第3天的根部细胞压片(40×物镜);
2.3.2 玉米体内金元素含量的测定

图4 ICP-AES测定玉米根部组织中的金元素含量
利用ICP-AES对玉米根和芽中的金元素含量进行测定,结果见图4.由图4可见,对照组的根中未检测到金元素的存在;金纳米簇处理5 d后的玉米根系中金元素的含量随着处理浓度的增加而升高,最大质量浓度400 mg/L金纳米簇处理的玉米根系中金含量(1 604.11 μg/g)是50 mg/L 处理(57.90 μg/g)的27.7倍.而在玉米芽中,ICP-AES的结果显示未检测到金元素的存在.
3 讨论
许多研究表明纳米材料对植物的萌发率没有影响,但是对其生长和发育却能产生影响[16].如柠檬酸包被的金纳米粒子在较低浓度就能抑制水稻根的伸长,但是对水稻种子的萌发率没有影响[17].本研究发现,金纳米簇对玉米种子的萌发率未产生影响,但是一定浓度的金纳米簇能够促进发芽期间玉米幼苗根和芽的生长.Kumar等[18]的研究发现,10和80 μg/mL的金纳米粒子(24 nm)能下调参与种子萌发、幼苗生长以及根伸长的miR( microRNA )398和miR408的表达从而促进拟南芥的营养生长.我们推测金纳米簇促进玉米幼苗生长的原因可能是金纳米簇改变了一些与玉米生长发育相关的miR的表达.
粒径是纳米粒子重要的特征,也是进入植物体并产生生物学效应的关键因素.与动物细胞相比,植物细胞多了一层细胞壁(孔径≤10 nm)[19-20],有报道表明,小粒径的纳米粒子可以进入到植物细胞[21-23].我们的课题组已经报道了粒径在3 nm左右的碳量子点可以进入玉米根部细胞[23],本实验同样在玉米根尖脱落细胞中观测到了金纳米簇的存在,这可能是由于3 nm的金纳米簇粒径小于细胞壁孔径导致的结果.
利用ICP-AES在玉米根中能检测到大量金元素的存在,而利用荧光显微镜仅能在玉米根中的皮层细胞中检测到少量金纳米簇的存在,结合金纳米簇能够被过氧化氢淬灭[24],推测玉米根中被吸收的金纳米簇的荧光可能被组织中的过氧化氢淬灭,也有可能是植物组织中的其他成分改变了金纳米簇的表面结构致使其荧光性质改变.
在金纳米簇暴露下的玉米,其根中可以检测出金元素,而在其地上部分并未发现,说明金纳米簇在玉米体内不能向地上运输.金纳米簇不能从玉米根组织进一步运输到芽可能是受到玉米内皮层凯氏带的阻碍,因而金纳米簇无法进入维管束随着水分向上运输.这与Wang等[25]的研究结果一致:CdSe/CdZnS量子点能够被杨树根部吸收但不能运输到地上部分.
本实验探究了金纳米簇对玉米种子萌发的影响,发现这种纳米材料对玉米早期萌发阶段根和芽的生长有促进作用,但其作用机制仍需进一步研究.
[1] 方吉祥.溶液中Au、Ag纳米结构及其晶体生长机制研究[D].西安:西安交通大学,2007.
[2] 张立德,牟季美.纳米材料和纳米结构[M].北京:科学出版社,2001:525.
[3] NEL A,XIA T,MäDLER L,et al.Toxic potential of materials at the nanolevel[J].Science,2006,311(5761):622-627.
[4] NOWACK B,BUCHELI T D.Occurrence,behavior and effects of nanoparticles in the environment[J].Environmental Pollution,2007,150(1):5-22.
[5] MIRALLES P,CHURCH T L,HARRIS A T.Toxicity,uptake,and translocation of engineered nanomaterials in vascular plants[J].Environmental Science & Technology,2012,46(17):9224-9239.
[6] WIESNER M R,LOWRY G V,ALVAREZ P,et al.Assessing the risks of manufactured nanomaterials[J].Environmental Science & Technology,2006,40(14):4336-4345.
[7] ROBICHAUD C O,TANZIE D,WEILENMANN U,et al.Relative risk analysis of several manufactured nanomaterials:an insurance industry context[J].Environmental Science & Technology,2005,39(22):8985-8994.
[8] 吕继涛,张淑贞.人工纳米材料与植物的相互作用:植物毒性、吸收和传输[J].化学进展,2013,25(1):156-163.
[9] CUI M L,ZHAO Y,SONG Q J.Synthesis,optical properties and applications of ultra-small luminescent gold nanoclusters[J].Trac-Trends in Analytical Chemistry,2014,57:73-82.
[10] 曹雪玲.蛋白质保护金纳米簇的性能优化及在药物小分子检测中的应用[D].长春:吉林大学,2014.
[11] CHEN L Y,WANG C W,YUAN Z Q,et al.Fluorescent gold nanoclusters:recent advances in sensing and imaging[J].Analytical Chemistry,2015,87(1):216-229.
[12] DONG L,LI M,ZHANG S,et al.Cytotoxicity of BSA-stabilized gold nanoclusters:in vitro and in vivo study[J].Small,2015,11(21):2571-2581.
[13] ZHAO J Y,CUI R,ZHANG Z L,et al.Cytotoxicity of nucleus-targeting fluorescent gold nanoclusters[J].Nanoscale,2014,21(6):13126-13134.
[14] XIE J P,ZHENG Y G,YING J Y.Protein-directed synthesis of highly fluorescent gold nanoclusters[J].Journal of the American Chemical Society,2009,131(3):888-889.
[15] UNITED STATES ENVIRONMENTAL PROTECTION AGENCY(US EPA).Ecological effects test guidelines(OPPTS 850.4200):seed germination/root elongation toxicity test.EPA 712-C-96 609[R].Washington,DC:1996.
[16] STAMPOULIS D,SINHA S K,WHITE J C.Assay-dependent phytotoxicity of nanoparticles to plants[J].Environmental Science & Technology,2009,43(24):9473-9479.
[17] WANG A,NG H P,XU Y,et al.Gold nanoparticles:synthesis,stability test,and application for the rice growth[J].Journal of Nanomaterials,2014,2014:1-6.
[18] KUMAR V,GULERIA P,KUMAR V,et al.Gold nanoparticle exposure induces growth and yield enhancement inArabidopsisthaliana[J].Science of the Total Environment,2013,461-462: 462-468.
[19] CARPITA N,SABULARSE D,MONTEZINOS D,et al.Determination of the pore size of cell walls of living plant cells[J].Science,1979,205(4411):1144-1147.
[20] BERESTOVSKY G N,TERNOVSKY V I,KATAEV A A.Through pore diameter in the cell wall ofCharacorallina[J].Journal of Experimental Botany,2001,52(359):1173-1177.
[21] SABO-ATTWOOD T,UNRINE J M,STONE J W,et al.Uptake,distribution and toxicity of gold nanoparticles in tobacco(Nicotianaxanthi) seedlings[J].Nanotoxicology,2012,6(4): 353-360.
[22] ZHU Z-J,WANG H H,YAN B,et al.Effect of surface charge on the uptake and distribution of gold nanoparticles in four plant species[J].Environmental Science & Technology,2012,46(22):12391-12398.
[23] CHEN J,DOU R Z,YANG Z Z,et al.The effect and fate of water-soluble carbon nanodots in maize(ZeamaysL.)[J].Nanotoxicology,2016,10(6):818-828.
[24] WEN F,DONG Y,FENG L,et al.Horseradish peroxidase functionalized fluorescent gold nanoclusters for hydrogen peroxide sensing[J].Anal Chem,2011,83(4):1193-1196.
[25] WANG J,YANG Y,ZHU H G,et al.Uptake,translocation,and transformation of quantum dots with cationic versus anionic coatings byPopulusdeltoides×nigracuttings[J].Environmental Science & Technology,2014,48(12):6754-6762.
(责任编辑:方 林)
Fabrication and characterization of gold nanoclusters and their effects on maize(ZeamaysL.) seed germination
DOU Run-zhi,CHEN Jing,YANG Zhong-zhou,YOU Ting-ting,GAO Xiang,WANG Li
(Institute of Genetics and Cytology,Northeast Normal University,Changchun 130024,China)
Maize,as a model plant,was chosen in this research to assess the safety of gold nanoclusters in plants.The results showed that gold nanoclusters had no effect on germination rate of maize seeds.However,gold nanoclusters at 50~400 mg/L could significantly promote the elongation of roots and shoots during the germination.The fluorescence of gold nanoclusters in the cells and tissue of maize roots was tracked by slicing and fluorescent microscope.Fluorescent microscope graphs showed that gold nanoclusters were existed in detached root-cap cells and cortex of roots,suggesting that gold nanoclusters were absorbed by maize.Moreover,the content of gold element in maize was determined by inductively coupled plasma atomic emission spectrometer(ICP-AES),which suggested that gold nanoclusters can not be translocated to the shoots from the roots of maize.
gold nanoclusters; maize seed germination; uptake; transport
1000-1832(2016)04-0100-06
10.16163/j.cnki.22-1123/n.2016.04.022
2016-05-06
国家国际科技合作专项项目(2014DFA31740);吉林省科技发展计划项目(20130604037TC).
窦润芝(1992—),女,硕士研究生;王丽(1957—),女,博士,教授,博士研究生导师,主要从事植物遗传学研究.
Q 943 [学科代码] 180·5155
A

