闽江口潮滩湿地不同植被带土壤及间隙水中硅的分布特征
翟水晶, 薛丽丽
1 福建师范大学地理研究所,福州 350007 2 福建师范大学地理科学学院,湿润亚热带生态地理过程教育部重点实验室,福州 350007 3 浙江大学环境与资源学院,杭州 310058
闽江口潮滩湿地不同植被带土壤及间隙水中硅的分布特征
翟水晶1,2,*, 薛丽丽3
1 福建师范大学地理研究所,福州 350007 2 福建师范大学地理科学学院,湿润亚热带生态地理过程教育部重点实验室,福州 350007 3 浙江大学环境与资源学院,杭州 310058
以闽江口潮滩湿地为研究对象,由岸及海方向对芦苇、短叶茳芏、互花米草(潮沟内)和互花米草(潮沟外)4种湿地土壤生物硅和土壤间隙水氮硅营养盐含量及其随深度变化的特征进行为期1a的季度观测。结果显示:互花米草(外)、短叶茳芏、芦苇和互花米草(内)带湿地土壤生物硅的年均含量依次降低,分别为14.33、10.40、9.98、7.50 mg/g;互花米草(外)、互花米草(内)、短叶茳芏和芦苇带湿地土壤间隙水活性硅酸盐年均含量依次降低,分别为407、359、344、323 μmol/L;湿地各植被带土壤及间隙水含硅量均呈现夏秋季节高于冬春季节的趋势。统计分析表明:间隙水活性硅酸盐与土壤生物硅含量、距潮沟的距离之间的正相关性均比较显著(P<0.05),温度对土壤中硅含量的影响也有一定的正相关性,说明湿地植被、温度和潮汐作用是影响闽江口湿地硅分布的重要因素。与土著种对比,互花米草入侵在一定程度上改变了闽江口潮滩湿地土壤硅分布的格局。
生物硅;活性硅酸盐;间隙水;潮滩湿地;闽江口
硅是大多数土壤的基本成分,也是多种植物生长所必需的营养元素。湿地植被普遍被认为是硅聚集体,湿地土壤也被认为是巨大的硅库[1- 2]。关于硅生物地球化学循环的研究主要集中在陆地和海洋[3],硅在湿地中的循环过程却没有得到充分的认识,特别是其在植物和土壤中的产生、滞留、传输以及无定形硅的溶解过程和机制研究较少[4]。据统计,海洋生态系统从外部获取的活性硅酸盐中80%是来自于河流生态系统[5],因此陆海交界的河口湿地生态系统被认为是研究硅的重要区域[6]。目前,关于硅在河口湿地生态系统的研究多集中在比利时、美国、法国等湿地[7- 15],我国仅在长江口和黄河口湿地开展过[16-19]。闽江河口是中国东南沿海典型的开放式感潮河口,其最大的湿地——鳝鱼滩湿地位于闽江河口区的外河口段,从潮上带到潮下带依次分布的优势种为芦苇(Phragmitesaustralis)、短叶茳芏(Cyperusmalaccensis)和藨草(Scirpustriqueter),2004年开始外来植物互花米草(Spatinaalterniflora)入侵鳝鱼滩湿地,并呈斑块分布,而藨草逐渐消失。因此,闽江河口潮滩湿地是研究营养盐沉积和互花米草入侵的典型区域。目前,在闽江口湿地进行了大量关于植被及土壤氮、磷、碳及钾等元素的研究,但主要集中在变化特征、生态化学计量特征和储量等方面[20-25],而关于生源要素硅还没有开展相关工作。
在近海岸和河口生态系统中,越来越多的研究认为对藻类生长和生产力起限制作用的因子逐渐由N、P转变为Si和Fe[26-27],尤其是河口区活性硅酸盐下降可导致近海海域中硅限制,给海洋生态系统带来巨大的危害[28-31]。影响活性硅酸盐的营养盐因素中有机氮被认为对硅素影响较大[32-34],而无机氮对硅素的影响研究较少,仅在胶州湾发现海水中颗粒态生物硅含量与溶解无机氮显著正相关[33]。鉴于以上问题,本文以闽江口潮滩湿地为研究对象,于2012年10月—2013年9月期间沿由岸及海方向依次选择芦苇、短叶茳芏和互花米草植被带(分潮沟内外),对土壤间隙水中活性硅酸盐与无机氮以及土壤生物硅含量进行了1a的观测,分析其剖面和季节变化特征,以期为闽江口地区硅生物地球化学循环过程研究提供基础数据,为研究互花米草入侵提供新的思路。
1 材料与方法
1.1 研究区域及采样点
在鳝鱼滩湿地西部,选择植被带分布比较明显、受人类干扰相对较少的区域,设置一个由岸向海方向的垂直样线,分别在该样线上的芦苇、短叶茳芏和互花米草植被带选择中心点位,其经纬度信息分别为(26°1′58.64″,119°36′52.46″)、(26°5′0.63″,119°36′55″)和(26°2′1.98″,119°36′56.88″),2013年1月起增加离海更近、30 m宽潮沟外的互花米草植被带(其中心点位信息为26°2′8″,119°37′3.9″)作为对比。以每个植被带的中心点位为中心选择边长1m的正三角形,其3个顶点作为采样点(图1)。

图1 研究区域与采样点(根据2010年遥感影像数字化所绘)Fig.1 Map of study area and sampling locations
为了便于比较各植被斑块湿地间的差异,本文分别将芦苇、短叶茳芏和互花米草植被带湿地简称为芦苇湿地、短叶茳芏湿地和互花米草湿地,潮沟内外的互花米草湿地分别简称为互花米草(内)湿地和互花米草(外)湿地。
1.2 样品采集与处理
(1)样品采集 分别于2012年10月24日、2013年1月28日、2013年4月20日和2013年9月7日,在芦苇、短叶茳芏、潮沟内外互花米草植被采样点用直径 10 cm高60 cm的柱状采泥器取地下30 cm的柱状土样,以 5 cm厚度进行现场分割,共分6层 (0—5、5—10、10—15、15—20、20—25、25—30 cm),装入自封袋,立即运回实验室。
(2)间隙水 对每层土壤以4000 r/min的转速进行离心10 min,将所得上清液置于聚丙烯瓶内,在4℃冰箱里冷藏备用。
(3)土壤 将未进行离心的土壤自然风干,待样品完全干燥后研磨、过100目尼龙网筛,装入聚乙烯塑料袋中密封保存,备用。
1.3 分析方法与数据处理
活性硅酸盐(Dissolved Silicate,DSi)测定:按照《海洋监测规范》第4部分(GB17378.4—1998)中“活性硅酸盐硅钼蓝法”测定间隙水活性硅酸盐含量。方法的精密度:以2015年4月在芦苇斑块湿地所取表层5 cm间隙水样为例测得其活性硅酸盐含量为(57.11±2.85)μmol/L (n=3),相对标准偏差为4.99%。

土壤(Biogenic Silica,BSi)的测定:采用热碱法。称取重量约200 mg土壤样品于50 mL聚丙烯离心管中,加入5 mLH2O2(10%)震荡摇匀,30 min后,加入5 mL 1 mol/L HCl摇匀并静置30 min,去除碳酸盐和有机质。再加入20 mL去离子水,以4000 r/min离心10 min,弃去上清液,去除多余的酸和过氧化物。然后,将样品置于烘箱中60 ℃干燥12h后,加入85℃ 2 mol/L的Na2CO3提取液50 mL,震荡混匀,放入85℃恒温水浴,间隔1、3、5 h,各提取1次,每次提取0.2 mL,提取液中的硅酸盐含量用硅钼蓝比色法测定,根据提取液中硅含量随时间变化做动力曲线,利用其直线部分的反延长线与Y轴的交点值确定样品中BSi含量[16,35]。
方法的精密度:潮沟外互花米草湿地(生物硅含量相对较高)土壤生物硅含量为(6.60±1.11)mg/g(n=5),相对标准偏差为18.7%。潮沟内互花米草湿地(生物硅含量相对较低样品)土壤生物硅含量为(4.57±0.96)mg/g (n=5),相对标准偏差为21.1%。
实验数据采用SPSS17.0,EXCEL软件进行统计分析与制图。
2 结果与分析
2.1 不同季节不同植被带湿地土壤间隙水活性硅酸盐含量的垂直变化特征
总体上,湿地土壤间隙水活性硅酸盐含量在夏秋季节高于冬春季节(图2)。2013年9月正值夏末,闽江口各植被带土壤间隙水中活性硅酸盐含量最高,变化于389—763 μmol/L;其次为2012年10月(308—342μmol/L)、2013年4月(73—412 μmol/L);2013年1月最低,变化于171—311 μmol/L。从各植被带湿地来看,土壤间隙水活性硅酸盐含量大小分别为:互花米草(外)>互花米草(内)>短叶茳芏>芦苇,年均值分别为407、359、344和323 μmol/L。其中,互花米草湿地(内外湿地平均)间隙水在2013年9月含硅量最高达592 μmol/L,2013年1月最低264 μmol/L。从剖面来看,各种植被带土壤间隙水含硅量的变化趋势大体一致,均随深度增加呈折线变化趋势,且季节间差异较大。

图2 不同季节不同植被带湿地土壤间隙水活性硅酸盐含量垂直变化 Fig.2 Vertical variance of DSi in the interstitial water of different vegetations wetland soil in different seasons

图3 不同季节不同植被带湿地土壤间隙水中含量垂直变化特征Fig.

图4 不同季节不同植被带湿地土壤间隙水中含量垂直变化特征Fig.
2.3 不同植被带土壤间隙水营养盐的季节平均含量


图5 不同植被带土壤间隙水营养盐各季节的平均含量 Fig.5 Average nutrients′ contents in interstitial water of different vegetation soil in each season
2.4 不同植被带土壤生物硅的剖面分布特征
从深度变化来看,4种植被湿地土壤生物硅含量的剖面分布特征大致呈现折线变化趋势(图6),除了2013年4月互花米草(外)、2013年9月互花米草(外)和芦苇湿地土壤生物硅含量随深度变化较大,其他变化幅度均较小,总体上随深度增加生物硅含量略有增加的趋势,特别是在2013年4月和9月比较明显,而2012年10月和2013年1月深度越大土壤生物硅含量下降的趋势比较明显。从季节变化来看,4种植被湿地土壤生物硅在2012年10月、2013年1月、4月和9月的平均含量分别为:(8.48±0.60)、(6.76±0.78)、(10.92±1.98)、(14.60±2.69) mg/g。
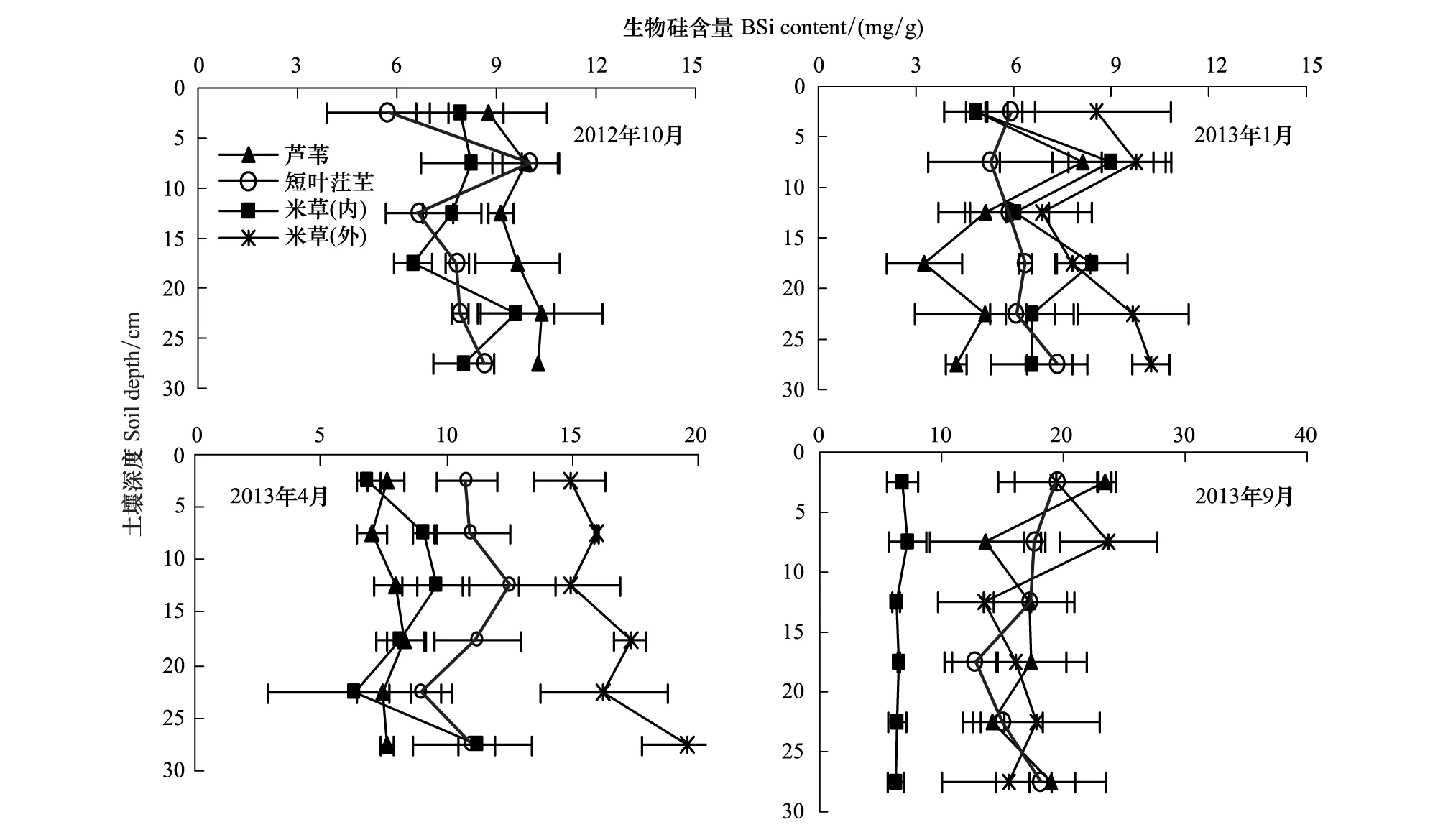
图6 不同季节不同植被带土壤生物硅含量剖面分布特征Fig.6 Vertical variance of BSi content in the soil of different vegetations in different seasons
2.5 不同植被带湿地土壤生物硅的季节变化
芦苇、短叶茳芏、互花米草(内)和互花米草(外)湿地土壤生物硅的年平均含量分别为(9.98±2.66)、(10.40±2.33)、(7.50±0.46)、(14.33±2.78)mg/g(图7)。其中,潮沟外互花米草湿地土壤生物硅含量最高(8.82—17.67 mg/g),潮沟内互花米草湿地土壤生物硅含量最低(6.57—8.56 mg/g),年均变化较小。除了潮沟内互花米草,其他3种植被湿地土壤生物硅含量均遵循“夏秋季节高、冬春季节低”的趋势。
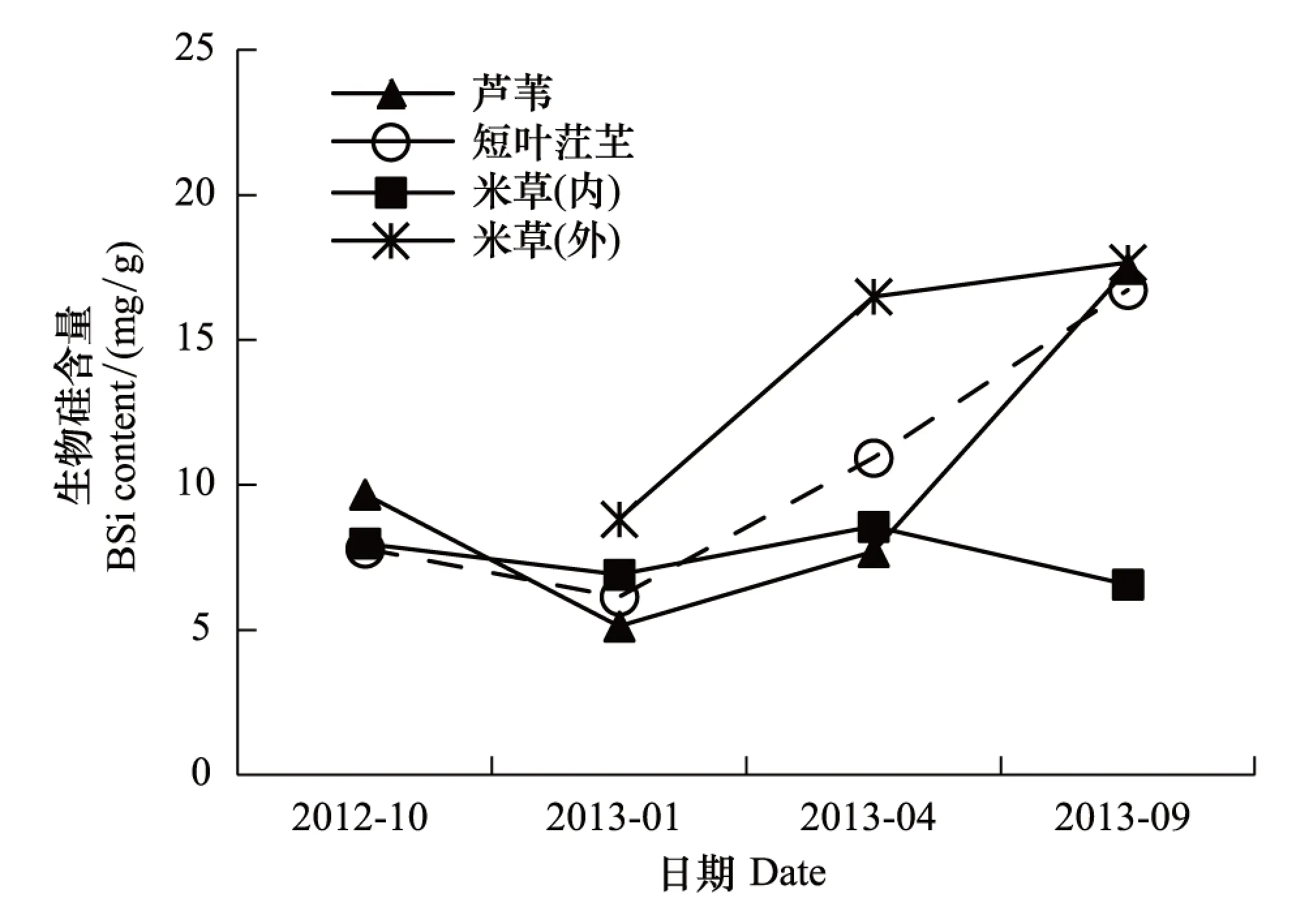
图7 不同植被带土壤生物硅平均含量的季节变化 Fig.7 Seasonal variance of the average BSi content in the wetland soil of different vegetations
3 讨论
3.1 影响土壤和间隙水中硅分布的主要因素
河口湿地土壤中生物硅含量高低与土壤理化性质有关。当土壤pH值小于8时,pH值对生物硅溶解度的影响略小,大于8时影响显著[36- 37]。鳝鱼滩湿地土壤pH值平均6.68±0.03[38],对土壤生物硅含量影响较小。土壤的机械组成差异也能影响生物硅含量变化,颗粒越细有机质含量越丰富,越有利于生物硅的赋存与累积[32]。本文研究地点鳝鱼滩湿地土壤中黏土、粉砂含量分别为22.33%、71.11%[39],有利于土壤生物硅赋存,通过对比大致上可以发现:芦苇、短叶茳芏、互花米草(潮沟内)湿地土壤黏土含量越高,土壤生物硅含量也越高;相反,砂砾含量越高,土壤生物硅含量越低。
一般,土壤中无机氮含量相对较低(鳝鱼滩湿地土壤无机氮约占全氮0.40%[40]),对土壤生物硅的影响尚不明确,只有叶曦雯[33]在胶州湾研究发现海水中颗粒态生物硅含量与溶解无机氮(P=0.01)显著正相关,与磷酸盐之间不存在明显关系(P=0.14)。在鳝鱼滩湿地也发现:土壤生物硅含量与间隙水中活性硅酸盐含量以及间隙水中溶解无机氮含量之间均呈现一定的正相关关系(图8)。据统计,闽江河口硅藻占浮游植物总数量的91%,其密度与溶解无机氮和硅酸盐均呈正相关关系,与磷酸盐呈负相关关系[41]。由此可见,湿地水体及土壤水中营养盐(活性硅酸盐与无机氮)的高低对藻类、植物体生长和繁殖有明显的影响,死亡的硅藻碎屑是水体中颗粒态生物硅的重要来源,并最终成为土壤生物硅的一部分。而植物体死亡后,分解释放活性硅酸盐至湿地水体或土壤水中,植硅石通过成岩过程在土壤中沉积[2,42]。因此可推断,湿地水体中活性硅酸盐与无机氮含量较高时,可以促进硅藻和植物体的生物作用,间接地提高土壤生物硅的含量。

图8 土壤生物硅含量与土壤间隙水中营养盐的相关性Fig.8 Correspondence between concentration of nutrients in the interstitial water and BSi in the soil
在潮汐湿地,潮水的滞留和冲刷对湿地硅含量有重要影响[4]。闽江河口湿地属于半日潮潮汐湿地,潮汐给鳝鱼滩湿地带来丰富的水源。2012年10月—2013年9月间闽江口四种植被带湿地土壤间隙水活性硅酸盐年均含量依次为:互花米草(外)湿地>互花米草(内)湿地>短叶茳芏湿地>芦苇湿地,基本符合离海愈近土壤间隙水含硅量愈高的规律,说明离潮沟愈近、潮水滞留愈久,湿地土壤含水量愈高,间隙水活性硅酸盐含量也愈高。而土壤生物硅年均含量依次为:互花米草(外)湿地>短叶茳芏湿地>芦苇湿地>互花米草(内)湿地,与距潮沟距离无明显相关性,这与刘森[43]在黄河口湿地得出的土壤生物硅含量与距海岸线的距离均呈负相关关系(P<0.01)的结论相悖,这可能与两湿地土壤理化性质、生长的植物类型不同而导致土壤储存硅的能力有关。本研究采样点恰好位于三种植被带中心位置,由此也可进一步推断湿地植被对土壤生物硅影响的重要性[44]。
不同种类植被对硅素的生长吸收与分解释放的能力不同,因此,湿地植物的类型和丰度能够影响湿地土壤生物硅含量的高低以及硅的分布[4]。研究发现,在芦苇为优势种的淡水湿地中超过40%活性硅酸盐是芦苇分解造成的[10]。在我国长江河口湿地芦苇含硅量(25.78—40.92 mg/g)高于互花米草(6.71—7.97 mg/g),导致长江口芦苇湿地土壤含硅量高于互花米草湿地[16],本文同样也发现闽江口鳝鱼滩湿地芦苇带湿地土壤生物硅含量(5.12—17.46 mg/g)高于潮沟内互花米草带湿地土壤生物硅含量(6.57—8.56 mg/g)。
另外,土壤生物硅在不同温度下具有不同的溶解度,温度越高溶解度越大[45],而且温度升高可以加速湿地植被枯枝烂叶分解、土壤微生物活动而促进更多的硅进入土壤和间隙水中[46-47]。在潮汐影响下,闽江口枯落物分解过程中从5月份开始热值明显升高[48],说明此时植物枯落物分解加速,引起植物枯落物向水体释放硅的速度加快,并导致夏季(平均30.6℃)湿地土壤间隙水活性硅酸盐含量达到最高。秋季,虽然枯落物继续分解,但温度下降(平均21.0℃)导致间隙水活性硅酸盐浓度降低,冬季最低,春季随着温度回升(平均18.5℃),植物生长也开始消耗硅,这样就导致冬春季节湿地土壤间隙水活性硅酸盐含量低于夏秋季节。同样,在比利时 Schelde河口湿地[7]和美国北卡罗来纳州半咸水潮汐湿地间隙水[11]也发现同样的季节变化特征。
综上,闽江口鳝鱼滩湿地水体中营养盐(主要指活性硅酸盐与无机氮)含量、湿地植被、潮汐作用、温度等因素均可以影响湿地土壤生物硅含量的高低,但其具体影响过程及机制尚不明确,还有待进一步研究。
3.2 互花米草入侵对湿地硅分布的影响
河口潮滩湿地在控制海域营养状况和营养盐循环过程中具有重要的作用,其具有净化陆源污染和削减其入海通量的缓冲功能[49],而植物则是潮滩湿地对物质的保持与去除的净化功能的体现者。潮滩植物除了影响营养盐分布外,还会改变沉积环境,因此会影响间隙水中各营养盐生物有效性。自2004年以来,互花米草作为入侵种,改变了闽江河口鳝鱼滩湿地从潮上带到潮下带依次分布的土著种芦苇带、短叶茳芏带以及藨草带的分布格局,在一定程度上改变了湿地系统原有的生态结构与功能。
根据1a观测结果,闽江口鳝鱼滩湿地由岸及海方向,芦苇、短叶茳芏、潮沟内互花米草带土壤间隙水中活性硅酸盐年平均含量分别为323、344、359 μmol/L,土壤生物硅年平均含量分别为9.98、10.40、7.50 mg/g。纵然,闽江口各植被带湿地土壤硅分布与距离潮沟远近有一定相关性,但潮沟内互花米草带土壤生物硅含量远低于芦苇和短叶茳芏,这除了与潮汐冲刷作用有关,还可能与植物根系有关。夏季,互花米草0—15 cm地下生物量最低,其次是芦苇,短叶茳芏最高[50],根系不发达也可能造成潮沟内互花米草湿地土壤不易保存生物硅。同时也说明互花米草入侵在一定程度上改变了闽江口潮滩湿地土著种湿地土壤硅分布的格局。
湿地植物是硅聚集体,在植物的生长过程中,不断吸收水体中的硅酸盐并以植硅石的形式保存在体内,不同植物吸收硅的能力不同。长江口湿地芦苇、互花米草体内生物硅含量分别为25.78—42.74mg/g、6.71—8.92mg/g,且死亡组织高于活体[16],法国Brest海湾湿地互花米草生物硅含量为2.23—7.82mg/g[12],可见互花米草富集硅的能力并不是很高。邓自发等[51]的研究结果表明:互花米草的净生长速率明显高于芦苇等土著种,因此在生长速度、生产力等方面占有极大的优势,增加了互花米草入侵及扩张的几率。因此,我们推测:互花米草的快速生长吸收了土壤中硅造成植被带中生物硅含量较低,而同时较低的土壤生物硅含量不能够满足互花米草生长需要,只能进一步向周边土著种入侵吸收更多的硅,对土著种生存环境造成威胁,独立斑块规模逐渐扩大,同时更大范围地改变了潮滩湿地的理化性质,包括pH、碱度及溶解性还原溶质等[4],进而影响湿地硅的生物化学地球循环过程。
3.3 闽江口土壤生物硅与其他河口、海域对比
生物硅具有来源和循环过程相对简单、保存也相对较为稳定的特点,相对于有机碳,表征水体生产力水平也比较有优势[52]。通过对近30年来叶绿素和初级生产力资料的整理和分析发现:中国渤海、黄海、东海、南海的初级生产力分别为289、404、372、468 mg C m-2d-1,具有从北到南逐渐上升的趋势[53]。从表1可以看出,中国近海沉积物中生物硅分布也呈现出一定的纬度分布规律:渤海和胶州湾较低(平均值分别为4.3 mg/g[54]和5.1 mg/g[33]),其次为长江口海域平均12.0 mg/g[55],而南海南部生物硅含量则较高(平均值49.6 mg/g[56]),这与中国近海水体生产力水平保持一致[57]。从河口湿地来看,闽江口(本文数据)湿地生物硅含量最高,其次为黄河口[43],长江口[34]最低,这除了与周边海域生产力水平高低有关外,可能还与湿地生长植物的类型、覆盖率和生物量有关,另外还与上游河流输入有一定关系。与国外河口潮汐湿地相比,闽江口潮滩湿地土壤生物硅平均含量为10.6 mg/g,与比利时河口湿地[6]、德国易北河流域潮汐湿地[15]和美国北卡罗来纳州半咸水潮汐湿地[11]相当。

表1 国内外海湾、海口土壤/沉积物生物硅含量分布(括号内为平均值)
4 结论
(1)闽江口潮滩4种植被带土壤间隙水含硅量大小分别为:互花米草(外)湿地>互花米草(内)湿地>短叶茳芏湿地>芦苇湿地。从土壤剖面来看,间隙水含硅量的变化均随深度增加呈折线变化趋势,季节差异较大。
(2)湿地土壤生物硅的平均含量大小分别为:互花米草(外)湿地>短叶茳芏湿地>芦苇湿地>互花米草(内)湿地,湿地土壤及间隙水含硅量均呈现“夏秋高于冬春”的季节变化特征。
致谢:黄佳芳、章文龙、杨平、汪旭明、任洪昌、纪钦阳对野外采样提供帮助,特此致谢。
[1] Sommer M, Kaczorek D, Kuzyakov Y, Breuer J. Silicon pools and fluxes in soils and landscapes—a review. Journal of Plant Nutrition and Soil Science, 2006, 169(3): 310- 329.
[2] Alexandre A, Meunier J D, Colin F, Koud J M. Plant impact on the biogeochemical cycle of silicon and related weathering processes. Geochimica et Cosmochimica Acta, 1997, 61(3): 677- 682.
[3] Conley D J. Terrestrial ecosystems and the global biogeochemical silica cycle. Global Biogeochemical Cycles, 2002, 16(4): 68- 1, 68- 68.
[4] Struyf E, Conley D J. Silica: an essential nutrient in wetland biogeochemistry. Frontiers in Ecology and the Environment, 2009, 7(2): 88- 94.
[5] Tréguer P, Nelson D M, Van Bennekorn A J, Demaster D J, Leynaert A, Quéguiner B. The silica balance in the world ocean: A reestimate. Science, 1995, 268(5209): 375-379.
[6] Struyf E, Dausse A, Van Damme S, Bal K, Gribsholt B, Boschker H T S, Middelburg J J, Meire P. Tidal marshes and biogenic silica recycling at the land-sea interface. Limnology and Oceanography, 2006, 51(2): 838- 846.
[7] Struyf E, Van Damme S, Gribsholt B, Middelburg J J, Meire P. Biogenic silica in tidal freshwater marsh sediments and vegetation (Schelde estuary, Belgium).Marine Ecology Progress Series, 2005, 303: 51- 60.
[8] Struyf E, Van Damme S, Gribsholt B, Meire P. Freshwater marshes as dissolved silica recyclers in an estuarine environment (Scheldt estuary, Belgium). Hydrobiologia, 2005, 540(1/3): 69- 77.
[9] Struyf E, Temmerman S, Meire P. Dynamics of biogenic Si in freshwater tidal marshes: Si regeneration and retention in marsh sediments (Scheldt estuary). Biogeochemistry, 2007, 82(1): 41- 53.
[10] Struyf E, Van Damme S, Gribsholt B, Bal K, Beauchard O, Middelburg J J, Meire P.Phragmitesaustralisand silica cycling in tidal wetlands. Aquatic Botany, 2007, 87(2): 134- 140.
[11] Norris A R, Hackney C T. Silica content of a mesohaline tidal marsh in North Carolina. Estuarine, Coastal and Shelf Science, 1999, 49(4): 597- 605.
[12] Querné J, Ragueneau O, Poupart N. In situ biogenic silica variations in the invasive salt marsh plant, Spartina alterniflora: A possible link with environmental stress. Plant and Soil, 2012, 352(1/2): 157- 171.
[13] Borrelli N, Osterrieth M, Romanelli A, Alvarez M F, Cionchi J L, Massone H. Biogenic silica in wetlands and their relationship with soil and groundwater biogeochemistry in the Southeastern of Buenos Aires Province, Argentina. Environmental Earth Sciences, 2012, 65(2): 469- 480.
[14] Lehtimäki M, Tallberg P, Siipola V. Seasonal Dynamics of Amorphous Silica in Vantaa River Estuary. Silicon, 2013, 5(1): 35- 51.
[15] Weiss A, Amann T, Hartmann J. Silica Dynamics of Tidal Marshes in the Inner Elbe Estuary, Germany. Silicon, 2013, 5(1): 75- 89.
[16] Hou L J, Liu M, Yang Y, Ou D N, Lin X, Chen H. Biogenic silica in intertidal marsh plants and associated sediments of the Yangtze Estuary. Journal of Environmental Sciences, 2010, 22(3): 374- 380.
[17] 侯立军, 刘敏, 闫惠敏, 许世远, 欧冬妮, 林啸. 长江口潮滩沉积物生物硅的分布及其影响因素. 中国环境科学, 2007, 27(5): 665- 669.
[18] 高磊, 李道季, 王延明, 余立华, 孔定江, 李玫, 李云, 方涛. 长江口最大浑浊带潮滩沉积物间隙水营养盐剖面研究. 环境科学, 2006, 27(9): 1744- 1752.
[19] 陈晖, 刘敏, 侯立军, 许世远, 闫惠敏, 林啸. 崇明东滩海三棱藨草生物硅分布及季节变化. 中国环境科学, 2009, 29(1): 73- 77.
[20] 王维奇, 曾从盛, 钟春棋, 仝川. 人类干扰对闽江河口湿地土壤碳、氮、磷生态化学计量学特征的影响. 环境科学, 2010, 31(10): 2411- 2416.
[21] 王维奇, 王纯, 曾从盛, 仝川. 闽江河口不同河段芦苇湿地土壤碳氮磷生态化学计量学特征. 生态学报, 2012, 32(13): 4087- 4093.
[22] 曾从盛, 钟春棋, 仝川, 徐欢欢. 闽江口湿地不同土地利用方式下表层土壤N, P, K含量研究. 水土保持学报, 2009, 23(3): 87- 91.
[23] 章文龙, 曾从盛, 张林海, 王维奇, 林燕, 艾金泉. 闽江河口湿地植物氮磷吸收效率的季节变化. 应用生态学报, 2009, 20(6): 1317- 1322.
[24] 王纯, 王维奇, 曾从盛, 仝川, 贾瑞霞, 黄佳芳. 闽江河口区盐-淡水梯度下湿地土壤氮形态及储量特征. 水土保持学报, 2011, 25(5): 147- 153.
[25] 贾瑞霞, 仝川, 王维奇, 曾从盛. 闽江河口盐沼湿地沉积物有机碳含量及储量特征. 湿地科学, 2008, 6(4): 492- 499.
[26] Maestrini S Y, Berland B R, Bréret M, Béchemin C, Poletti R, Rinaldi A. Nutrients limiting the algal growth potential (AGP) in the Po River Plume and an adjacent area, Northwest Adriatic Sea: Enrichment bioassays with the test algaeNitzschiaclosteriumandThalassiosiraPseudonana. Estuaries, 1997, 20(2): 416- 429.
[27] Martin J H, Fitzwater S E. Iron deficiency limits phytoplankton growth in the north-east Pacific subarctic. Nature, 1988, 331(6154): 341- 343.
[28] Humborg C, Conley D J, Rahm L, Wulff F, Cociasu A, Ittekkot V. Silicon retention in river basins: far-reaching effects on biogeochemistry and aquatic food webs in coastal marine environments. Ambio: A Journal of the Human Environment, 2000, 29(1): 45- 50.
[29] Papush L, Danielsson A. Silicon in the marine environment: dissolved silica trends in the Baltic Sea. Estuarine, Coastal and Shelf Science, 2006, 67(1/2): 53- 66.
[30] Danielsson A. Alterations in nutrient limitations-scenarios of a changing Baltic Sea. Journal of Marine Systems, 2008, 73(3/4): 263- 283.
[31] Spilling K, Tamminen T, Andersen T, Kremp A. Nutrient kinetics modeled from time series of substrate depletion and growth: dissolved silicate uptake of Baltic Sea spring diatoms. Marine Biology, 2010, 157(2): 427- 436.
[32] Bernárdez P, Francés G, Prego R. Benthic-pelagic coupling and postdepositional processes as revealed by the distribution of opal in sediments: The case of the Ría de Vigo (NW Iberian Peninsula). Estuarine Coastal and Shelf Science, 2006, 68(1/2): 271- 281.
[33] 叶曦雯. 胶州湾中生物硅的研究[D]. 青岛: 中国海洋大学, 2002: 48- 55.
[34] 闫慧敏, 刘敏, 侯立军, 许世远, 林啸. 长江口沙洲表层沉积物中生物硅分布特征. 环境科学, 2008, 29(1): 164- 169.
[35] Mortlock R A, Froelich P N. A simple method for the rapid determination of biogenic opal in pelagic marine sediments. Deep Sea Research Part A. Oceanographic Research Papers, 1989, 36(9): 1415- 1426.
[36] Hurd, D C. Interactions of biogenic opal, sediment and seawater in the Central Equatorial Pacific. Geochimica et Cosmochimica Acta, 1973, 37(10): 2257- 2282.
[37] Van Cappellen P, Qiu L. Biogenic silica dissolution in sediments of the Southern Ocean I Solubility. Deep Sea Research Part II: Topical Studies in Oceanography, 1997, 44(5): 1109- 1128.
[38] 张子川. 闽江口不同盐度短叶茳芏潮汐沼泽土壤理化特征及模拟盐水入侵对甲烷产生速率的影响[D]. 福州: 福建师范大学, 2013: 19- 19.
[39] Wang W Q, Wang C, Sardans J, Tong C, Jia R X, Zeng C S, Peuelas J. Flood regime affects soil stoichiometry and the distribution of the invasive plants in subtropical estuarine wetlands in China. Catena, 2015, 128: 144- 154.
[40] 林贤彪, 林啸, 颜燕燕, 何诗, 蒋利玲, 曾从盛. 闽江口盐淡水湿地沉积物-水界面无机氮交换通量特征. 水土保持学报, 2013, 27(5): 260- 266.
[41] 肖莹. 闽江口海域浮游植物群落结构特征. 福建水产, 2013, 35(4): 258- 263.
[42] 王惠, 马振民, 代力民. 森林生态系统硅素循环研究进展. 生态学报, 2007, 27(7): 3010- 3017.
[43] 刘森, 冉祥滨, 车宏, 马永星, 臧家业. 黄河口湿地土壤中生物硅的分布与植硅体的形态特征. 土壤, 2014, 46(5): 886- 893.
[44] Clarke J. The occurrence and significance of biogenic opal in the regolith. Earth-Science Reviews, 2003, 60(3/4): 175- 194.
[45] Dixit S, Van Cappellen P, Van Bennekom A J. Processes controlling solubility of biogenic silica and pore water build-up of silicic acid in marine sediments. Marine Chemistry, 2001, 73(3/4): 333- 352.
[46] Vitousek P M, Turner D R, Parton W J, Sanford R L. Litter decomposition on the Mauna Loa environmental matrix, Hawaii: patterns, mechanisms, and models. Ecology, 1994, 75(2): 418- 429.
[47] 孙志高, 刘景双. 湿地枯落物分解及其对全球变化的响应. 生态学报, 2007, 27(4): 1606- 1618.
[48] 翟水晶, 刘白贵, 贾宜, 仝川, 薛丽丽. 闽江河口潮汐沼泽枯落物分解过程的能量动态特征. 福建师范大学学报: 自然科学版, 2013, 29(4): 73- 79.
[49] 全为民, 沈盎绿, 钱蓓蕾, 平先隐, 韩金娣, 李春鞠, 施利燕, 陈亚瞿. 长江口盐沼植物对营养盐和重金属的吸收、分布与滞留分析. 海洋环境科学, 2007, 26(1): 14- 18.
[50] 张林海. 闽江河口湿地优势植物净初级生产力及N、P养分动态[D]. 福州: 福建师范大学, 2008: 23- 29.
[51] 邓自发, 安树青, 智颖飙, 周长芳, 陈琳, 赵聪蛟, 方淑波, 李红丽. 外来种互花米草入侵模式与爆发机制. 生态学报, 2006, 26(8): 2678- 2686.
[52] Lyle M, Murray D W, Finney B P, Dymond J, Robbins J M, Brooksforce K. The record of Late Pleistocene biogenic sedimentation in the eastern tropical Pacific Ocean. Paleoceanography, 1988, 3(1): 39- 59.
[53] 郝锵. 中国近海叶绿素和初级生产力的时空分布特征和环境调控机制研究[D]. 青岛: 中国海洋大学, 2010: 107- 108.
[54] Liu S M, Ye X W, Zhang J, Zhao Y F. Problems with biogenic silica measurement in marginal seas. Marine Geology, 2002, 192(4): 383- 392.
[55] 徐杰. 浙江沿海富营养化与赤潮历史的沉积记录研究[D]. 杭州: 浙江大学, 2004: 29- 33.
[56] 张兰兰, 陈木宏, 向荣, 陆钧, 张丽丽. 南海南部表层沉积物中生物硅的分布及其环境意义. 热带海洋学报, 2007, 26(3): 24- 29.
[57] 叶曦雯, 刘素美, 赵颖翡, 张经. 东、黄海沉积物中生物硅的分布及其环境意义. 中国环境科学, 2004, 24(3): 265- 269.
Changes in the distribution of silica in the porewaters and sediments of the intertidal zone with different plant communities in the Min River Estuary
ZHAI Shuijing1,2,*, XUE Lili3
1InstituteofGeography,FujianNormalUniversity,Fuzhou350007,China2CollegeofGeographicalSciences,FujianNormalUniversity;KeyLaboratoryofHumidSubtropicalEco-geographicalProcessMinistryofEducation,Fuzhou350007,China3CollegeofEnvironmental&ResourceSciencesofZhejiangUniversity,Hangzhou310058,China
Silicon (Si) is an essential nutrient for many plants as well as an important element that controls the functions of terrestrial and aquatic ecosystems. Wetland ecosystems are considered to be very important for Si transport and transformation in nutrient biogeochemical cycles. However, information on Si cycling in wetland ecosystems is scarce. The Shanyutan wetland is the largest tidal wetland in the estuary of the Min River, southeast China. In this study, the Si distribution pattern and its influencing factors were determined by seasonally measuring the levels of dissolved silicates (DSis) in the porewater and biogenic silica (BSi) in the sediments ofPhragmitesaustraliswetland (PAW),Cyperusmalaccensiswetland (CMW), andSpartinaalterniflorawetland (SAW) from October 2012 to September 2013. For better comparison, three sampling sites were added in SAW since January 2013; these sites were isolated by a 30m wide tidal creek. The sampling sites near the land were marked asS.alterniflorawetland (inside; SAWI), whereas those near the sea were marked asS.alterniflorawetland (outside; SAWO). The results indicated that the average contents of BSi were 14.33 mg/g in SAWO, 10.40 mg/g in CMW, 9.98 mg/g in PAW, and 7.50 mg/g in SAWI. The average concentrations of DSis in the sediment porewater were 407 μmol/L in SAWO, 359 μmol/L in SAWI, 344 μmol/L in CMW, and 323 μmol/L in PAW. Generally, the contents of BSi in the sediments and DSis in the porewater were higher in summer and autumn, whereas they were lower in spring and winter. Statistical analysis revealed significantly positive correlations between DSi concentration in the porewater and BSi content in the sediments or the distance from the shoreside to the tidal creek (P<0.05). BSi content in the sediments was slightly positively correlated with temperature. Taken together, our findings suggest that the distribution of Si in the wetlands of the Min River estuary was correlated with vegetation, temperature, and tidal action. Unlike that of native species, the invasion ofS.alterniflora, to some extent, altered the distribution patterns of Si in the wetlands.
biogenic silica; dissolved silica; porewater; tidal wetland; Min River estuary
国家自然科学基金项目(41401114);福建省教育厅项目(JA14082)
2015- 01- 14;
日期:2016- 03- 03
10.5846/stxb201501140109
*通讯作者Corresponding author.E-mail: zhaisj@fjnu.edu.cn
翟水晶, 薛丽丽.闽江口潮滩湿地不同植被带土壤及间隙水中硅的分布特征.生态学报,2016,36(21):6766- 6776.
Zhai S J, Xue L L.Changes in the distribution of silica in the porewaters and sediments of the intertidal zone with different plant communities in the Min River Estuary.Acta Ecologica Sinica,2016,36(21):6766- 6776.

