外源抗坏血酸和尿素对田间臭氧胁迫下阿白葡萄叶片光合作用的影响
邢浩,耿庆伟,郝桂梅,翟衡,杜远鹏*
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
外源抗坏血酸和尿素对田间臭氧胁迫下阿白葡萄叶片光合作用的影响
邢浩,耿庆伟,郝桂梅,翟衡,杜远鹏*
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
以对臭氧敏感的葡萄品种阿白(White,暂定名)为试材,探讨了喷施外源抗坏血酸和尿素对田间臭氧胁迫下葡萄叶片光合作用的缓解作用。实时监测表明,田间臭氧日最高浓度在6月份,极值出现在7月上旬,达到56 nL/L。阿白葡萄叶片在8月份即出现了明显的臭氧伤害症状。喷施外源抗坏血酸显著提高了阿白葡萄叶片的叶绿素含量、Pn和Fv/Fm,比对照分别提高了30.02%、59.84%、3.94%,同时显著提高了阿白葡萄叶片的PIabs、ΦPSⅡ和qP,比对照分别提高了56.15%、120.50%、93.29%;喷施尿素后阿白葡萄的叶绿素含量以及Pn分别比对照提高了23.67%和69.74%,同时ΦPSⅡ以及qP分别比对照提高了55.76 %和53.40 %。快速叶绿素荧光动力学分析表明,喷施两种外源缓解剂明显改变了OJIP曲线形状,提高了P点荧光强度。说明喷施外源抗坏血酸和尿素缓解了田间臭氧胁迫对葡萄叶片光合电子传递链的抑制,改善光能的分配和利用,从而缓解了臭氧胁迫对葡萄叶片的影响,以抗坏血酸效果较明显。
葡萄;抗坏血酸;尿素;臭氧;光合
臭氧(O3)是具有特殊刺鼻臭味的强氧化剂。平流层的臭氧层具有吸收紫外线的作用,而对流层的臭氧是促进温室效应的温室气体,而且高浓度的臭氧会对动植物的生长发育造成不良影响。近地层大气自然本底浓度较低,大约为20 nL/L[1]。近几十年来,由于化石燃料和含N化肥的大量使用,以及汽车尾气的排放,致使大气中臭氧的浓度剧增。随着工业化进程的加快,我国近地层臭氧浓度明显增加,大气臭氧污染也日益严重,臭氧污染已经超过PM2.5,成为首要污染物,对作物、森林和人类健康造成极大的伤害。据报道,臭氧污染可导致农作物减产5%~15%,番茄、西瓜和大豆等作物减产超过20%[2]。欧洲地区每年因臭氧污染造成的农作物经济损失高达40亿欧元[3],美国每年因臭氧污染损失达20亿~40亿美元,而我国长江三角洲地区因臭氧浓度过高造成的农业经济损失为14.75亿元人民币[4]。
通过叶片喷施外源物质是一种快速有效的缓解活性氧胁迫的方式[5-6]。抗坏血酸作为一种抗氧化剂,可在体内合成[7-9],直接参与体内活性氧的清除,而人工合成的抗坏血酸,喷施在植物体上则能抑制脂质过氧化,使受胁迫的植物组织丙二醛含量下降[10-11],从而提高植物的抗氧化能力。谢居清等[12]研究表明,外源抗坏血酸可以缓解臭氧胁迫对水稻的影响。
另外,段旺军等[13]研究表明,氮素营养不仅影响植物的正常生长发育,还会影响植物的感病性或抗病性。胁迫伴随着叶片衰老,而叶片衰老的一个重要标志是叶绿体降解,叶绿体既是叶片光合器官,又是成熟叶片中重要的贮藏细胞器,叶片中约70%~80%的氮素存在于叶绿体中[14]。叶片氮素含量与光合速率呈显著正相关[15]。在小麦上的研究表明,提高氮素供应水平有利于改善叶片光合色素性状,增加PSⅡ的潜在活性及其最大光化学效率,减少非光化学淬灭,提高光合效率[16-19],提高植株抗逆性。
本实验室前期田间调查发现,在田间大气臭氧浓度下,臭氧对一些葡萄品种的叶片造成了明显的表观伤害症状,其中,河岸葡萄系列的砧木品种如5BB、酿酒葡萄品种Frontenac,以及种间杂种摩尔多瓦等的叶片上,随着夏季的到来经常出现臭氧伤害的褐斑[20]。本文以从德国引进的抗寒、抗霜霉病但对臭氧敏感的鲜食酿酒兼用品种‘阿白’(暂定名)为材料,研究抗坏血酸和尿素对臭氧胁迫下阿白葡萄光合参数的影响,为缓解臭氧对葡萄造成的伤害提供理论依据。
1 材料与方法
1.1 试验材料与试验设计
试验于山东农业大学葡萄实验园进行,以对臭氧敏感的5年生阿白葡萄为试材,选择长势一致的树体进行试验,臭氧浓度用监测仪(DR70C-O3型,深圳沃赛特)实时监控葡萄园大田臭氧浓度。前期实验发现,实验园中田间臭氧浓度能对阿白葡萄产生表观伤害,叶片叶脉中出现黄褐色斑点[21]。
试验设两个处理,喷施0.1 mol/L抗坏血酸(VC)和喷施0.1%尿素溶液(尿素),以清水做对照,每处理10株葡萄。实验于2015年8月21日开始喷施。每隔7 d喷施一次,连喷5次,每次喷施时间为下午5点左右,每次喷至葡萄叶片滴水。于2015年9月20日上午测定各处理葡萄中部同一节位叶片的光合和荧光数据和叶绿素含量SPAD值。
1.2 指标测定
光合指标测定:所测叶片为阿白葡萄中部的叶片,每组随机抽取5片叶,用CIRAS-2便携式光合系统测定仪(PPSystems,英国)测定叶片净光合速率(Pn)、胞间CO2浓度(Ci)、蒸腾速率(E)、气孔导度(Gs)等参数。测定时控制光强为1000 μmol/(m2·s),CO2浓度为(360±20)μL/L,温度为25 ℃左右,试验重复5~7次。
用连续激发式荧光仪(Handy PEA,Hansatech,英国)测定快速叶绿素荧光曲线及参数,可得到如下参数:PSⅡ最大光化学量子产量(Fv/Fm);反应中心捕获的激子将电子传递到QA以后的效率(ψo);吸收的光量子用于电子传递的效率(φEo)。
采用英国Hansatech公司的FMS-2型便携脉冲调制式荧光仪进行叶片荧光淬灭参数的测定,可得到如下参数:光化学淬灭系数(qP),实际光化学效率(ФPSⅡ),非光化学淬灭(NPQ)。
叶绿素测定:利用SPAD-502叶绿素仪测定各处理中部葡萄叶片SPAD值。
2 结果与分析
2.1 田间臭氧浓度日最高值变化
由图1可以看出,4~10月日最高臭氧浓度变化于16~56 nL/L,以6月最高,臭氧平均浓度为37.6 nL/L;其次是5月,臭氧平均浓度为31.9 nL/L;7月9日臭氧日最大浓度达到56 nL/L,8月葡萄园大气臭氧浓度有所回落。田间调查还发现,本年度臭氧浓度水平与2014年相似,阿白葡萄均在8月份发生了表观臭氧伤害症状。

图1 田间臭氧浓度日最高值变化
2.2 抗坏血酸及尿素对田间臭氧胁迫下阿白葡萄叶片叶绿素含量的影响
由图2可以看出,喷施外源抗坏血酸和尿素均显著提高了臭氧胁迫下阿白葡萄叶片的SPAD值。分别比对照提高了30.02%和23.67%。但两处理之间没有显著性差异。
2.3 抗坏血酸及尿素对田间臭氧胁迫下阿白葡萄叶片光合作用的影响
净光合速率是光合系统功能的直接体现,也是植株光合系统正常与否的重要指标[22]。从表1可以看出,喷施外源抗坏血酸和尿素均显著提高了叶片的净光合速率,分别比对照提高了59.84%和69.74%,但两处理之间没有显著性差异。喷施外源抗坏血酸和尿素的葡萄叶片气孔导度均比对照显著升高,分别提高了34.04%和77.37%。各处理后的叶片胞间CO2浓度没有显著性差异。
2.4 快速叶绿素荧光诱导曲线
图3显示的是不同处理下阿白葡萄叶片快速叶绿素荧光诱导曲线(OJIP)的变化。与对照叶片相比,喷施两种外源缓解剂明显改变了OJIP曲线形状,均提高了P点荧光强度,说明臭氧胁迫后降低了叶片单位面积吸收的光能,VC处理的提升效果好于尿素处理。

图2 不同处理‘阿白’葡萄叶片SPAD值的比较

表1 不同处理对阿白葡萄叶片净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci)的影响
2.5 抗坏血酸及尿素对田间臭氧胁迫下阿白葡萄叶片绿素荧光参数的影响
Fv/Fm是PSⅡ最大光化学量子产量,其大小反映了PSⅡ反应中心内初光能的转换效率(最大转换效率)。从图4可以看出,喷施外源抗坏血酸显著提高了葡萄叶片Fv/Fm、反应中心捕获的激子将电子传递到QA以后的效率Ψo和天线吸收的光能用于电子传递的效率φEo,分别比对照提高了3.94%、28.65%、42.23%。喷施尿素使各指标分别比对照提高了1.88%、23.11%和31.52%,均与对照未达到显著性差异水平。这表明了外源抗坏血酸可以有效地提高阿白葡萄的最大光化学效率。光合性能指数PIabs是以吸收光能为基础的光合性能指数,比Fv/Fm能更灵敏的反应光合机构的变化。喷施外源抗坏血酸显著提高了葡萄叶片PIabs,比对照提高了56.15%;喷施尿素比对照提高了15.27%,但没有达到显著差异水平。
2.6 抗坏血酸及尿素对田间臭氧胁迫下阿白葡萄叶片叶绿素荧光淬灭的影响
从表2可以看出,叶片喷施外源抗坏血酸和尿素均显著提高葡萄叶片的ΦPSⅡ,分别比对照提高了120.50%和55.76%;也显著提高了葡萄叶片的qP,分别比对照提高了93.29%和53.40%。说明喷施外源抗坏血酸和尿素均可以有效缓解臭氧胁迫下叶片实际光化学效率和非光学化学淬灭系数。但是,喷施外源抗坏血酸和尿素均降低了葡萄叶片的NPQ,分别比对照降低了28.37%和30.26%。

图3 快速叶绿素荧光诱导曲线
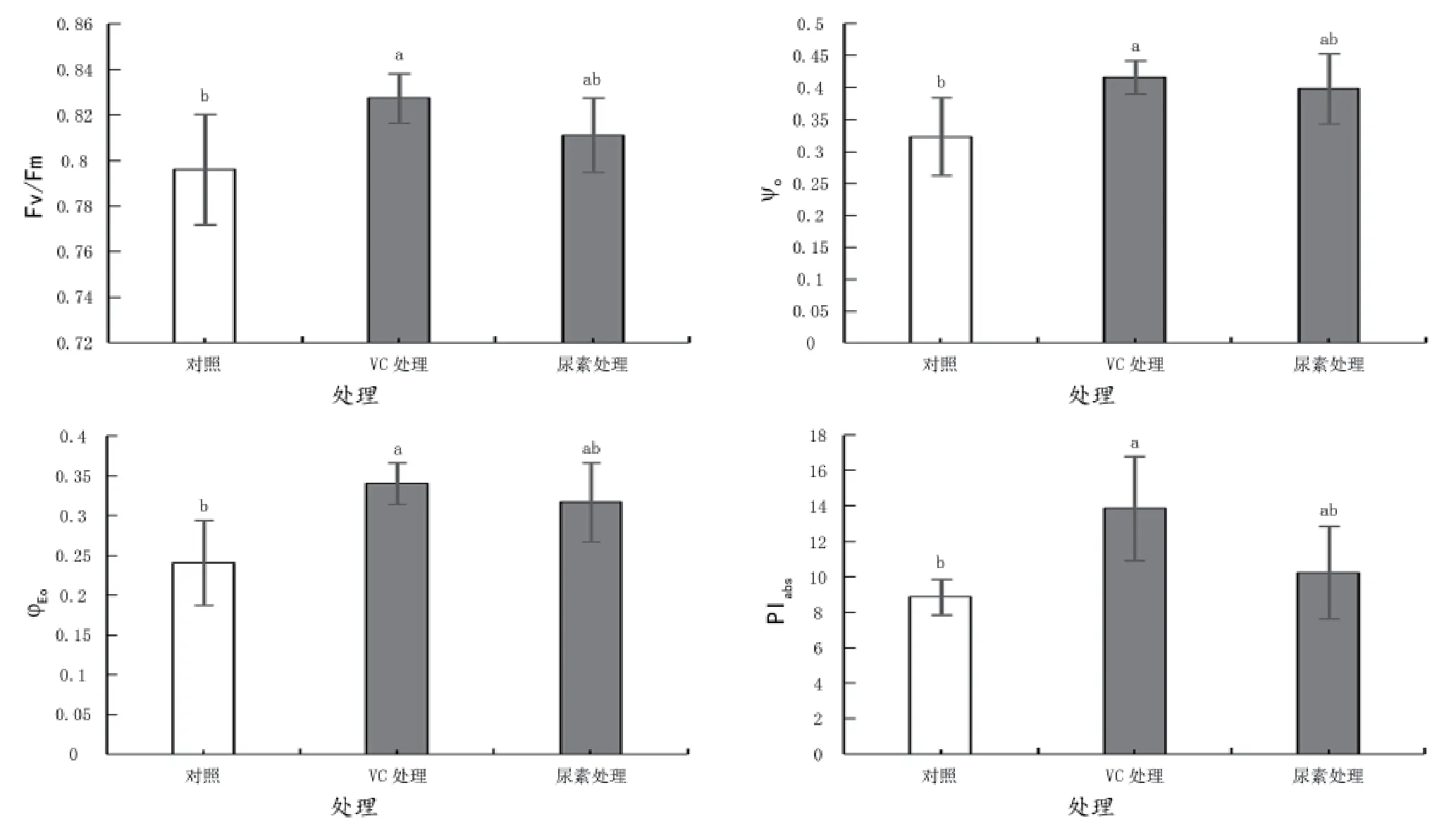
图4 不同处理对阿白葡萄叶片光系统Ⅱ最大光化学效率、ψo、φEo和PIabs的影响
3 讨论
随着大气污染的加剧,臭氧对葡萄叶片的伤害也日渐明显,在一些葡萄品种的叶片上越来越频繁的出现大面积的褐化斑点,尤其是中下部叶片呈现整体褐化,直接影响叶片的光合作用[23],进而影响葡萄的产量与果实品质。臭氧作用于植物有2个途径:一是直接作用,即臭氧与植物组织直接作用;二是通过气孔进入植物体内后诱导产生活性氧物质(AOS),包括过氧化氢(H2O2)、超氧自由基(O2-·)、羟基(·OH)等,这些活性氧物质破坏植物的膜系统,加剧了膜脂过氧化程度,影响植物的光合作用等正常生理功能[24]。本实验室前期研究发现,随着臭氧胁迫的加重,葡萄叶片细胞内O2-·和H2O2含量逐渐升高,MDA含量不断增大[25]。
抗坏血酸在抗氧化和清除自由基、光合作用和光保护、细胞生长和分裂等方面起到重要作用[26],具备直接清除单线态氧和超氧化物的能力,还可以通过抗坏血酸过氧化氢酶的活性间接清除过氧化氢,抑制脂质过氧化,使受胁迫的植物组织丙二醛含量下降,从而提高植物的抗氧化能力,具有防止苹果在强光下发生氧化伤害的作用[27]。而臭氧伤害是典型的活性氧伤害,因此,外源抗坏血酸被植物叶片吸收后,直接参与了对臭氧和活性氧系统(AOS)的解毒[28],抑制了臭氧和AOS对叶绿素的破坏,从而使叶绿素得到保护,使葡萄叶片叶绿素总量增加,提高了叶片净光合速率。本实验发现在田间臭氧浓度下,阿白葡萄叶片出现明显的黄褐色伤斑,喷施外源抗坏血酸可以明显地提高臭氧胁迫下阿白葡萄PSⅡ反应中心的最大光化学效率Fv/Fm、吸收与利用光能的能力,同时ψo相比清水处理有显著性升高,表明抗坏血酸有助于电子从QA向下的传递,同时φEo数据升高,表明抗坏血酸有助于提高有活性反应中心的开放程度,防止过剩的激发能破坏反应中心的结构。喷施抗坏血酸比对照的非光化学淬灭有显著性降低,表明抗坏血酸减少阿白葡萄叶片的热耗散。喷施外源抗坏血酸和尿素的葡萄叶片斑点面积比清水的伤斑面积较小,说明外源抗坏血酸和尿素有助于防止臭氧伤斑的扩大。

表2 不同处理对阿白葡萄叶片实际光化学效率(ΦPSⅡ)、光化学淬灭系数(qP)和非光化学淬灭(NPQ)的影响
关于施用氮素对叶片光合性能的影响,在水稻、小麦、玉米等作物中前人已有许多研究。氮素提高了叶片的叶绿素和可溶性蛋白含量,并通过调节光合电子传递能力和光合羧化酶的活性而影响表观光合速率的高低[29]。本实验结果也发现喷施尿素可以提高臭氧胁迫下阿白葡萄叶绿素含量以及净光合速率,但是Fv/Fm、PIabs、ψo和φEo参数介于清水处理和VC处理之间,比清水处理有所提高,说明外源氮肥有助于缓解臭氧对PSⅡ反应中心的破坏,但是缓解作用不明显。由于核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)含量及其活化程度都是影响光合速率的限制因子[30],推断外源氮素可能通过增加叶片叶绿素含量和1,5-二磷酸核酮糖羧化酶的含量来抵御臭氧的胁迫,具体影响机制还有待进一步研究。
综上,外源抗坏血酸可以明显的提高臭氧胁迫下阿白葡萄叶绿素含量、净光合速率和荧光参数,喷施方便,可以用于缓解大田葡萄臭氧胁迫。
[1] BRIDGMAN H A. Global air pollution: Problems for the 1990s[M]. London:Belhaven Press, 1990: 33-44.
[2] SHAO M, TANG X, ZHANG Y, et al. City clusters in China: Air and surface water pollution[J]. Frontiers in Ecology and the Environment, 2006, 4(7): 353-361.
[3] CHO K, TIWARI S, AGRAWAL S B, et al. Tropospheric Ozone and Plants: Absorption, Responses, and Consequences, Whitacre D M[J]. Reviews of Environmental Contamination and Toxicology, 2011, 212: 61-111.
[4] FENG Z, JIN M, ZHANG F Z, et al. Effects of ground-level ozone (O3) pollution on the yields of rice and winter wheat in the Yangtze River Delta[J]. Journal of Environmental Sciences, 2003, 15(3): 360-362.
[5] 谭伟, 李庆亮, 罗音, 等. 外源CaCl2预处理对高温胁迫烟草叶片光合作用的影响[J]. 中国农业科学, 2009, 42(11): 3871-3879.
[6] 赵莹, 杨克军, 赵长江, 等. 外源糖调控玉米光合系统和活性氧代谢缓解盐胁迫[J]. 中国农业科学, 2014, 47(20): 3962-3972.
[7] LOEWUS F A. L-Ascorbic acid: Metabolism, Biosynthesis, Function[M]//PREISS J. The Biochemistry of Plants. New York: Academic Press, 1980: 77-99.
[8] ZHENG Y B, LYONS T, JOHN H, et al. Ascorbate in the leaf apoplast is a factor mediating ozone resistance in Plantago major[J]. Plant Physiology and Biochemistry, 2000, 38(5): 403-411.
[9] SMIRNOFF N. BOTANICAL BRIEFING: The function and metabolism of ascorbic acid in plants[J]. Annals of Botany, 1996, 78(6): 661-669.
[10] TANG X J, WANG K. Effects of kinetin and ascorbic acid on protection of cell membrane and promotion of SOD biosyn-thesis in rice seedlings after chilling injury[J]. Acta Botanica Sinica,1993, 35 (suppl.): 45-49.
[11] 郑启伟, 王效科, 谢居清, 等. 外源抗坏血酸对臭氧胁迫下水稻叶片膜保护系统的影响[J]. 生态学报, 2006, 26(4): 1131-1137.
[12] 谢居清, 李国学, 王效科, 等. 外源抗坏血酸对臭氧胁迫下水稻光合及生长参数的影响[J]. 中国生态农业学报, 2009, 17(6): 1176-1181.
[13] 段旺军, 杨铁钊, 戴亚, 等. 植物氮素营养与病害发生关系研究进展[J]. 西北植物学报, 2011, 31(10): 2139-2146.
[14] MAKINO A, OSMOND B. Effects of nitrogen nutrition on nitrogen partitioning between chloroplasts and mitochondria in pea and wheat[J]. Plant Physiology, 1991, 96(2): 355-362.
[15] SAGE R F, PEARCY R W. The nitrogen use efficiency of C3and C4plants Ⅱ. Leaf nitrogen effects on the gas exchange characteristics of Chenopodium album (L.) and Amaranthus retroflexus (L.)[J]. Plant Physiology, 1987, 84(3): 959-963.
[16] 张雷明, 上官周平, 毛明策, 等. 长期施氮对旱地小麦灌浆期叶绿素荧光参数的影响[J]. 应用生态学报, 2003, 14(5): 695-698.
[17] 戴廷波, 曹卫星, 荆奇. 氮形态对不同小麦基因型氮素吸收和光合作用的影响[J]. 应用生态学报, 2001, 12(6): 849-852.
[18] 戴廷波, 曹卫星, 孙传范, 等. 增铵营养对小麦光合作用及硝酸还原酶和谷氨酰胺合成酶的影响[J]. 应用生态学报, 2003, 14(9): 1529-1532.
[19] 范雪梅, 姜东, 戴廷波, 等. 花后干旱或渍水下氮素供应对小麦光合和籽粒淀粉积累的影响[J]. 应用生态学报, 2005,16(10): 1883-1888.
[20] 王金欢, 耿庆伟, 孙永江, 等. 臭氧胁迫对3个葡萄品种叶片原初光化学反应的影响[J]. 中外葡萄与葡萄酒, 2015(2): 16-20.
[21] 耿庆伟, 宋伟, 邢浩, 等. 葡萄园微域臭氧对5个葡萄品种光合特性的影响[J]. 中外葡萄与葡萄酒, 2015(5): 8-11.
[22] 周建, 杨立峰, 郝峰鸽, 等. 低温胁迫对广玉兰幼苗光合及叶绿素荧光特性的影响[J]. 西北植物学报, 2009, 29(1): 136-42.
[23] FUHRER J, BOOKER F. Ecological issues related to ozone: agricultural issues[J]. Environment International, 2003, 29(2/3): 141-154.
[24] 黄益宗, 隋立华. 臭氧污染胁迫下植物的抗氧化系统调节机制[J]. 生态毒理学报, 2013, 8(4): 456-464.
[25] 孙永江, 王金欢, 耿庆伟, 等. 不同浓度臭氧处理对‘赤霞珠‘葡萄叶片光系统Ⅱ功能的影响[J]. 植物生理学报, 2015(11): 1947-1954.
[26] 郭泽建, 李德葆. 活性氧与植物抗病性[J]. 植物学报(英文版), 2000, 42(9): 881-891.
[27] 李明军. 苹果和猕猴桃抗坏血酸形成与积累的生理和分子机理研究[D]. 西北农林科技大学, 2009.
[28] CHAMEDIES W L. The chemistry of ozone deposition to plant leaves: Role of ascorbic acid[J]. Environmental Science & Technology, 1989, 23(5): 595-600.
[29] 段巍巍, 赵红梅, 郭程瑾, 等. 夏玉米光合特性对氮素用量的反应[J]. 作物学报,2007, 33(6): 949-954.
[30] 魏锦城. 水稻叶片生育过程中Rubisco活性与光合、光呼吸的关系[J]. 植物生理学报, 1994(3): 285-292.
Effects of exogenous ascorbate acid and urea on photosynthesis of White grape leaves under ozone stress in field
XING Hao, GENG Qingwei, HAO Guimei, ZHAI Heng, DU Yuanpeng*
(College of Horticulture Science and Engineering, Shandong Agricultural University/ State Key Lab of Crop Biology, Tai'an 271018, Shandong, China)
In order to study the effects of exogenous ascorbate acid and urea on photosynthesis of grape under ozone stress in fi eld, ozone sensitive grape variety 'white' was sprayed with exogenous ascorbic acid and urea in fi eld under the condition of ozone concentration real-time monitoring. Real time monitoring showed that the highest concentration of ozone in the fi eld appeared in June, and the extreme value appeared in early July, reaching 56 nL/L. Conspicuous injury on grape leaves appeared in August.The results showed that exogenous ascorbic acid signifi cantly increased the 'white' grape leaves chlorophyll content, Pn and Fv/Fm, were increased 30.02%, 59.84%, 3.94% than that of the control, and PIabs, ΦPSⅡand qP were significantly increased by 56.15%, 120.50% and 93.29%; Spraying urea after 'white' grape chlorophyll content and Pn were compared with the control improves 23.67% and 69.74%. At the same time, ΦPSⅡand qP were increased by 55.76% and 53.40%. Fast Chlorophyll fl uorescence kinetics analysis showed that spraying two kinds of exogenous ease agent could obviously change the OJIP curve shape and improve the fluorescence strength of p-points. The results showed that exogenous ascorbic acid and urea spraying relieved the fi eld ozone stress on photosynthetic inhibition of the electron transport chain in grape leaves, improved the distribution of light energy and utilization, so as to relieve the effects of ozone stress on grape leaves.
grapevine; exogenous ascorbic acid; urea; ozone; photosynthetic
S663.1
A
10.13414/j.cnki.zwpp.2016.06.001
2016-05-20
国家葡萄产业技术体系(CARS-30),教育部“长江学者和创新团队发展计划”创新团队IRT15R42
邢浩,男,硕士研究生,从事葡萄抗逆栽培研究。
★通讯作者:杜远鹏,E-mail: duyuanpeng001@163.com

