活性炭对玉米朊中黄色素的吸附机理研究
韩及华 吴其飞 徐斌 薛丁萍
(江苏大学食品与生物工程学院,镇江 212013)
活性炭对玉米朊中黄色素的吸附机理研究
韩及华 吴其飞 徐斌 薛丁萍
(江苏大学食品与生物工程学院,镇江 212013)
为了揭示活性炭脱色玉米朊过程中活性炭对色素和蛋白的吸附机理,本研究首先对活性炭进行扫描电镜、比表面积及孔径分析,在此基础上研究活性炭对色素和蛋白的吸附动力学和热力学。结果表明,活性炭P的吸附能力、比表面和孔隙结构最佳,可作为研究对象;活性炭P对色素和蛋白的吸附均可以用Langmuir模型和Freundlich模型(R2>0.92)描述;吸附动力学研究表明,活性炭吸附色素和蛋白过程中,伪二级动力学模型(R2>0.99)占主导地位;吸附热力学研究表明,活性炭吸附色素和蛋白过程中,ΔG0<0,ΔHa0>0,S0Δ>0,ΔG0绝对值随温度升高而增大。活性炭对色素的吸附效果不仅受表面结构和比表面积影响,还与活性炭的微孔或中孔结构有关;活性炭以单层吸附与多层吸附共存的复杂吸附方式吸附黄色素,通过物理和化学复合吸附、膜扩散等共同作用脱除黄色素。
玉米朊 脱色 活性炭 动力学 热力学 吸附等温线
玉米朊中色素(β-胡萝卜素、叶黄素和玉米黄素等)的存在导致产品呈现黄色,这在一定程度上限制了玉米朊的应用[1]。由于色素分子被紧紧地包埋在玉米朊蛋白分子内部,因而其脱除难度明显高于一般物料中那些呈游离状态的色素分子[2]。针对这一难题,国内外学者对玉米朊脱色方法做了大量研究,其中报道最多的为活性炭脱色法[3-4]。由于活性炭的吸附没有目标性,因而采用活性炭脱色玉米朊过程中活性炭不仅吸附色素,同时还吸附玉米朊,造成蛋白的损失。因而,脱色过程涉及玉米朊、色素和活性炭三者间错综复杂的关系。目前,国内外对玉米朊的脱色技术研究大都只停留在表面层次阶段[5],而对于活性炭吸附色素和玉米朊的吸附机理研究鲜见报道。
脱色过程热力学和动力学是研究吸附机理的重要手段[6]。目前关于吸附热力学及动力学的研究,主要集中在吸附剂(如活性炭、凹凸棒土等)对染料、金属离子的吸附等领域[7-10],Sessa等[11]针对活性炭脱色玉米朊的热力学进行研究的学者,但仅研究了Freundlich吸附等温模型,没有涉及动力学方面内容。
本研究通过扫描电镜、比表面积及孔径分析对活性炭进行微观结构分析;在此基础上,进一步研究活性炭对β-胡萝卜素和玉米朊的吸附等温线、吸附动力学和热力学参数,多层次揭示活性炭对β-胡萝卜素和玉米朊的吸附机理。
1 材料与仪器
1.1 材料与试剂
黄色玉米朊:高邮市日星药用辅料有限公司;活性炭C(ACC):江西某活性炭有限公司;活性炭N(ACN):江苏某活性炭有限公司;活性炭P(ACP):广州某活性炭有限公司;β-胡萝卜素标品:梯希爱(上海)化成工业发展有限公司。
1.2 仪器与设备
JSM-7001F型热场发射扫描电镜:日本JEOL电子株式会社;NOVA 2000e比表面积孔径分析仪:美国Quantachrome 公司;UV-1801紫外/可见分光光度计:北京瑞利分析仪器公司;BR4i高速冷冻离心机:法国Jouan公司。
2 试验方法
2.1 标准曲线绘制
2.1.1 β-胡萝卜素标准曲线绘制
参考薛丁萍等[12]的方法。准确吸取100 μg/mL β-胡萝卜素标准液100、200、300、400、500、600 μL分别至10 mL棕色容量瓶中,90%乙醇定容至刻度。以90%乙醇为参比溶液,将该系列溶液于448 nm下测定吸光值,绘制标准曲线。
2.1.2 玉米朊标准曲线绘制
准确吸取浓度为1 mg/mL玉米朊标准液2、4、6、8、10 mL分别至10 mL容量瓶中,90%乙醇定容至刻度。以90%乙醇为参比溶液,将该系列溶液于280 nm[13]下测定吸光值,绘制标准曲线。
2.2 活性炭的结构表征
2.2.1 扫描电镜分析
使用导电双面胶将不同型号的活性炭固定在SEM铜样品台上,用洗耳球吹去未固定的样品。真空离子溅射喷金镀膜,JSM-7001F型热场发射电镜扫描,加速电压为15 kV,放大倍数为500倍,获得相应的扫描电镜图。
2.2.2 比表面和孔隙结构分析
参考Noonpui等[14]的方法,采用NOVA 2000e比表面积孔径分析仪进行N2物理吸附-脱附分析。称取0.01 g活性炭置于样品管中,测试前将样品在90 ℃下脱气2 h后,升温至150 ℃继续脱气12 h转入分析站,然后以N2为吸附质,在液氮中(-196 ℃)进行吸附;比表面积及孔径分布均由NOVA 2000e仪器自带的分析软件进行分析处理。
2.3 吸附等温线研究
2.3.1 活性炭对β-胡萝卜素的吸附等温线研究
分别准确称取0.40 g ACP于100 mL锥形瓶中,加入30 mL β-胡萝卜素初始质量浓度分别为3.343、3.870、4.433、4.964、5.498、6.101、6.530 mg/L的玉米朊溶液,在35、45和55 ℃条件下,吸附平衡时间为2 h。试验完成后,离心除去活性炭,测量脱色液在448 nm下吸光值,根据标准曲线,求出此时溶液中β-胡萝卜素的平衡质量浓度。研究不同温度条件下β-胡萝卜素在活性炭上的吸附,将数据进行拟合分析并作图。
2.3.2 活性炭对玉米朊的吸附等温线研究
准确称取0.040 g ACP 于100 mL锥形瓶中,加入30 mL初始质量浓度分别为400、450、500、550、600、650、700 mg/L的玉米朊溶液,在35、45和55 ℃条件下,吸附平衡时间为2 h。试验完成后,离心除去活性炭,测量脱色液在280 nm下吸光值,根据标准曲线,求出此时溶液中玉米朊的平衡质量浓度。研究不同温度条件下玉米朊在活性炭上的吸附,将数据进行拟合分析并作图。

(1)
式中:qe为平衡吸附量/mg/g;C0为初始质量浓度/mg/L;Ce为平衡质量浓度/mg/L;V为溶液体积/L;W为活性炭质量/g。
2.3.3 吸附等温线模型
(1)Langmuir吸附等温模型

(2)
式中:Qm为最大单层吸附量/mg/g;Ce为平衡质量浓度/mg/L;qe为平衡吸附量/mg/g;KL为吸附常数/L/mg。
此外,可以用平衡参数RL来判断Langmuir吸附等温模型的适宜性:
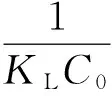
(3)
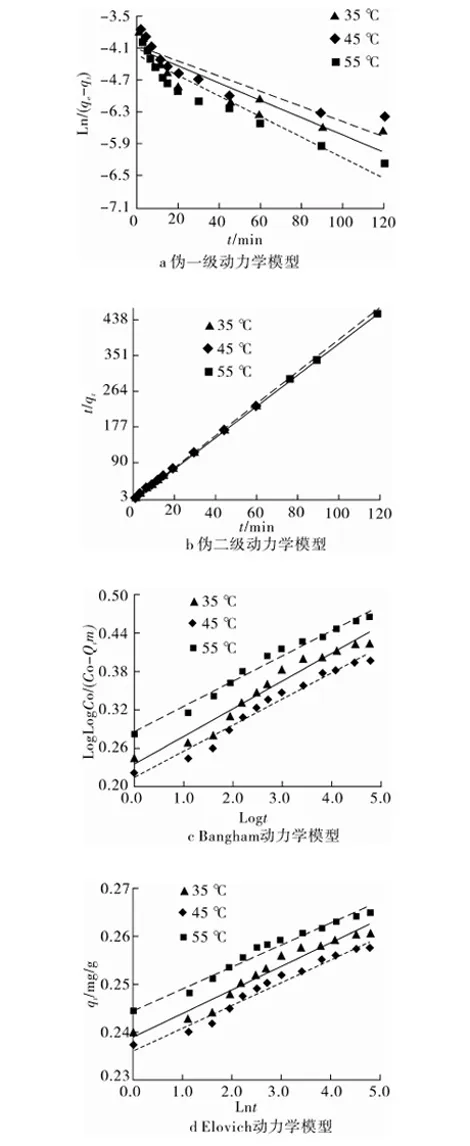
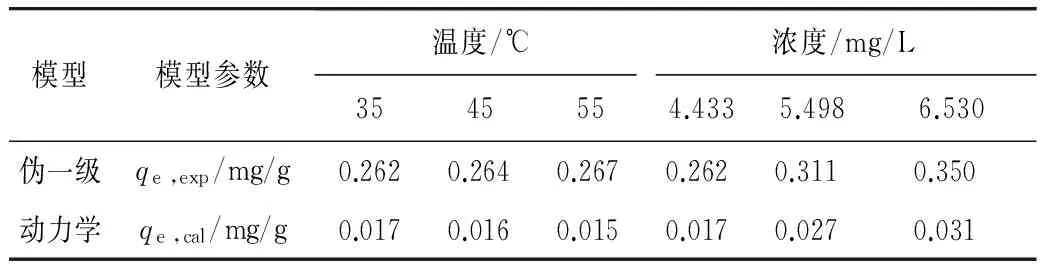
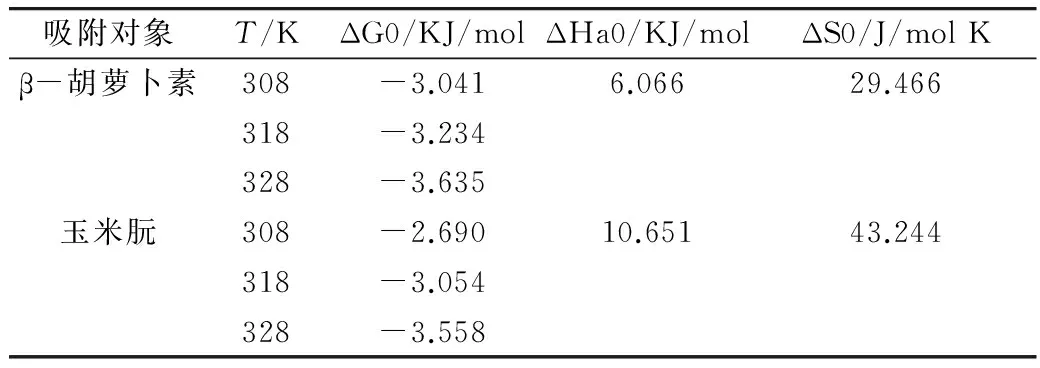
RL>1,非优惠吸附;RL=1,可逆吸附;0 (2)Freundlich吸附等温模型 (4) 2.4.1 活性炭对β-胡萝卜素的吸附动力学研究 准确称取0.40 g ACP 于100 mL锥形瓶中,加入30 mL β-胡萝卜素质量浓度为4.433 mg/L的黄色玉米朊溶液。在35、45和55 ℃条件下,脱色时间分别为1、3、5、7、9、12、15、20、30、45、60、90、120 min。试验完成后,离心除去活性炭,测量脱色液在448 nm下吸光值,根据标准曲线,求出溶液中β-胡萝卜素的平衡质量浓度。研究不同温度条件下活性炭对β-胡萝卜素的吸附动力学行为[16],将数据进行拟合分析并作图。 准确称取0.40 g ACP 于100 mL锥形瓶中,分别加入30 mL β-胡萝卜素质量浓度为4.433、5.498和6.530 mg/L的黄色玉米朊溶液。在35 ℃条件下,重复上述试验。研究不同β-胡萝卜素初始浓度条件下活性炭对β-胡萝卜素的吸附动力学行为,根据数据进行拟合分析并作图。 2.4.2 活性炭对玉米朊的吸附动力学研究 参照2.4.1方法步骤,ACP用量0.040 g,玉米朊溶液质量浓度为500 mg/L,脱色温度和脱色时间同2.4.1,测量脱色液在280 nm下吸光值。研究不同温度条件下活性炭对玉米朊的吸附动力学行为,将数据进行拟合分析并作图。 参照2.4.1方法步骤,ACP用量0.040 g,玉米朊溶液质量浓度为500、600和700 mg/L。研究不同玉米朊初始浓度条件下活性炭对玉米朊的吸附动力学,根据数据进行拟合分析并作图。 2.4.3 吸附动力学模型拟合 (1)伪一级动力学模型 (5) 式中:qt为t时刻的色素吸附量/mg/g;qe,exp为实际测得吸附平衡时吸附量/mg/g;qe ,cal为公式计算所得吸附平衡时吸附量/mg/g;kl为伪一阶吸附速率常数/min-1;t为吸附时间/min。 (2)伪二级动力学模型 (6) 式中:qt为t时刻的色素吸附量/mg/g;qe为吸附平衡时的吸附量/mg/g;k2为伪二阶吸附速率常数/g/mg·min;t为吸附时间/min;h(h=k2qe2)为初始吸附量速率/mg/g min。 (3)Bangham模型 (7) 式中:C0为初始质量浓度/mg/L;V为溶液体积/L;qt为t时刻吸附量/mg/g;m为活性炭质量浓度/g/L;α(<1)和k0(L/(g/L))均为常数。 (4)Elovich模型 qt=a+bLnt (8) 式中:qt为t时刻吸附量/mg/g;a、b:常数。 通过热力学参数标准吸附焓ΔHa0、标准吸附熵ΔS0和标准吸附自由能ΔG0的计算[17-18],可以进一步了解活性炭的吸附规律。标准吸附焓ΔHa0和标准吸附熵ΔS0可用式(9)进行计算: ΔG=-RTLnKC (9) 标准吸附焓ΔHa0和标准吸附熵ΔS0可以通过Van’t Hoff 公式求出: (10) 采用SPSS 17.0进行数据分析,用95%置信水平(P<0.05)来说明数据间差异显著性。每组试验重复3次,试验结果为3次测定结果的平均值。 β-胡萝卜素质量浓度对吸光值的标准曲线的回归曲线方程为Y=0.137 6X-0.007 5(R2=0.999),质量浓度在1.0~6.0 μg/mL之间呈良好的线性关系;玉米朊质量浓度对吸光值的标准曲线的回归曲线方程为Y=0.742 4X+0.127 5(R2=0.999 6),质量浓度在0.5~2.5 mg/mL之间呈良好的线性关系。 3.2.1 扫描电镜分析 对吸附剂进行表面形态观察,可为活性炭吸附性能差异分析提供理论支持[19]。3种活性炭的电子扫描电镜结果见图1。与ACN相比,ACC和ACP表面更加粗糙,不规则地密布着大量孔隙,凹凸不平,有褶皱和缺陷,发达的孔隙表明有较高的吸附能力。 图1 3种活性炭的SEM图 3.2.2 比表面和孔隙结构分析 3种活性炭对N2的吸附-脱附等温线如图2。ACC和ACP对氮气的吸/脱附类型属于Ⅱ型等温线,高压范围内出现的明显滞后环说明结构中存在大量的中孔结构[20],因此,ACC和ACP为微孔和中孔混合结构。ACN对氮气的吸/脱附曲线属于Ⅰ型等温曲线,表明其微孔结构占主导地位,因此活性炭N的吸附主要是以微孔吸附为主。表1为这2种活性炭的比表面积和孔径分布情况。ACC和ACP具有较高的比表面积(>1 400 m2/g)和总孔容积(>1.2 m3/g),微孔和中孔容积占总容积总量30%和70%左右,微孔表面积占总表面积的一半以上,表明ACC和ACP为微孔-中孔混合结构且微孔和中孔结构发达,因此二者具有较强的吸附性能。ACN微孔结构发达,对比表面积和总孔孔容的贡献达90%和80%以上。ACN的比表面积为ACC的二分之一,但前期研究发现ACN的脱色效果仅为ACC的三分之一[12],推测导致该现象发生的原因可能有2个:ACC表面有褶皱和凹陷,增加了吸附位点;中孔结构与β-胡萝卜素分子大小相接近,活性炭对β-胡萝卜素的吸附主要是在中孔结构中进行。 表1 不同型号活性炭的结构参数 注:SBET表示总比表面积;Sext表示中孔比表面积;Smic表示微孔比表面积;Vt表示总孔容积;Vmic表示微孔容积;Vmeso表示中孔容积。 图2 3种活性炭对氮气的吸附-脱附等温线 试验结果表明,活性炭的吸附能力不完全由表面结构和比表面积所决定,还与活性炭的微(中)孔结构有关,即孔隙结构与被吸附物质分子大小关系。因此,活性炭的吸附能力是活性炭表面结构、比表面积和孔隙结构共同作用的结果。 综合考虑吸附能力、比表面和孔隙结构等因素,本试验选用ACP作为研究对象,进行活性炭在玉米朊脱色过程中的热力学和动力学研究。 3.3.1 活性炭对β-胡萝卜素的吸附等温线 目前常用的吸附等温模型有2种:Langmuir模型和Freundlich模型。本研究选取这2种模型,对不同温度条件下活性炭对β-胡萝卜素的吸附过程进行回归拟合,拟合结果如图3所示,并求得不同模型的参数值,如表2所示。 由图3和表2可见,不同温度条件下,β-胡萝卜素在活性炭上的吸附过程均可运用Langmuir模型和Freundlich模型进行拟合(R2>0.92),表明不同温度条件下,活性炭对β-胡萝卜素的吸附可能是单层吸附与多层吸附共存的复杂吸附过程。利用Langmuir模型可以对β-胡萝卜素在活性炭上的最大单层吸附量进行预测。Freundiich模型常数KF值的大小反映了吸附性能的差异性,随温度的升高,KF值呈上升趋势,相应的吸附性能提高,这表明活性炭对色素的吸附是一个吸热过程。常数1/n介于0.1~1.0之间,说明吸附过程是容易进行的。 图3 不同温度条件下ACP对β-胡萝卜的吸附等温模型拟合线 表2 活性炭ACP对β-胡萝卜素的吸附等温线模型参数及相关系数 3.3.2 活性炭对玉米朊的吸附等温线 采用Langmuir和Freundlich等温线模型对活性炭吸附玉米朊过程的试验数据进行回归拟合,拟合结果如图5和图6所示,并求得不同模型的参数值,如表3所示。 由表3可见,不同温度条件下,Langmuir模型和Freundlich模型均能较好地描述活性炭对玉米朊的吸附(R2>0.994),表明不同温度条件下,活性炭对玉米朊的吸附可能是单层吸附与多层吸附共存的复杂吸附过程。Langmuir模型特征分离系数RL介于0~1之间,表明吸附过程均为优惠吸附,同时利用Langmuir模型可以对玉米朊在活性炭上的最大单层吸附量进行预测。随着温度的升高,ΚF、Qm和KL数值呈上升趋势,表明活性炭对玉米朊的吸附是一个吸热过程,升温有利于吸附,因此工业脱色玉米朊时,升高温度有利于提高脱色效果,但也会增加玉米朊的损失,因此需要综合考虑。 图4 不同温度条件下ACP对玉米朊的吸附等温模型拟合线 表3 ACP对玉米朊的吸附等温线模型参数及相关系数 温度/℃Langmuir吸附等温模型参数Freundlich吸附等温模型参数KL/L/mgQm/mg/gRLR2ΚF/L/g1/nR2350.0094446.4290.132~0.2110.997237.5020.37000.9947450.0100456.6210.125~0.2000.997240.4030.38940.9991550.0118460.8300.108~0.1750.998046.8380.39600.9966 3.4.1 活性炭对β-胡萝卜素的吸附动力学 本研究采用伪一级模型、伪二级模型、Bangham模型和Elovich 4个动力学模型对活性炭吸附β-胡萝卜素的试验数据进行回归拟合来探究吸附机理。拟合结果如图5和图6所示,并求得不同模型的参数值,如表4所示。 表4为不同温度及初始浓度条件下活性炭吸附β-胡萝卜素的动力学模型参数。以Ln(qe-qo)对t作直线,通过直线斜率和截距可以求出伪一级动力学模型常数k1和平衡吸附量qe ,cal(图5a,图6a)。不同温度及初始浓度条件下,伪一级动力学模型的线性相关系数在4个模型中最低(R2<0.92),同时经过模型拟合得到的平衡吸附量qe ,cal与实际测得平衡吸附量qe ,exp数值(表4)差别非常大,表明不同温度及初始浓度条件下,β-胡萝卜素在活性炭上的吸附行为不能用伪一级动力学模型来解释。 以t/qt对t做一条直线,通过直线斜率和截距可以求出伪二级动力学模型常数Κ2和平衡吸附量qe ,cal(图5b,图6b)。不同温度及初始浓度条件下,伪二级动力学模型的线性相关系数在4个模型中最高(R2>0.999),通过模型可预测得到平衡吸附量qe ,cal,与实际测得平衡吸附量qe ,exp数值(表4)相比,二者数值非常接近。因此该模型可用来预测整个吸附过程,表明活性炭吸附β-胡萝卜素过程可能是物理和化学复合吸附过程[21]。 Bangham模型是以LogLog[C0/(C0-qtm)]对Logt作直线拟合得到(图5c、图6c)。不同温度及不同初始浓度条件下,表4显示拟合后的Bangham模型线性相关系数相对较高,介于0.95~0.99之间,表明β-胡萝卜素在活性炭孔径上的扩散可能是膜扩散和微孔扩散共同作用的结果[19]。 Elovich模型以均匀表面上的Langmuir速率方程为基础,推导出的描述不均匀表面上动力学模型。以qt对Lnt作直线,通过直线斜率和截距可以求出常数a和b。不同温度及不同初始浓度条件下,表4显示拟合后的Bangham模型线性相关系数介于0.95~0.98之间,说明吸附过程可能是在活性炭的不均匀表面上进行的。 图5 不同温度条件下ACP对β-胡萝卜素的4种吸附动力学模型拟合线 图6 不同初始浓度条件下ACP对β-胡萝卜素的4种吸附动力学模型拟合线 表4 ACP对β-胡萝卜素的吸附动力学模型参数及相关系数 模型模型参数温度/℃浓度/mg/L3545554.4335.4986.530伪一级qe,exp/mg/g0.2620.2640.2670.2620.3110.350动力学qe,cal/mg/g0.0170.0160.0150.0170.0270.031 表4(续) 3.4.2 活性炭对玉米朊的吸附动力学 本研究采用伪一级模型、伪二级模型、Bangham模型和Elovich 4个动力学模型对活性炭吸附玉米朊的试验数据进行回归拟合来探究吸附机理。拟合结果如图7和图8所示,并求得不同模型的模型参数值,如表5所示。 表5 ACP对玉米朊的吸附动力学模型参数及相关系数 不同温度及初始浓度条件下,伪一级动力学模型的线性相关系数在4个模型中最低(R2<0.91),经过模型拟合得到的平衡吸附量qe ,cal与实际测得平衡吸附量qe ,exp数值(表5)差别非常大,说明伪一级动力学模型不能反映玉米朊在活性炭上的实际吸附动力学行为。 从图7b、图8b和表5可见,不同温度及初始浓度条件下,伪二级动力学模型的线性相关系数在4个模型中最高(R2>0.999),通过模型预测活性炭对玉米朊的最大单层吸附量qe ,cal与实际测得qe ,exp数值非常接近。因此可用该模型预测玉米朊在活性炭上的整个吸附过程,同时也表明活性炭吸附玉米朊过程是物理和化学复合吸附过程。 图7 不同温度条件下活性炭对玉米朊的4种吸附动力学模型拟合线 不同温度及不同初始浓度条件下,图7c、图8c和表5显示拟合后的Bangham模型线性相关系数相对较高(介于0.94~0.98之间),表明玉米朊在活性炭孔径上的扩散可能是膜扩散和微孔扩散共同作用的结果[19]。 不同温度及不同初始浓度条件下,图7d、图8d和表5显示拟合后的、Elovich模型线性相关系数同样相对较高(介于0.93~0.97之间),同样说明活性炭对玉米朊的吸附过程可能是在活性炭的不均匀表面上进行的。 图8 不同初始浓度条件下ACP对玉米朊的4种吸附动力学模型拟合线 根据吸附等温线数据可得活性炭对β-胡萝卜素和玉米朊的吸附热力学参数,如表6所示。由表可见,ΔG0均为负值且绝对值随温度升高而增大,表明活性炭对β-胡萝卜素和玉米朊的吸附过程为自发进行的,升温有利于吸附过程的进行。ΔHa0为正值,表明活性炭对β-胡萝卜素和玉米朊的吸附过程是吸热反应,因为活性炭对水分子解吸吸收的热量要大于其吸附二者所放出的热量,因此整个吸附过程表现为吸热反应。活性炭对β-胡萝卜素和玉米朊的饱和吸附量随温度的上升而增大(表2、表3)证实了上述结论。ΔS0为正值,表明活性炭对β-胡萝卜素和玉米朊的吸附是亲和吸附,吸附过程为熵增加过程。本研究的脱色体系中,玉米朊、β-胡萝卜素和溶剂(乙醇水溶液)同时存在,活性炭对β-胡萝卜素和玉米朊的吸附必然伴随着溶剂的脱附。β-胡萝卜素和玉米朊的吸附导致吸附过程熵减少,而溶剂的脱附则促使该过程熵增加,因此该吸附过程总熵值是吸附/脱附过程熵值变化的总和[5]。 表6 ACP对β-胡萝卜素和玉米朊的吸附热力学参数 活性炭的吸附能力是活性炭表面结构、比表面积和孔隙结构共同作用的结果。活性炭的吸附效果不仅受表面结构和比表面积影响,还与活性炭的微(中)孔结构有关,即孔隙结构与被吸附物质分子大小关系。 活性炭对β-胡萝卜素和玉米朊的吸附可能是单层吸附与多层吸附共存的复杂吸附过程。Langmuir模型可预测活性炭对二者的饱和吸附量,Freundlich模型可用于分析吸附过程的进行方向。活性炭对β-胡萝卜素和玉米朊的吸附过程是物理和化学复合吸附,膜扩散等共同作用的结果,利用伪二级动力学模型可以对活性炭的平衡吸附量进行预测。活性炭对β-胡萝卜素和玉米朊的吸附是一个自发吸热过程,驱动力为熵驱动,升温有利于吸附过程的进行。 [1]Sessa D J. Decolorization/deodorization of corn zein products: U.S. Patent 7939633[P]. 2011-5-10 [2]Momany F A, Sessa D J, Lawton J W, et al. Structural characterization of α-zein[J]. Journal of Agricultural and Food Chemistry, 2006, 54(2): 543-547 [3]Mason I D, Palmer L S. Preparation of white zein from yellow corn[J]. Journal of Biological Chemistry, 1934, 107(1): 131-132 [4]Pearce L O G. Preparation and purification of zein[P].U.S. 2229870,1941 [5]马广亮,董英,徐斌.玉米朊的活性炭脱色工艺研究[J].食品科技,2007,32(2):261-264 Ma G L, Dong Y, Xu B. Study on decoloring zein with active carbon[J]. Food Science and Technology, 2007,32(2):261-264 [6]Khaled A, Nemr A E, El-Sikaily A, et al. Removal of direct n blue-106 from artificial textile dye effluent using activated carbon from orange peel: adsorption isotherm and kinetic studies[J]. Journal of Hazardous Materials, 2009, 165(1-3):100-110 [7]Lyubchik S I, Lyubchik A I, Galushko O L, et al. Kinetics and thermodynamics of the Cr (Ⅲ) adsorption on the activated carbon from co-mingled wastes[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2004, 242(1): 151-158 [8]Kobya M. Adsorption, kinetic and equilibrium studies of Cr (Ⅵ) by hazelnut shell activated carbon[J]. Adsorption Science & Technology, 2004, 22(1): 51-64 [9]Demirbas E, Dizge N, Sulak M T, et al. Adsorption kinetics and equilibrium of copper from aqueous solutions using hazelnut shell activated carbon[J]. Chemical Engineering Journal, 2009, 148(2): 480-487 [10]Jumasiah A, Chuah T G, Gimbon J, et al. Adsorption of basic dye onto palm kernel shell activated carbon: sorption equilibrium and kinetics studies[J]. Desalination, 2005, 186(1): 57-64 [11]Sessa D J, Palmquist D E. Effect of heat on the adsorption capacity of an activated carbon for decolorizing/deodorizing yellow zein[J]. Bioresource Technology,2008,99(14):6360-6364 [12]薛丁萍, 徐斌, 韩及华, 等. 玉米朊脱色用活性炭的筛选及其脱色工艺的优化[J].中国粮油学报, 2014, 29(8):11-16 Xue D P, Xu B, Han J H, et al. Screening of activated carbon for zein decolorization and optimization of decolorization process[J]. Journal of The Chinese Cereals and Oils Association, 2014, 29(8):11-16 [13]Sessa D J, Woods K K. Purity assessment of commercial zein products after purification[J]. Journal of the American Oil Chemists' Society, 2011, 88(7): 1037-1043 [14]Noonpui S, Thiravetyan P, Nakbanpote W, et al. Color removal from water-based ink wastewater by bagasse fly ash, sawdust fly ash and activated carbon[J]. Chemical Engineering Journal, 2010, 162(2): 503-508 [15]Crini G, Peindy H N, Gimbert F, et al. Removal of CI Basic Green 4 (Malachite Green) from aqueous solutions by adsorption using cyclodextrin-based adsorbent: kinetic and equilibrium studies[J]. Separation and Purification Technology, 2007, 53(1): 97-110 [16]Muntean S G, Paska O, Coseri S, et al. Evaluation of a functionalized copolymer as adsorbent on direct dyes removal process: kinetics and equilibrium studies[J]. Journal of Applied Polymer Science, 2013, 127(6): 4409-4421 [17]Amin N K. Removal of direct blue-106 dye from aqueous solution using new activated carbons developed from pomegranate peel: adsorption equilibrium and kinetics[J]. Journal of Hazardous Materials, 2009, 165(1): 52-62 [18]Belala Z, Jeguirim M, Belhachemi M, et al. Biosorption of basic dye from aqueous solutions by date stones and palm-trees waste: kinetic, equilibrium and thermodynamic studies[J]. Desalination, 2011, 271(1): 80-87 [19]Al-Othman Z A, Ali R, Naushad M. Hexavalent chromium removal from aqueous medium by activated carbon prepared from peanut shell: adsorption kinetics, equilibrium and thermodynamic studies[J]. Chemical Engineering Journal, 2012, 184: 238-247 [20]Sun R Q, Sun L B, Chun Y, et al. Catalytic performance of porous carbons obtained by chemical activation[J]. Carbon, 2008, 46(13): 1757-1764 [21]Tan I A W, Ahmad A L, Hameed B H. Adsorption of basic dye on high-surface-area activated carbon prepared from coconut husk: equilibrium, kinetic and thermodynamic studies[J]. Journal of Hazardous Materials, 2008, 154(1): 337-346. Adsorption Mechanism of Activated Carbon During Zein Decolorization Process Han Jihua Wu Qifei Xu Bin Xue Dingping (School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013) In order to explore the adsorption mechanism of activated carbon during zein decolorization process, the microstructure of activated carbons for decolorization was analyzed by scanning electron microscopy (SEM), surface area analysis (BET) and pore size distribution analysis. Then, we focused on researching the adsorption isotherm, adsorption kinetics and thermodynamics parameters of decolorization process for activated carbon P (ACP). The results showed that activated carbon P (ACP) had optimum adsorption capacity, surface area and pore structure. Both Langmuir and Freundlich models fit the adsorption data of pigment and zein on ACP quite reasonably(R2>0.92).The adsorption kinetics suggest pseudo-second-order kinetic model was the dominant model all through the total adsorption process (R2>0.99).Thermodynamics parameters showed that the adsorption of pigment and zein on ACP was spontaneous(ΔG0<0) and endothermal(ΔHa0>0) , and entropy was the driving force(ΔS0>0).We could conclude that the adsorption capacities of activated carbons were affected by not only the surface structure and specific surface area, but also micropore and mesopore structure. The adsorption of pigment on activated carbon was a complex process accompanying with monolayer and multilayer adsorption and was the result of joint action of physical and chemical composite adsorption, membrane diffusion etc. zein, decolorization, activated carbon, kinetic, thermodynamic, adsorption isotherm TS201. 1 A 1003-0174(2016)10-0098-10 科技部创新基金(11C26213201415),扬州市农业科技攻关(SGG201220049) 2015-02-12 韩及华,男,1989年出生,硕士,食品工程 吴其飞,男,1972年出生,副研究员,化工机械

2.4 吸附动力学

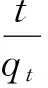
2.5 热力学参数


2.6 统计分析
3 结果与讨论
3.1 标准曲线制作
3.2 活性炭的结构表征



3.3 吸附等温线分析




3.4 吸附动力学分析





3.5 吸附热力学参数分析
4 结论

