温阳活血通络方对SSc小鼠体内TGF-β1与MCP-1水平的影响①
谭利平 尤加锐 向方华 陈安平 夏 燕 冯 佳 蔡 杰 袁 林 苏林冲 黄 勤向 阳⑥
(湖北民族学院风湿性疾病发生与干预湖北省重点实验室,恩施445000)
·中医中药与免疫·
温阳活血通络方对SSc小鼠体内TGF-β1与MCP-1水平的影响①
谭利平②尤加锐③向方华④陈安平 夏 燕 冯 佳 蔡 杰⑤袁 林 苏林冲④黄 勤②向 阳④⑥
(湖北民族学院风湿性疾病发生与干预湖北省重点实验室,恩施445000)
目的:观察温阳活血通络方对硬皮病小鼠体内TGF-β1、MCP-1水平的影响。方法:采用博来霉素皮下注射制造硬皮病小鼠模型,对模型组小鼠分别给予温阳活血通络方、醋酸泼尼松、二药联合、生理盐水灌胃28 d;HE染色与Masson染色观察皮肤与肺组织病理学改变,ELISA检测血清中TGF-β1与MCP-1的表达;免疫组化检测皮肤与肺组织中二者表达水平。结果:①TGF-β1与MCP-1在模型鼠皮肤组织与肺中的表达部位有一定差异。各治疗组TGF-β1与MCP-1较模型组均明显减弱(P<0.05),尤以两药联合治疗组变化明显。②模型鼠血清中TGF-β1与MCP-1表达较正常鼠均显著升高(P<0.01),治疗后,TGF-β1与MCP-1表达明显降低(P<0.05),尤以两药联合治疗组变化明显。结论:温阳活血通络方能够改善硬皮病小鼠皮肤与肺组织的病理学变化,且可能通过下调血清及皮肤组织中TGF-β1与MCP-1来发挥治疗作用。
系统性硬化症;温阳活血通络方;转化生长因子β1;单核细胞趋化因子1
系统性硬化症(Systemic sclerosis,SSc)又叫硬皮病,是一种进行性、系统性、慢性结缔组织疾病,在我国自身免疫性疾病中,SSc的发病率仅次于类风湿关节炎、系统性红斑狼疮居第三位。本病女性发病率大约为男性的4.6倍[1],80%发病年龄在11~50岁[2],这个发病年龄段占据了整个社会人群的大部分。毛笑非等[3]采用SF-36量表评估87例系统性硬化症患者的健康相关生活质量,与健康人群的生活质量进行比较,结果显示SSc患者(局限型、弥漫型)与健康人群比较,生活质量均存在不同程度的下降。这种下降与病情严重程度、生理机能下降情况、躯体疼痛程度、心理状况变化及社会适应能力减退等存在显著关联性。
本病病因与发病机制至今尚不完全清楚,目前研究表明,在遗传易感性基础上,环境因素刺激活化机体产生炎症反应和自身免疫应答,血管内皮细胞进而受损,成纤维细胞活化、异常增殖,大量合成细胞外基质(ECM),造成组织纤维化,随着病情不断发展,炎症逐渐消退,但纤维化的组织却不可逆转,最终导致多系统血管病变、组织纤维化改变和脏器功能衰竭,致使死亡,病情预后极差。本实验以前期研究为基础,采取动物实验研究中药复方温阳活血通络方(WHT)对SSc小鼠皮肤与血清的影响,探讨其作用机制,并为寻找抑制SSc皮肤组织纤维化的新治疗靶点提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/c小鼠,雌性,清洁级,体重平均为(20±2) g,6周龄左右,50只,购买于武汉大学动物实验中心,质量许可证编号:SCXK(鄂)20080004。
1.1.2 实验药品与试剂 温阳活血通络方:由淫羊藿20 g、丹参20 g、黄芪20 g、当归10 g、桂枝10 g、白芍10 g、竹节参15 g、白芥子10 g、甘草5 g组成,购买于湖北民族学院附属民大医院中药房;Zeocin博来霉素1.25 ml(100 mg/ml)由美国Invitrogen公司生产;醋酸泼尼松片(5 mg)由山东新华制药股份有限公司生产;PBS缓冲液(pH:7.2~7.4)由武汉科瑞生物技术有限公司生产;快速Masson染液由南京建成科技有限公司生产;鼠TGF-β1与MCP-1一抗、鼠TGF-β1与鼠MCP-1 ELISA试剂盒均由美国BD公司生产;兔SP检测试剂盒DAB显色试剂盒由北京中杉金桥生物技术有限公司生产。
1.1.3 实验仪器 纯水超纯水制备系统由美国Millipore公司制造;倒置荧光显微成像系统(IX71型)由日本OLYMPUS公司制造;倒置生物显微镜(CKX41型)由日本OLYMPUS公司制造;全波长全自动酶标仪由美国雷勃公司制造;轮转式切片机(R138型)由湖北泰维科技实业有限公司制造;全系列单道可调移液器、多道可调移液器(8道型)由德国Eppendorf公司制造;液氮生物容器(ZCR型)由成都金凤液氮容器有限公司制造;超低温冰箱(-80℃)由日本SANYO公司制造;低温冰箱(-20℃)由海尔公司制造。
1.2 方法
1.2.1 动物分组 将50只小鼠适应性饲养7 d后,随机分为正常组(5只)与模型组(45只),模型组随机分为对照组、WHT组、泼尼松组、WHT+泼尼松组、细胞实验组,每组各9只,所有小鼠均常规饲养,自由进食。正常组均给予PBS皮下注射,模型组均给予配制好的博来霉素溶液皮下注射。
1.2.2 建立硬皮病小鼠模型 将所有小鼠背部中央靠近尾部区域皮肤碘伏消毒,用一次性备皮刀剃除该区域被毛,面积约1.5 cm×1.5 cm,用温水擦洗背部脱落的被毛,室温中晾干,在剃去被毛的皮肤区域用记号笔做好标记,酒精消毒背部标记区域皮肤,戴上无菌手套,用1 ml无菌注射器(已吸取相应药物0.1 ml)取30~45倾斜缓慢进针,针下有空虚感即提示针头刺入皮下,同时左右轻轻摇摆针头,无阻碍感则继续进针约1 cm深度,回抽注射器无回血,则可将相应药物缓慢注入,可见皮下起囊性包块,提示药物进入皮下,注射完毕后缓慢拔出针头,用无菌棉签按压片刻。所有小鼠均每天给药1次,每次0.1 ml,且保证每次同一部位进针,持续给药28 d。
1.2.3 小鼠模型评估 在小鼠造模期间,密切观察小鼠活动情况、精神状况、皮肤毛发生长、毛发光泽度、皮肤弹性、厚度及表皮毛细血管充盈度等情况。造模给药第28天,于正常组随机选取1只,模型组随机选取3只小鼠颈椎脱臼处死,通过肉眼观察表皮情况与剪取背部皮肤与肺组织切片做HE染色、免疫组织化学的方法,评估硬皮病小鼠模型是否制作成功。
1.2.4 给药方法 造模给药28 d后,开始给予模型组小鼠灌胃给药,持续灌胃28 d,给药剂量按成人每日常规服药量换算而成。WHT组、泼尼松组、WHT+泼尼松组分别灌服相应药物,正常组、对照组每天灌服等量生理盐水,每天1次。以上各组小鼠均在相同环境下常规饲养,自由进食,密切观察小鼠生命体征及活动情况,于灌胃给药28 d后处死。
1.2.5 标本采集与保存 处死小鼠前采用摘除眼球取血采集血清,-20℃保存备用;待取血完毕后,处死小鼠,剪下病变区与正常区皮肤,分别放入提前标记好相应编号的标本盒中,置于4%多聚甲醛中及时固定,待后期常规脱水、石蜡包埋、切片进行病理学检测及免疫组织化学检测;将小鼠皮肤取下并固定好后,立即剪开胸部皮肤,逐层分离肌层剪断肋骨完整分离出肺组织,取左肺下叶一部分组织放入提前标记好的相应标本盒中,浸泡于4%多聚甲醛中及时固定,待后期常规脱水、石蜡包埋、切片进行HE染色观察肺组织形态学改变。
1.2.6 实验室指标检测 皮肤与肺组织病理学检测:将造模的小鼠皮肤与肺组织取下后,采用HE染色评估是否造模成功;后期予模型小鼠给药治疗后,采集到的皮肤通过HE染色与Masson染色,观察皮肤组织中纤维组织增生情况,确定其病理改变;皮肤与血液中TGF-β1、MCP-1的表达:将所采集的小鼠血清采用ELISA检测两项指标,采用免疫组化方法检测皮肤组织中二者的表达。
2 结果
2.1 造模后皮肤与肺组织HE染色 如图1A所示,模型组小鼠皮肤HE染色可见皮损处真皮层明显增厚,且在真皮层内出现了胶原纤维明显增生、膨大、排列紧密、均质化等改变;真皮下血管增粗,管腔狭窄,血管壁明显增厚,有些甚至出现堵塞;皮下毛囊等附属器明显减少,脂肪层显著变薄;并伴有较多炎症细胞浸润的现象。PBS组小鼠皮肤(图1B)组织学上基本正常,未出现上述变化。如图1C所示,模型组小鼠肺组织HE染色可见肺组织结构紊乱,部分肺泡消失;肺泡间隔明显增厚;肺间质及肺泡腔内见大量炎性细胞浸润,且伴有大量胶原纤维沉积;肺间质内小血管壁增厚甚至闭塞。PBS组小鼠肺(图1D)组织学上基本正常,未出现上述变化。由此我们可证实动物模型制造成功。
2.2 治疗后皮肤组织HE染色 经治疗后,与同期灌服生理盐水对照组(图2D)小鼠相比,WHT治疗组疗效尚可,真皮层稍变薄,胶原纤维束排列较疏松,炎性细胞浸润略有缓解,皮下附属器稍有增多,且部分微血管管腔有些许增大、排列较均匀(图2A);泼尼松治疗组疗效较WHT组稍明显,真皮层变薄,皮下脂肪层增厚,皮下附属器增多(图2B);WHT+泼尼松治疗组疗效显著,表皮层毛孔凹陷部位较对照组增多,真皮层胶原纤维增生情况明显改善,且胶原纤维束排列疏松,均匀分布着毛囊,汗腺等皮下附属器,毛囊萎缩与微血管堵塞情况均有所好转,皮下脂肪层较对照组明显增厚(图2C)。
2.3 治疗后肺组织HE染色 经治疗后,与同期灌服生理盐水对照组(图3D)小鼠相比,WHT治疗组肺组织结构紊乱程度较对照组缓解,肺泡间隔增厚程度较对照组有所减轻,部分肺泡壁变薄,且炎性细胞浸润略有缓解(图3A);泼尼松治疗组肺泡壁明显变薄,纤维增生情况明显改善,见少许炎性细胞浸润,血管管腔增大(图3B);WHT+泼尼松治疗组疗效显著,肺泡壁较对照组变薄,肺泡腔明显变大,但分布不均匀,炎性细胞浸润程度较对照组明显好转(图3C)。
2.4 治疗后皮肤组织Masson染色结果 经治疗后,与同期灌服生理盐水对照组(图4D)小鼠相比,WHT治疗组疗效尚可,真皮层胶原纤维增生程度有所减轻,胶原纤维束排列较疏松,炎性细胞浸润略有缓解,皮下附属器稍有增多,脂肪层较对照组略有增厚(图4A);泼尼松治疗组真皮层胶原纤维增生情况改善,皮下附属器稍增多,脂肪层增厚不明显(图4B);WHT+泼尼松治疗组疗效显著(图4C),真皮层胶原纤维增生情况明显改善,且胶原纤维束排列疏松,均匀分布毛囊,汗腺等皮下附属器,毛囊萎缩与微血管堵塞情况均有所好转,皮下脂肪层较对照组明显增厚,更接近正常皮肤(图4E)。
2.5 TGF-β1、MCP-1免疫组织化学染色结果 用PBS代替一抗做阴性对照,在光镜下观察,每组随机选取2张切片,每张切片随机选取5个不同的视野,阳性结果为淡黄到深棕色细颗粒状,阴性结果为不着色,根据如下标准计分:①细胞无着色记0分,棕黄色或淡黄色着色记1分,深棕色或棕褐色着色记2分;②无阳性细胞着色记0分,阳性细胞着色比例<25%记1分,25%~50%记2分,50%~75%记3分,>75%记4分;①②乘积为最后得分:0分为(-),1~2分为弱阳性(+),3~4分为阳性(++),>4分为强阳性(+++)。
2.5.1 TGF-β1免疫组化染色结果 光镜下可观察到TGF-β1阳性表达位于表皮层、皮下附属器、血管内皮层、基底层。正常皮肤组织的表皮层和血管内皮层表达弱阳性,计分1分(见图5E);在模型对照组皮肤组织的表皮层、皮下附属器、血管内皮层和基底细胞层呈强阳性表达,计分8分(见图5D);WHT组皮肤在表皮层、血管内皮层、毛囊、汗腺内表达信号较模型对照组稍弱,计分6分(见图5A);泼尼松组皮肤较模型对照组表达减弱,计分4分(见图5B);WHT+泼尼松组皮肤较模型对照组均明显减弱,且较WHT组与泼尼松组均减弱更明显,计分2分(见图5C);每组皮肤PBS代替一抗的对照皮肤组织上表达均显示阴性,计分0分(见图5a~e)。
2.5.2 MCP-1免疫组化染色结果 光镜下可观察到MCP-1表达主要集中于血管内皮层、胶原层、皮下附属器内,基质层与脂肪层几乎无表达。正常组皮肤在胶原层与血管内皮层均弱阳性表达,在基质层表达阴性,计分0分(见图6E);模型对照组皮肤在胶原层、血管内皮层与皮下附属器内表达强阳性,计分8分,在基质层表达阴性,计分0分(见图6D);WHT组皮肤在胶原层与皮下附属器内表达较对照组减弱,计分4分,基质层表达阴性,计分0分(见图6A);泼尼松组皮肤在血管内皮层表达阳性,计分3分,在胶原层表达弱阳性,计分2分,较模型对照组均减弱(见图6B);WHT+泼尼松组皮肤在胶原层与血管内皮层表达较模型对照组明显减弱,计分2分,且比WHT组与泼尼松组相比均减弱更明显(见图6C);每组皮肤PBS代替一抗的对照皮肤组织上表达均显示阴性,计分0分(见图6a~e)。
2.6 血清中TGF-β1、MCP-1的含量 根据酶标仪所测得的OD值计算出各组小鼠血清中TGF-β1、MCP-1的浓度(见表1),结果显示在模型组中TGF-β1与MCP-1的浓度较正常组均显著升高(P<0.01);其中TGF-β1含量在各治疗组较模型组均显著降低(P<0.05),尤以WHT+泼尼松组降低更为明显(P<0.01),且在正常组中仅少量分泌TGF-β1;MCP-1含量在各治疗组较模型组均降低(P<0.05),尤以WHT+泼尼松组降低最为明显,差异有统计学意义(P<0.05)。

图1 造模后小鼠皮肤与肺HE染色(×4)Fig.1 Mice skin and lung HE staining after modeling(×4)Note: A.The skin tissue of BIS models;B.The skin tissue of PBS mice;C. The pulmonary tissue of BIS models;D.The pulmonary tissue of PBS mice.

图2 灌胃治疗后各组皮肤HE染色(×10)Fig.2 Treatment groups′ skin of HE staining after gavage(×10)Note: A.WHT group;B.Prednisone group;C.WHT+prednisone group;D.Saline group.

图3 灌胃治疗后各组肺组织HE染色(×10)Fig.3 Treatment groups′ lung tissue of HE staining after gavage(×10)Note: A.WHT group;B.Prednisone group;C.WHT+prednisone group;D.Saline group.

图4 灌胃治疗后各组皮肤Masson染色(×4)Fig.4 Treatment groups′skin of Masson staining after gavage(×4)Note: A.WHT group;B.Prednisone group;C.WHT+prednisone group;D.Models group;E.Normal group.

图5 治疗后各组皮肤TGF-β1免疫组化结果(×10)Fig.5 Skin′ immunohistochemical results of TGF-β1 after treat ment(×10)
表1 ELISA检测血清中TGF-β1、MCP-1含量
Tab.1 ELISA detect TGF-β1,MCP-1 content in serum
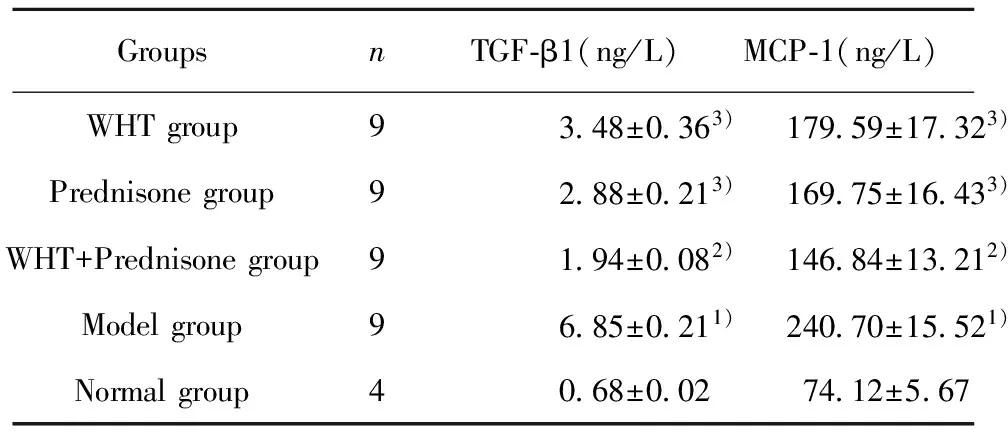
GroupsnTGF⁃β1(ng/L)MCP⁃1(ng/L)WHTgroup9348±0363)17959±17323)Prednisonegroup9288±0213)16975±16433)WHT+Prednisonegroup9194±0082)14684±13212)Modelgroup9685±0211)24070±15521)Normalgroup4068±0027412±567
Note:Compared with normal group,1)P<0.01;compared with model group,2)P<0.01,3)P<0.05.
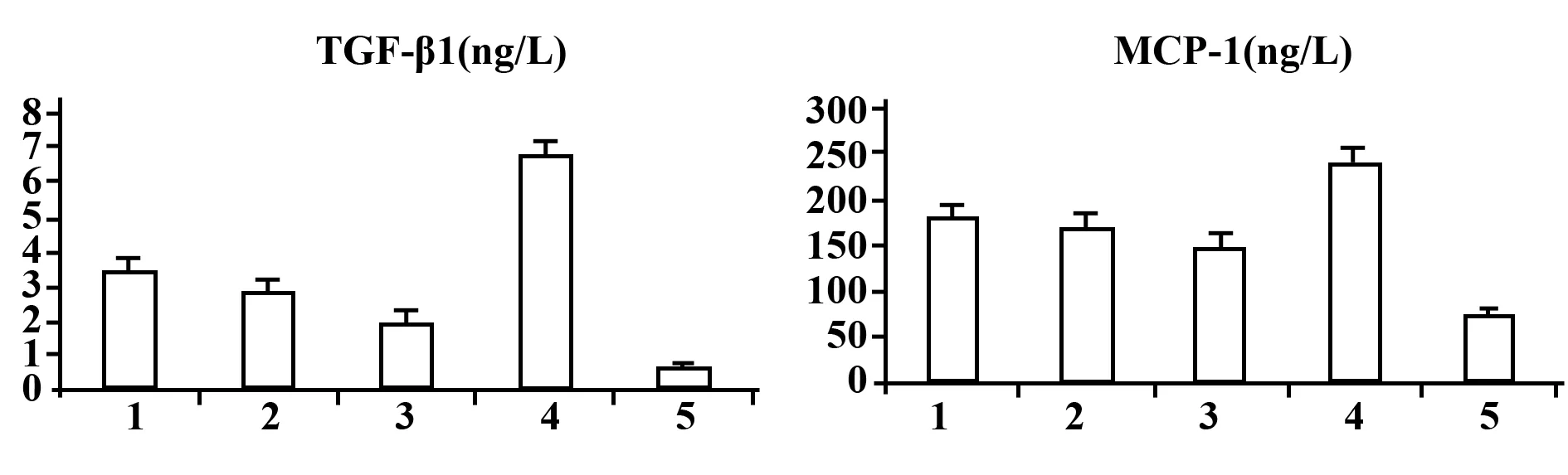
图7 ELISA检测血清中TGF-β1、MCP-1含量Fig.7 ELISA detect TGF-β1,MCP-1 content in serumNote: 1.WHT group;2.Prednisone group;3.WHT+Prednisone group;4.Model group;5.Normal group.
3 讨论
SSc皮肤受损增厚变硬是SSc的基本病变,几乎所有SSc患者均会出现不同程度皮肤受损,皮肤硬化严重时关节活动受限,严重降低生活质量;对SSc生存率调查研究[4]结果显示,SSc的5年死亡率平均为40%,显著高于乳腺癌和前列腺癌的15%。SSc的发病机理至今尚未十分明确,目前推断可能与B细胞失衡和T细胞不恰当激活有关[5],也可能是在上述多种因素的共同作用下产生抗炎反应并刺激免疫系统激活,从而产生多种细胞因子与免疫介质,这些细胞因子与免疫介质刺激纤维母细胞,生成大量胶原及细胞外基质(ECM),沉积在皮下组织与结缔组织中,并损伤血管内皮细胞,造成血管壁增厚,管腔狭窄甚至闭塞。
其中关于这方面的细胞因子有很多种,比较重要的如TGF-β1、MCP-1。TGF-β1是体内TGF同种亚型中促纤维化发生较强的细胞因子之一,也是各种组织发生纤维化的重要介质之一,其通过信号通路Smad2和Smad3发挥相关作用,激活下游致病因子,调节组织纤维化的发生过程[6],有体外试验证实TGF-β1可加速成纤维细胞的增殖,对SSc患者组织进行基因检测结果提示TGF-β1所依赖的基因过度表达[7]。MCP是一种能够对白细胞起特异性化学趋化作用的细胞因子,其包括4个亚族,它们主要通过协同作用对中性粒细胞、淋巴细胞、单核细胞等起趋化作用[8],Mariagrazia等[9]研究表明,MCP-1促进了免疫细胞初期和晚期的纤维化发展,在动物实验研究中也显示,在SSc发病初期,所有这些细胞因子都参与了免疫调节,且MCP-1持续保持着高表达状态,表明MCP-1在本病的发生发展过程中作用明显,MCP-1在激活淋巴细胞和辅助T2细胞有着十分重要的作用,驱使机体发生免疫应答反应和与之相对应的促纤维化反应。
因SSc的病程长,病情重,常累及多脏腑器官,目前难以根治,其发病率与死亡率高,患者生活质量下降,而病因病机尚不清楚,故尚无特效治疗药,目前均是采用抗炎、抗纤维化、扩管、免疫调节等方法来治疗,并不能从根本上解决问题。中医关于该疾病的病因病机则有多种说法,诸如六淫学说、脏腑学说、络病学说等,在此我们认为阳虚寒凝、痰瘀互结、血脉不通为其主要病机。而中医讲究辩证施治,“痹症”证属本虚标实,气血亏虚为本,外邪侵袭为标。治以温阳固本、养血益气、祛湿散寒、活血通络。本实验所选用的“温阳活血通络方”正是鉴于该治法,也是基于在临床上的广泛应用,是在《伤寒论》经典方“当归四逆汤”基础上加减而成,其功效为温经散寒、温阳通脉、养血活血。采用该复方对SSc小鼠模型进行治疗,探求该复方对SSc的作用机制,为临床治疗SSc提供实验依据。
从皮肤与肺组织病理学TGF-β1与MCP-1的表达结果可以看出,模型鼠皮损处真皮层明显增厚,胶原纤维明显增生、膨大、排列紧密;真皮下血管增粗,管腔狭窄,血管壁明显增厚,有些甚至出现堵塞;皮下毛囊等附属器明显减少,脂肪层显著变薄;并伴有较多炎症细胞浸润的现象。模型鼠肺组织结构紊乱,肺泡间隔明显增厚,且伴有大量胶原纤维沉积;肺间质内小血管壁增厚甚至闭塞。免疫组化染色结果显示TGF-β1、MCP-1在皮损处均呈强阳性表达,与文献结果一致[10],表明模型复制成功。给药后,各治疗组均能不同程度地改善皮肤与肺的病理学特征,且能调节TGF-β1、MCP-1在皮肤组织上的表达,尤以WHT+泼尼松组变化明显,说明WHT+泼尼松联合治疗早期SSc疗效好。
综上所述,温阳活血通络方对博来霉素引起的SSc小鼠皮肤及肺组织纤维化改变有一定的治疗作用,其可能通过抑制体内TGF-β1与MCP-1的表达来控制SSc皮肤纤维化进程,且在SSc的临床治疗上宜联合醋酸泼尼松,能达到较为理想的疗效。
[1] 赵 凯,屠文震.硬皮病研究进展[J].中华风湿病学杂志,2003,7(6):356-359.
[2] 周茂松,严煜林.硬皮病病因及发病机制的研究进展[J].医学综述,2008,14 (1):88-89.
[3] 毛笑非,樊 雪,张心瑜,等.87例系统性硬化症患者健康相关生活质量的评价与分析[J].生物技术通讯,2014,25(5):700-704.
[4] Pattanaik D,Brown M,Poselethwaite AE.Vascular involvement in systemic sclerosis (scleroderma) [J].Inflammation Res,2011,4:105-125.
[5] Tyndall A,Matucci-Cerinic M,Müller-Ladner U.Future targets in the management of systemic sclerosis [J].Rheumatology(Oxford),2009,48(3):49-53.
[6] Swati B,Jun W,Warren G,etal.Fibrosis in systemic sclerosis: common and unique pathobiology[J].Fibrogenesis Tissue Repair,2012,5(1):18.
[7] Whitfield ML,Finlay DR,Murray JI,etal.Systemic and cell type-specific gene expression patterns in scleroderma skin[J].Proc Natl Acad Sci USA,2003,100(21):12319-12324.
[8] Codullo V, Baldwin HM,Singh MD,etal.An investigation of the inflammatory cytokine and chemokine network in systemic sclerosis[J].Ann Rheuma Dis,2011,70(6):1115-1121.
[9] Mariagrazia U,Massimo D′,Marcel L,etal.Marco baggiolini actions of the chemotactic cytokines MCP-1,MCP-2,MCP-3,RANTES,MIP-1α and MIP-1β on human monocytes[J].Eur J Immunol,1995,25(1):64-68.
[10] Yamamoto T,Takagawa S,Katayama I,etal.Animal model of sclerotic skin.I.Local injections of bleomycin induce sclerotic skin mimicking scleroderma[J].J Invest Dermatol,1999,112(4):456-462.
[收稿2016-01-25 修回2016-04-22]
(编辑 许四平)
Evaluation of influence of Wenyang Huoxue Tongluo medicine on expression of TGF-β1 and MCP-1 in mice with bleomycin-induced scleroderma
TAN Li-Ping,YOU Jia-Rui,XIANG Fang-Hua,CHEN An-Ping,XIA Yan,FENG Jia,CAI Jie,YUAN Lin,SU Lin-Chong,HUANG Qin,XIANG Yan.
Provincial Key Laboratory of Occurrence and Intervention of Rheumatic Diseases of Huibei University for Nationalities,Enshi 445000,China
Objective:To observe the influence of Wenyang Huoxue Tongluo(WHT) medicine in mice with bleomycin-induced scleroderma(BIS) of TGF-β 1 and MCP-1 levels.Methods: Bleomycin was injected into the subcutaneous tissue of mice to establish BIS models.The BIS mice were fed with WHT,prednisone,WHT plus prednisone or saline only as control for 28 days.The pathological changes in the skin and lung tissue of mice were evaluated with HE staining and Masson staining.The level of TGF-β1 and MCP-1 in serum was detected with ELISA,as well as which in the skin tissue was detected with immunohistochemistry.Results: ①The location and amount of TGF- β1and MCP-1 in skin and lung tissue were different in BIS mice.Expression of TGF-β1 and MCP-1 in BIC mice skin tissue were significantly decreased in WHT or WHT+prednisone treated groups compared to no-treated ones (P<0.05,respectively),especially in WHT+prednisone one.②In serum of BIS mice,TGF-β1 and MCP-1 increased significantly than in normal control (P<0.01).And after treated with WHT or WHT+prednisone,the level of TGF-β1 and MCP-1 were significantly decreased (P<0.05) compared with no-treated one,especially in WHT+prednisone one.Conclusion: WHT can improve the pathological changes in skin and pulmonary tissue of BIS mice,which might partially result from that WHT down-regulate TGF-β1 and MCP-1 in serum and skin tissue from BIS mice.
Bleomycin-incuced scleroderma;Wenyang Huoxue Tongluo medicine(WHT); Transforming growth factor-β1; Monocyte chemoattractant protein-1
10.3969/j.issn.1000-484X.2016.11.012
①本文为国家自然科学基金项目(81260458)和湖北省科技厅项目(2012FFA061)。
谭利平(1986年-),女,硕士,医师,主要从事风湿免疫学方面研究。
及指导教师:向 阳(1961年-),男,博士,教授,主任医师,院长,硕士生导师,主要从事临床、教学、科研等方面工作。
R259
A
1000-484X(2016)11-1621-06
②恩施土家族苗族自治州中心医院,恩施 445000。
③荆门市第二人民医院,荆门 448000。
④湖北民族学院附属民大医院,恩施 445000。
⑤武汉市武昌医院,武汉 430063。

