土贝母皂苷抑制对苯二胺诱发豚鼠接触性皮炎效应的研究①
于立坚 张永平 马润娣 于廷曦
(佛山德溥生物医药科技有限公司产品研发部,佛山528231)
土贝母皂苷抑制对苯二胺诱发豚鼠接触性皮炎效应的研究①
于立坚 张永平②马润娣 于廷曦③
(佛山德溥生物医药科技有限公司产品研发部,佛山528231)
目的:研究土贝母皂苷(Tubeimosides,TBMSs,简称皂苷)抑制对苯二胺诱发的豚鼠接触性皮炎的效应。方法:从土贝母块茎中提取分离出有效部位土贝母皂苷。实验所用皂苷的主要成分是土贝母苷甲和苷乙(简称苷甲、苷乙),以及微量土贝母苷丙(简称苷丙),其标志性成分苷甲的含量≥90%。采用异体和同体两种对照的局部涂皮封闭实验(Buehler test),研究皂苷对对苯二胺(p-phenylenediamine,PPDA)诱发豚鼠接触性皮炎的效应的影响。结果:异体和同体对照实验结果表明,皂苷提前或与PPDA混合应用,均可剂量依赖性地改善,甚至完全抑制PPDA诱发豚鼠接触性皮炎。一分子的土贝母皂苷能抑制或完全逆转6到12分子对苯二胺诱发的豚鼠接触性皮炎。结论:土贝母皂苷有显著抑制对苯二胺诱发豚鼠接触性皮炎的活性。
土贝母皂苷;对苯二胺;接触性皮炎;豚鼠
对苯二胺是多种染料的中间体。它既是染发剂中的有效成分,也是对人体健康具有潜在危害(包括致敏、致癌和损伤肝肾)的物质,暴露到它可引起接触性过敏、急性皮炎、面部水肿[1]。流行病学研究指出,普通人群样本中5.3 %的个体在染发后出现不同程度的皮肤反应[2]。
1939年确定对苯二胺为强过敏原,并被选入北美、欧洲和T.R.U.E斑贴试验的标准抗原组。对苯二胺是一个众所周知的染发剂中引起皮炎的最常见抗原,同时也被认为是测试染发剂皮炎的最佳抗原。局部涂皮封闭实验(Buehler test)是一个有价值的、行之有效的筛选过敏原的实验程序[3,4]。借之用来筛选抗过敏物质应该是顺理成章的事。局部涂皮封闭实验表明,随着对苯二胺浓度的升高,皮肤反应程度也增强。对苯二胺浓度为1 mg/ml时,皮肤反应强度较低,2.5 mg/ml时明显升高,5~20 mg/ml范围的反应强度基本一致[5]。
近年来染发人群暴增,其诱发的皮炎数量也显著增加。尽管对苯二胺皮炎在临床上多见,但目前还没有可以完全替代它的相对安全又有效的原料成分,因此寻找、筛选、研发出既不影响对苯二胺的染发效果,又能对抗对苯二胺引起接触性皮炎的原料成分具有重要意义。
土贝母[Bolbostemma paniculatum(Maxim.)Franquet (Cucurbitaceae)]是一种传统中药,载于清代赵学敏所编《本草纲目拾遗》,药用部分为其鳞茎。在古代用它来治疗乳岩、乳痈、乳腺增生和瘰疬等各种疾患,临床上显示出明显的散结毒、消痈肿等效果[6]。土贝母皂苷是从土贝母块茎中提取分离出的有效部位[7]。我们以前的研究已经证实,苷甲具有抗炎[8]、抗促癌[8,9]和抗肿瘤作用[10-12],本文则报告皂苷具有抑制对苯二胺诱发的豚鼠接触性皮炎的效应。
1 材料与方法
1.1 材料
1.1.1 动物 Hartley豚鼠,普通级,体重250~350 g,雌雄各半,购自长沙市开福区东创实验动物科技服务部,湖南省实验动物质量合格证号:SCXK(湘)2009-0012,使用实验动物质量合格证明编号:No.HNACSDC20100993和No.HNACSDC20101132。SPF级标准动物实验室(20~24℃,40%~60%饱和湿度)喂养及实验,广东省动物实验使用许可证号:SYXK(粤)2009-0053。实验前观察2周。动物的饲养和使用遵照中华人民共和国科学技术部2006年9月30日颁布的指导原则进行。
1.1.2 试剂 PPDA,AMRESCD产品,纯度>98%。40℃水浴加热溶解,配制成10、20 mg/ml对苯二胺水溶液。
1.1.3 药物 以土贝母的干燥块茎粉剂为原料,用热水回流提取,过大孔吸附树脂柱,得到土贝母总皂苷。再用有机溶剂沉淀、重结晶,得土贝母皂苷。本实验所用的土贝母皂苷的主要成分是苷甲和苷乙,以及微量苷丙,其标志性成分苷甲的含量≥90%(HPLC检测结果)。以去离子水配制成1、2、5、10、20 mg/ml皂苷水溶液。
1.2 方法
1.2.1 实验程序 按照国家药品注册技术指导原则的相关规定,参考Ritz和Buehler改进的实验方法[13,14],制定标准作业程序。
1.2.2 异体对照 动物分组:取检疫合格、雌雄各半的豚鼠56只,按照性别体重采用区段随机方法分为溶剂对照组、皂苷对照组、PPDA组、皂苷(4个浓度)+PPDA组共7组,每组8只动物。
局部涂皮封闭实验:实验前一天用宠物理发剪对豚鼠背部脊柱中线两侧进行脱毛处理。脱毛区不少于3 cm×3 cm。溶剂对照组:脱毛区皮肤涂抹去离子水100 μl;皂苷对照组:脱毛区皮肤涂抹20 mg/ml的皂苷水溶液100 μl;PPDA组:脱毛区皮肤涂抹10 mg/ml PPDA 水溶液100 μl;皂苷+PPDA 组:将不同浓度皂苷(1、5、10、20 mg/ml)的水溶液各100 μl分别涂抹在各组豚鼠背部脱毛区的皮肤上,30 min后再分别涂抹10 mg/ml PPDA 的水溶液100 μl。在第0天、第7天、第14天、第21天、第28天,各组分别按上述方式涂抹皮肤一次,每次涂抹之后以二层纱布和一层玻璃纸覆盖,再用无刺激性胶布封包固定。24 h 后用温水清洗皮肤,之后2 h、24 h、48 h观察并记录豚鼠局部皮肤反应(红斑、水肿、焦痂、水泡或破溃),同时密切观察动物是否有哮喘、站立不稳或休克等严重的全身性过敏反应。
1.2.3 同体对照 动物分组:取检疫合格、雌雄各半的豚鼠48只,按照性别体重采用区段随机方法分为溶剂对照组、皂苷对照组、PPDA组、PPDA+皂苷(3个不同浓度)混合组共6组,每组8只豚鼠。局部涂皮封闭实验:溶剂对照组:豚鼠背部脊柱中线两侧脱毛区各涂抹蒸馏水100 μl;皂苷对照组:豚鼠背部脊柱中线左侧脱毛区涂抹蒸馏水100 μl,右侧涂抹皂苷水溶液(10 mg/ml)100 μl;PPDA组:左侧涂抹蒸馏水100 μl,右侧涂抹PPDA水溶液(10 mg/ml)100 μl;PPDA+皂苷(1 mg/ml)混合组:左侧涂抹PPDA水溶液(10 mg/ml)100 μl;右侧涂抹PPDA(20 mg/ml)50 μl+皂苷(2 mg/ml)50 μl的混合液;PPDA+皂苷(5 mg/ml)混合组:左侧涂抹PPDA水溶液(10 mg/ml)100 μl;右侧涂抹PPDA(20 mg/ml)50 μl+皂苷(10 mg/ml)50 μl的混合液;PPDA+皂苷(10 mg/ml)混合组:左侧涂抹PPDA水溶液(10 mg/ml)100 μl;右侧涂抹PPDA(20 mg/ml)50 μl+皂苷(20 mg/ml)50 μl的混合液。在第0天、第7天、第14天、第21天、第28天,各组分别按上述方式涂抹皮肤一次,每次涂抹之后以二层纱布和一层玻璃纸覆盖,再用无刺激性胶布封包固定。其余实验操作及观察、记录同上。
1.2.4 皮肤反应评判标准 红斑:0分=无红斑;1分=轻度红斑,勉强可见;2分=中度红斑,明显可见;3分=重度红斑;4分=紫红色红斑至轻度焦痂形成。水肿:0分=无水肿;1分=轻度水肿,勉强可见;2分=中度水肿(边缘高出周围皮肤);3分=重度水肿(皮肤隆起1 mm,轮廓清楚);4分=严重水肿(皮肤隆起超过1 mm或有水泡或有破溃)。最高总分为8分,≥2分为反应阳性。实验由同一人员操作、观察、检查皮肤反应并做出评判。
1.3 统计学方法 统计所用软件为SPSS11.0。计数资料以构成比表示,用χ2检验。P<0.05表示差别有统计学意义,P<0.01表示差别有非常显著的意义。
2 结果
2.1 豚鼠接触性皮炎分级 豚鼠背部脱毛区的皮肤涂抹PPDA后出现红斑、水肿等反应,按其轻重程度分为0~4级(图1)。
2.2 异体对照实验结果 溶剂和皂苷对照组在整个实验期间未发现任何豚鼠有皮肤或全身性反应,动物得分皆为0(图2A、B)。PPDA组从第3周起少部分豚鼠(2/8)涂抹部位皮肤开始出现如红斑、水肿等阳性反应,第4周(7/8)、5周(8/8)大部或全部动物皮肤出现阳性反应,严重者出现紫红色红斑、重度水肿,乃至起泡、溃烂,皮毛稀疏甚至不长,第5周皮肤反应得3~6分(图2C)。皂苷(1 mg/ml) +PPDA组的部分动物在第3周(2/8)、第4周(4/8)、第5周(4/8)皮肤出现阳性反应,得2~4分(图2D),发生阳性皮肤反应的豚鼠数较PPDA组少,反应程度也较轻。皂苷(5 mg/ml)+PPDA组的部分豚鼠在第4周(2/8)、第5周(3/8)皮肤出现阳性反应,得2~3分(图2E),发生阳性皮肤反应的动物数较皂苷(1 mg/ml)+PPDA组少,反应程度也较轻。皂苷(10 mg/ml)+PPDA组在第5周仅个别豚鼠(1/8)出现轻度的红斑和极轻度的水肿,得2.0分(图2F)。皂苷(20 mg/ml)+PPDA组在整个实验期间未发现任何豚鼠有皮肤或全身性反应,动物得分皆为0(图2G)。结果显示,皂苷的提前应用可剂量依赖性地缓解、改善,甚至完全抑制对苯二胺诱发的豚鼠接触性皮炎(表1,图2)。皂苷本身不仅对皮肤无不良影响,而且在一定程度上有使皮肤光滑润泽,促进皮毛生长的作用。

图1 对苯二胺诱发的豚鼠接触性皮炎分级Fig.1 Grading of p-phenylenediamine-induced contact dermatitis in guinea pigsNote: A.No erythema and edema;B1,B2.Mild erythema and/or edema;C1,C2.Moderate erythema and/or edema;D1,D2.Severe erythema and/or edema;E1,E2.Very severe erythema and/or edema.
2.3 同体对照实验结果 溶剂和皂苷对照组在整个实验期间未发现任何豚鼠有皮肤或全身性过敏反应,动物得分皆为0。其余各组第5周动物皮肤反应如下。PPDA组:左侧(涂水)半数动物(4/8)皮肤反应阳性,动物皆得2分,右侧(涂PPDA)绝大部分动物(7/8)皮肤反应阳性,得3~3.5分;可见,PPDA不仅引起直接接触皮肤的反应,还引起邻近皮肤(未直接接触)的反应。PPDA+皂苷(1 mg/ml)混合组:左右两侧均有半数动物(4/8)皮肤反应阳性(得分:左为2.5~3,右为2.0~2.5);PPDA+皂苷(5 mg/ml)混合组:部分动物(左4/8,右3/8)皮肤反应阳性(得分:左为2.0~2.5,右均为2.0);PPDA+皂苷(10 mg/ml)混合组:仅个别动物(左1/8,右1/8)皮肤反应阳性(皆得2分)(表2)。结果表明,皂苷与对苯二胺混合后应用可剂量依赖性地缓解、改善,甚至显著抑制对苯二胺诱发的豚鼠接触性皮炎。值得注意的是,皂苷还能抑制相邻部位同时应用的对苯二胺诱发豚鼠接触性皮炎。
表1 土贝母皂苷对对苯二胺诱发豚鼠接触性皮炎的抑制效应(异体对照)
Tab.1 Inhibitory effect of tubeimosides on delayed contact hypersensitivity induced by p-phenylenediamine in guinea pigs (heterogeneous contrast)
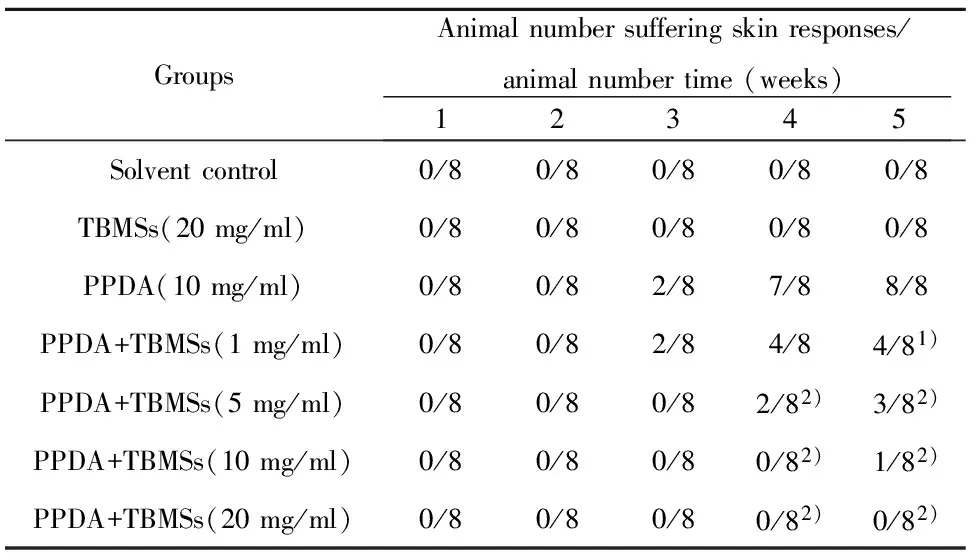
GroupsAnimalnumbersufferingskinresponses/animalnumbertime(weeks)12345Solventcontrol0/80/80/80/80/8TBMSs(20mg/ml)0/80/80/80/80/8PPDA(10mg/ml)0/80/82/87/88/8PPDA+TBMSs(1mg/ml)0/80/82/84/84/81)PPDA+TBMSs(5mg/ml)0/80/80/82/82)3/82)PPDA+TBMSs(10mg/ml)0/80/80/80/82)1/82)PPDA+TBMSs(20mg/ml)0/80/80/80/82)0/82)
Note:Compared with PPDA group,1)P<0.05,2)P<0.01;Solvent control group vs TBMSs control group,P>0.05;Solvent control group vs PPDA group,P<0.01.

图2 土贝母皂苷对对苯二胺诱发豚鼠接触性皮炎的抑制效应(异体对照)Fig.2 Inhibitory effect of tubeimosides on delayed contact hypersensitivity induced by p-phenylenediamine in guinea pigs (heterogeneous contrast)Note: Representative photographs (the fifth week):A.Control;B.TBMSs control (20 mg/ml);C.PPDA (10 mg/ml);D.PPDA+TBMSs (1 mg/ml);E.PPDA+TBMSs (5 mg/ml);F.PPDA+TBMSs (10 mg/ml);G.PPDA+TBMSs (20 mg/ml).
对苯二胺的结构式如图3,分子量是108.14。对苯二胺分子中有苯环、氨基,因此具有这两种官能团的性质。土贝母皂苷主要由土贝母苷甲、苷乙和微量苷丙组成,具有独特的五环三萜类化学结构,酸水解后释放出皂苷元贝咢苷元和四种糖:葡萄糖、鼠李糖、木糖和阿拉伯糖[15,16]。苷甲、苷乙和苷丙为天然结构类似物(图4)。苷乙与苷甲化学结构的唯一区别是:苷乙A(16)位碳连-OH,而苷甲A(16)位碳连-H。苷丙的化学结构与苷甲的区别是:苷丙A位碳连-OH,苷甲A位碳连-H;苷丙B位碳连-OH,苷甲B位碳连-O;苷丙C位碳连-CH2O,苷甲C位碳连-H。苷甲、苷乙和苷丙的相对分子量相当接近,分别为1 318、1 334 和1 364,分子式分别为C63H98-O29、C63H98O30和C64H100O31[17]。
表2 土贝母皂苷对对苯二胺诱发豚鼠接触性皮炎的抑制效应(同体对照)
Tab.2 Inhibitory effect of tubeimosides on delayed contact hypersensitivity induced by p-phenylenediamine in guinea pigs (autogenous contrast)
Note:The experimental result of the fifth week,compared with PPDA group,1)P<0.05,2)P<0.01;Solvent control group vs TBMSs control group,P>0.05;Solvent control group vs PPDA group,P<0.05(left),P<0.01(right).
本文实验中所用土贝母皂苷中苷甲含量≥90%,故以苷甲的分子量1 318参与下式的计算。1 318÷108.14=12.19;计算结果提示,土贝母苷甲分子量是对苯二胺的12.19倍。
本文异体对照实验中皂苷(10 mg/ml)+PPDA(10 mg/ml)组的实验结果显示,仅在第5周个别动物(1/8)出现轻度的红斑和极轻度的水肿。可见,一分子的土贝母皂苷可抑制或逆转大约12 分子对苯二胺诱发的豚鼠迟发型超敏反应。皂苷(20 mg/ml)+PPDA(10 mg/ml)组的实验结果显示,在整个实验期间未发现任何豚鼠有皮肤或全身性反应。可见,一分子的土贝母皂苷能完全抑制或逆转6分子对苯二胺诱发的豚鼠迟发型超敏反应。

图3 对苯二胺的化学结构Fig.3 Chemical structure of p-phenylenediamine

图4 土贝母苷甲、苷乙、苷丙的化学结构Fig.4 Chemical structure of tubeimoside Ⅰ,tubeimoside Ⅱ and tubeimoside Ⅲ
综合起来可以得出,一分子的土贝母皂苷能抑制甚至完全逆转6到12分子对苯二胺诱发的豚鼠迟发型超敏反应。
3 讨论
对苯二胺是一种有机化合物,其分子式为C6H8N2。它本来是一种白色固体,但空气氧化能使之变黑。它对毛发中的角蛋白有极强的亲和力,其氧化过程就是染发时颜色的固着过程。因此,它是染发剂的共同成分。
对苯二胺引起的迟发型超敏反应又名Ⅳ型超敏(变态)反应。Ⅳ型超敏反应是抗原诱导的一种细胞性免疫应答,包括典型的由CD4+T细胞介导的迟发型超敏反应和由CD8+T细胞介导的直接细胞毒作用。致敏性T细胞介导的免疫反应导致组织与细胞损伤。此型超敏反应发生较慢,通常在接触相同抗原后24~72 h出现炎症反应,因此又称迟发型超敏反应。此型超敏反应的发生与抗体和补体无关,而与效应T细胞和吞噬细胞及其产生的细胞因子或细胞毒性介质有关。临床常见的有感染性迟发型超敏反应、化学物质(如对苯二胺)接触性和移植排斥迟发型超敏反应等。Aeby等[18]研究了对苯二胺引起的迟发型超敏反应。皮肤是对芳香胺染发染料的前体(如对苯二胺)产生变态反应的靶器官。Aeby 等分析了对苯二胺的氧化和N-乙烯化衍生物的致敏潜能。从实验结果得出的结论是:对苯二胺的N-乙烯化和氧化作用互相竞争,而暴露在空气中的皮肤给对苯二胺的自身氧化作用提供了条件,正是对苯二胺的氧化产物提供的危险信号,有效地刺激了免疫系统,引起变态反应。
Svalgaard 等[19]研究了对苯二胺的系统免疫效应。对苯二胺是一种强半抗原,这种半抗原引起迟发型超敏反应,包括细胞因子反应和T细胞亚群的局部浸润,结果导致接触性皮炎。同体对照实验的结果表明,对苯二胺局部涂抹不仅能引起直接接触的皮肤的反应,还可引起邻近皮肤(未直接接触)的反应。皂苷与对苯二胺混合应用可剂量依赖性地缓解、改善,甚至显著抑制对苯二胺诱发的豚鼠接触性皮炎。值得注意的是,皂苷还能抑制相邻(但未直接接触)部位同时应用对苯二胺诱发的豚鼠接触性皮炎。
花生四烯酸(Arachidonic acid,AA)是二十碳不饱和脂肪酸,经环加氧酶和脂质加氧酶途径代谢,生成各种产物。AA代谢释放的代谢产物,导致发热、疼痛、血管扩张、通透性升高及白细胞渗出等炎症反应。而抗炎药物如阿司匹林、消炎痛和类固醇激素则能抑制花生四烯酸代谢,减轻炎症反应。AA诱发的鼠耳炎性水肿已经被用作筛选脂氧合酶抑制剂的模型[20]。12-O-14-烷酰佛波醇-13-乙酸酯(12-O-tetradecanoylphorbol-13-acetate,TPA)系十四烷酸和佛波醇形成的酯,它能诱发炎性水肿,并因能激活导致细胞增殖或分化的信号通路而具有促进细胞癌变的作用,是一种活性很高的皮肤黏膜促癌剂[21]。TPA诱发的鼠耳炎性水肿已经被用作检测非类固醇和类固醇制剂抗炎活性的经典试验[22]。此外,脂氧合酶抑制剂和脂氧合酶/环加氧酶双重抑制剂也抑制TPA诱发的鼠耳炎性水肿[23]。
我们以前的研究已经证实,土贝母皂苷的标志性成分土贝母苷甲对AA和TPA诱发的鼠耳炎性水肿具有显著的抑制作用[8,9]。近期我们的研究又发现,土贝母皂苷,无论是在花生四烯酸或12-O-十四烷酰佛波醇-13-乙酯之前还是之后应用,都能显著抑制它们诱发的鼠耳炎性水肿,其效果还表现出明显的量效依赖关系(结果另文发表)。土贝母皂苷的抗炎效果可能在土贝母皂苷抑制对苯二胺诱发豚鼠接触性皮炎的过程中起到一定作用,但绝不是其作用机制的启动环节。对于土贝母皂苷抑制对苯二胺诱发豚鼠接触性皮炎的细胞和分子生物学机制的阐明,有待于用免疫学的方法深入研究土贝母皂苷和对苯二胺对T淋巴细胞及其细胞因子,以及巨噬细胞的影响。
作为半抗原的对苯二胺诱发迟发型超敏反应的机制学术界尚未完全阐明,今次发现的土贝母皂苷有抑制或逆转对苯二胺诱发豚鼠迟发型超敏反应(Ⅳ型超敏反应)显著效果的实验事实,或许能为探究迟发型超敏反应和抗迟发型超敏反应的细胞和分子生物学机制提供新的思路。
土贝母皂苷不影响对苯二胺的染发效果[24],现在又发现它对对苯二胺诱发的豚鼠迟发型超敏反应具有显著的抑制作用,之前我们还证实土贝母皂苷对实验兔皮肤无明显刺激性,对豚鼠不引起主动皮肤过敏反应(以2,4-二硝基氯苯诱导的接触性皮炎做阳性对照)[25],所以土贝母皂苷及其标志性成分土贝母苷甲的开发应用前景值得期待。
[1] Thyssen JP,White JML. European Society of Contact Dermatitis.Epidemiological data on consumer allergy to p-phenylenediamine[J].Contact Dermatitis,2008,59(6):327-343.
[2] Sφsted H,Hesse U,Menné T,etal.Contact dermatitis to hair dyes in an adult Danish population:an interview-based study[J].Br J Dermatol,2005,153(1):132-135.
[3] Marks JG,Belsito DV,DeLeo VA,etal.North American Contact Dermatitis Group patch test results for the detection of delayed-type hypersensitivity to topical allergens[J].J Am Acad Dermatol,1998,38(6):911-918.
[4] Robinson MK,Nusair TL,Fletcher ER,etal.A review of the Buehler guinea pig skin sensitization test and its use in a risk assessment process for human skin sensitization[J].Toxicology,1990,61(2):91-107.
[5] 陈继莺,王学民,周玉田,等.对苯二胺皮肤接触致敏的剂量反应关系[J].毒理学杂志,2007,21(5):417-419.
[6] 赵学敏.本草纲目拾遗 [M].北京:人民卫生出版社,1983(木刻板重印):123-127.
[7] 王永清,于立坚,朱娟莉,等.土贝母结晶D 的抗肿瘤作用[J].陕西新医药,1981,10(1):55-56.
[8] Ma RD,Yu LJ,Wang YQ,etal.Potent inhibitory effects of tubeimoside 1 isolated from the bulb of Bolbostemma paniculatum (Maxim) franquet on inflammatory ear oedema and tumor promotion in mice[J].Chin Sci Bull,1991,7(7):602-606.
[9] Yu LJ,Ma RD,Wang YQ,etal.Potent anti-tumorigenic effect of tubeimoside 1 isolated from the bulb of Bolbostemma paniculatum (Maxim) Franquet[J].Int J Cancer,1992,50(4):635-638.
[10] Yu LJ,Ma RD,Wang YQ,etal.Potent anti-tumor activity and low toxicity of tubeimoside I isolatted from Bolbostemma paniculatum[J].Planta Med,1994,60(3):204-208.
[11] Wang F.Ma RD.Yu LJ.Role of mitochondria and mitochondrial cytochrome c in tubeimoside I-mediated apoptosis of human cervical carcinoma HeLa cell line[J].Cancer Chemother Pharmacol,2006,57(3):389-399.
[12] Ma RD,Song G,You W,etal.Anti-microtubule activity of tubeimoside 1 and its colchicine binding site of tubulin[J].Cancer Chemother Pharmacol, 2008,62(4):559-568.
[13] Buhler EV.Delayed contact hypersensitivity in the guinea pig[J].Arch Dermatol, 1965,91(2):171-177.
[14] Ritz HL,Buehler EV.Planning,conduct and interpretation of guinea pig sensitization patch tests in Current Concepts in Cutaneous Toxicity[M].NY:Academic Press,1980:25.
[15] Kong F,Zhu D,Xu R,etal.Structural study of tubeimoside I,a constituent of tu-bei-mo[J].Tetrahedron Lett,1986,27(47):5765-5768.
[16] Kaisai R,Miyakoshi M,Nie RL,etal.Saponins from Bolbostemma paniculatum:cyclic bisdesmosides,tubeimosides II,III[J].Phytochemistry,1988,27(27):1439-1446.
[17] Yu TX,Ma RD,Yu LJ.Structure-activity relationship of tubeimosides in anti-inflammatory,antitumor,and antitumor-promoting effects[J].Acta Pharmacol Sin,2001,22(5):463-468.
[18] Aeby P,Sieber T,Beck H,etal.Skin sensitization to p-phenylenediamine:the diverging roles of oxidation and n-acetylation for dendritic cell activation and the immune response[J].J Invest Dermatol,2009,129(1):99-109.
[19] Svalgaard JD,Srmark C,Dall M,etal.Systemic immunogenicity of para-phenylenediamine and Diphenylcyclopropenone:two potent contact allergy-inducing haptens[J].Immunologic Reseach,2014,58(1):40-50.
[20] Carlson RP,O′neill-Davis L,Chang J,etal.Modulation of mouse ear edema by cyclooxygenase and lipoxygenase inhibitors and other pharmacologic agents[J]. Agents & Actions,1985,17(2):197-204.
[21] Yu LJ,Nishino H,Iwashima A.Stimulation of choline transport in cultured cells induced by 12-O-teradecanoylphorbol-13-acetate:one of the earliest phenomena induced by the tumor promoter[J].Oncology,1988,45(4):326-330.
[22] Bird J,Kim HP,Lee HJ.Topical anti-inflammatory activity of esters of steroid 21-oic acid[J].Steroids,1986,47(1):35-40.
[23] Young JM,Wagner R BM,Spires DA.Tachyphylaxis in 12-O-tetradecanoylphorbol acetate-and arachidonic acid-induced ear edema[J].J Invest Dermatol,1983,80(1),48-52.
[24] 于立坚,马润娣,于廷曦.化妆品新原料土贝母总皂苷[P].中国专利,201510308579.2.
[25] 于立坚,马润娣,于廷曦.化妆品新原料土贝母总皂苷用于消除臭汗症的用途[P]中国专利,201510308559.5.
[收稿2016-03-17 修回2016-05-03]
(编辑 倪 鹏)
Studies on inhibitory effect of tubeimosides on delayed contact hypersensitivity induced by p-phenylenediamine in guinea pigs
YU Li-Jian,ZHANG Yong-Ping,MA Run-Di,YU Ting-Xi.
Department of Product Research and Development,Foshan Depu Biomedical Technology Co.,Ltd.,Foshan 528231,China
Objective:To study the inhibitory effect of tubeimosides on the delayed contact hypersensitivity induced by p-phenylenediamine in guinea pigs.Methods: Tubeimosides(TBMSs) was the effective fraction extracted and isolated from the tubers of Bolbostemma paniculatum.The main ingredients of TBMSs used in the experiments were tubeimoside Ⅰ,tubeimoside Ⅱ and a trace of tubeimoside Ⅲ,wherein the content of tubeimoside Ⅰ was equal to or greater than 90%.The closed or occlusive patch tests(Buehler test)of heterogeneous and autogenous contrast on guinea pigs were utilized to this investigation.Results: TBMSs could significantly improve,or even completely suppressed p-phenylenediamine (PPDA)-induced contact dermatitis in guinea pigs in a dose-dependent manner,and that 1 molecule of TBMSs could inhibit or completely reverse the delayed contact hypersensitivity induced by approximately 6 to 12 molecules of PPDA.Conclusion: TBMSs have obvious activity against the delayed contact hypersensitivity induced by PPDA in guinea pigs.
Tubeimosides;p-phenylenediamine;Delayed contact hypersensitivity;Guinea pigs
10.3969/j.issn.1000-484X.2016.11.013
①本文受佛山市科技创新专项资金(2013AA100332)资助。
于立坚(1942年-),男,研究员,主要从事中药药理与毒理方面研究,E-mail:yulj2013@163.com。
R392.8
A
1000-484X(2016)11-1626-06
②广东海洋大学,海洋药物研究与开发重点实验室,湛江 524025。
③通讯作者,上海交通大学新华医院,上海市儿科医学研究所,上海200092,E-mail:yutingxi@yahoo.com。

