结核分枝杆菌Esx-1底物蛋白Rv3615c的原核表达及其免疫功能研究①
许礼发 王晓春 王 健 张荣波
(安徽理工大学医学院病原生物学与免疫学教研室,淮南232001)
·免疫学技术与方法·
结核分枝杆菌Esx-1底物蛋白Rv3615c的原核表达及其免疫功能研究①
许礼发 王晓春 王 健 张荣波
(安徽理工大学医学院病原生物学与免疫学教研室,淮南232001)
目的:构建结核分枝杆菌(M.tb)Esx-1底物蛋白Rv3615c的原核表达质粒pET30b-Rv3615c并在大肠杆菌BL21(DE3)中进行原核表达;以全血IFN-γ分析试验(WBIA)检测rRv3615c蛋白能否被淮南市M.tb感染者T细胞所识别;在小鼠模型中检测其免疫原性。方法:以分子克隆技术构建重组载体pET30b-Rv3615c并表达、纯化rRv3615c蛋白,以WBIA检测rRv3615c抗原刺激淮南市M.tb感染者和未感染者外周血淋巴细胞产生的特异性IFN-γ水平。此外联合佐剂SAS免疫C57BL/6小鼠,评价其体液免疫应答和Th1型应答水平。结果:成功构建pET30b-Rv3615c质粒,SDS-PAGE和Western blot显示其正确表达和纯化。rRv3615c蛋白特异性刺激淮南市M.tb感染者淋巴细胞产生的IFN-γ浓度显著高于健康对照者。Rv3615c/SAS诱导小鼠产生的IgG、IgG1、IgG2a以及Rv3615c1SAS诱导小鼠脾淋巴细胞分泌的特异性IFN-γ、TNF-α和IL-2,均显著高于PBS组和SAS组,显示rRv3615c可诱导趋向于Th1型免疫应答。结论:Rv3615c可被淮南市M.tb感染者T细胞识别,具有较强的免疫原性,是用于结核病(TB)预防和诊断的潜力靶抗原。
Rv3615c;原核表达;免疫功能;全血IFN-γ分析试验;结核分枝杆菌
卡介苗(Bacille calmette-Guerin,BCG)作为当前全球范围内唯一广泛应用于结核病(Tuberculosis,TB)预防的减毒活疫苗,尽管对婴幼儿TB(尤其是结核性脑膜炎和粟粒性TB)预防效果较好,但却受制于免疫保护期较短、对成人TB保护性不够理想的缺陷[1,2]。因此,筛选具有高度免疫原性的、能够被活动性TB(Active TB,ATB)患者和潜伏感染者(Latent TB infection,LTBI)T细胞所识别的结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)靶抗原,并应用于TB临床诊断和疫苗研制一直是TB研究热点[3]。靶抗原诱导Th1型免疫应答水平(尤其是抗原特异性IFN-γ水平)被公认为与抗TB保护性密切相关[4],而能否诱导效应性和记忆性CD4+和CD8+T细胞产生强烈的IFN-γ和IFN-γ/IL-2多功能应答效应,则是评价候选疫苗免疫原性的重要依据[5]。
M.tb生长早中期分泌到胞外的一类蛋白质称为分泌性蛋白,具有高度免疫原性和特异性,常作为新型TB诊断和预防研究的重要靶抗原。对分泌性蛋白研究较深入的是6 kD早期分泌抗原(ESAT-6)和早期滤液蛋白-10(CFP-10),其编码基因位于RD1基因区中;二者均隶属于Esx-1分泌系统,被公认为免疫原性较强的M.tb靶抗原[6]。ESAT-6/CFP-10能诱发特异性Th1应答,与细菌的毒力密切相关,可提供抗M.tb感染的保护性。如ESAT-6参与构建融合蛋白亚单位疫苗Hybrid 1(Ag85B-ESAT-6)和H56(Ag85B-ESAT-6-Rv2660c),在小鼠和灵长类动物TB模型中显示了持久而稳定的抗感染保持性,同时已进入临床Ⅱ期试验[7,8]。此外CFP-10被认为是M.tb感染者T细胞识别诊断实验的基础,而基于ESAT-6/CFP-10建立的两种商业化的检测技术T-SPOT和QuantiFERON-Gold已在临床上广泛应用,其基本原理是通过IFN-γ释放试验(IFN-γ release assays,IGRAs) 对M.tb感染者进行有效诊断,且不受BCG预防接种的影响[9]。尽管IGRAs可用于各年龄段和高危人群中M.tb感染者的特异性筛查,但因抗原组成成分较少而使其诊断的灵敏性受限。有鉴于此,Esx-1家族蛋白作为研究M.tb感染诊断和防控的靶抗原备受关注。
Esx-1底物蛋白Rv3615c是含有103个氨基酸的ESAT-6样蛋白,分子量与ESAT-6、CFP-10相近(仅为10.1 kD),其N-末端的20个氨基酸在ESAT-6家族成员中相对保守,BLAST比对显示其序列与ESAT-6、CFP-10高度相似[10]。体外转录反应研究显示Rv3615c在低pH值和低铁条件下转录水平上调,提示M.tb体内感染时Rv3615c可在巨噬细胞的吞噬体内活跃表达[11]。因此,我们假设Rv3615c可被淮南市M.tb感染者(包括LTBI)T细胞特异性识别,从而构建其原核表达载体并进行表达,同时以WBIA检测其特异性刺激淮南市M.tb感染者外周血淋巴细胞分泌IFN-γ水平;然后在小鼠模型中验证其抗原特异性细胞免疫和体液免疫反应水平,为研究Rv3615c是否可作为候选靶抗原应用于TB诊断及疫苗研究提供相关依据。
1 材料与方法
1.1 实验材料、动物及分组M.tb标准毒株H37Rv由安徽省淮南市疾控中心提供,E.coliDH5α、BL21(DE3)菌株和抗His鼠单抗购自北京天根生物公司;Ni-NTA蛋白纯化系统、内毒素去除试剂盒和BCA蛋白定量试剂盒购自Invitrogen公司;人IFN-γ、鼠细胞因子(IFN-γ、TNF-α、IL-2)ELISA检测试剂盒购自武汉博士德生物公司;IgG、IgG1、IgG2a兔抗鼠二抗和SAS佐剂系统购自Sigma公司;实验动物为6周龄SPF级雌性C57BL/6小鼠(购自安徽医科大学动物实验中心),分为PBS组、BCG组、SAS组和Rv3615c/SAS组(6只/组),免疫方式为皮下2点注射,注射剂量如下:PBS组为200 μl/只,BCG组为200 μl/只(含菌1×106CFU);SAS组为100 μl SAS混合100 μl PBS/只;Rv3615c/SAS组为含40 μg rRv3615c蛋白溶液100 μl混合100 μl SAS/只。注射方式为PBS组和BCG组仅0周注射1次;SAS和Rv3615c/SAS组每3周注射1次,共3次。
1.2 方法
1.2.1 质粒构建 以酚-氯仿法抽提M.tbH37Rv基因组DNA作为模板,根据Rv3615c全序列酶切位点及原核表达载体pET30b上的多克隆位点分析设计特异性引物(P1: TTCCATATGACGGAAAACTTGACCGTCCAGCCC;P2: ATCTCGAGGGTAAACAA-CCCGTCGATAGCCTT)。PCR扩增条件:95℃ 5 min;94℃ 45 s,62℃ 45 s,72℃ 30 s,30 cycles;72 ℃ 10 min。将PCR产物克隆入N端标记有6-His的pET30b中,将重组质粒命名为pET30b-Rv3615c,以NdeⅠ、XhoⅠ双酶切和测序鉴定。
1.2.2 原核表达、蛋白纯化和免疫印迹检测 重组质粒pET30b-Rv1789转化到E.coliBL21(DE3)感受态细胞中过夜培养(加入终浓度为50μg/ml的卡那霉素),转摇至150mlLB培养基后加入IPTG(终浓度0.5mmol/L)诱导培养并进行可溶性鉴定。以Ni-NTA纯化体系进行蛋白纯化,蛋白洗脱液复性则应用1×PBS配制的尿素进行4℃过夜梯度透析(尿素浓度分别为8、6、5、4、3、1、0mol/L,pH7.9)。用内毒素去除试剂盒检测并去除内毒素(<0.1EU/ml),BCA试剂盒测定纯化蛋白浓度并估算表达量,以15%SDS-PAGE分析蛋白纯度。同时以鼠抗-His6抗体作一抗、HRP标记羊抗鼠IgG作二抗进行Westernblot检测。
1.2.3 受试者分类和WBIA检测人群外周血抗原特异性IFN-γ浓度 从淮南市疾控中心选择40名受试者进行问卷调查、病史采集及全身体检,同时进行TST(结核菌素试验)、痰涂片(或痰培养)检测,并且排除合并免疫异常性疾病及HIV感染。M.tb感染者(包括TB患者和LTBIs)和健康对照者的临床诊断和筛选标准如表1所示。无菌收集受试者新鲜抗凝全血,在6h内加入无菌24孔板(0.5ml/孔);每孔加入rRv3615蛋白5μg/孔进行刺激,并以同体积PBS和PHA分别为阴、阳对照,震荡混匀后置37℃温箱孵育24h,收集血浆,按说明书以人IFN-γ检测试剂盒检测各孔IFN-γ浓度并加以比较,各孔最终值为实际测得值减去PBS刺激的本底值后所得数值。
1.2.4ELISA检测小鼠血清中抗原性特异性抗体水平 免疫后9周,将各组小鼠摘除眼球取血收集血清;处死各组小鼠后解剖并分离脾淋巴细胞。将96孔板以rRv3615c蛋白包被和BSA-PBST封闭后,把每列血清样本以PBS按1∶200进行倍比稀释,加入HRP标记兔抗鼠二抗(IgG、IgG1、IgG2a)并以TMB底物显色,以酶标仪检测OD值。抗体滴度以出现阳性结果的最高稀释倍数的倒数表示,即log10(抗体滴度)。以log10(抗体滴度)计算各组的平均值和标准误,以IgG2a和IgG1实际测得的稀释倍数计算IgG2a∶IgG1。
1.2.5ELISA检测脾淋巴细胞培养上清中抗原特异性IFN-γ、TNF-α、IL-2水平 24孔板中每孔加入2.5×106/个脾淋巴细胞,阴性对照、阳性对照和实验组刺激物分别为RPMI1640培养基、PPD(10μg/孔)和rRv3615c重组蛋白(10μg/孔),37℃培养72h,离心后收集细胞上清。按小鼠ELISA检测试剂盒说明书检测相应细胞因子水平。
1.3 统计学分析 组间比较采用非参数U检验,以SPSS18.0进行统计学分析,P<0.05认为具有统计学差异。
2 结果
2.1rRv3615c原核表达载体的构建、表达纯化和免疫印迹分析 编码Rv3615基因序列大小为312bp,插入pET30b(+)后构建重组质粒成功,NdeⅠ、XhoⅠ双酶切及测序鉴定无误,见图1A、B。rRv3615c蛋白经鉴定为包涵体形式表达,经Ni-NTA柱以变性条件纯化,SDS-PAGE显示其分子量大小为12.5kD,与预期符合;以鼠抗-His6抗体作一抗Westernblot鉴定证明rRv3615c蛋白成功表达(见图1D)。收集所有洗脱液中的重组蛋白经内毒素去剂盒检测并去除内毒素(<0.1EU/ml),BCA试剂盒测定蛋白浓度为0.75mg/ml,蛋白总表达量为4.5mg。重组蛋白纯度测定在Bio-Rad凝胶成像仪上拍摄电泳图,采用ImageLabTM软件进行图像分析,rRv3615蛋白纯度为94.5%。

图1 Rv3615c重组原核表达载体的构建、表达、纯化及鉴定Fig.1 Construction,expression,purification and identifi-cation of recombinant prokaryotic expression plasmid pET30b-Rv3615c
表1 受试人群的特征
Tab.1 Characteristics of human subjects

GroupsMtbinfectionsActivepulmonaryTBpatients(ATB)LatentTBinfections(LTBIs)HealthycontrolsClinicaldiagnosisclinicalsymptomofpulmonaryTB,positiveacid⁃fastbacilliinsputumsmearsofculturing,suggestivechestX⁃ray,TST≥5mmcloseTBcontacts,noclinicalsymptomnorabnormalchestradiograph,TST≥5mmnopriorMtbcontactorexposure,TST<5mmNoofsubjects141610Meanage283398361Male/Female8/610/65/5
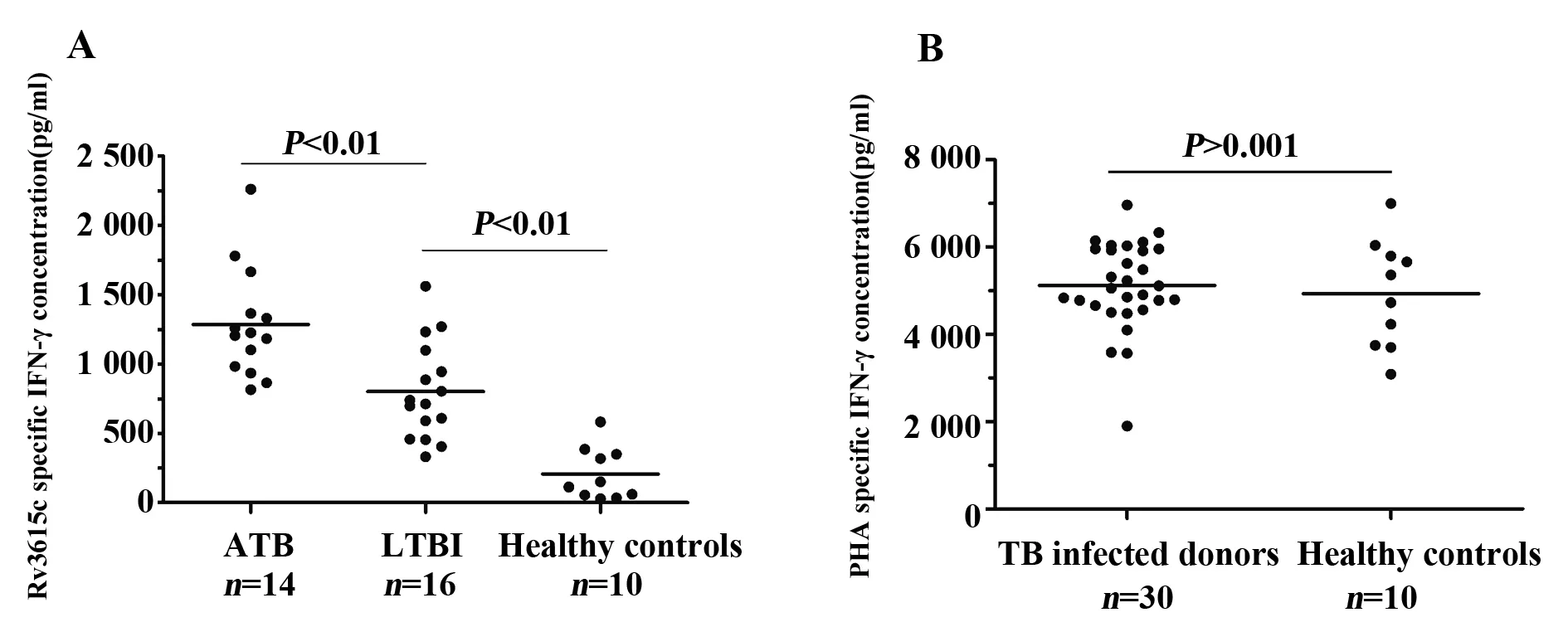
图2 rRv3615c和PHA刺激活动性TB患者、潜伏感染者和健康对照者全血IFN-γ水平Fig.2 Whole blood IFN-γ profiles in response to rRv3615c and PHA in ATB,LTBIs and healthy controls

图3 各组小鼠rRv3615c特异性小鼠血清IgG、IgG1、IgG2a抗体水平(n=3)Fig.3 rRv3615-specific IgG,IgG1 and IgG2a antibodies in immunized mice(n=3)

图4 不同免疫组小鼠脾淋巴细胞特异性分泌IFN-γ、IL-2 和TNF-α水平(n=3)Fig.4 Levels of IFN-γ,IL-2 and TNF-α secreted by splenic lymphocytes of differently immunized mice (n=3)
2.2 Rv3615c诱导ATB、LTBI和健康对照者特异性IFN-γ水平比较 由淮南市疾控中心筛选出符合临床诊断标准的ATB患者14例,LTBI受试者16例,健康对照者10例(如表1所示)。由图2A可见rRv3615c蛋白刺激M.tb感染者外周血中淋巴细胞分泌IFN-γ水平均显著高于健康者(P<0.05),同时诱导ATB人群外周血中淋巴细胞分泌IFN-γ水平显著高于LTBI人群(P<0.001)。由图2B可见PHA刺激M.tb感染者和健康对照者外周血中淋巴细胞分泌的IFN-γ水平无统计学差异(P>0.001)。
2.3 Rv3615c/SAS免疫小鼠诱导高水平的特异性IgG抗体 如图3所示,免疫后9周SAS组无显著特异性IgG抗体及其亚类产生;Rv3615c/SAS组诱导产生最高水平的抗体滴度,IgG2a/IgG1>1且为各组最高(5.33±2.31),显示倾向于Th1型免疫应答。
2.4 Rv3615c/SAS免疫小鼠脾淋巴细胞分泌高水平特异性Th1型细胞因子 不同免疫组小鼠经PPD和rRv3615c蛋白刺激后,如图4所示,无论是PPD或rRv3615c蛋白刺激,PBS组均分泌最低水平的IL-2、IFN-γ和TNF-α。PPD刺激时,BCG组均分泌最高水平的3种细胞因子;rRv3615c蛋白刺激时,则Rv3615c/SAS组相应细胞因子分泌水平最高。
3 讨论
BCG与M.tb标准毒株H37Rv进行基因组杂交比较后发现,BCG在进化过程中缺失129个开放读码框,即RD(Regions of deletion,RD)区,包括RD1-16,在M.tb有毒株中均存在[12]。RD1基因区(Rv3871-Rv3879c)包括ESAT-6和CFP-10,是M.tb重要的毒力因子,其中Rv3871、Rv3877是ESAT-6/CFP-10分泌所必需的,其突变株在表型上与RD-1区缺失菌株相似,对巨噬细胞的毒力减弱,在感染巨噬细胞的过程中引发较弱的免疫应答[13]。有研究发现除RD-1区外,Rv3614c~Rv3616c区域基因共同形成一个操纵子,是Esx-1型分泌系统必不可少的组成部分;该区域内任何一个基因表达受阻均会导致菌株对实验小鼠的肺、脾脏的毒力减弱[14]。采用酵母双杂交技术分析Rv3615c表达的蛋白产物,发现它们自身间相互作用密切。在本研究中我们选择了Rv3615c,构建其原核表达载体并在大肠杆菌中成功表达,相关研究有助于阐明TB的发生、发展及分子基础,为筛选抗TB基因药物的作用靶点奠定基础。 Rv3615c可能是免疫原性较强的靶抗原,在M.tb感染者尤其是BCG已初免者的诊断具有重要意义。Kerry等以Rv3615c肽刺激ATB和LTBI的PBMC,进行ELISPOT检测IFN-γ反应,发现其反应频率较高,与ESAT-6/CFP-10特异性反应频率相比甚至更敏感,提示Rv3615c包含多重和广泛的T细胞表位,是诱导ATB和LTBI产生Th1型应答的重要靶抗原[15]。Sidders等[16]研究发现感染牛分枝杆菌的小鼠尽管无法识别ESAT-6-CFP-10多肽,却可部分被Rv3615c诱导出强烈的IFN-γ细胞免疫应答,从而有效提高了诊断的敏感度。同样推测Rv3615c作为Esx-1底物蛋白也可用于人类的TB诊断,与ESAT-6/CFP-10作用类似[17]。我们此次构建、表达纯化的rRv3615c蛋白可特异刺激淮南市ATB和LTBI受试者产生显著高于健康者的IFN-γ水平,同时诱导ATB特异性IFN-γ水平显著高于LTBI受试者,验证了以WBIA技术筛选M.tbT细胞抗原的合理性,也提示了Rv3615c是可被淮南市M.tb感染人群T细胞所识别的特异性抗原。 有研究认为能同时分泌IFN-γ和IL-2的抗原特异性T细胞,对于疫苗设计和评估其效果至关重要[18]。如ESAT-6可刺激小鼠产生强烈的IFN-γ和IFN-γ/IL-2应答并由此获得保护性,而Ag85A重组腺病毒可诱导肺部产生多功能T细胞并与保护性相关[19]。ESAT-6、CFP-10、Ag85B和TB10.4的相关研究均显示,候选疫苗靶抗原必须能在自然感染时被单独分泌IFN-γ和同时分泌IFN-γ/IL-2的多功能T细胞所识别[20,21]。有研究发现Rv3615c刺激ATB时单独分泌IFN-γ和共分泌IFN-γ/IL-2的多功能T细胞均可产生,而刺激经治疗的ATB和LTBI时以共分泌IFN-γ/IL-2的CD4+T细胞为主[15]。本研究中,PPD刺激BCG组小鼠脾淋巴细胞所产生的IFN-γ、TNF-α和IL-2显著高于其他组,体现出CD4+Th1型应答对BCG免疫保护性的重要作用;同时rRv3615c蛋白亦可刺激Rv3615c/SAS组分泌显著高于PBS和佐剂组的特异性Th1型细胞因子,提示rRv3615c蛋白的保护性可能亦来自于有效诱导Th1型应答的潜在能力。此外,由于IFN-γ能够刺激机体表达IgG2a亚类抗体并抑制IgG1型抗体的产生[22],而Rv3615c/SAS组小鼠血清IgG2a∶IgG1比例大于1,亦提示Rv3615c诱导的抗体反应倾向于Th1型免疫应答。
综上所述,本研究证实了Rv3615c可被淮南M.tb感染人群T细胞特异性识别,同时具有较好的免疫原性,既可用于作为M.tb感染人群(尤其是LTBIs)辅助诊断的候选靶抗原,亦可作为有效的亚组分用于构建融合蛋白亚单位疫苗,从而有效提高抗M.tb感染的保护性。本课题研究为进一步评价该疫苗在不同感染动物模型中的保护性效果奠定了坚实的基础。
[1] McShane H.Tuberculosis vaccines: beyond bacille Calmette-Guerin[J].Philos Trans R Soc Lond B Biol Sci,2011,366(1579):2782-2789.
[2] Mangtani P,Abubakar I,Ariti C,etal.Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials[J].Clin Infec Dis,2014,58(4):470-480.
[3] Bocanegra-Garcia V,Valencia-Delgadillo J,Cruz-Pulido W,etal.From genetics to genomics in the rational design of new Mycobacterium tuberculosis vaccines[J].Enferm Infec Microbiol Clin,2011,29(8):609-614.
[4] Leroux-Roels I,Forgus S,De Boever F,etal.Improved CD4(+) T cell responses to Mycobacterium tuberculosis in PPD-negative adults by M72/AS01 as compared to the M72/AS02 and Mtb72F/AS02 tuberculosis candidate vaccine formulations: a randomized trial[J].Vaccine,2013,31(17):2196-2206.
[5] Lin PL,Dietrich J,Tan E,etal.The multistage vaccine H56 boosts the effects of BCG to protect cynomolgus macaques against active tuberculosis and reactivation of latent Mycobacterium tuberculosis infection[J].J Clin Invest,2012,122(1):303-314.
[6] Behr MA,Wilson MA,Gill WP,etal.Comparative genomics of BCG vaccines by whole-genome DNA microarray[J].Science,1999,284(5419):1520-1523.
[7] Aagaard C,Hoang T,Dietrich J,etal.A multistage tuberculosis vaccine that confers efficient protection before and after exposure[J].Nat Med,2011,17(2):189-194.
[8] van Dissel JT,Arend SM,Prins C,etal.Ag85B-ESAT-6 adjuvanted with IC31 promotes strong and long-lived Mycobacterium tuberculosis specific T cell responses in naive human volunteers[J].Vaccine,2010,28(20):3571-3581.
[9] Luksic B,Kljajic Z,Roje Z,etal.Direct molecular detection of Mycobacterium tuberculosis suspected to be the specific infection in a case of recurrent tonsillitis[J].J Infect Chemother,2013,19(6):1185-1187.
[10] MacGurn JA,Raghavan S,Stanley SA,etal.A non-RD1 gene cluster is required for Snm secretion in Mycobacterium tuberculosis[J].Mol Microbiol,2005,57(6):1653-1663.
[11] Jang HJ,Nde C,Toghrol F,etal.Microarray analysis of Mycobacterium bovis BCG revealed induction of iron acquisition related genes in response to hydrogen peroxide[J].Environ Sci Technol,2009,43(24):9465-9472.
[12] Bottai D,Majlessi L,Simeone R,etal.ESAT-6 secretion-independent impact of ESX-1 genes espF and espG1 on virulence of Mycobacterium tuberculosis[J].J Infect Dis,2011,203(8):1155-1164.
[13] Guinn KM,Hickey MJ,Mathur SK,etal.Individual RD1-region genes are required for export of ESAT-6/CFP-10 and for virulence of Mycobacterium tuberculosis[J].Mol Microbiol 2004,51(2):359-370.
[14] Korotkova N,Piton J,Wagner JM,etal.Structure of EspB,a secreted substrate of the ESX-1 secretion system of Mycobacterium tuberculosis[J].J Struct Biol,2015,191(2):236-244.
[15] Millington KA,Fortune SM,Low J,etal.Rv3615c is a highly immunodominant RD1 (Region of Difference 1)-dependent secreted antigen specific for Mycobacterium tuberculosis infection[J].Proc Natl Acad Sci USA,2011,108(14):5730-5735.
[16] Sidders B,Pirson C,Hogarth PJ,etal.Screening of highly expressed mycobacterial genes identifies Rv3615c as a useful differential diagnostic antigen for the Mycobacterium tuberculosis complex[J].Infect Immun, 2008,76(9):3932-3939.
[17] Sellam J,Hamdi H,Roy C,etal.Comparison of in vitro-specific blood tests with tuberculin skin test for diagnosis of latent tuberculosis before anti-TNF therapy[J].Ann Rheum Dis,2007,66(12):1610-1615.
[18] Seder RA,Darrah PA,Roederer M.T-cell quality in memory and protection: implications for vaccine design[J].Nat Rev Immunol,2008,8(4):247-258.
[19] Forbes EK,Sander C,Ronan EO,etal.Multifunctional,high-level cytokine-producing Th1 cells in the lung,but not spleen,correlate with protection against Mycobacterium tuberculosis aerosol challenge in mice[J].J Immunol,2008,181(7):4955-4964.
[20] Caccamo N,Guggino G,Joosten SA,etal.Multifunctional CD4(+) T cells correlate with active Mycobacterium tuberculosis infection[J].Eur J Immunol,2010,40(8):2211-2220.
[21] Tena-Coki NG,Scriba TJ,Peteni N,etal.CD4 and CD8 T-cell responses to mycobacterial antigens in African children[J].Am J Respir Crit Care Med,2010,182(1):120-129.
[22] Snapper CM,Paul WE.Interferon-gamma and B cell stimulatory factor-1 reciprocally regulate Ig isotype production[J].Science,1987,236(4804):944-947.
[收稿2016-04-05 修回2016-08-26]
(编辑 张晓舟)
Prokaryotic expression and study on immunological function of Rv3615c(Esx-1 substrate protein) of Mycobacterium tuberculosis
XU Li-Fa,WANG Xiao-Chun,WANG Jian,ZHANG Rong-Bo.
Department of Pathogenic Biology and Immunology,Medical College of Anhui University of Science and Technoglgy,Huainan 232001,China
Objective:To construct recombinant prokaryotic expression plasmid pET30b-Rv3615c expressing Esx-1 substrate protein and expressed inE.coliBL21(DE3);to detect whether rRv3615c protein could be recognized by T cells ofM.tbinfections from Huainan using WBIA and to confirm its immunogenicity through mice model. Methods: Prokaryotic expression vector pET30b-Rv3615c was constructed using molecular cloning technology,then rRv3615c protein was expressed and purified.WBIA was performed to detect the specific concentration of IFN-γ stimulated from peripheral-blood lymphocyte of HuainanM.tbinfections and non-infections.Moreover,C57BL/6 mice were immunized by protein rRv3615c combing with adjuvant SAS and responses of humoral immune and Th1-type cell-mediated immune were evaluated.Results: Recombinant plasmid pET30b-Rv3615c was constructed successfully and expressed correctly according to the results of SDS-PAGE and Western blot.The mean level of IFN-γ detected by rRv3615c-WBIA inM.tbinfected donors was much higher than that in healthy donors from Huainan.Meanwhile,Rv3615c/SAS induced higher levels of rRv3615c-specific antibodies(IgG,IgG1,IgG2a)and cytokines(IFN-γ,TNF-α,IL-2)from splenic lymphocyte than that of PBS and SAS,which indicated that Rv3615c/SAS mainly induced the Th1-type cell-mediated immune response.Conclusion: Since Rv3615c could be recognized by T cells ofM.tbinfections from Huainan and also has strong immunogenicity,it may be utilized as a potential candidate antigen in TB prevention and TB diagnosis.
Rv3615c;Prokaryotic expression;Immunological function;Whole-blood IFN-γ release assay;Mycobacteriumtuberculosis
10.3969/j.issn.1000-484X.2016.11.015
①本文受2015度安徽省高校自然科学研究重点项目(KJ2015A093)资助。
许礼发(1968年-),男,副教授,硕士生导师,主要从事病原生物学与免疫学研究,E-mail:ahhnlfxu@126.com。
R378.91+1
A
1000-484X(2016)11-1636-06

