mTORC1 信号促进前成骨细胞MC3T3-E1的分化成熟①
张婧婧 张 楠 吴 伟 王 鹏 杨景瑞 段巨洪 于海川
(河南省新乡医学院医学检验学院和分子诊断与医学检验技术河南省协同创新中心,新乡453003)
mTORC1 信号促进前成骨细胞MC3T3-E1的分化成熟①
张婧婧 张 楠②吴 伟③王 鹏③杨景瑞 段巨洪 于海川
(河南省新乡医学院医学检验学院和分子诊断与医学检验技术河南省协同创新中心,新乡453003)
目的:研究mTORC1 信号对前成骨细胞MC3T3-E1向成骨细胞分化成熟的调控作用。方法:通过向MC3T3-E1转染pcDNA3.1-Raptor,对mTORC1 信号相关蛋白Raptor进行过表达。向MC3T3-E1转染Raptor siRNA,对mTORC1 信号蛋白Raptor进行基因沉默。通过Real-time PCR方法测定Raptor的基因表达,通过蛋白免疫印迹法测定Raptor蛋白水平,并通过茜素红染色检测成骨矿化情况,以测定成骨分化程度。通过Real-time PCR检测成骨分化指标的基因表达。结果:与对照组相比,Raptor过表达组的Raptor mRNA和蛋白水平明显增加;茜素红染色结果显示Raptor过表达组染色更深,说明成骨矿化程度更高;荧光定量PCR结果显示,Raptor过表达组的成骨分化标记基因以及成骨转录因子的表达量均高于对照组。与对照组相比,Raptor siRNA组的Raptor mRNA和蛋白水平明显降低;茜素红染色结果显示Raptor siRNA组染色更浅,说明成骨矿化程度更低;荧光定量PCR结果显示,Raptor siRNA组的成骨分化标记基因以及成骨转录因子的表达量均低于对照组。结论:mTORC1 信号促进前成骨细胞MC3T3-E1向成骨细胞分化成熟。
mTORC1信号;成骨分化;前成骨细胞
前成骨细胞是一种已经向成骨细胞方向进行定向的细胞类型[1]。前成骨细胞来源于多潜能间充质干细胞,并且可以在成骨相关信号的诱导刺激下进一步分化为成熟的成骨细胞[2]。因此,成骨分化的整个过程包括两个阶段,一是间充质干细胞被定向为前成骨细胞[3],另一个过程是前成骨细胞进一步向成熟的成骨细胞分化[4,5]。这两个分化过程都受到细胞外信号的紧密调控[6,7]。
mTOR信号通路是一种进化保守的,营养因子敏感性信号通路,并能在一系列细胞过程中起到重要的调控作用[8,9]。mTOR为一种丝氨酸/苏氨酸激酶,并且在细胞内常以mTORC1或mTORC2两种不同的复合物形式存在。这两种复合物由不同的成分组成,例如mTORC1包含Raptor蛋白,而mTORC2包含Rictor蛋白[9]。当收到上游信号激活后,mTORC1和mTORC2控制不同的下游效应因子并影响不同的细胞过程[9,10]。已有基因敲除小鼠实验证实,mTORC1在小鼠胚胎发育过程中的主要功能是对软骨组织的大小进行调控[11],而mTORC2主要功能在于促进骨质形成[12]。然而,通过使用mTOR信号抑制剂Rappamycin对mTOR信号进行研究,发现mTOR对成骨分化的调控既有促进效应也有抑制效应[13,14]。因此,mTOR信号在成骨分化过程中所扮演的具体角色至今尚未有定论。
考虑到成骨细胞分化的过程包含不同的两个阶段,我们推测mTOR信号对成骨分化的不同阶段具有不同的效应。因此,本研究着重探索mTORC1对前成骨细胞MC3T3-E1向成熟的成骨细胞分化过程的调控作用。
1 材料与方法
1.1 材料 MC3T3-E1细胞购自美国细胞库ATCC。DMEM高糖培养基及胎牛血清(Gibco公司,美国),青链霉素(碧云天公司,上海),LB 培养基、RIPA裂解液和PMSF(苯甲基磺酰氟)(上海生工),pcDNA3.1-Raptor通过基因克隆方法构建,TRIzol 总RNA抽提试剂(TaKaRa公司,日本),Lipofectamie-2000(Invitrogen公司,美国),二甲基亚砜(DMSO)、氨苄霉素、台盼蓝染液、HRP标记的二抗(Sigma公司,美国),SYBRGreen PCR Master Mix(TOYOBO公司,日本),BMP-2 (R&D公司,美国),Anti-Raptor一抗(Abcam公司,英国)。siRNA由上海吉玛生物技术公司定制。限制性内切酶BamHⅠ以及XhoⅠ、T4 DNA连接酶(NEB公司,美国)。
1.2 方法
1.2.1 细胞培养以及诱导成骨分化 MC3T3-E1采用含10% FBS高糖DMEM培养基,在37℃、5% CO2及相对湿度条件下培养。采用终浓度为100 ng/ml 的BMP-2对MC3T3-E1进行为期7 d或14 d的成骨诱导分化。
1.2.2 RNA提取与荧光定量PCR 根据试剂盒提供的实验方案使用TRIzol 总RNA抽提试剂进行总RNA提取。以总RNA为模板使用M-MLV反转录酶在25 μl体系中对cDNA进行反转录。用SYBR Green Ⅰ mix试剂进行荧光定量PCR实验,使用ABI ⅦA7荧光定量PCR仪进行检测。引物序列如表1所示,荧光定量PCR反应条件如下:95℃预变性30 s,95℃变性5 s,60℃退火34 s,40个循环;采用U6为内参。数据使用Ct值法(2-ΔΔCt)进行分析。
1.2.3 pcDNA3.1-Raptor质粒的构建 以MC3T3-E1基因组DNA为模板,用以下引物进行PCR扩增:上游序列AAGGATCCATGCATCGGGCAGTG-GACCC,以及下游序列TTCTCGAGTCATCGAGA-CGTGCTGGCGG。用限制性内切酶BamHⅠ以及XhoⅠ对质粒pcDNA3.1载体和PCR扩增条带分别进行双酶切,回收DNA条带后用T4 DNA连接酶进行连接。转化到DH5-α感受态细胞。挑选单克隆进行培养并抽取质粒DNA进行测序鉴定。
1.2.4 pcDNA3.1-Raptor以及Raptor siRNA转染实验 为实现Raptor过表达,实验分组分为阴性对照组,BMP-2组,以及Raptor过表达组。阴性对照组以及BMP-2组均转染pcDNA3.1空载体,过表达组转染pcDNA3.1-Raptor质粒。为实现Raptor基因沉默,实验分组分为阴性对照组,BMP-2组,以及Raptor siRNA组。阴性对照组以及BMP-2组均转染非特异性siRNA阴性对照,过表达组转染Raptor siRNA。质粒和siRNA均使用Lipofectamine® 2000试剂进行转染。细胞培养基含10%胎牛血清,50 U/ml青霉素和50 μg/ml链霉素,转染后,所有细胞在37℃温度和5%CO2培养箱中进行孵育。
表1 Real-Time PCR引物序列
Tab.1 Primer sequences for Real-Time PCR
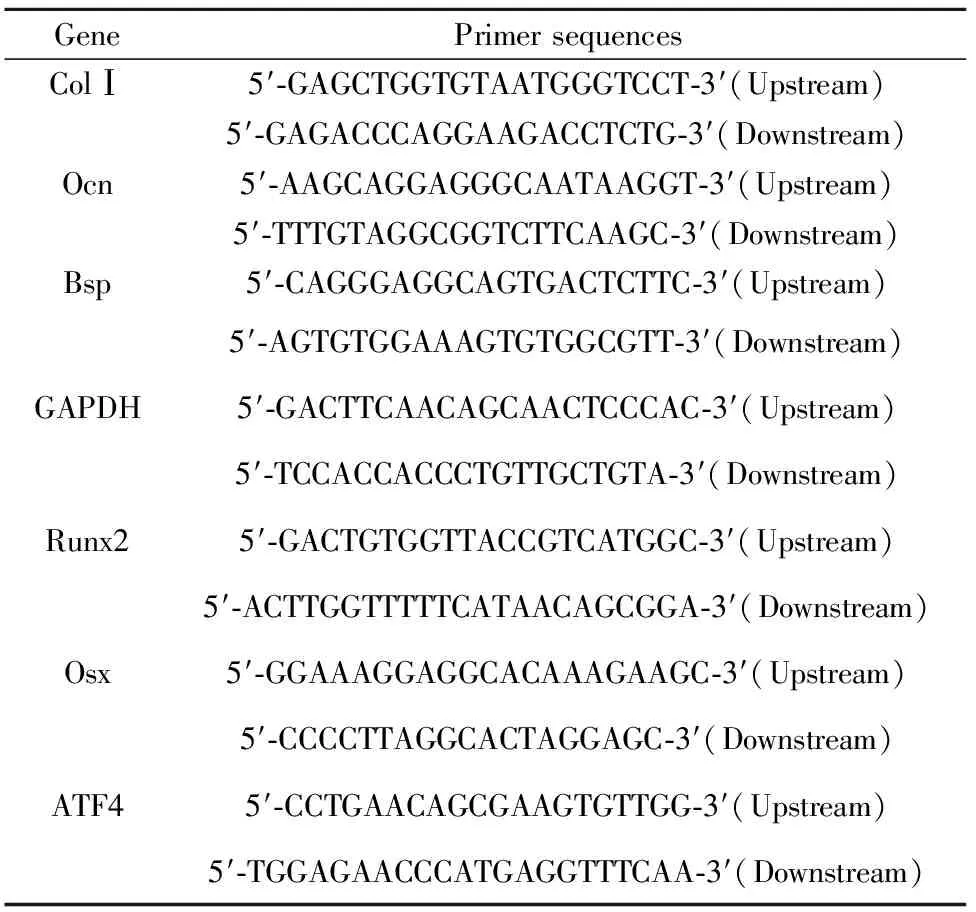
GenePrimersequencesColⅠ5′⁃GAGCTGGTGTAATGGGTCCT⁃3′(Upstream)5′⁃GAGACCCAGGAAGACCTCTG⁃3′(Downstream)Ocn5′⁃AAGCAGGAGGGCAATAAGGT⁃3′(Upstream)5′⁃TTTGTAGGCGGTCTTCAAGC⁃3′(Downstream)Bsp5′⁃CAGGGAGGCAGTGACTCTTC⁃3′(Upstream)5′⁃AGTGTGGAAAGTGTGGCGTT⁃3′(Downstream)GAPDH5′⁃GACTTCAACAGCAACTCCCAC⁃3′(Upstream)5′⁃TCCACCACCCTGTTGCTGTA⁃3′(Downstream)Runx25′⁃GACTGTGGTTACCGTCATGGC⁃3′(Upstream)5′⁃ACTTGGTTTTTCATAACAGCGGA⁃3′(Downstream)Osx5′⁃GGAAAGGAGGCACAAAGAAGC⁃3′(Upstream)5′⁃CCCCTTAGGCACTAGGAGC⁃3′(Downstream)ATF45′⁃CCTGAACAGCGAAGTGTTGG⁃3′(Upstream)5′⁃TGGAGAACCCATGAGGTTTCAA⁃3′(Downstream)
1.2.5 免疫印迹实验 将细胞用RIPA裂解液和PMSF(苯甲基磺酰氟)处理,冰上孵育30 min。4℃,12 000 r/min离心30 min,得上清蛋白。用BCA蛋白浓度测定试剂盒检测蛋白浓度。一抗anti-Raptor采用1∶1 000的比例进行使用,anti-GAPDH,HRP标记的二抗均以1∶2 000的比例进行使用。通过ECL法进行显影。

2 结果
2.1 过表达Raptor的MT3T3-E1细胞构建成功 为了实现Raptor在MC3T3-E1细胞的过表达,我们首先构建了Raptor的基因表达质粒。通过以MC3T3-E1细胞的基因组DNA为PCR模板,我们对Raptor的编码基因片段进行扩增。通过对PCR片段和表达载体pcDNA3.1进行限制性内切酶BamHⅠ和XhoⅠ双酶切,通过连接反应获得pcDNA3.1-Raptor表达质粒。通过Liposome 2000介导,该质粒被转染到MC3T3-E1细胞中。经3 d培养后,通过定量PCR和蛋白免疫印迹技术,检测到质粒转染后的细胞中Raptor mRNA及蛋白水平明显增加,说明Raptor在MC3T3-E1细胞的过表达得以实现,见图1。
2.2 过表达Raptor促进MT3T3-E1细胞的成骨分化 在pcDNA3.1-Raptor表达质粒转染的基础上,再利用100 ng/ml BMP-2对MC3T3-E1细胞进行诱导刺激,检测14 d后的矿化程度。实验发现,转染pcDNA3.1-Raptor并用BMP-2处理的细胞,其茜素红染色显示着色更深,说明该组细胞的矿物沉积显著增加,矿化程度显著高于pcDNA3.1空载体转染+BMP-2处理组(图2)。
利用定量PCR方法检测mTORC1信号对成骨细胞标记基因表达的影响。结果显示,同样的BMP-2处理条件下,pcDNA3.1-Raptor转染组的成骨细胞特异性标记基因的表达均显著升高。具体表现为,在BMP-2处理7 d和14 d后,pcDNA3.1-Raptor组的一型胶原蛋白基因ColⅠ,骨钙素基因Ocn,骨涎蛋白基因Bsp,其mRNA水平都显著高于pcDNA3.1空载体转染组(图3)。因此,我们认为,过表达Raptor蛋白,激活mTORC1信号能极大地促进成骨细胞特异性标记基因的表达。

图1 Raptor在MC3T3-E1细胞的过表达Fig.1 Overexpression of Raptor in MC3T3-E1Note: *.P<0.001,n=5.
进一步探讨过表达Raptor对成骨细胞的关键转录因子Runx2,Osx以及ATF4基因表达的影响。定量PCR实验显示,在BMP-2处理7 d和14 d的情况下,pcDNA3.1-Raptor组的Runx2、Osx以及ATF4的mRNA水平都显著高于pcDNA3.1空载体转染组(图4)。因此,我们认为过表达Raptor蛋白以激活mTORC1信号能显著促进成骨细胞的关键转录因子Runx2、Osx以及ATF4的基因表达。
2.3 MC3T3-E1细胞的Raptor基因沉默 通过Liposome 2000介导,Raptor siRNA被转染到MC3T3-E1细胞中。经过3 d培养后,通过定量PCR和免疫印迹技术,我们检测到质粒转染后的细胞中Raptor的表达量显著降低,说明Raptor在MC3T3-E1细胞的基因沉默得以实现(图5)。
2.4 Raptor基因沉默抑制MC3T3-E1的成骨分化 在Raptor基因沉默的基础上,再利用100 ng/ml BMP-2对MC3T3-E1细胞进行诱导刺激,检测14 d后的矿化程度。实验发现,转染Raptor siRNA并用BMP-2处理的细胞,其茜素红染色显示着色较浅,说明该组细胞的矿物沉积显著降低,矿化程度显著低于BMP-2处理组(图6)。

图2 过表达Raptor促进MT3T3-E1细胞的矿化Fig.2 Overexpression of Raptor promoted mineralizaion of MC3T3-E1

图3 过表达Raptor促进ColⅠ、Ocn和Bsp基因表达Fig.3 Overexpression of Raptor promoted gene expression of ColⅠ,Ocn and BspNote: *.P<0.05;**.P<0.01,n=5.
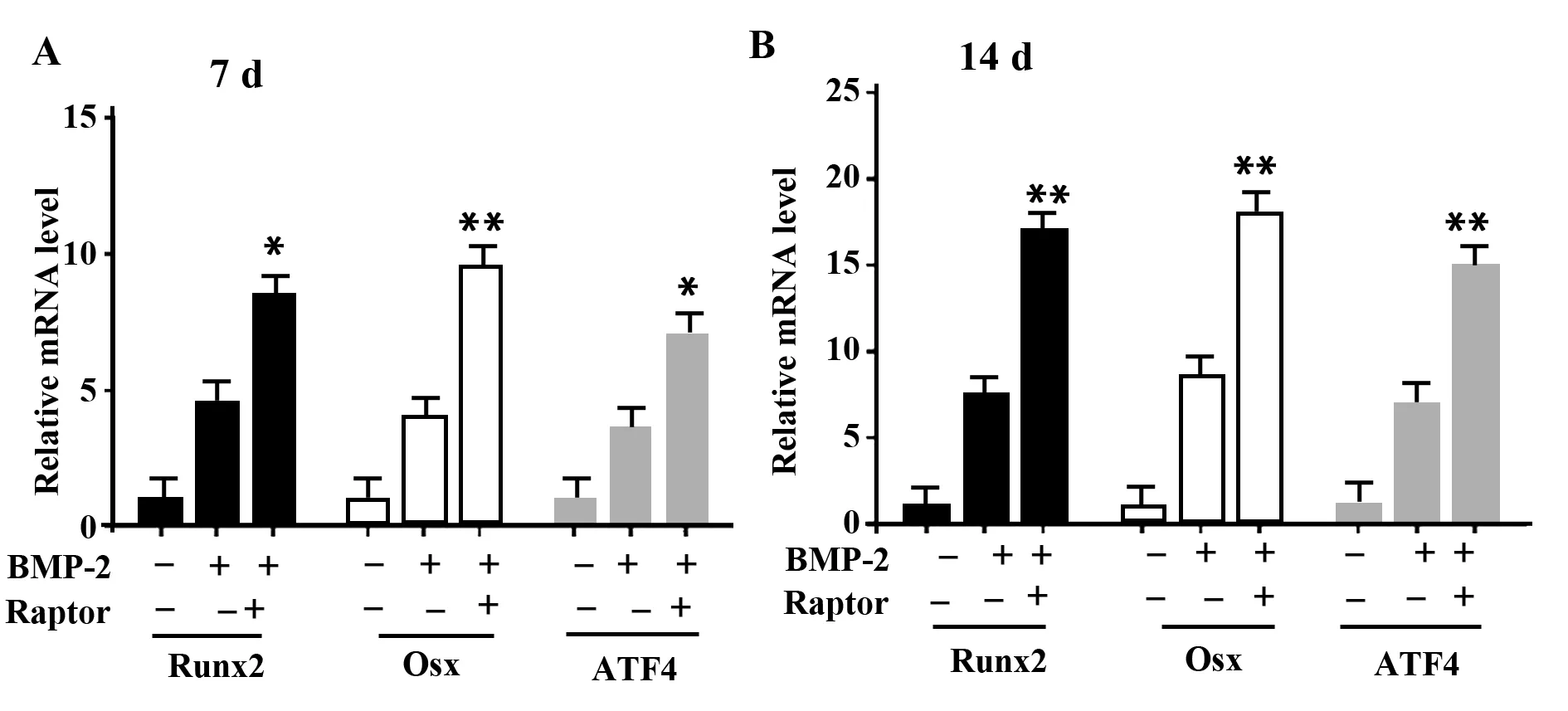
图4 过表达Raptor促进成骨细胞转录因子Runx2、Osx和ATF4的表达Fig.4 Overexpression of Raptor promoted gene expression of transcription factor Runx2,Osx and ATF4Note: *.P<0.05;**.P<0.01,n=5.

图5 Raptor在MC3T3-E1的基因沉默Fig.5 Gene silence of Raptor in MC3T3-E1Note: ***.P<0.001,n=5.
进一步探讨Raptor基因沉默对成骨细胞标记基因表达的影响。结果显示,同样的BMP-2处理条件下, Raptor siRNA转染组的成骨细胞特异性标记基因的表达均显著降低。具体表现为,在BMP-2处理7 d和14 d后, Raptor siRNA组的一型胶原蛋白基因ColⅠ,骨钙素基因Ocn,骨涎蛋白基因Bsp,其mRNA水平都显著低于单独BMP-2处理组(图7)。因此,我们认为,通过Raptor基因沉默,抑制mTORC1信号能显著抑制成骨细胞特异性标记基因的表达。
定量PCR实验显示,在BMP-2处理7 d和14 d的情况下,Raptor siRNA组的Runx2、Osx以及ATF4的mRNA水平都显著低于单独BMP-2处理组(图8)。因此,我们认为通过Raptor基因沉默以抑制 mTORC1信号能显著抑制成骨细胞的关键转录因子Runx2、Osx以及ATF4的基因表达。

图6 Raptor 基因沉默降低MC3T3-E1矿化水平Fig.6 Gene silence of Raptor reduced mineralization of MC3T3-E1

图7 Raptor基因沉默抑制ColⅠ、Ocn和Bsp基因表达Fig.7 Gene silence of Raptor reduced gene expression of ColⅠ,Ocn and BspNote: *.P<0.05;**.P<0.01,n=5.

图8 Raptor基因沉默抑制成骨细胞转录因子Runx2、Osx和ATF4的表达Fig.8 Gene silence of Raptor reduced gene expression of transcription factor Runx2,Osx and ATF4
3 讨论
间充质干细胞的成骨分化是骨骼发育以及骨质维持的重要过程。尽管对成骨分化的研究已经揭示了部分分子调控机理,包括BMPs以及Wnts等重要信号通路的发现,Runx2等关键转录因子的转录机制阐明等[3,6],然而,目前对成骨分化的分子调控过程的了解依然不足。
本实验探讨了mTORC1信号对成骨分化的调控作用。实验结果显示,通过Raptor过表达激活mTORC1信号能显著增加MT3T3-E1细胞骨矿化程度,并显著促进了成骨分化的特异性标记基因ColⅠ、Ocn、Bsp的基因表达,以及促进成骨转录因子Runx2和Osx以及ATF4的基因表达。说明过表达Raptor,激活mTORC1信号能显著促进MT3T3-E1细胞的分化成熟。与此同时,通过Raptor基因沉默以抑制mTORC1信号,显著降低了MT3T3-E1细胞骨矿化程度,并显著抑制了成骨分化的特异性标记基因ColⅠ、Ocn、Bsp的基因表达,以及抑制成骨转录因子Runx2和Osx以及ATF4的基因表达。说明通过Raptor基因沉默以抑制mTORC1信号能显著抑制MT3T3-E1细胞的分化成熟。Chen等[10]研究发现,Wnt7B能通过激活mTORC1信号通路进而促进间充质干细胞的成骨分化。另外,Zhan等[15]通过采用雷帕霉素研究发现mTORC1信号参与调控血管平滑肌细胞的成骨分化。上述文献报道结果与本研究结论类似。说明已有越来越多的证据支持mTORC1对成骨分化具有促进作用的论断。
骨重建对骨骼的维持和再生起到关键作用[6]。骨重建的失衡则会导致骨质疏松等骨骼疾病。骨质疏松的基本原因是破骨吸收过强而成骨不足,最终导致骨质丢失,骨量下降,从而形成骨质疏松[16,17]。目前对骨质疏松治疗的主要思路是抑制骨质吸收,减少骨质流失[18]。而通过促进骨质合成从而对骨质疏松进行治疗被认为是一条新的思路[19,20]。但是对于如何促进骨质合成,增加骨量目前尚无有效方法。本实验证实了mTORC1信号能显著促进成骨分化,因而,推测提高mTORC1信号在人体前成骨细胞中的水平能相应地促进成骨分化,增加骨质的合成。因此, mTORC1信号具有成为骨质疏松治疗靶点的潜在可能。
综上所述,本实验通过在MT3T3-E1细胞中过表达和基因沉默mTORC1信号关键蛋白Raptor,激活或抑制mTORC1信号,印证了mTORC1对前成骨细胞向成熟的成骨细胞分化的正向调控作用。本研究揭示了一种新的成骨分化的分子细胞机制,并为日后开发促进骨质合成的药物提供了新的思路。
[1] Bellows CG,Heersche JNM.The frequency of common progenitors for adipocytes and osteoblasts and of committed and restricted adipocyte and osteoblast progenitors in fetal rat calvaria cell populations[J].J Bone Miner Res,2001,16(11): 1983-1993.
[2] Long F.Building strong bones: molecular regulation of the osteoblast lineage[J].Nat Rev Mol Cell Biol,2012,13(1): 27-38.
[3] Huang W,Yang S,Shao J,etal.Signaling and transcriptional regulation in osteoblast commitment and differentiation [J].Front Bio Sci,2007,12(6): 3068-3092.
[4] Karsenty G,Kronenberg HM,Settembre C.Genetic control of bone formation [J].Annu Rev Cell Dev Biol,2009,25(8): 629-638.
[5] Javed A,Chen H,Ghori FY.Genetic and transcriptional control of bone formation [J].Oral Maxillofac Surg Clin North Am,2010,22(3):283-293.
[6] Zaidi M.Skeletal remodeling in health and disease [J].Nat Med,2007,13(7): 791-801.
[7] Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease [J].Nat Rev Immunol,2008,8(9):726-736.
[8] Laplante M,Sabatini DM.mTOR signaling in growth control and disease [J].Cell,2012,149(2): 274-293.
[9] Sengupta S,Peterson TR,Sabatini DM.Regulation of the mTOR complex 1 pathway by nutrients,growth factors,and stress [J].Mol Cell,2010,40(2): 310-322.
[10] Chen J,Tu X,Esen E,etal.WNT7B promotes bone formation in part through mTORC1[J].PLoS Genet,2014,10(1):e1004145.
[11] Chen J,Long F.mTORC1 signaling controls mammalian skeletal growth through stimulation of protein synthesis [J].Development,2014,141(14): 2848-2854.
[12] Chen J,Holguin N,Shi Y,etal.mTORC2 signaling promotes skeletal growth and bone formation in mice [J].J Bone Miner Res,2015,30(2): 369-378.
[13] Isomoto S,Hattori K,Ohgushi H,etal.Rapamycin as an inhibitor of osteogenic differentiation in bone marrow-derived mesenchymal stem cells [J].J Orthop Sci,2007,12(1): 83-88.
[14] Singha UK,Jiang Y,Yu S,etal.Rapamycin inhibits osteoblast proliferation and differentiation in MC3T3-E1 cells and primary mouse bone marrow stromal cells [J].J Cell Biochem,2008,103(2): 434-446.
[15] Zhan JK,Wang YJ,Wang Y,etal..The mammalian target of rapamycin signalling pathway is involved in osteoblastic differentiation of vascular smooth muscle cells[J].Canadian J Cardiol,2014,30(5):568-575.
[16] Eriksen EF.Cellular mechanisms of bone remodeling [J].Rev Endocr Metab Disord,2010,11(4): 219-227.
[17] Graat-Verboom L,Wouters EF,Smeenk FW,etal.Current status of research on osteoporosis in COPD: a systematic review [J].Eur Respir J,2009,34(1): 209-218.
[18] Lau RY,Guo X.A review on current osteoporosis research: with special focus on disuse bone loss [J].J Osteoporos,2011,20(11): 293-298.
[19] Khosla S,Westendorf JJ,Oursler MJ.Building bone to reverse osteoporosis and repair fractures [J].J Clin Invest,2008,118(2): 421-428.
[20] Papapoulos SE.Anabolic bone therapies in 2014: New bone-forming treatments for osteoporosis [J].Nat Rev Endocrinol,2015,11(2): 69-70.
[收稿2016-03-26 修回2016-06-08]
(编辑 许四平)
mTORC1 signaling promotes osteoblast differentiation of preosteoblast MC3T3-E1
ZHANG Jing-Jing,ZHANG Nan,WU Wei,WANG Peng,YANG Jing-Rui,DUAN Ju-Hong,YU Hai-Chuan.
Collaborative Innovation Center of Henan Province,Institute of Medical Laboratory Science and Molecular Diognostics and Medical Laboratory Technology,Xinxiang 453003,China
Objective:To investigate the regulatory role of mTORC1 signaling on osteoblast differentiation from preosteoblast cell MC3T3-E1.Methods: To overexpress the gene Raptor,which was a critical component of mTORC1 signaling,pcDNA3.1-Raptor was transfected to preosteoblast cell MC3T3-E1.The Raptor overexpression was confirmed by Real-time PCR and Western blot.For the gene silence of Raptor,Raptor siRNA was transfected to preosteoblast cell MC3T3-E1.Alizarin red staining was used to detect the mineralization of MC3T3-E1.Real-time PCR was used to detect the gene expression of osteoblast specific marker genes.Western blot was used to detect the protein level of Raptor.Results: Compared to the control group,the levels of Raptor mRNA and proteins increased significantly in the Raptor overexpression group;the Alizarin red staining results revealed darker staining in the Raptor overexpression group,suggesting higher level of mineralization;the Real-time PCR results showed that the expression of osteoblast differentiation marker genes and osteoblast transcription factors in the Raptor overexpression group was higher than the control group.Compared to the control group,the levels of Raptor siRNA and proteins decreased significantly in the Raptor siRNA group;the Alizarin red staining results revealed lighter staining in the Raptor siRNA group,indicating lower level of mineralization;the real-time PCR results showed that the expression of osteoblast differentiation marker genes and osteoblast transcription factors in the Raptor siRNA group was lower than the control group.Conclusion: mTORC1 signaling promoted the osteoblast differentiation from preosteoblast cell MC3T3-E1.
mTORC1;Osteoblast differentiation;Preosteoblast
10.3969/j.issn.1000-484X.2016.11.002
①本文为国家自然科学基金项目(No.31301135)。
张婧婧(1982年-),女,硕士,实验师,主要从事分子免疫方面的研究。
及指导教师:于海川(1979年-),男,博士,副教授,主要从事造血免疫分化方面的研究,E-mail:15225991758@163.com。
R329.24
A
1000-484X(2016)11-1573-05
②河南省新乡医学院,新乡453003。
③河南省新乡医学院第三附属医院,新乡453003。

