TSLPR抗体抑制ApoE敲除小鼠动脉粥样硬化血栓形成①
王博远 吴 纯 何少林 黄 恺 李大主
(华中科技大学同济医学院附属协和医院心血管内科,武汉430022)
·基础免疫学·
TSLPR抗体抑制ApoE敲除小鼠动脉粥样硬化血栓形成①
王博远 吴 纯 何少林 黄 恺 李大主
(华中科技大学同济医学院附属协和医院心血管内科,武汉430022)
目的:探讨TSLPR抗体在抑制动脉粥样硬化血栓形成中的作用。方法:8周龄载脂蛋白E-/-小鼠,给予高脂饲养 12周,期间分别周期性尾静脉注射TSLPR抗体和同型无关IgG抗体,检测各组小鼠动脉粥样硬化血栓形成时间,血小板聚集和释放功能,血小板膜糖蛋白表达。结果:与对照组相比,TSLPR抗体处理组血栓形成时间明显长,血小板聚集功能和释放功能明显低,血小板活化指标CD62p、CD63、PAC-1表达明显低,静息指标CD42b表达明显高。结论:静脉注射TSLPR抗体可以明显抑制血小板聚集功能和释放功能,降低血小板活化程度,从而抑制动脉粥样硬化血栓形成。
TSLPR抗体;动脉粥样硬化;动脉粥样硬化血栓形成;血小板
动脉粥样硬化(AS)是由血脂代谢异常诱发的动脉血管斑块形成为特征的免疫炎性疾病[1]。动脉粥样硬化血栓形成是动脉粥样硬化的主要并发症,因其导致的急性冠脉综合征(ACS)已成为冠状动脉粥样硬化患者最常见的死因。细胞因子介导的血小板的活化、聚集在这一过程中发挥着重要的作用[2,3]。胸腺基质淋巴细胞生成素(TSLP)是新近发现的一种细胞因子,参与了包括过敏性疾病、肿瘤和动脉粥样硬化等疾病的发生发展[4-9]。目前,靶向TSLP/TSLP受体(TSLPR)信号通道已成功用于疾病的干预[10,11]。我们的前期研究表明,血小板表面有TSLPR表达,ACS患者血小板表面TSLPR表达明显增加,TSLP可促进血小板活化,提示TSLP/TSLPR可能参与并促进ACS患者血小板活化后致血栓形成[12,13],阻断TSLP/TSLPR信号通道是否抑制血小板聚集和血栓形成目前尚无研究。本文探讨TSLPR抗体对动脉粥样硬化血栓形成的影响。
1 材料与方法
1.1 动物与试剂 AS易感(ApoE基因敲除C57BL/6)小鼠(ApoE小鼠)和野生型C57BL/6小鼠(WT小鼠)购自北京维通利华公司;TSLPR antibody及其同型无关对照IgG抗体购自R&D公司;FITC-抗CD42b-Ab、PE-抗CD62p Ab、PE-抗CD63 Ab、FITC-PAC-1 Ab及相应同型无关对照IgG抗体均为eBioscience公司产品;胶原购自Chro-Log公司;血小板功能分析仪和流式细胞分析仪均为BD公司产品。
1.2 方法
1.2.1 小鼠分组和高脂饲养 将8周龄雄性实验小鼠分为3组;WT对照组:WT小鼠,普食喂养12周,期间PBS每隔2周静脉注射1次;TSLPR抗体处理组:ApoE小鼠,用1%胆固醇、30%脂肪的高脂饲料喂养12周[4],期间TSLPR抗体(80 μg/ml)每隔1周尾静脉注射1次,每次0.3 ml[11];IgG对照组:ApoE小鼠,用同样高脂饲料喂养12周,期间同型无关IgG抗体(80 μg/ml)每隔1周尾静脉注射一次,每次0.3 ml。
1.2.2 动脉粥样硬化血栓形成模型 用戊巴比妥(100 mg/kg)将小鼠麻醉后固定于解剖显微镜下,钝性分离以暴露右侧颈总动脉。将充分浸润有10%氯化铁的滤纸敷在暴露的颈总动脉外膜表面2.5 min,从而诱导动脉粥样硬化血栓形成。利用微型多普勒探针连续测定颈动脉远端动脉粥样硬化血栓形成前,直到动脉血管完全闭塞的血液流量变化,计录血管闭塞所需要的时间[13]。
1.2.3 小鼠血小板制备 小鼠用戊巴比妥钠(100 mg/kg)麻醉后,从眶后丛用肝素涂层的玻璃毛细管将血液收集到含3%ACD(1/9 V/V)的小管中。将血液以1 500 r/min×7 min离心得到富含血小板的血浆(PRP)。再将PRP用PBS以2 000 r/min×5 min洗涤3次得到沉淀血小板,最后将沉淀血小板悬浮于改良的Tyrode-HEPES缓冲液(pH7.4,不含CaCl2)中待用,调整血小板至终浓度1×1012L-1。
1.2.4 血小板聚集实验 采用比浊法,测试前补充CaCl2(终浓度1 mmol/L),刺激试剂为胶原(终浓度 16 μg/ml),用血小板功能分析仪(BD公司)测定血小板聚集率,测试时间5 min。
1.2.5 血小板释放实验 测试前各组分别加入鲁米那发光剂(终浓度20 nmol/L),孵育2 min,补充CaCl2(终浓度1 mmol/L),刺激试剂为胶原(终浓度 16 μg/ml),用血小板功能分析仪测定血小板ATP释放水平,测试时间5 min。
1.2.6 流式细胞术(FCM)检测血小板膜糖蛋白实验 取各实验组血小板悬浮液,分别加入FITC-抗CD42b Ab、PE-抗CD62p Ab和PE-抗CD63 Ab、FITC-PAC-1 Ab, 室温避光反应30 min,加2 ml含有1%BSA的pH7.4 PBS稀释,3 300 r/min离心10 min,重复3次,即用流式细胞术分析,测定平均荧光强度(MFI),每份样本均设阴性对照(加相应IgG抗体),以消除本底荧光的影响。

2 结果
2.1 各组小鼠动脉粥样硬化血栓形成 各实验组小鼠外周血血小板浓度无明显差异(P>0.05)。TSLPR抗体处理组血管闭塞时间明显长于IgG对照组 (P<0.05),WT对照组血管闭塞时间明显长于IgG对照组(P<0.05),WT对照组与TSLPR抗体处理组血管闭塞时间无明显差异(P>0.05),见图1。
2.2 各组小鼠血小板聚集功能 TSLPR抗体处理组血小板聚集率明显低于IgG对照组和WT对照组(P<0.05)。WT对照组和IgG对照组血小板聚集率无明显差异 (P>0.05),见图2。
2.3 各组小鼠血小板释放功能 TSLPR抗体处理组血小板ATP释放水平明显低于IgG对照组和WT对照组(P<0.05)。WT对照组血小板ATP释放水平明显低于IgG对照组(P<0.05),见图3。
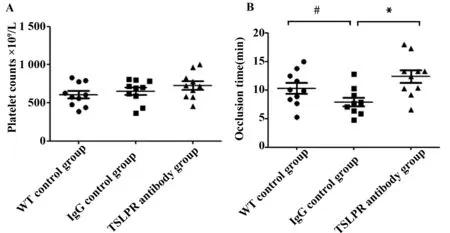
图1 各组小鼠动脉粥样硬化血栓形成Fig.1 Atherothrombosis in different groupsNote: A.Platelet concentration,there was no significant in different groups (P>0.05);B.Occlusion time of blood flow,*.P<0.05,vs TSLPR antibody group;#.P<0.05,vs WT control group.

图2 各组小鼠血小板聚集功能Fig.2 Platelet aggregation function in different groupsNote: A.Aggregation rate of platelet aggregation induced by collagen in different groups.*.P<0.05,vs TSLPR antibody group;B.Representative figure of platelet aggregation rate analysis was shown.

图3 各组小鼠血小板释放功能Fig.3 Platelet release function in different groupsNote: *.P<0.05,vs TSLPR antibody group;#.P<0.05,vs WT control group.
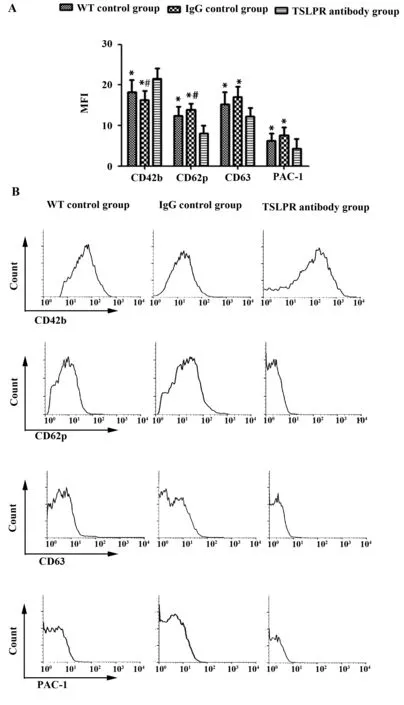
图4 各组小鼠血小板膜糖蛋白表达Fig.4 Expression of platelet membrane glycoprotein in different groupsNote: A.The mean fluorescence intensity(MFI) of CD42b,CD62p,CD63 and PAC-1 in platelets,*.P<0.05,vs TSLPR antibody group;#.P<0.05,vs WT control group;B.Representative figures are shown.
2.4 各组小鼠血小板膜糖蛋白表达 TSLPR抗体处理组血小板CD62p 、CD63、PAC-1表达明显低于PBS对照组和WT对照组(P<0.05),CD42b表达明显高于IgG对照组和WT对照组(P<0.05);WT对照组血小板CD62p表达明显低于IgG对照组(P<0.05),CD42b表达明显高于PBS对照组 (P<0.05),CD63、PAC-1表达无明显差异(P>0.05),如图4。
3 讨论
动脉粥样硬化是由血脂代谢异常诱发的动脉血管斑块形成为特征的免疫炎性疾病[1,3,14]。动脉粥样硬化的主要并发症为动脉粥样硬化血栓形成,其并发的心血管事件已成为冠状动脉粥样硬化患者最常见的死因。急性冠脉综合征是冠状动脉粥样硬化最严重的表现形式,其发生的主要原因为冠状动脉粥样硬化斑块病变处炎性细胞浸润,趋化和诱导下游炎症因子,促使斑块破裂,斑块破裂后暴露的胶原蛋白使血小板活化、黏附和聚集,导致冠状动脉内血栓形成,管腔闭塞,从而引发急性冠脉综合征等心血管事件。在这一病理过程中血小板的活化、聚集和释放发挥着重要的作用,抗血小板治疗成为预防和治疗动脉粥样硬化血栓形成的基石[2]。然而血小板活化是复杂的过程,其确切机制仍需进一步研究。已知血小板激活途径包括胶原、血栓素A2(TXA2)、二磷酸腺苷(ADP)、凝血酶和血小板膜糖蛋白GPⅡb/Ⅲa受体等方面,但现有抗ADP和环氧化酶(COX)、GPⅡb/Ⅲa等途径并不能完全阻断血小板的活化,说明可能还有其他活化机制,如细胞因子的作用[15,16]。
TSLP是一种新型的、与IL-7具有交叉生物学功能的细胞因子,具有重要的免疫调节效应。既往研究发现TSLP/TSLPR可促进Th1和Th17介导的免疫损伤;类风湿性关节炎、支气管哮喘黏膜和过敏性皮炎局部都有TSLP/TSLPR过表达,并在这些疾病的发生与发展过程中发挥重要作用[7-10]。新近的动物和临床研究均表明,TSLP抗体可减轻支气管哮喘患者的气道炎性反应并改善支气管狭窄状况[10,11]。我们研究发现,在血管紧张素Ⅱ或ox-LDL的诱导下,血管内皮细胞与平滑肌细胞的TSLP表达增加,冠状动脉粥样硬化患者AS斑块局部有TSLPR过表达,提示TSLP/TSLPR可能在AS中起到重要作用;我们还发现,人血小板表面有TSLPR表达,而ACS患者血小板表面TSLPR表达明显增加,TSLP可促进血小板活化,以上结果提示TSLP/TSLPR可能参与并促进ACS患者血小板活化后造成的血栓形成过程[4-6,12,13]。研究新型抗血小板活化抗体——TSLPR抗体可能为防治AS血栓形成提供更为有效的手段。
本实验通过在高脂喂养ApoE小鼠过程中周期性静脉注射TSLPR抗体,检测血小板功能和血栓形成,探究TSLPR抗体对抑制动脉粥样硬化血栓形成的影响。我们的研究表明,TSLPR抗体处理组血栓形成时间明显长于IgG对照组,TSLPR抗体处理组血小板聚集功能和释放功能明显低于IgG对照组,TSLPR抗体处理组血小板活化指标CD62p、CD63、PAC-1表达明显低于 IgG对照组,静息指标CD42b表达明显高于IgG对照组,表明TSLPR抗体可以明显抑制血小板聚集和释放功能,降低血小板活化程度,从而抑制动脉粥样硬化血栓形成。使用TSLPR单克隆抗体抗AS血栓形成,相比于传统抗血小板药物(如阿司匹林、氯吡格雷等),具有半衰期长,特异性强,安全性高等优点。希望本次研究结果可以为将来TSLPR抗体应用于临床提供理论与实验基础。
[1] Hansson GK,Robertson AK,Soderberg-Naucler C.Inflammation and atherosclerosis [J].Annu Rev Pathol,2006,1:297-329.
[2] Wang Y,Andrews M,Yang Y,etal.Platelets in thrombosis and hemostasis:Old topic with new mechanisms [J].Cardiovasc Hematol Disord Drug Targets,2012,12(2):126-132.
[3] Hansson GK.Inflammation,atherosclerosis,and coronary artery disease [J].N Engl J Med,2005,352(16):1685-1695.
[4] Wu C,He S,Peng Y,etal.TSLPR deficiency attenuates atherosclerotic lesion development associated with the inhibition of th17 cells and the promotion of regulator t cells in apoe-deficient mice [J].J Mol Cell Cardiol,2014,76:33-45.
[5] Lin J,Chang W,Dong J,etal.Thymic stromal lymphopoietin over-expressed in human atherosclerosis:Potential role in Th17 differentiation [J].Cell Physiol Biochem,2013,31(2-3):305-318.
[6] Zhao H,Li M,Wang L,etal.Angiotensin Ⅱ induces TSLP via an AT1 receptor/NF-kappaB pathway,promoting th17 differentiation [J].Cell Physiol Biochem,2012,30(6):1383-1397.
[7] Zhang Y,Zhou B.Functions of thymic stromal lymphopoietin in immunity and disease [J].Immunol Res,2012,52(3):211-223.
[8] Ying S,O′Connor B,Ratoff J,etal.Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease [J].J Immunol,2008,181(4):2790-2798.
[9] Ying S,O′Connor B,Ratoff J,etal.Thymic stromal lymphopoietin expression is increased in asthmatic airways and correlates with expression of Th2-attracting chemokines and disease severity [J].J Immunol,2005,174(12):8183-8190.
[10] Gauvreau GM,O′Byrne PM,Boulet LP,etal.Effects of an anti-TSLP antibody on allergen-induced asthmatic responses [J].N Engl J Med,2014,370(22):2102-2110.
[11] Cheng DT,Ma C,Niewoehner J,etal.Thymic stromal lymphopoietin receptor blockade reduces allergic inflammation in a cynomolgus monkey model of asthma [J].J Allergy Clin Immunol,2013,132(2):455-462.
[12] Wang B,Peng Y,Dong J,etal.Human platelets express functional thymic stromal lymphopoietin receptors:A potential role in platelet activation in acute coronary syndrome [J].Cell Physiol Biochem,2013,32(6):1741-1750.
[13] Dong J,Lin J,Wang B,etal.Inflammatory cytokine TSLP stimulates platelet secretion and potentiates platelet aggregation via a TSLPR-dependent pi3k/akt signaling pathway [J].Cell Physiol Biochem,2015,35(1):160-174.
[14] Warnatsch A,Ioannou M,Wang Q,etal.Inflammation.Neutrophil extracellular traps license macrophages for cytokine production in atherosclerosis [J].Science,2015,349(6245):316-320.
[15] Jackson SP.The growing complexity of platelet aggregation [J].Blood,2007,109(12):5087-5095.
[16] Kaushansky K.The molecular mechanisms that control thrombopoiesis [J].J Clin Invest,2005,115(12):3339-3347.
[收稿2015-11-30 修回2016-01-07]
(编辑 倪 鹏)
TSLPR antibody inhibits platelet function and atherothrombosis in ApoE-/-mice
WANG Bo-Yuan,WU Chun,HE Shao-Lin,HUANG Kai,LI Da-Zhu.
Department of Cardiology,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Objective:To explore the role of TSLPR antibody in the atherothrombosis inhibition.Methods: 8 weeks old ApoE-/-mice were fed with high-cholesterol diet for 12 weeks.During this time,mice in different groups were injected periodically with TSLPR antibody or isotype IgG respectively.The time of atherothrombosis,platelet aggregation function,platelet release function,and the expression of platelet membrane glycoprotein in different groups were detected.Results: Compared with those in the IgG control group,in the TSLPR antibody group the time of atherothrombosis was prolonged,the function of platelet aggregation and release was weakened,the expression of CD62p,CD63,PAC-1 was decreased,the expression of CD42b was increased.Conclusion: TSLPR antibody injection could inhibit atherosclerosis thrombus formation via weakening platelet aggregation and release function and repressing platelet activation.
TSLPR antibody;Atherosclerosis;Atherothrombosis;Platelet
10.3969/j.issn.1000-484X.2016.11.001
①本文受国家自然科学基金(81170258)和湖北省自然科学基金重点项目资助。
王博远(1986年-),男,在读博士,主要从事冠心病发病机理及其诊断与治疗的研究,E-mail:wby1101@163.com。
及指导教师:李大主(1964年-),男,博士,教授, 博士生导师,主任医师,主要从事冠心病发病机理及其诊断与治疗的研究,E-mail:lidazhuhp@sohu.com。
R392.11
A
1000-484X(2016)11-1569-04

