肺炎克雷伯菌和大肠埃希菌产超广谱β-内酰胺酶菌株的临床特点及感染的危险因素
余悦能 张祎萍 金旭红 钱文坚
●临床研究
肺炎克雷伯菌和大肠埃希菌产超广谱β-内酰胺酶菌株的临床特点及感染的危险因素
余悦能 张祎萍 金旭红 钱文坚
目的 探讨2012—2014年肺炎克雷伯菌(KPN)和大肠埃希菌(ECO)产超广谱β-内酰胺酶(ESBLs)菌株的临床分布、耐药性及危险因素,为临床合理使用抗生素及医院感染防控提供依据。方法 采用双纸片协同试验确认产ESBLs菌株,法国生物梅里埃ATB细菌鉴定仪对临床分离的病原菌进行菌种鉴定及药敏试验。采用多因素logistic回归分析评估产ESBLs耐药菌感染的独立危险因素。结果 2012、2013、2014年肺炎克雷伯菌检出率分别为13.7%、19.3%、21.4%;大肠埃希菌检出率为34.5%、41.2%、49.6%,呈逐年上升的趋势,且大肠埃希菌产ESBLs的检出率明显高于肺炎克雷伯菌(均P<0.05);产ESBLs肺炎克雷伯菌主要从痰液中检出,产ESBLs大肠埃希菌主要从尿液中检出;产ESBLs菌株对常用抗菌药物的耐药率普遍高于非产ESBLs菌株(均P<0.05)。产ESBLs菌株对青霉素类耐药率为92.5%~100.0%、对除头孢西丁外的头孢菌素类、喹诺酮类、磺胺类的耐药性超过50%,产ESBLs肺炎克雷伯菌和大肠埃希菌菌株对阿米卡星的耐药率分别为6.3%、5.2%,对哌拉西林/他唑巴坦的耐药率分别为15.6%、13.3%,对亚胺培南和美罗培南的耐药率最低;影响产ESBLs菌株感染的因素为:年龄≥55岁(OR=3.02,P=0.012)、住院≥15d(OR=3.76,P=0.008)、侵入性置管(OR=6.30,P=0.001)、使用糖皮质激素(OR=4.23,P=0.003)、使用喹诺酮类药物(OR=4.62,P=0.002)、使用第三代头孢菌素(OR=4.51,P=0.004)。结论 产ESBLs肺炎克雷伯菌和大肠埃希菌耐药现象严重,呈多重耐药,临床上应加强监测产ESBLs菌株的耐药情况,减少产ESBLs菌株的危险因素,科学合理应用抗菌药物,延缓细菌耐药性的变迁。
肺炎克雷伯菌 大肠埃希菌 超广谱β-内酰胺酶 耐药性 危险因素
超广谱β-内酰胺酶(ESBLs)主要由肺炎克雷伯菌和大肠埃希菌产生。由于第三、四代头孢菌素的广泛和不合理使用,耐药基因在细菌间不断扩散,产ESBLs耐药株逐年增多,已引起临床的广泛关注[1]。笔者选取近年我院分离出的产ESBLs肺炎克雷伯菌和大肠埃希菌,进行临床分布、耐药性的分析,并筛选产ESBLs菌株感染的危险因素,旨在为指导临床上合理选用抗菌药物,有效降低产ESBLs肺炎克雷伯菌和大肠埃希菌感染提供参考依据,现报道如下。
1 材料和方法
1.1 材料 选取2012年1月至2014年12月我院各科室住院患者的送检标本(痰液、尿液、全血、切口分泌物、脓液等),分离出肺炎克雷伯菌344株及大肠埃希菌316株,共660例患者,其中男312例,女348例,年龄32~89(66.23±12.09)岁。
1.2 ESBLs筛选 按美国临床实验室标准化协会(CLSI)2009年标准推荐的双纸片协同试验法。判断标准:ESBLs阳性株:酶抑制剂复方制剂与单药抑菌圈直径差≥5mm;ESBLs阴性株:酶抑制剂复方制剂与单药抑菌圈直径差<5mm。
1.3 菌株鉴定和药敏试验 严格按照《全国临床检验操作规程》(第3版)进行细菌培养,采用法国生物梅里埃公司ATB-Expression微生物分析系统及配套ID32E鉴定条、ATBG-5药敏条进行菌株鉴定和药敏试验。质控菌株:肺炎克雷伯菌ATCC700603和大肠埃希菌ATCC25922。
1.4 危险因素筛选 收集患者的临床资料,包括:一般资料(性别、年龄、基础疾病)、住院情况(住院时间、糖皮质激素的应用、侵袭性操作)、抗生素使用情况(喹诺酮类、氨基糖苷类、第一~四代头孢菌素)等。
1.5 统计学处理 采用SPSS21.0统计软件,计数资料组间比较采用χ2检验,单因素分析筛选出有统计学意义的影响因素作为自变量,将其纳入多因素logistic回归模型进行分析。
2 结果
2.1 2012—2014年肺炎克雷伯菌和大肠埃希菌产ESBLs菌株的检出率 见表1。
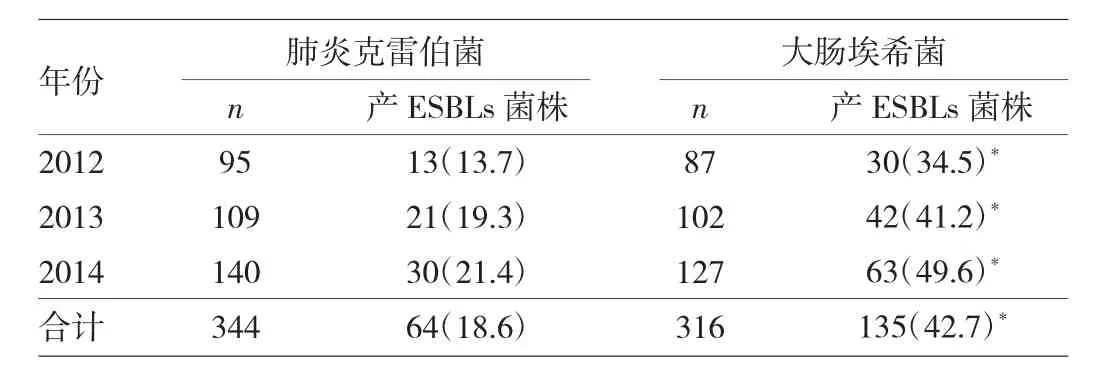
表1 2012—2014年肺炎克雷伯菌和大肠埃希菌产ESBLs菌株的检出率[株(%)]
由表1可见,2012—2014年产ESBLs菌株检出率呈逐年上升的趋势,且大肠埃希菌产ESBLs的检出率均明显高于肺炎克雷伯菌(均P<0.05)。
2.2 肺炎克雷伯菌和大肠埃希菌产ESBLs菌株在不同标本中的分布比较 见表2。
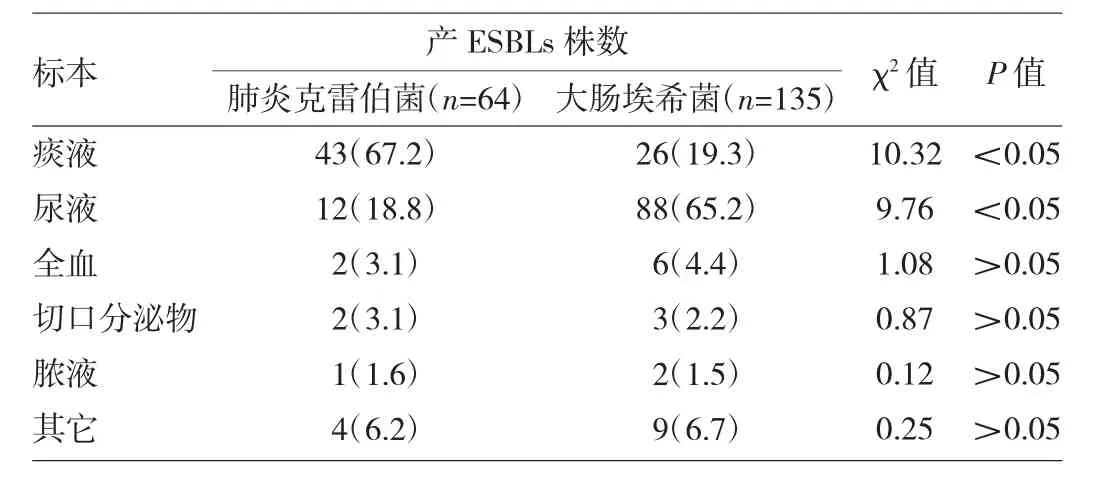
表2 肺炎克雷伯菌和大肠埃希菌产ESBLs菌株在不同标本中的分布比较[株(%)]
由表2可见,肺炎克雷伯菌产ESBLs菌株主要分离自痰液标本,占67.2%,明显高于大肠埃希菌产ESBLs菌株的19.3%(P<0.05);大肠埃希菌产ESBLs菌株主要分离自尿液标本,占65.2%,明显高于肺炎克雷伯菌产ESBLs菌株的18.8%(P<0.05),其他标本间的差异均无统计学意义(均P>0.05)。
2.3 产ESBLs与非产ESBLs肺炎克雷伯菌和大肠埃希菌对抗菌药物耐药率的比较 见表3。
由表3可见,除碳青霉烯类抗菌药物(亚胺培南、美罗培南)外,产ESBLs菌对其余15种抗菌药物的耐药率均明显高于非产ESBLs菌(均P<0.05)。产ESBLs菌株对青霉素类、除头孢西丁外的头孢菌素类药物有较高耐药性,为92.2%~100.0%,对除阿米卡星的氨基糖苷类、喹诺酮类、磺胺类药的耐药率达50.0%以上,对碳青酶烯类、阿米卡星的耐药率低,为0.0%~7.8%,哌拉西林/他唑巴坦的耐药率较低,分别为15.6%、13.3%。

表3 产ESBLs与非产ESBLs肺炎克雷伯菌和大肠埃希菌对抗菌药物耐药率的比较[株(%)]
2.4 产ESBLs菌株感染的危险因素分析
2.4.1 单因素分析 见表4。

表4 产ESBLs菌株感染相关因素的单因素分析[株(%)]
由表4可见,产ESBLs菌株感染的危险因素:年龄≥55岁、住院≥15d、侵入性置管、使用糖皮质激素、使用抗生素(喹诺酮类、氨基糖苷类、第三代头孢菌素和第四代头孢菌素)。
2.4.2多因素logistic回归分析 见表5。
由表5可见,年龄≥55岁、住院≥15d、侵入性置管、使用糖皮质激素、使用抗生素(喹诺酮类、第三代头孢菌素),是产ESBLs菌株感染的独立危险因素(均P<0.05)。
3 讨论
3.1 产ESBLs大肠埃希菌和肺炎克雷伯菌的临床分布 本文结果显示,2012—2014年我院产ESBLs菌株检出率呈上升趋势,产ESBLs肺炎克雷伯菌从13.7%增加至21.4%,产ESBLs大肠埃希菌从34.5%增加至49.6%,与张瑞君等[2]报道的趋势一致,说明产ESBLs的肺炎克雷伯菌和大肠埃希菌已达到一定比例,需引起临床医生的高度重视,且感染大肠埃希菌更易产生ESBLs菌株。产ESBLs肺炎克雷伯菌和大肠埃希菌分离自痰液、尿液、血液、切口分泌物、脓液等标本,其中产ESBLs肺炎克雷伯菌以痰液为主(67.2%),主要引起呼吸道感染;产ESBLs大肠埃希菌以尿液为主(65.2%),主要引起泌尿道感染,与詹燏、侯利剑等[3-4]的报道一致。

表5 产ESBLs菌株感染相关因素的多变量logistic回归分析
3.2 产ESBLs大肠埃希菌和肺炎克雷伯菌的耐药分析 药敏试验显示,临床抗生素治疗面临产ESBLs大肠埃希菌和肺炎克雷伯菌耐药的严重挑战,除碳青霉烯类抗菌药物(亚胺培南、美罗培南)外,产ESBLs菌对抗菌药物的耐药率均明显高于非产ESBLs菌(均P<0.05)。对青霉素类、除头孢西丁外的头孢菌素类药物的耐药率高达95.3%~100.0%,提示抗产ESBLs菌株感染时不宜使用第二、三、四代头孢菌素,对氨基糖苷类药中的妥布霉素、磺胺类药中的复方新诺明耐药率超过50.0%,说明应慎用出现多重耐药的氨基糖苷类和磺胺类[5]。对喹诺酮类药中的环丙沙星耐药率高达51.6%、59.3%,与喹诺酮类药物长期作为泌尿系感染时临床医师经验性首选用药有关。产ESBLs大肠埃希菌对美罗培南和亚胺培南全部敏感,碳青霉烯类可作为临床上产ESBLs大肠埃希菌严重感染时的首选用药,但临床上现陆续出现耐亚胺培南的大肠埃希菌的报道[6],可能与碳青霉烯类抗生素应用增多有关。结果显示肺炎克雷伯菌对亚胺培南出现1例耐药菌株,耐药率为1.6%,对美罗培南出现2例耐药菌株,耐药率为3.1%,应引起高度重视。对阿米卡星的耐药率为6.3%、5.2%,可能与阿米卡星经结构改造、能抵抗氨基糖苷修饰酶的半合成氨基糖苷类抗生素有关。对哌拉西林-他唑巴坦的耐药率为15.6%、13.3%,与他唑巴坦作为不可逆β-内酰胺酶抑制剂有关,与β-内酰苷类抗生素联用可增强其抗菌活性,对产ESBLs菌株抑制作用强。故阿米卡星、哌拉西林-他唑巴坦可选做产ESBLs大肠埃希菌和肺炎克雷伯菌的替代治疗用药。另外,两种产ESBLs菌的耐药性也存在一定的差异,产ESBLs肺炎克雷伯菌对阿莫西林/克拉维酸、替卡西林/克拉维酸的的耐药率为73.4%、87.5%,产ESBLs大肠埃希菌的耐药率为40.7%、61.5%,由于抗生素的广泛应用,产ESBLs大肠埃希菌和肺炎克雷伯菌多药耐药现象普遍,耐药性复杂,应根据细菌药敏结果合理选用抗生素。
3.3 产ESBLs大肠埃希菌和肺炎克雷伯菌感染的危险因素分析 多因素logistic回归分析显示,高龄、住院时间是产ESBLs菌株感染的独立危险因素。≥55岁的高龄患者自身免疫力低下,对外界细菌侵袭的抵御能力降低,容易感染各类细菌。住院时间越长的患者,一方面,接受各种治疗和接触各类病原菌的机会越大,交叉感染的机会也越大;另一方面,感染也会相应延长患者的住院时间。与冯慧芬等[7]的报道一致。多因素logistic回归分析显示OR=6.30,P<0.05,证实侵入性置管是产ESBLs菌株感染的强危险因素,侵袭性操作需要突破人体的基础防御屏障,产ESBLs菌株定植于黏膜表面并定期释放入血,且留置导管内壁容易形成细菌生物膜,使细菌产生耐药性,再则,侵入性操作使临床医师可能予更高级别的抗生素且增加治疗时间,加大产ESBLs细菌感染的风险。因此,临床上需减少不必要的介入性操作,操作过程中需加强医务人员的无菌观念和操作规范[8]。在多因素logistic回归分析中,使用糖皮质激素确定是产ESBLs菌株感染的独立危险因素,与皮质激素本身即可抑制免疫功能,也掩盖了潜在的感染有直接关系,需在临床上合理使用激素。临床上第三代头孢菌素类、喹诺酮的广泛应用,在杀灭敏感菌群的同时,广泛且不合理应用易诱导产ESBLs菌株,成为其感染的独立危险因素。提示我们应进一步合理使用第三代头孢菌素类和喹诺酮类药物,以避免诱导越来越多的产ESBLs菌产生。单因素分析显示产ESBLs菌株和非产ESBLs菌株的第四代头孢菌素类的差异有统计学意义(P<0.05),纳入多因素logistic回归分析显示P>0.05,未见统计学差异,与黄蓓洁等[9]的报道不一致,可能是不同地区、不同医院医生的抗生素用药习惯差异导致。我们在临床治疗中,需规范使用抗菌素和激素类,严格掌握侵入性操作的指征,时刻贯彻无菌原则,缩短不必要的住院时间,特别是对于高龄患者更应引起重视,最大程度减少产ESBLs菌感染的概率。
综上所述,各级医院需要掌握感染的流行病学及耐药性的变化规律,加强产ESBLs菌株的耐药检测,控制产ESBLs细菌的高危因素,科学合理选用抗菌药物,有效措施控制产ESBLs菌的播散和流行。
[1] 蒋冬香,陈刚,王玉春,等.产ESBLs大肠埃希菌与肺炎克雷伯菌的临床分布及耐药性[J].中华医院感染学杂志,2011,21(2):371-373.
[2] 张瑞君,鞠春梅,王海涛,等.产超广谱β-内酰胺酶大肠埃希菌的临床分布及耐药性分析[J].中国临床研究,2015,28(2):249-250.
[3] 詹燏,张红梅,汪慧,等.泌尿系感染病原菌分布及耐药分析[J].中华医院感染学杂志,2012,22(4):845-847.
[4] 侯利剑,梁毅.不同标本中大肠埃希菌与肺炎克雷伯菌的耐药分析[J].检验医学与临床,2013,10(7):784-785.
[5] Petty N K,Ben Zakour N L,Stanton-Cook M,et al.Globaldissemination of a muhidrug resistant Escherichia coli clone[J].Proc Natl Acad SciU S A,2014,111(15):5694-5699.
[6] 王云凤.革兰阴性杆菌对亚胺培南耐药性的变迁[J].中华医院感染学杂志,2012,22(13):2914-2916.
[7] 冯慧芬,赵秋民,段广才,等.产超广谱β-内酰胺酶大肠埃希菌和肺炎克雷伯菌的耐药性及其危险因素分析[J].现代预防医学,2015,42(7): 1325-1327.
[8] Cetinkaya B,Tezer H,Ozkaya P A,et al.Evaluation of pediatric patients with hepatitis A[J].J Infect Dev Ctries,2014,8(3):326-330.
[9] 黄蓓洁,郭雪君,倪培华,等.产超广谱β-内酰胺酶大肠埃希菌和肺炎克雷伯菌肺炎临床及基因型分析[J].中国呼吸与危重监护杂志,2010,9 (2):172-176.
Distribution and antibiotic resistance of ESBLs-producing Klebsiella pneumoniae and Eschedchia coli clinical isolates and risk factors of infection
YU Yueneng,ZHANG Weiping,JIN Xuhong,et al.Department of Clinical Laboratory,Yiwu TCM Hospital,Yiwu 322000, China
【 Abstract】 Objective To investigate the clinical distribution,drug resistance and risk factors of Klebsiella pneumoniae (KPN)and Escherichia coli(ECO)from 2012 to 2014 in Yuwu TCM Hospital.Methods The extended-spectrum β-lactamases (ESBLs)-producing bacteria were detected by using the double-disk synergy testing.Pathogens identification and drug susceptibility test were performed for clinical isolated strains using BioMerieux ATB bacteria detection machine.Multivariate Logistic regression analysis was performed to analyze the risk factors of infection of ESBLs-producing E.coli and K.pneumonia. Results The detection rates of ESBLs-producing K.pneumonia were 13.7%,19.3%and 21.4%in 2012,2013 and 2014, respectively;while the detection rates of ESBLs-producing E.coli were 34.5%,41.2%and 49.6%,respectively.The increase of detection rate by year ofESBLs-producing E.coliwas higher than that ofESBLs-producing K.pneumonia(P<0.05).K.pneumoniae was more commonly isolated from sputum (67.2%),E.coli was more commonly from urine(65.2%).The drug resistance rates of ESBLs-producing bacterial isolates were higher than that of non-ESBLs-producing bacterial isolates(P<0.05).Drug resistance rate of ESBLs-producing bacteria to penicillins was the highest(92.5%~100.0%),the rates of resistance to aminoglycosides (amikacin excluded),quinolones and sulphonamides were over 50%,that to amikacin was 6.3%and 5.2%,to Piperacillin/ Tazobactam was 15.6%and 13.3%,the lowest resistance was found in imipenem and meropenem.Multivariate Logistic regression analysis showed that the independent risk factors of ESBLs-producing bacterial infections were:aged>55 years(OR=3.02, P=0.012),length of hospital stay>15d (OR=3.76,P=0.008);invasive catheterization (OR=6.30,P=0.001),administration of glucocorticoid hormone(OR=4.23,P=0.003),quinolones(OR=4.62,P=0.002),and the third generation cephalosporins(OR=4.51,P=0.004). Conclusion The status of drug resistance of ESBLs-producing K.pneumonia and E.coli is serious and multidrug-resistance is common.In order to delay the drug-resistance of ESBLs-producing bacteria,it is necessary to strengthen the monitoring ofdrug resistance,to reduce the risk factors and to reasonably use antibiotics.
Klebsiella pneumonia Escherichia coliESBLs Drug resistance Risk factors
2015-07-09)
(本文编辑:沈昱平)
义乌市科研计划项目(13-3-10)
322000 义乌市中医医院检验科

