DADS上调RORα抑制人胃癌MGC803细胞增殖与迁移侵袭
,, ,, , , , *
(1.南华大学药学与药理学研究所,湖南省高校药物蛋白质组学重点实验室,湖南 衡阳 421001;2.南华大学肿瘤研究所,湖南省胃癌研究中心,湖南省高校肿瘤细胞与分子病理学重点实验室;3.南华大学附属怀化医院,怀化市第一人民医院;4.南华大学附属第二医院病理科;5.海南省妇幼保健院)
·消化系统疾病专题·
栏目主持人——许翠萍博士

许翠萍 博士
论文点评:消化系统疾病是人类的多发病和常见病,包括消化道肿瘤、溃疡、胃炎、慢性肝病等。本期苏波等发表的二烯丙基二硫(DADS)通过上调维甲酸相关孤核受体α(RORα)表达抑制人胃癌MGC803细胞增殖、细胞周期与迁移侵袭,为探索和开发研究抑制胃癌新药提供了实验依据。陈敏等观察到替吉奥单药联合热疗技术能显著增强老年晚期胃癌患者的临床治疗效果,且治疗过程中不良反应较少,值得借鉴。在消化性溃疡方面,朱友等临床观察到注射用奥美拉唑联合康复新液治疗消化性溃疡并出血的临床效果较好,复发率低,为该类疾病的治疗提供了有价值的依据。乙型肝炎治疗也是医学难题之一,滕丹华及其同行发现e抗原阳性乙型肝炎病毒(HBV)患者应用干扰素联合拉米夫定治疗可以改善血清ALT、HBV DNA水平、提高HBeAb/HBeAg转换率、HBsAg及HBV DNA阴转率,治疗过程中不良反应少、应予推广。在本期鲍乐及其同事还探讨两种不同化疗方案联合经导管肝动脉化疗栓塞(TACE)治疗不可切除肝癌的临床疗效和安全性,结果发现雷替曲塞与奥沙利铂联合TACE治疗不可切除肝癌的临床疗效较好,不良反应较少、值得临床参考。
DADS上调RORα抑制人胃癌MGC803细胞增殖与迁移侵袭
苏波1,2,向姝霖2,3,苏坚2,4,赵晓红2,5,夏红2,刘芳2,凌晖2,苏琦2*
(1.南华大学药学与药理学研究所,湖南省高校药物蛋白质组学重点实验室,湖南 衡阳 421001;2.南华大学肿瘤研究所,湖南省胃癌研究中心,湖南省高校肿瘤细胞与分子病理学重点实验室;3.南华大学附属怀化医院,怀化市第一人民医院;4.南华大学附属第二医院病理科;5.海南省妇幼保健院)
目的研究二烯丙基二硫(DADS)是否通过上调维甲酸相关孤核受体α(RORα)表达抑制人胃癌MGC803细胞增殖、细胞周期与迁移侵袭。方法实验组分为6组,对照组,空载体组,RORα干扰组(miR-RORα),DADS组,空载体联合DADS组,miR-RORα联合DADS组。Western blot检测RORα、MMP-9与TIMP3蛋白表达。MTT、流式细胞术、迁移和侵袭实验分别检测细胞增殖、细胞周期与迁移侵袭的改变。结果DADS处理细胞24 h后,与对照组和空载体组比较,DADS上调RORα和TIMP3、下调MMP-9蛋白表达。干扰组较对照组与空载体组RORα表达明显下调。与DADS处理组比较,干扰RORα表达上调MMP-9、下调TIMP3蛋白表达。MTT实验显示,DADS抑制MGC803细胞增殖,而干扰RORα表达促进增殖。流式细胞术显示,DADS诱导G2/M期阻滞,下调RORα削弱其作用。迁移实验显示,DADS处理组迁移距离明显减少。RORα干扰组迁移距离明显高于对照组和空载体组。侵袭实验显示,DADS处理组较对照组和空载体组穿膜细胞明显减少。干扰组穿膜细胞明显多于对照组和空载体组。干扰RORα表达降低DADS对细胞迁移和侵袭的抑制作用。结论DADS上调TIMP3表达,下调MMP-9表达,抑制MGC803细胞增殖与迁移侵袭,其作用机制与上调RORα表达有关。
二烯丙基二硫; RORα; 人胃癌细胞; 增殖; 迁移与侵袭
胃癌是最常见的恶性肿瘤之一,发生率与死亡率分别为全球第四位与第三位[1]。据2015年最新统计,胃癌在我国的发生率与死亡率位于第二,每年约新发67.9万和死亡49.8万人[2]。由于患者就诊时大多已发生侵袭转移,5年生存率低于10%[3]。因此,研究胃癌侵袭转移机制,寻找靶点具有重要的意义。
维甲酸相关孤核受体α(Retinoid acid receptor related Orphan Receptor α,RORα)是核受体超家族成员之一,在调节生理与病理过程中发挥重要作用[4]。近年来,发现RORα与肿瘤密切相关,可能是肿瘤治疗靶点[5]。最近,本实验室运用蛋白质组学技术鉴定二烯丙基二硫(Diallyl disulfide,DADS)处理人胃癌MGC803细胞的差异蛋白,发现RORα蛋白表达明显上调[6]。本实验进一步研究DADS是否通过上调RORα抑制胃癌细胞增殖与迁移侵袭。
1 材料与方法
1.1细胞培养人胃癌MGC803细胞株由本实验室保存,miR-RORα稳定表达细胞株由本实验室构建[7],置于含10%小牛血清的RPMI1640培养基中,37 ℃,5% CO2、饱和湿度的培养箱内传代培养。取对数生长期的细胞用于实验。实验组分为6组:未处理对照组,DADS组,空载体组,RORα干扰组(miR-RORα),空载体联合DADS组,miR-RORα联合DADS组。
1.2主要试剂BCA蛋白定量试剂盒为Promega公司产品;RORα与β-actin抗体购自Abcam公司;MMP-9与TIMP3 抗体和ECL发光试剂盒购自Santa Cruz公司;新生牛血清购自杭州四季青生物工程公司。
1.3 MTT检测取对数生长期细胞,接种于96孔平底培养板,每个样本设6个重复孔。细胞贴壁6~8 h后更换为150 μL RPMI 1640完全培养基,再加入20 μL 5 mg/mL MTT溶液,继续培养4 h后,吸弃培养基,加150 μL DMSO溶液,室温震荡10 min,酶联免疫检测仪OD570nm处测量各孔吸光值。细胞增殖抑制率=(1-实验组OD570值/对照组OD570) ×100%。
1.4流式细胞术检测取对数生长期细胞,1 000 rpm×5 min离心,预冷PBS液重悬细胞,重复离心一次;将收集的细胞用4 ℃预冷的75%乙醇固定。上机前将乙醇固定的细胞离心洗涤,去上清摇匀;加RNA酶50 μL,37 ℃水浴30 min;加碘化丙啶50 μL,振荡混匀,避光置冰箱30 min;300目尼龙网滤过,上机检测,进行细胞周期分析。
1.5迁移实验将0.8×105个各组MGC803细胞接种在12孔细胞培养板中,每组3个平行样本。RPMI 1640培养基37 ℃、5% CO2培养,直至形成细胞单层。用20 μL的tip头垂直板面划痕,无血清培养液洗3次,加入新鲜无血清培养基。倒置显微镜下观察、测量划痕区相对距离。
1.6侵袭实验将基质胶稀释液铺置在transwell小室中,放置成膜。取100 μL细胞稀释液接种至小室上腔,取500 μL含10%胎牛血清培养基添加至下腔,小室放置在37 ℃、5% CO2的细胞培养箱中培养36 h后取出,擦弃小室上层细胞并用4%多聚甲醛固定10 min,0.1%结晶紫染色,PBS液洗涤,晾干。光镜下观察随机选取4个高倍视野进行细胞计数,取平均值。
1.7 Western blot检测收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加一抗,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X片曝光、显影、定影。
1.8统计学分析各组实验数据采用均值±标准差表示,SPSS 13统计软件进行统计学分析,结果比较采用t检验,P<0.05为差异具有显著性意义。
2 结 果
2.1 DADS上调MGC803细胞RORα表达如图1所示,与对照组、空载体组比较,用30 mg/L DADS处理细胞24 h后, RORα蛋白表达明显上调(P<0.05),而miR-RORα稳定表达细胞(RORα干扰组)RORα蛋白表达明显下调(P<0.05)。miR-RORα可显著下调DADS处理组RORα蛋白表达 (P<0.05)。
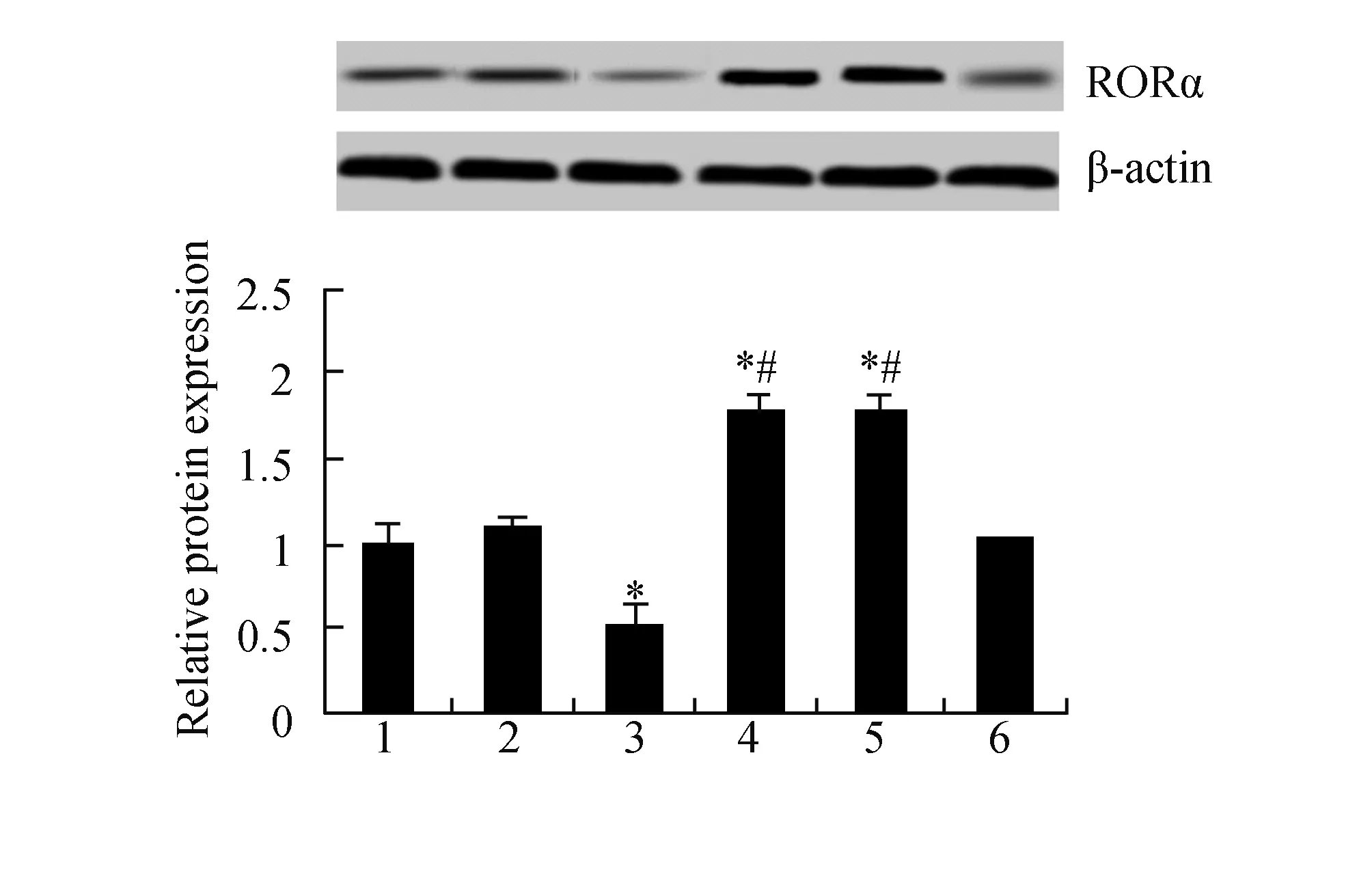
图1 DADS与miR-RORα对RORα蛋白表达的影响 1:对照组;2:空载体;3:miR-RORα;4:DADS;5:空载体联合DADS;6:miR-RORα联合DADS. 与对照组和空载体组比较,*P<0.05;与miR-RORα联合DADS组比较,#P<0.05
2.2干扰RORα表达对DADS抑制MGC803细胞增殖的影响之前已证实干扰-RORα表达可促进细胞增殖[7]。为了研究下调RORα表达是否影响DADS对细胞增殖的抑制作用,用30 mg/L DADS分别处理miR-RORα稳定表达MGC803细胞24,48和72 h。结果显示,与DADS组、空载体联合DADS组比较,miR-RORα联合DADS组细胞增殖抑制率下调 (P<0.05)。见表1。
表1MTT检测干扰RORα表达对DADS处理不同时间细胞增殖率的影响(%)
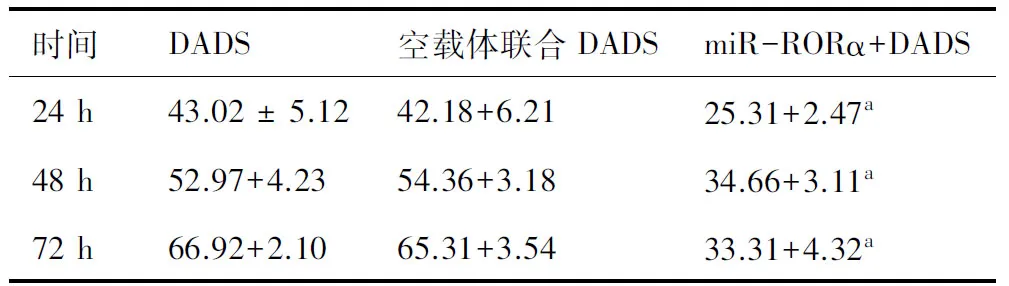
时间DADS空载体联合DADSmiR-RORα+DADS24h43.02±5.1242.18+6.2125.31+2.47a48h52.97+4.2354.36+3.1834.66+3.11a72h66.92+2.1065.31+3.5433.31+4.32a
与DADS和空载体联合DADS相同时间比较, a:P<0.05
2.3 DADS与干扰RORα表达对MGC803细胞周期的影响如表2所示,对照组与空载体组G2/M期细胞百分率分别为21.5%与20.7%。干扰RORα表达后,G2/M期细胞比率为11.6%。用30 mg/L DADS处理24 h后,DADS组与空载体联合DADS组G2/M期细胞比率分别为44.0%与43.6%,较对照组与空载体组明显增加(P<0.05),而miR-RORα联合DADS组G2/M期细胞比率为33.1%,低于DADS组与空载体联合DADS组。
表2DADS与干扰RORα表达对MGC803细胞周期的影响(%)

对照组空载体组miR-RORαDADS空载体联合DADSmiR-RORα联合DADSG152.451.941.529.331.732.6S26.127.446.926.724.734.3G2/M21.520.711.6a44.0ab43.6ab33.1
与对照组和空载体组比较,a:P<0.05; 与 miR-RORα联合DADS比较, b:P<0.05
2.4 DADS与干扰RORα表达对MGC803细胞迁移的影响如图2所示,0 h各组划痕距离基本相同 (P>0.05)。24 h后,miR-RORα组迁移距离1.76 ± 0.19 mm明显高于对照组1.32 ± 0.14 mm和空载体组1.29 ± 0.17 mm (P<0.05)。用30 mg/L DADS处理24 h后,DADS组和空载体联合DADS组迁移距离分别明显减少为0.58±0.08 mm、0.61±0.07 mm,而miR-RORα联合DADS组迁移距离0.95±0.09 mm较DADS组和联合DADS组迁移距离增加 (P<0.05)。

图2 DADS与干扰RORα表达对胃癌MGC803细胞迁移的影响(100×)
2.5 DADS与干扰RORα表达对MGC803细胞侵袭的影响如图3所示,miR-RORα组穿膜细胞172±27个明显多于对照组147±17个和空载体组149±14个(P<0.05)。用30 mg/L DADS处理24 h后,DADS组和空载体联合DADS组平均细胞数分别为35±4和37±8个,细胞侵袭能力均明显减弱(P<0.05),而miR-RORα联合DADS组穿膜细胞97±18个,与DADS组与空载体联合DADS组比较差异具有显著性(P<0.05)。
2.6 DADS与干扰RORα表达对MGC803细胞MMP-9和TIMP3表达的影响与对照组和空载体组比较,干扰RORα表达可明显上调MMP-9、下调TIMP3蛋白表达 (P<0.05);用30 mg/L DADS处理24 h后,可明显下调MMP-9、上调TIMP3蛋白表达(P<0.05)。干扰RORα表达后,DADS对MMP-9和TIMP3蛋白表达的作用减弱(P<0.05)。见图4。
3 讨 论
目前认为,RORα在肿瘤中起着抑癌基因的作用。RORα在乳腺癌表达下调和活性下降,而上调RORα表达可在体内外抑制乳腺癌细胞增殖与侵袭和裸鼠移植瘤生长,促进SEMA3F表达上调,提示RORα是乳腺癌治疗的靶点[5,8]。RORα及其靶基因在人结肠癌中表达降低,而RORα活化可抑制结肠癌细胞增殖与迁移以及血管发生,表明RORα低表达是结肠癌发生的危险信号[9]。RORα磷酸化可竞争结合β-catenin,抑制Wnt/β-catenin通路靶基因cyclin D1、c-myc、Axin表达。RORα可依赖PGE2/PKCα途径磷酸化减弱结肠癌细胞Wnt靶基因表达,表明RORα是肿瘤细胞增殖的关键调控因子[10,11]。RORα在肝癌组织表达明显下调,与血清AFP、病理分级、肿瘤复发、血管侵袭和预后密切相关[12]。本实验室证实,RORα蛋白在胃癌组织表达明显低于正常胃黏膜和癌旁黏膜,高分化腺癌明显高于中分化与低分化腺癌,表明RORα低表达与胃癌的发生和分化相关[13]。近年来,研发促进RORα表达的有效药物为治疗肿瘤开拓了新的途径[5]。植物提出物neoruscogenin可活化RORα并影响其靶基因的表达[14]。RORα 激动剂SR1078处理肿瘤细胞可稳定p53蛋白表达与诱导凋亡[15]。

图3 DADS与干扰RORα表达对MGC803细胞侵袭能力的影响(100×) A:对照组;B:空载体组;C:miR-RORα;D:DADS;E:空载体联合DADS;F:miR-RORα联合DADS

图4 DADS与干扰RORα表达对MMP-9和TIMP3蛋白表达的影响 1:对照组;2:空载体组;3:miR-RORα;4:DADS;5:空载体联合DADS;6:miR-RORα联合DADS 与对照组和空载体组比较, *P<0.05; 与空载体联合DADS 和 DADS比较,#P<0.05
二烯丙基二硫(diallyl disulfide,DADS)是大蒜中的一种脂溶性的有效成分,对多种肿瘤均有明显的抑制作用,在调节生物酶降低化学致癌物毒性,抑制DNA加合物形成,阻滞细胞周期演进,诱导肿瘤细胞分化和调亡,组蛋白修饰,抑制迁移侵袭等方面发挥重要作用,是一种具有开发潜力的抗肿瘤药物[16]。前期工作证明,DADS可体内外抑制MGC803细胞的增殖,其机制与G2/M阻滞,激活p38与抑制ERK通路,调节ATR/Chk1/Cdc25C/cyclin B1,上调组蛋白乙酰化与p21,上调miR-200b和miR-22阻断Wnt通路等有关[16-19]。并且,DADS可通过Rac1-Pak1/Rock1通路下调LIMK1、MMP-9和上调TIMP-3,抑制人胃癌细胞EMT与侵袭[20]。最近,本实验室发现DADS处理人胃癌MGC803细胞差异蛋白质中,RORα蛋白明显上调[6]。本研究结果显示,DADS上调 RORα表达,下调MMP-9和上调TIMP3表达,而干扰RORα表达可降低DADS的作用。DADS诱导MGC803细胞增殖抑制与G2/M期阻滞,而干扰RORα表达可削弱其作用。迁移实验与侵袭实验显示,干扰RORα表达可降低DADS对MGC803细胞迁移与侵袭的抑制作用。上述结果表明下调RORα促进MGC803细胞增殖与迁移侵袭,DADS上调RORα与其下调MMP-9和上调TIMP3、抑制细胞增殖与迁移侵袭有关。然而,DADS上调RORα抑制人胃癌细胞增殖与迁移侵袭的分子机制尚待深入研究。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012 [J].CA Cancer J Clin,2015,65(2):87-108.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015 [J].CA Cancer J Clin,2016,66(2):115-132.
[3] Orditura M,Galizia G,Sforza V,et al.Treatment of gastric cancer [J].World J Gastroenterol,2014,20(7):1635-1649.
[4] 赵晓红,苏琦.维甲酸相关孤核受体α与Wn1t信号途径及肿瘤的关系 [J].国际病理科学与临床杂志,2011,31(3):234-237.
[5] Du J,Xu R.RORα,a potential tumor suppressor and therapeutic target of breast cancer [J].Int J Mol Sci,2012,13(12):15755-15766.
[6] Su B,Su J,He H,et al.Identification of potential targets for diallyl disulfide in human gastric cancer MGC-803 cells using proteomics approaches [J].Oncol Rep,2015,33(5):2484-94.
[7] 凌晖,陈真伟,曾铁兵,等.RORα miRNA真核表达载体构建及对人胃癌细胞增殖的影响[J].中国现代医药杂志,2011,13(2):1-4.
[8] Xiong G,Wang C,Evers BM,et al.RORα suppresses breast tumor invasion by inducing SEMA3F expression [J].Cancer Res,2012,72(7):1728-1739.
[9] Xiao L,Wang J,Li J,et al.RORα inhibits adipocyte-conditioned medium-induced colorectal cancer cell proliferation and migration and chick embryo chorioallantoic membrane angiopoiesis [J].Am J Physiol Cell Physiol,2015,308(5):C385-396.
[10] Lee JM,Kim IS,Kim H,et al.RORalpha attenuates Wnt/beta-catenin signaling by PKCalpha-dependent phosphorylation in colon cancer [J].Mol Cell,2010,37(2):83-195.
[11] Shin D,Kim IS,Lee JM,et al.The hidden switches underlying RORα-mediated circuits that critically regulate uncontrolled cell proliferation [J].J Mol Cell Biol,2014,6(4):338-348.
[12] Fu RD,Qiu CH,Chen HA,et al.Retinoic acid receptor-related receptor alpha (RORalpha) is a prognostic marker for hepatocellular carcinoma [J].Tumour Biol,2014,35(8):7603-7610.
[13] 石莺,黄建军,苏坚,等.RORα蛋白在胃癌中的表达及临床病理意义 [J].实验与病理学杂志,2012,28(3):270-273.
[14] Helleboid S,Haug C,Lamottke K,et al.The identification of naturally occurring neoruscogenin as a bioavailable,potent,and high-affinity agonist of the nuclear receptor RORα (NR1F1) [J].J Biomol Screen,2014,19(3):399-406.
[15] Wang Y,Solt LA,Kojetin DJ,et al.Regulation of p53 stability and apoptosis by a ROR agonist [J].PLoS One,2012,7(4):e34921.
[16] Yi L,Su Q.Molecular mechanisms for the anti-cancer effects of diallyl disulfide [J].Food Chem Toxicol,2013,57:362-370.
[17] Su B,Xiang SL,Su J,et al.Diallyl disulfide increased histone acetylation and p21WAF1 expression in human gastric cancer cells in vivo and in vitro [J].Biochem Pharmacol,2012,1(7):1-10.
[18] Su B,He H,Wang L,et al.Chk1,but not Chk2,is responsible for G2/M phase arrest induced by diallyl disulfide in human gastric cancer BGC823 cells [J].Food Chem Toxicol,2014,68:61-70.
[19] Tang H,Kong Y,Guo J,et al.Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22 [J].Cancer Lett,2013,340(1):72-81.
[20] Su B,Su J,Zeng Y,et al.Diallyl disulfide suppresses epithelial-mesenchymal transition,invasion and proliferation by downregulation of LIMK1 in gastric cancer [J].Oncotarget,2016,7(9):10498-10512.
Up-regulationofRORαInducedbyDiallylDisulfideInhibitingProliferaion,MigrationandInvasionofHumanGastricCancerMGC803Cells
SU Bo,XIANG Shulin,SU Jian,et al
(KeyLaboratoryforPharmacoproteomicsofHunanProvincialUniversity,InstituteofPharmacyandPharmacology,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo investigate whether diallyl disulfide (DADS) inhibits human gastric cancer MGC803 cell proliferation,migration and invasion by up-regulating the expression of RORα.MethodsThe experimental group was divided into six groups,control group,vector group,DADS group,vector+DADS group,and miR-RORα+DADS group.RORα,miR-RORα,MMP-9 and TIMP3 protein levels were detected by using Western blot.MTT and flow cytometry were used for cell proliferation and cell cycle assays.Wound healing and transwell assays were performed to examine cell migration and invasion activities.ResultsDADS increased RORα and TIMP3 expression,decreased MMP-9 expression.TIMP3 was down-regulated and MMP-9 was up-regulated in miR-RORα stable expression cells.DADS induced cell proliferation inhibition and cell cycle G2/M phase arrest.Downregulation of RORα by miR attenuated these effects of DADS.Compared with control and vector groups,the migration distance was decreased and increased in DADS treated and miR-RORα expression groups,respectively.And,the mumber of cancer cells which passed through the Matrigel coated membrane was reduced and increased in DADS treated and miR-RORα expression groups,respectively.miR-RORα attenuated the inhibitory effects of DADS on cell migration and invasion.ConclusionsDADS can increase TIMP3 and decrease MMP-9 expression,suppressing proliferation,migration and invasion of human gastric cancer MGC803 cells,and its mechanism may be associated with up-regulating RORα.
diallyl disulfide; RORα; human gastric cancer cells; proliferation; migration and invasion
10.15972/j.cnki.43-1509/r.2016.06.002
2016-06-08;
2016-11-09
国家自然科学基金(81374013,81102854),湖南省卫计委科研课题(B2015-182).
向姝霖为并列第一作者.*
,E-mail:suqi1945@163.com.
R735.2
A
蒋湘莲)

