miR-21对肺癌干细胞增殖、侵袭和化疗敏感性的影响
(广州医科大学附属肿瘤医院ICU,广东 广州510095)
·基础医学·
miR-21对肺癌干细胞增殖、侵袭和化疗敏感性的影响
田艳
(广州医科大学附属肿瘤医院ICU,广东 广州510095)
目的探讨miR-21对肺癌干细胞增殖、侵袭能力,以及对化疗药物敏感性的影响。方法采用流式细胞边缘群分选技术从人肺癌细胞系A549中分离出肺癌干细胞。应用脂质体分别介导成熟miR-21的阻遏物(inhibitors)和模拟物(mimics)来抑制和增强肺癌干细胞miR-21的表达;实时荧光定量PCR检测肺癌干细胞中miR-21表达水平的变化;噻唑蓝(MTT)法检测转染干预前后肺癌干细胞的增殖情况和对化疗药物的敏感性;Transwell小室检测肺癌干细胞迁移能力。结果抑制组肺癌干细胞miR-21表达水平明显低于非转染组和阴性对照组,而增强组肺癌干细胞miR-21表达水平则显著高于非转染组和阴性对照组(P<0.05);抑制组肺癌干细胞转染后各时间点增殖率较非转染组和阴性对照组明显降低,而增强组肺癌干细胞转染后各时间点增殖率较非转染组和阴性对照组显著升高(P<0.05);Transwell实验显示抑制组转染后48 h穿过人工基底膜的细胞数为(29.55±5.48)个,明显少于非转染组和阴性对照组,而增强组转染后48 h穿过人工基底膜的细胞数为(74.47±8.63)个,明显多于非转染组和阴性对照组(P<0.05);顺铂(DDP)和吉西他滨(GEM)对抑制组转染后48 h肺癌干细胞的IC50值明显低于非转染组和阴性对照组(P<0.05);DDP和GEM对增强组转染后48 h肺癌干细胞的IC50值则明显高于非转染组和阴性对照组(P<0.05)。结论下调miR-21的表达可以抑制肺癌干细胞的增殖和侵袭能力,增强其对化疗药物的敏感性。
肺癌干细胞; miR-21; 细胞增殖; 化疗; 耐药性
随着空气环境质量的不断恶化,我国肺癌的发病率居高不下,甚至呈现出逐渐上升的趋势。据国家癌症中心统计数据显示,我国肺癌发病率每年增长达26.9%,已代替肝癌成为我国首位恶性肿瘤死亡原因[1]。尽管目前针对肺癌的诊疗技术上已经取得长足的进展,但由于肺癌患者就诊时多为中晚期,易发生肿瘤扩散/转移,以及肿瘤细胞对化疗不敏感这些不利因素,因此导致肺癌患者总体预后较差。随着对肿瘤发生机制研究的不断深入,科学家们发现干细胞样肿瘤细胞——即肿瘤干细胞,在肿瘤的发生、复发/转移和化疗耐药中起着至关重要的作用[2]。因此,将肿瘤干细胞作为肿瘤治疗的靶细胞进行研究是目前肿瘤学领域的研究热点。microRNA-21 (miR-21) 是近年来发现的一个在恶性肿瘤中高表达的小RNA分子。研究显示miR-21与肿瘤细胞的增殖、凋亡和化疗敏感性有关[3]。本次实验采用肺癌干细胞作为研究对象。研究调控肺癌干细胞中miR-21的表达对细胞增殖、侵袭能力,以及对化疗药物敏感性的影响。
1 材料与方法
1.1主要材料与试剂人肺癌细胞系A549购自中国科学院上海生命科学院细胞库; DMEM F12培养基、小牛血清购于Gibco公司;四甲基偶氮唑盐(MTT)和荧光染料Hoechst33342购自Sigma公司;Trizol、miRNA SYBR Green PCR Kit 和miScript Reverse Transcription Kit购自天根生化科技(北京)有限公司;miR-21、U6引物序、miR-21 inhibitors和miR-21 mimics购自美国Applera公司;Nanodrop®ND-1000购自美国NanoDrop公司;Prism®7300实时荧光定量PCR仪购自美国ABI公司。
1.2方法
1.2.1 细胞培养 A549细胞系接种于含10%小牛血清,100 u/mL青霉素,100 u/mL链霉素的DMEM F12 培养基中,置于细胞培养箱中培养(37 ℃、5% CO2饱和湿度条件)。0.25%胰蛋白酶消化液消化、传代,取对数生长期细胞进行实验。
1.2.2 肺癌干细胞分选[4-5]将培养的A549细胞消化并制成单细胞悬液。将单细胞悬液分为两组,分别加入荧光染料Hoechst33342和维拉帕米至终浓度分别为6 mg/L和50 mmol/L。采用Advantage II型流式细胞仪进行肺癌干细胞分选,选择355nmUV激光发射源进行检测,根据细胞二维散点图形态及参数分选出边缘群细胞,即为肺癌干细胞。
1.2.3 细胞分组及转染 制备Lipofectamine2000-miR-21 inhibitor和mimics的复合物,并将其转染分选后的肺癌干细胞,并接种于六孔板中培养24 h,即为抑制组(inhibitor)和增强组(mimics)。转染48 h后采用实时荧光定量RT-PCR检测细胞miR-21表达水平。同时将未经转染处理肺癌干细胞作为非转染组和转染无关序列的肺癌干细胞作为阴性对照组。miR-21inhibitor[6]:5′-UCAACAUCAGUCUGAUAAGCUA-3′,5′-CAGUACUUUUGUGUAGUACAA-3′;miR-21 mimics:5′-UAGCUUAUCAGACUGAUGUUGA-3′,5′-AACAUCAG UCUGAUAAGCUAUU-3′。
1.2.4 实时荧光定量PCR(real-time PCR) ①Total RNA抽提:采用Trizol试剂对细胞总RNA进行提取。每5×107细胞数加入1 mL Trizol试剂裂解。经过RNA沉淀、洗涤、溶解后。在分光光度计Nanodrop®ND-1000上测定RNA浓度。RNA电泳检测RNA分子完整性。②逆转录(RT)反应:按照miScript Reverse Transcription Kit的说明进行操作。反应体系:RNA 3 μL,mirVana RT Buffer(5×)2 μL,1×mirVana RT Primer 1 μL,Array script Enzyme Mix 0.4 μL,加RNase-free water至总体积10 μL。反应条件:37 ℃,60 min;95 ℃,5 min。③PCR反应:5×Golden HS SYBR Green qPCR Mix 4 μL,50×ROX Reference Dye 0.4 μL,PCR Forward Primer(20×) 1 μL,PCR Reverse Primer(20×) 1 μL,1×cDNA模板 1~2.5 μL,加入ddH2O 至总体积20 μL。 反应条件:95 ℃ 15 min; (95 ℃,5 s;60 ℃,30 s) 40个PCR循环。反应结束后分析PCR反应曲线,数据采用2-ΔΔCT法对miR-21表达相对值进行分析。引物序列:miR-21 F:5′-ACACTCCAGCTGGGTAGCTTATCA G-3′,R:5′-CAACTGGTGTCGTGGAGTCG-3′;U6 F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCAC GAATTTGCGT-3′。
1.2.5 四甲基偶氮唑盐(MTT)实验 ①细胞增殖检测:将四组肺癌干细胞接种于96孔板(平均5×104个/孔)培养,培养24 h后,每孔加入20 μL MTT(5 mg/mL),置于37 ℃、5% CO2饱和湿度条件下孵育4 h。终止反应后弃上清液,加入150 μL DMSO,振荡10 min。在全自动酶标仪上以490 nm波长检测各孔的吸光度(OD),计算肿瘤细胞增殖情况并绘制细胞生长曲线图。②细胞对化疗药物敏感性检测:将四组肺癌干细胞按5×104/孔接种于96 孔板中培养24 h后,设置DDP组、GEM组和空白对照组。配制不同浓度的含DDP (DDP浓度分别为1、4、8、12、16、18、22、26、30、34、38、40 mg/L)和GEM药物(GEM浓度分别为10、50、100、150、200、250、300、350、400、450 mg/L)的细胞培养基,然后分别加入相应培养基进行培养,每个药物不同浓度分别设置6个复孔;同时设置无药物干预的细胞对照组和无细胞的空白对照组。干预培养细胞24 h 后,加入20 μL MTT(5 g/L)孵育4 h,去除培养基,加入150 μL DMSO,振荡10 min。在全自动酶标仪上以490 nm波长检测各孔的吸光度(OD),计算半数抑制剂量(IC50)。
1.2.6 Transwell小室实验 采用孔径为8μm的聚碳酸酯膜Transwell小室,在滤膜的上下表面分别铺以Matrigel和纤维粘连蛋白,上室加1×108/L肿瘤细胞悬液200 μL,下室加入400 μL含10%肽牛血清的条件培养液,置于37 ℃,50 mL/L CO2条件下培养24 h。培养结束后棉签擦去微孔膜上室面的细胞,HE染色后,倒置显微镜下随机选择5个视野,统计视野中细胞数,以细胞的相对数表示肿瘤细胞的侵袭能力。每组重复试验3次。

2 结 果
2.1转染干预前后肺癌干细胞miR-21表达水平改变情况利用流式边缘群细胞分选技术分离所得肺癌干细胞约占所有肺癌细胞的1.57%(图1)。real- time PCR检测各组细胞miR-21表达水平。结果显示:非转染组和阴性对照组肺癌干细胞miR-21表达水平比较差异无统计学意义(P>0.05);抑制组肺癌干细胞miR-21表达水平明显低于非转染组和阴性对照组,而增强组肺癌干细胞miR-21表达水平则显著高于非转染组和阴性对照组,差异比较均具有统计学意义(P<0.05)(图2)。
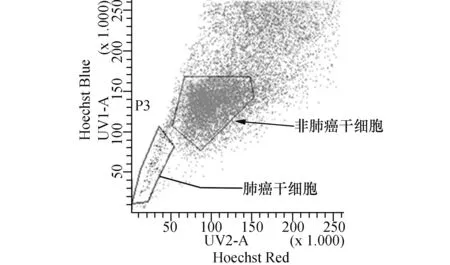
图1 肺癌干细胞流式分选图

图2 不同干预组肺癌干细胞miR-21表达水平比较 与非转染组或阴性对照组比较,*:P<0.05
2.2转染干预miR-21表达对肺癌干细胞增殖的影响MTT细胞生长曲线图显示:非转染组和阴性对照组增殖生长曲线比较的差异无统计学意义(P>0.05);抑制组肺癌干细胞转染后各时间点增殖率明显降低,同非转染组和阴性对照组比较差异具有统计学意义(P<0.05);而增强组肺癌干细胞转染后各时间点增殖率则显著升高,同非转染组和阴性对照组比较差异具有统计学意义(P<0.05)(图3)。
2.3转染干预miR-21表达对肺癌干细胞侵袭能力的影响非转染组穿过人工基底膜的细胞数为(59.47±7.40)个,阴性对照组穿过人工基底膜的细胞数为(57.72 ±7.28)个,两组比较差异无统计学意义(P>0.05);抑制组转染后48 h穿过人工基底膜的细胞数为(29.55 ±5.48)个,明显少于非转染组和阴性对照组(P<0.05);增强组转染后48 h穿过人工基底膜的细胞数为(74.47 ±8.63)个,明显多于非转染组和阴性对照组(P<0.05) (图4、5)。

图3 不同干预组肺癌干细胞增殖情况比较

图4 不同干预组肺癌干细胞侵袭能力比较 与非转染组或阴性对照组比较,*:P<0.05

图5 不同干预组肺癌干细胞Transwell结果比较(200×) A:非转染组;B:阴性对照组;C:抑制组;D:增强组
2.4转染干预miR-21前后肺癌干细胞耐药性检测
DDP和GEM对非转染组和阴性对照组肺癌干细胞的IC50值比较差异无统计学意义(P>0.05);DDP和GEM对抑制组转染后48 h肺癌干细胞的IC50值明显低于非转染组和阴性对照组(P<0.05);DDP和GEM对增强组转染后48 h肺癌干细胞的IC50值则明显升高,同非转染组和阴性对照组比较差异具有统计学意义(P<0.05) (表1)。
表1不同干预组肺癌干细胞药物IC50(mg/L)

化疗药物非转染组阴性对照组抑制组增强组DDP22.45±3.1722.18±2.9714.38±2.41a27.39±2.82aGEM289.53±24.61288.35±26.25219.04±33.76a329.27±35.47a
与非转染组比较,a:P<0.05
3 讨 论
肿瘤干细胞理论认为:恶性肿瘤是一种干细胞疾病。目前已在多种恶性肿瘤中发现肿瘤干细胞的存在[7-8]。大量的研究表明:肿瘤干细胞所具有的无限增殖、高侵袭/转移特性,以及对化疗药物的天然耐药性是导致目前肿瘤治疗失败的罪魁祸首。因此,本次实验选择肺癌干细胞作为研究对象。目前确认的鉴别和分离肺癌干细胞的方法有多种[9]。本次研究利用肿瘤干细胞普遍表达转运蛋白ABCG2而具有外排荧光染料Hoechst33342的特性来从肺癌细胞系A549 中鉴别和获取肺癌干细胞[4]。结果显示利用流式边缘群细胞分选技术分离所得肺癌干细胞约占所有肺癌细胞的1.57%。
miRNA是目前已知在肿瘤发生发展密切相关的内源性非编码小RNA分子[10]。随着对肿瘤干细胞相关miRNAs的研究,发现miRNA在维持肿瘤干细胞的干细胞特性中起重要调控作用[11]。miR-21为目前已知的肿瘤相关miRNA。在多种恶性肿瘤组织中发现miR-21的表达明显高于正常同类组织。通过功能学研究表明,miR-21能够调控肿瘤细胞的增殖、凋亡和转移。在胶质瘤、乳腺癌、肝癌、胰腺癌等多种肿瘤中的研究均表明,通过人为抑制肿瘤细胞中miR-21的表达,可以抑制肿瘤细胞的增殖和成瘤能力,促进其凋亡。进一步对其下游靶基因的研究发现,miR-21能够调控肿瘤相关基因PDCD4、maspin、Bcl-2、HNRPK、TAp63、TGF-β等的表达,从而改变肿瘤细胞的增殖和侵袭能力[12-13]。本次研究我们通过人工合成miR-21 inhibitors和mimics并成功转染肺癌干细胞后能抑制或增强细胞中miR-21的表达。MTT和Transwell小室检测结果显示,抑制miR-21的表达后肺癌干细胞的增殖和侵袭能力明显减弱,而上调miR-21的表达则能够增强肺癌干细胞增殖和侵袭性。这一研究表明miR-21具有调控肺癌干细胞在体外的增殖和侵袭能力。
肿瘤干细胞具有的天然耐药性导致化疗药物无法完全消灭肿瘤干细胞,因而是化疗治疗失败的关键所在。目前证实的肿瘤干细胞耐药性与其细胞膜表达ABC转运蛋白、DNA修复能力增强、抗凋亡基因表达增强等机制有关[14-15]。本次选用DDP和GEM这两种临床上肺癌患者最常用的化疗药物来研究miR-21对肺癌干细胞耐药性的影响。结果显示,抑制肺癌干细胞中miR-21的表达能够显著降低DDP和GEM的IC50值,反之增强肺癌干细胞中miR-21的表达则会导致DDP和GEM的IC50值明显升高。说明miR-21能够逆转肺癌干细胞对化疗药物的敏感性。已有的证据显示,miR-21在肿瘤耐药性中的作用可能通过对hMSH2、PTEN等肿瘤耐药相关基因的调控,进而影响肺癌干细胞对化疗药物的敏感性[16-17]。
综上,本次研究结果显示miR-21在肺癌干细胞的增殖、侵袭和化疗耐药性中起着重要的调控作用。然而其具体的相关机制还有待进一步研究。随着未来结合miRNA与肿瘤干细胞而进行的靶向性研究,有望在肿瘤治疗取得新的进展和突破。
[1] 姚晓军,刘伦旭.肺癌的流行病学及治疗现状[J].现代肿瘤医学,2014(8):1982-1986.
[2] Suzuki Y,Ishii H,Sekimoto M,et al.Cancer stem cell[J].Nihon Rinsho,2011,69 (Suppl 3):98-102.
[3] Melnik BC.MiR-21:an environmental driver of malignant melanoma[J].J Transl Med,2015,13:202.
[4] Shi Y,Fu X,Hua Y,et al.The side population in human lung cancer cell line NCI-H460 is enriched in stem-like cancer cells[J].PLoS One,2012,7(3):e33358.
[5] Li XX,Wang J,Wang H L,et al.Characterization of cancer stem-like cells derived from a side population of a human gallbladder carcinoma cell line,SGC-996[J].Biochem Biophys Res Commun,2012,728-734.
[6] Li X,Xin S,He Z,et al.MicroRNA-21 (miR-21)post-transcriptionally downregulates tumor suppressor PDCD4 and promotes cell transformation,proliferation,and metastasis in renal cell carcinoma[J].Cell Physiol Biochem,2014,33(6):1631-1642.
[7] Ji J,Wang X W.Clinical implications of cancer stem cell biology in hepatocellular carcinoma[J].Semin Oncol,2012,39(4):461-472.
[8] Szafarowski T,Szczepanski MJ.Cancer stem cells in head and neck squamous cell carcinoma[J].Otolaryngol Pol,2014,68(3):105-111.
[9] O’Flaherty JD,Barr M,Fennell D,et al.The cancer stem-cell hypothesis:its emerging role in lung cancer biology and its relevance for future therapy[J].J Thorac Oncol,2012,7(12):1880-1890.
[10] David R.Small RNAs:miRNA machinery disposal[J].Nat Rev Mol Cell Biol,2013,14(1):4-5.
[11] Liu C,Tang D G.MicroRNA regulation of cancer stem cells[J].Cancer Res,2011,71(18):5950-5954.
[12] Pan T H,Wu X Y.Regarding article 'Bcl-2 upregulation induced by miR-21 via a direct interaction is associated with apoptosis and chemoresistance in MIA PaCa-2 pancreatic cancer cells’[J].Arch Med Res,2012,43(3):252,253.
[13] Liu Y,Nie H,Zhang K,et al.A feedback regulatory loop between HIF-1alpha and miR-21 in response to hypoxia in cardiomyocytes[J].FEBS Lett,2014,588(17):3137-3146.
[14] Wang H,Zhang G,Zhang H,et al.Acquisition of epithelial-mesenchymal transition phenotype and cancer stem cell-like properties in cisplatin-resistant lung cancer cells through AKT/beta-catenin/Snail signaling pathway[J].Eur J Pharmacol,2014,723:156-166.
[15] Wang K,Wu X,Wang J,et al.Cancer stem cell theory:therapeutic implications for nanomedicine[J].Int J Nanomedicine,2013,8:899-908.
[16] Deng J,Lei W,Fu J C,et al.Targeting miR-21 enhances the sensitivity of human colon cancer HT-29 cells to chemoradiotherapy in vitro[J].Biochem Biophys Res Commun,2014,443(3):789-795.
[17] He C,Dong X,Zhai B,et al.MiR-21 mediates sorafenib resistance of hepatocellular carcinoma cells by inhibiting autophagy via the PTEN/Akt pathway[J].Oncotarget,2015,6(30):28867-28881.
EffectofmiR-21ontheCapacityofProliferation,InvasionandChemo-SensitivityinLungCancerStemCells
TIAN Yan
(DepartmentofICU,AffiliatedCancerHospitalofGuangzhouMedicalUniversity,Guangzhou,Guangdong510095,China)
ObjectiveTo investigatet the effect of miR-21 on the capacity of proliferation,invasion and chemo-sensitivity in lung cancer stem cells.MethodsLung cancer stem cells were isolated by fluorescence activated cell sorting (FACS) from human lung adenocarcinoma cell line A549.The miR-21 inhibitors and mimics were transfected into Lung cancer stem cells by liposome.The expression levels of miR-21 in Lung cancer stem cells was measured by reverse transcription polymerase chain reaction (RT-PCR).MTT method was used to evaluate the capability of cell proliferation and chemoresistance.The invasive capability of cells was evaluated by using transwell chamber model.ResultsThe expression of miR-21 in inhibition group was obviously lower than non-transfection group and negative control group,and in enhanced group it was obviously higher than non-transfection group and negative control group (P<0.05).The proliferation rate at each time point in inhibition group was down-regulated compared with non-transfection group and negative control group,and in enhanced group it was up-regulated compared with non-transfection group and negative control group (P<0.05).Transwell chamber assay demonstrated the cell penetrating number was 29.55 ±5.48 in inhibition group at 48 h post-transfection,which was obviously less than non-transfection group and negative control group(P<0.05).In enhanced group,the cell penetrating number was 74.47 ±8.63,which was obviously more than non-transfection group and negative control group (P<0.05).The half inhibition concentration (IC50) of Cisplatin (DDP) and Gemcitabine (GEM) in inhibition group was obviously lower than non-transfection group and negative control group.And in enhanced group it was obviously higher than non-transfection group and negative control group (P<0.05).ConclusionDown-regulation of miR-21 expression in lung cancer stem cells would inhibit their ability of proliferation and invasion,enhance the sensitivity to chemotherapy.
lung cancer stem cell; miR-21; cell proliferation; chemoresistance
10.15972/j.cnki.43-1509/r.2016.06.009
2016-03-08;
2016-09-17
R735.6
A
秦旭平)

