hMLH1基因甲基化在胃癌早期诊断中的应用价值
易 默 周 健 李 颖 史丽萍 何小勤
·论著·
hMLH1基因甲基化在胃癌早期诊断中的应用价值
易 默 周 健 李 颖 史丽萍 何小勤
目的 探讨hMLH1基因表达和甲基化与胃癌的关系,旨在为胃癌早期诊断治疗提供新思路。方法 选取本院2013年5月至2015年7月收治的肠上皮化生34例、异型增生37例、胃癌41例,胃镜活组织检查收集病理组织,另选取同期医院门诊收集的30例正常胃黏膜组织作为对照组。通过甲基化特异聚合酶链反应和免疫组织化学方法检测hMLH1基因表达和甲基化水平,并进行组间对比分析。结果 hMLH1基因甲基化率依次为肠上皮化生组20.6%,异型增生组43.2%,胃癌组51.2%,对照组3.3%;与对照组相比较,肠上皮化生组hMLH1基因甲基化水平有所升高但差异无统计学意义(P>0.05),异型增生组和胃癌组均显著升高,差异具有统计学意义(P均<0.01),且异型增生组及胃癌组甲基化水平均显著高于肠上皮化生组(P均<0.05)。组织样本中hMLH1基因蛋白表达阳性率分别为肠上皮化生组73.5%,异型增生组54.1%,胃癌组31.7%,对照组100%;与对照组相比较,肠上皮化生组、异型增生组及胃癌组hMLH1基因蛋白表达阳性率均显著降低,且差异有统计学意义(P均<0.01)。hMLH1基因蛋白表达水平与基因甲基化水平呈负相关(r=-0.4675,P<0.01)。结论 hMLH1基因启动子区高甲基化可通过调节hMLH1蛋白表达在胃癌发生发展中起作用。
hMLH1基因;甲基化;胃癌;诊断
胃癌是一种消化道常见的恶性肿瘤。胃癌的发生是由生活饮食习惯、遗传因素及环境等多种因素共同作用的结果。其发病机制是一个慢性胃炎黏膜萎缩—肠上皮化生—异常增生最终导致胃癌的过程[1]。研究基因水平的改变对探索肿瘤的发生机制以及肿瘤的早期诊断具有重要意义。近年来研究表明,几乎在所有的人类肿瘤中,特别是在肿瘤初期,均存在CpG岛高度甲基化的现象[2-3],提示这种肿瘤特异性的DNA甲基化可能是一种潜在的肿瘤标志物。hMLH1是一种DNA修复基因,且与胃癌的发病机制存在相关性[4]。本研究对胃癌组织、异型增生及肠上皮化生组织中hMLH1基因甲基化及蛋白表达水平进行检测,旨在探讨hMLH1基因甲基化及表达与胃癌的关系,为胃癌的早期诊断与治疗提供理论依据。
1 资料与方法
1.1 一般资料
本研究选取2013年5月至2015年7月陕西省人民医院消化内二科收治的胃病患者112例,其中男性59例,女性53例,年龄21~79岁,平均年龄(45.7±11.6)岁;所有患者在此之前均未接受放射、化学治疗及生物免疫治疗。纳入标准:经病理诊断为慢性萎缩性胃炎伴肠上皮化生、异型增生及胃癌患者,排除患有其他系统肿瘤、其他胃肠系统疾病及其他器官衰竭等疾病的患者;112例患者包括肠上皮化生34例、异型增生37例、胃癌41例。胃镜活组织检查收集所有患者的病理组织,部分10%甲醛固定后经石蜡包埋备用,另一部分-80°液氮保存备用。对照组为同期本院门诊收集的30例经正常活组织检查的胃黏膜组织。此研究获本院伦理委员会批准,所有患者知情同意并签署知情同意书。所有患者的一般资料情况见表1,肠上皮化生组、异型增生组、胃癌组和对照组患者在一般基线资料上的差异无统计学意义(P>0.05),具有可比性。
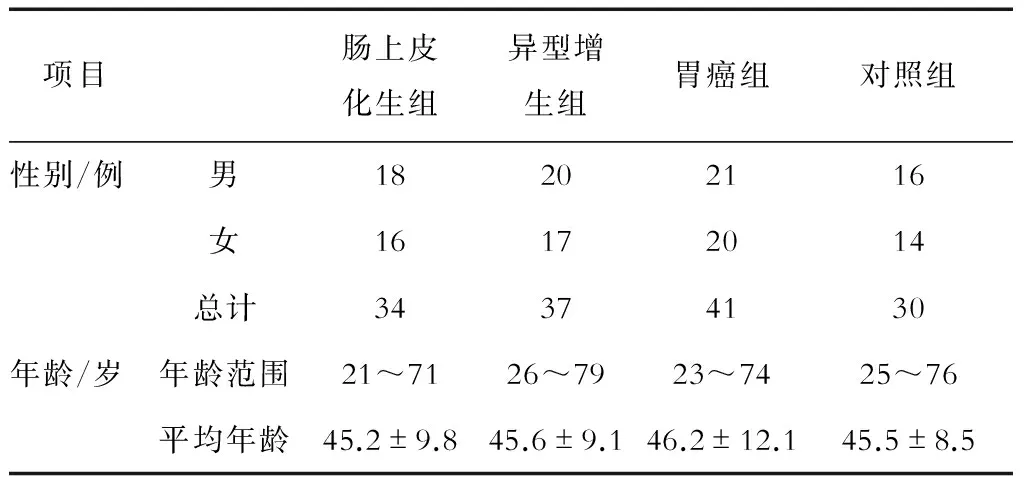
表1 患者的一般资料情况
1.2 主要仪器和试剂
Gel Doc 2000凝胶成像分析系统(美国BIO-RAD公司),Gene Amp PCR System 9700 PCR仪(美国ABI公司),QIAamp DNA Mini Kit DNA提取试剂盒(德国GIAGEN公司),Sss.Ⅰ甲基转移酶(美国New England Biolabs公司),Zymo TaqTMPre Mix PCR反应试剂盒(美国ZYMO公司),hMLH1单克隆抗体(美国Sigma公司),引物由深圳华大基因科技服务有限公司合成。
1.3 DNA提取及甲基化处理
采空腹静脉血5 mL,放入含EDTA抗凝剂的离心管中,1 500 g 离心10 min,收集血浆备用。采用试剂盒进行DNA提取,DNA纯度分析采用核酸蛋白分析仪,采用凝胶电泳进行质量检测。之后进行DNA亚硫酸盐修饰,针对hMLH1基因启动子区CpG岛的甲基化及非甲基化特异性检测引物见表2,本研究采用双蒸水作为空白对照,采用Sss.Ⅰ甲基转移酶修饰过的对照组人外周血淋巴细胞DNA作为阳性对照,未经处理的对照组人外周血淋巴细胞DNA作为阴性对照。PCR反应采用Zymo TaqTMPre Mix试剂盒,反应体系为25 μL,反应条件为:95°预变性10 min,循环体系(95°变性30 s,62°退火30 s,72°延伸30 s),共进行40个循环,之后72°延伸10 min,4°保存。PCR产物经琼脂糖凝胶电泳进行检测。
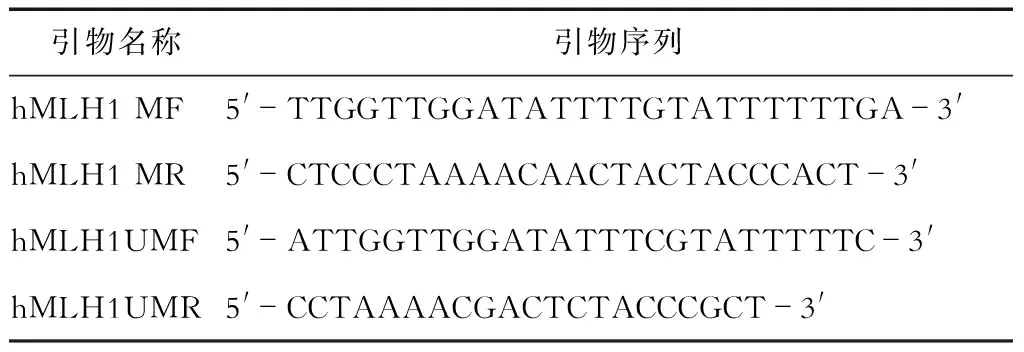
表2 hMLH1基因引物序列
1.4 免疫组织化学检测
病理组织制成4 μm厚石蜡切片,常规脱蜡且经过抗原修复后加10%山羊血清封闭,之后hMLH1一抗孵育4℃过夜,在PBS缓冲液中进行震荡清洗3次,二抗室温孵育4 h,之后进行DAB显色,苏木素复染后常规封片。阳性对照为已知阳性片,阴性对照采用PBS代替一抗做平行操作。每张片子随机选取12个视野(×400)进行观察,以阳性细胞比率作为阳性判定标准(阳性:阳性细胞比率>5%;阴性:阳性细胞比率<5%)。
1.5 统计学分析
本研究数据采用SPSS 16.0统计学软件进行分析,计量资料以平均值±标准差表示,采用t检验;计数资料采用率表示,采用Fisher确切概率法及卡方检验,P<0.05表示差异有统计学意义。
2 结果
2.1 hMLH1基因甲基化水平
hMLH1基因甲基化水平结果显示,肠上皮化生组、异型增生组、胃癌组及对照组hMLH1基因甲基化率分别为20.6%(7/34)、43.2%(16/37)、51.2%(21/41)和3.3%(1/30);肠上皮化生组较对照组hMLH1基因甲基化检出率有所升高,但差异无统计学意义(χ2=1.346 8,P>0.05);与对照组相比较,异型增生组及胃癌组的hMLH1基因甲基化率显著升高,差异有统计学意义(χ2=8.933 9,10.837 5;P均<0.01);与肠上皮化生组相比较,异型增生组及胃癌组的hMLH1基因甲基化率均显著升高,且差异具有统计学意义(χ2=3.993 7,7.957 1;P均<0.05)。见图1。
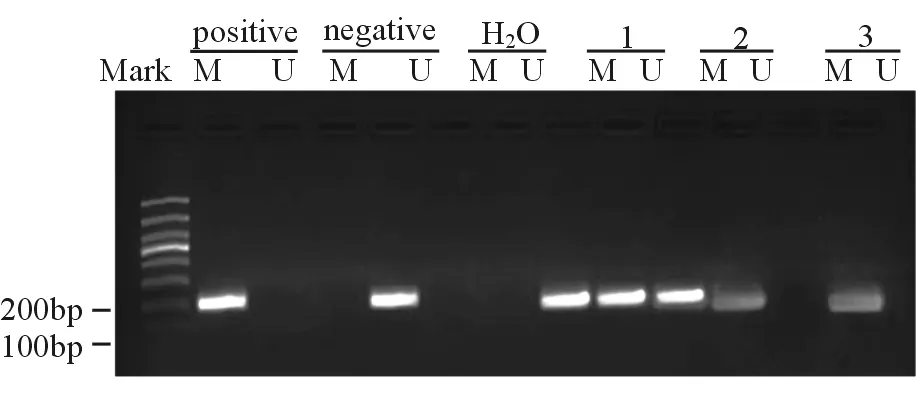
注:M 甲基化;U 非甲基化;positive 阳性对照;negative 阴性对照;H2O 蒸馏水对照;1 胃癌组织;2 异型增生;3 肠上皮化生
2.2 hMLH1基因蛋白表达水平
进一步分析hMLH1基因蛋白表达水平,结果显示组织样本中hMLH1基因蛋白表达阳性率分别为肠上皮化生组73.5%(25/34)、异型增生组
54.1%(20/37)、胃癌组31.7%(13/41)和对照组100%(30/30)。与对照组相比较,肠上皮化生组、异型增生组及胃癌组的hMLH1基因蛋白表达阳性率均显著降低,差异具有统计学意义(χ2=23.640 0,13.066 7,11.076 9;P均<0.01)。13例hMLH1蛋白表达阳性的胃癌患者中仅1例检出hMLH1基因甲基化(7.7%),28例hMLH1蛋白表达阴性的胃癌患者中有20例检出hMLH1基因甲基化(71.4%),详见图2、表3。统计分析发现,hMLH1基因蛋白表达水平与基因甲基化水平呈负相关(r=-0.4675,P<0.01),见图3。
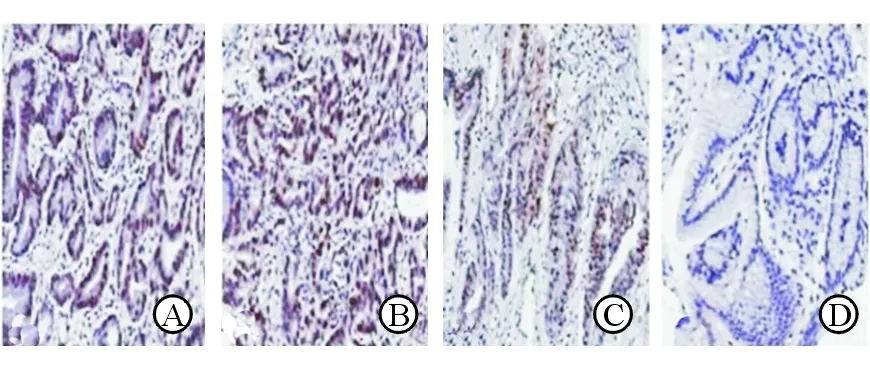
注:A 肠上皮化生;B 异性增生;C 胃癌阳性表达;D 胃癌阴性表达

表3 各组hMLH1甲基化和蛋白表达对比情况/例
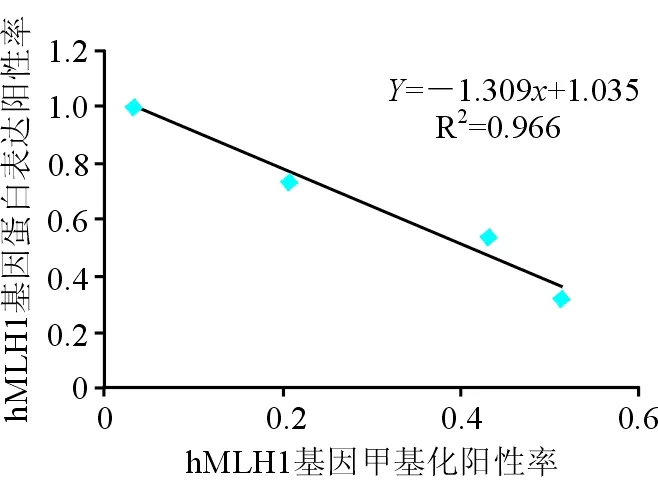
图3 hMLH1基因甲基化和蛋白表达水平相关性分析
3 讨论
有研究表明,早期胃癌患者的5年生存率可达95%,但当病灶侵袭至肌层或浆膜层后,5年生存率则降至20%[5]。早期干预对于胃癌患者具有重要意义,但由于缺乏胃癌早期的独特临床诊断特征及指标,早期胃癌的诊出率仅为10%,多数患者确诊时已处于进展期,大大降低了生存率。因此,寻找有效的早期诊断指标对于提高胃癌患者的生存率具有重要意义[6]。目前胃癌的早期诊断依赖于对包括慢性胃炎黏膜萎缩、肠上皮化生及异常增生等在内的癌前病变的追踪随访。近年来研究发现,以DNA甲基化为代表的表观遗传学可能在肿瘤的诊断及预后中具有重要作用[7-8]。本研究旨在探讨hMLH1基因甲基化及蛋白表达水平在胃癌早期诊断中的价值。
hMLH1是一种DNA错配修复基因,可影响细胞的内源性修复功能,维持基因组稳定。研究表明,70%的hMLH1基因突变后会形成终止密码子,导致机体不能产生具有功能的hMLH1蛋白,进而引起肿瘤的发生[9]。Herman等[10]对结肠癌细胞株的研究发现,21.6%的细胞株发生hMLH1基因甲基化。研究进一步对原发性结肠癌及正常对照组织进行分析,发现原发性结肠癌组织中有32.4%发生甲基化,而正常对照组织无1例发生甲基化,提示hMLH1基因甲基化与肿瘤密切相关。微卫星不稳定性(MSI)在胃癌患者中较为常见,已成为其常见指证,研究证实MSI与错配修复基因密切相关。有研究发现,MSI抑制hMLH1基因表达的机制是促进hMLH1基因甲基化,而当MSI缺失时可通过抑制基因甲基化水平而促进hMLH1基因表达[11]。Fleisher等[12]研究发现,65例胃癌患者中有29例发生hMLH1基因甲基化。此外,有研究通过对胃癌患者的癌旁黏膜组织分析发现,有部分癌旁组织也出现了hMLH1基因高甲基化状态[13-14]。以上研究均提示,hMLH1蛋白的缺失可能在胃癌的发生发展中起重要作用,而hMLH1蛋白缺失的机制很可能是通过hMLH1基因启动子区的高甲基化来实现的。
本研究结果提示,hMLH1基因启动子区甲基化水平和hMLH1蛋白表达水平在胃癌的发生发展中起重要作用,hMLH1基因通过启动子区高甲基化下调蛋白表达,进而引发机体DNA错配修复功能缺陷,在胃癌的发生发展中起重要作用。此外本研究显示,hMLH1蛋白表达阴性的例数多于hMLH1基因启动子区高甲基化的例数,提示hMLH1蛋白表达阴性的机制除了通过基因甲基化之外,还可能通过包括泛素降解等其他途径实现,但具体机制仍需进一步研究证实。
综上所述,hMLH1基因启动子区高甲基化可通过调节hMLH1蛋白表达在胃癌发生发展中起作用。因此,检测hMLH1基因启动子区甲基化水平有助于胃癌的早期诊断及预后判断;同时,hMLH1基因启动子区CpG岛也可作为胃癌治疗的一个潜在药物靶点,为胃癌的早期诊断和治疗提供新的思路与理论依据。
1 Dirnu R, Secureanu FA, Neamtu C, et al. Chronic gastritis with intestinal metaplasia: clinico-statistical, histological and immunohis-tochemical study[J]. Rom J Morphol Embryol, 2012, 53: 293-297.
2 Gilsbach R, Preissl S, Grüning BA, et al. Dynamic DNA methylation orchestrates cardiomyocyte development, maturation and disease[J]. Nat Commun, 2014, 5: 5288.
3 Balgkouranidou I, Matthaios D, Karayianna-kis A, et al. Prognostic role of APC and RASSF1A promoter methylation sta-tus in cell free circulating DNA of operable gas-tric cancer patients[J]. Mutat Res, 2015, 778: 46-51.
4 Xiao XQ, Gong WD, Wang SZ, et al. Polymorphisms of mismatch re-pair gene hMLH1 and hMSH2 and risk of gas-tric cancer in a Chinese population[J]. Oncol Lett, 2012, 3: 591-598.
5 Yao K, Doyama H, Gotoda T, et al. Diagnostic performance and limitations of magnifying narrow-band imaging in screening endoscopy of early gastric cancer: a prospective multicenter feasibility study[J]. Gastric Cancer, 2014, 17: 669-679.
6 Badgwell B, Roy-Chowdhuri S, Chiang YJ, et al. Long-term survival in patients with metastatic gastric and gastroesophageal cancer treated with surgery[J]. J Surg Oncol, 2015, 111: 875-881.
7 Liu L, Yang X. Implication of Reprimo and hMLH1 gene methylation in early diagnosis of gastric carcinoma[J]. Int J Clin Exp Pathol, 2015, 8: 14977-14982.
8 周玮, 芦珊, 魏海云, 等. 外周血P16、E-cad和hMLH1基因启动子甲基化在胃癌早期诊断中的价值[J]. 实用癌症杂志, 2015, 31: 1758-1760.
9 缪辉来, 桂水清, 林木生, 等. 原发性肝细胞癌中错配修复基因hMLH1的表达及其意义[J]. 中华实验外科杂志, 2005, 22: 435-436.
10 Herman JG, Graff JR, Myöhänen S, et al. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands[J]. Proc Nat Acad Sci U S A, 1996, 93: 9821-9826.
11 Vogelsang M, Komel R. Non-truncating hMLH1 variants identified in Slovenian gastric cancer patients are not associated with Lynch Syndrome: a functional analysis report[J]. Fam Cancer, 2011, 10: 255-263.
12 Fleisher AS, Esteller M, Tamura G, et al. Hypermethylation of the hMLH1 gene promoter is associated with microsatellite instability in early human gastric neoplasia[J]. Oncogene, 2001, 20: 329-335.
13 Mir MR, Shabir N, Wani KA, et al. Association between p16, hMLH1 and E-cadherin promoter hypermethylation and intake of local hot salted tea and sun-dried foods in Kashmiris with gastric tumors[J]. Asian Pac J Cancer Prev, 2012, 13: 181-186.
14 Alves MK, Ferrasi AC, Lima VP, et al. Inactivation of COX-2, HMLH1 and CDKN2A gene by promoter methylation in gastric cancer: relationship with histological subtype, tumor location and Helicobacter pylori genotype[J]. Pathobiology, 2011, 78: 266-276.
(本文编辑:周骏)
Implication of hMLH1 gene methylation in early diagnosis of gastric carcinoma
YIMo,ZHOUJian,LIYing,SHILiping,HEXiaoqin.
TheSecondDepartmentofGastroenterology,ShaanxiProvincialPeople’sHospital,Xi’an(710068),China
Objective This paper investigated the relationship between hMLH1 genemethylation and protein expressionand gastric carcinoma in order to provide a new method for early diagnosis of gastric carcinoma. Methods A total of 142 tissue samples (including 34 cases of intestinal metaplasia, 37 cases of dysplasia, 41 cases of gastric carcinoma and 30 cases of normal) were selected for detecting DNA methylation and protein expression status using methylation specific PCR and immunohistochemical staining from May in 2013 to July in 2015 and the differences among groups were compared. Results The positive rate of DNA methylation rate is 20.6% in intestinal metaplasia, 43.2% in dysplasia, 51.2% in gastric cancer, and 3.3% in the control group. There is no significant difference in positive rate of DNA methylation rate between intestinal metaplasia and the control (P>0.05), but compared with the control group, there is significant difference between higherin dysplasia and gastric cancer (P<0.01); and compared with intestinal metaplasia, there is significant difference between higherin dysplasia and gastric cancer (P<0.05). The positive rate of hMLH1 protein is 73.5% in intestinal metaplasia, 54.1% in dysplasia, 31.7% in gastric cancer, and 100% in the control group. All those tissues have significant difference compared to the control group (P<0.01). A significantly negative relationship exists between the methylation level and the protein expression level in hMLH1 (r=-0.4675,P<0.01). Conclusion The DNA methylation which occurred in promoter regions of hMLH1 genes depresses the protein expression, and may participate in the occurrence and progression of gastric cancer.
hMLH1; Methylation; Gastric carcinoma; Diagnosis
陕西省科技厅社会发展攻关项目(2013k12-03-18)
710068 西安,陕西省人民医院消化内二科
10.3969/j.issn.1673-534X.2016.05.011
2016-06-12)

