循环血miR⁃21在空间辐射监测中的应用潜力
危文俊,华君瑞,林素兰,王菊芳
(1.中国科学院近代物理研究所甘肃省空间辐射生物学重点实验室,兰州730000;2.中国科学院大学,北京100049)
循环血miR⁃21在空间辐射监测中的应用潜力
危文俊1,2,华君瑞1,林素兰1,2,王菊芳1
(1.中国科学院近代物理研究所甘肃省空间辐射生物学重点实验室,兰州730000;2.中国科学院大学,北京100049)
深空探测中如何在辐射暴露早期用快速、简便的方法进行辐射损伤及风险评估问题,对传统的辐射剂量计提出巨大的挑战。循环血microRNA(miRNA)具有很好的特异性和稳定性,且积极响应外界环境变化,因此,筛选循环血中辐射敏感的miRNA,对开发基于血液的微创生物辐射标志物具有较大的研究意义和应用价值。本文利用X射线对昆明小鼠进行全身照射,24小时后取血,利用miRNA PCR array的方法检测了21种候选miRNA的表达谱水平,发现多种miRNA对辐射有响应,其中miR⁃21具有较大的变化幅度。利用实时定量PCR分别验证了miR⁃21在不同射线(X射线、碳离子束、铁离子束)条件下的剂量效应和时间效应。检测了miR⁃21在相同和不同鼠龄小鼠个体间的本底表达水平。结果表明,miR⁃21在不同类型射线照射下表达水平都有升高的趋势,特别是对低剂量辐射也具有显著的响应,具有较强的剂量效应关系。在6~72小时内,其表达水平维持在一个稳定的阈值内。miR⁃21在相同和不同鼠龄小鼠个体间的本底表达水平不具有差异性,在血清样本的保存及RNA的提取过程中具有较强的稳定性。以上特征说明miR⁃21具有作为生物辐射剂量计并应用于辐射损伤检测的潜力。
循环血;miR⁃21;辐射;生物标志物;风险评估
1 引言
太空辐射由质子、电子及少量重离子等多种射线组成,具有随机性和不确定性,长期暴露会对宇航员造成辐射损伤和各种潜在的健康风险,已成为深空探索活动最主要的限制因素之一[1]。美国国家航空航天局的研究表明,近地轨道的国际空间站内受到的辐射剂量约为2 mSv/day,而好奇号火星车搭载的RAD辐射系统监测飞船在巡航途中受到的银河系宇宙射线剂量约为1.8 mSv/day[1⁃2]。对于人类来说,暴露于致死剂量(大于6 Gy)下可能会在几天至几周内死亡;而亚致死剂量(2~6 Gy)的辐射将会导致急性辐射综合症的产生,包括头晕、呕吐、腹泻、皮肤坏死、眼底病变、内出血等;低于2 Gy的辐射一般不会产生明显的急性辐射综合症,所以很难通过临床及生理症状进行诊断,但是低剂量的辐射会造成造血和免疫系统的损伤,导致再生障碍性贫血或免疫疾病等,其所造成的DNA损伤也会大大增加癌症的风险[3]。国际放射防护委员会(ICRP)建议的职业照射限值是平均每年不超过20 mSv[4]。执行长期太空任务的宇航员接受的辐射剂量很可能大于这个限值[5],所以,辐射损伤的检测以及风险的评估对于宇航员的安全保障具有重要意义。
传统的辐射检测方法包括物理辐射剂量仪和生物标志物两类。物理辐射剂量仪只能监测环境中的辐射剂量,很难准确评估不同个体吸收剂量的差异[6]。而目前通用的生物标志物也有很大的局限性。例如,外周血淋巴细胞染色体畸变检测对样本要求高,处理过程繁琐耗时,并且对低剂量的辐射不敏感[7⁃8];基于细胞DNA损伤修复蛋白γ⁃H2AX检测的最佳时间为2~3小时,随时间推移,γ⁃H2AX焦点的数量也会逐渐减少,严重影响检测的准确性,但是如此短的时间在实际应用中并不足以完成取样及制备样本[9]。如何快速、简便地在辐射暴露早期对辐射损伤风险做出预测,对辐射标志物研究提出了巨大的挑战。
循环血因样本采集方便,成为标志物研究的热点。近年来,基于循环血辐射敏感蛋白和基因的研究越来越多。例如,Menard[8]、Ossetrova[9]等人发现,小鼠血清中的IL⁃6、GADD45α、C⁃reactive Protein等蛋白分子对γ射线具有敏感性;Joiner等通过血清基因表达谱的检测发现多种基因对0.5~10 Gy的γ射线辐射也具有敏感性[12]。但是,由于蛋白及分子量较大的基因容易被蛋白酶及核酸酶水解,所以采样及提取过程要求较高,并且准确率也容易受到影响[13]。所以,寻找小分子的核酸作为标志物可以提高标志物的稳定性。
microRNA(miRNA)是一类小分子非编码RNA,长度约为18~24 nt,它通过与特异的mR⁃NA3'非编码区(UTR)互补配对来抑制mRNA的翻译,是一种非常重要的转录后调控因子,参与细胞中大部分生物过程的调控,包括细胞凋亡、增殖分化、周期阻滞和 DNA损伤修复等[14]。由于miRNA长度较短,并且在循环系统中常以被囊泡包裹的形式存在,所以miRNA可以稳定存在于循环系统当中,并且在样本的提取及保存中都具有很高的稳定性和再现性[15,16]。近年来,已有大量研究显示血液系统特异的miRNA与某些疾病紧密相关,可以作为疾病早期诊断的标志物[17⁃19]。循环血中也存在辐射敏感的miRNA,例如在受到2~8 Gy的X射线辐照后,小鼠循环血中的miR⁃200b和 miR⁃762显示出较明显的上升趋势,而miR⁃150表达则随辐照剂量的增加呈现降低趋势[20]。但是,以上这些研究选取的辐照剂量较大,都为致死剂量或亚致死剂量(大于2 Gy),射线种类比较单一。本研究利用X射线对小鼠进行全身照射,在24小时后收集血清,检测21种候选miRNA对辐射的敏感性。挑选理想的候选miRNA,选取0~2 Gy的低剂量X射线、铁离子和碳离子束进行辐照,检测其剂量效应及时间效应关系,以期得到能在受到低剂量辐射早期阶段准确预测辐射损伤风险的生物辐射标志物。
2 实验材料及方法
2.1 实验动物及照射方案
实验动物选取6~7周的清洁级雄性昆明小鼠(兰州大学医学院提供),初始体重约为20± 2 g,饲养一周后,挑选体重约为24±2 g的健康小鼠,分别利用Faxitron RX⁃650射线仪产生的X射线、近代物理研究所重离子加速器浅层治疗终端提供的碳(12C6+)离子束和铁(56Fe17+)离子对小鼠进行全身照射。进行表达谱筛选的X射线照射小鼠分为4个组,每组6只小鼠,照射剂量为0、0.5 Gy、2 Gy、4 Gy,剂量率为0.5 Gy/min。对挑选出的miRNA进行验证时,X射线照射小鼠分为5个小组,每组6只小鼠,照射剂量为0、0.1 Gy、0.5 Gy、1 Gy、2 Gy,剂量率为0.5 Gy/min;碳离子射线照射小鼠分为5个小组,每组9只小鼠,照射剂量为0、0.1 Gy、0.5 Gy、1 Gy、2 Gy,剂量率为0.5 Gy/min;铁离子射线照射小鼠分为4个小组,每组5只小鼠,照射剂量为0、0.1 Gy、0.5 Gy、1 Gy,剂量率为0.5 Gy/min。所有照射组都以未照射组(0 Gy组)作为对照。
2.2 血清的提取和RNA的纯化
照射结束24 h后,采用眼眶取血的方法,将全血采集到无RNA酶的EP管中,整个过程避免剧烈晃动EP管,并且不要让鼠毛等杂质落入管中,防止溶血。将全血在室温下放置 2 h,3000 r/min离心10 min,吸取上层澄清的血清,放入新的无RNA酶管中,10 000 r/min离心10 min,即可分离得到实验所需血清样品。由于血清样品中RNA的丰度较低,所以采用QIAGENE公司的miRNeasy Serum/Plasma Kit提取总的RNA,提取之前,在血清样品中加入外源的cel⁃miR⁃39作为内参用于归一化。
2.3 miRNA PCR芯片的检测及数据分析
得到的总RNA利用miScript II RT Kit(QIA⁃GENE)进行反转录,使总RNA中的miRNA形成特异的cDNA聚合体。将cDNA聚合体和miScript SYBR Green PCR Kit(QIAGENE)充分混合,加入miScript miRNA PCR Arrays(QIAGENE)芯片的反应孔中。将加入反应体系的PCR芯片放入实时定量PCR仪CFX96TM Real⁃time System(Bio⁃RAD)中,进行PCR扩增及定量。miRNA芯片所得原始数据利用在线工具miScript miRNA PCR Array Date Analysis[21]进行分析。分析工具采用的是2-ΔΔCt法,利用每组中外源cel⁃miR⁃39的Ct值对本组其它miRNA的Ct值进行归一化,然后进行变化倍数、P值(与对照组进行t检验)的分析。
2.4 miRNA芯片结果的PCR定量验证
同2.2步骤,从经过照射的小鼠血清样本中提取得到总RNA,利用All⁃in⁃one First⁃stand cD⁃NA Sythesis Kit(Gene Copoeia)反转录试剂盒进行反转录,得到cDNA聚合物。将从PCR芯片中筛选得到的几种miRNA的引物分别与cDNA混合,再与All⁃in⁃oneTM miRNA qRT⁃PCR Detection Kit(Gene Copoeia)反应体系混合,上机进行实时定量PCR反应。
2.5 PCR定量数据分析
PCR定量分析采用2-ΔΔCt法。相同处理组中,分别利用每种miRNA的Ct值减去外加内参cel⁃miR⁃39的Ct值,得到ΔCt,完成归一化。处理组与对照组中相同 miRNA的 ΔCt相减,得到ΔΔCt值。然后求2-ΔΔCt值,即为此miRNA处理组与对照组的相对变化量。实验组与对照组的差异性分析采用t检验,p<0.05即为具有显著性差异。
3 结果与分析
3.1 辐射敏感miRNA的筛选
通过前期表达谱的筛选及文献调研[22⁃23],挑选出了21种与辐射相关的miRNA,定制了miRNA PCR array芯片。利用X射线对小鼠进行全身照射,照射后24 h取血,提取血清后分离总RNA并进行反转录,用miRNA PCR array检测21种候选miRNA表达水平(图1),并通过平均Ct值、变化倍数和统计学条件(p<0.1)进行筛选。
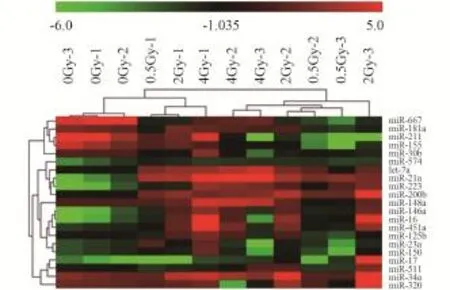
图1 21种miRNA表达水平的聚类热图Fig.1 The clustering heat map of expression levels of 21 candidate miRNAs
如聚类热图(图1)所示,在不同样本的聚类中,未照射组和照射组明显被分为不同的簇,说明在受到照射后,血清中的这些miRNA表达水平与未受照射组相比存在明显的差异。例如let⁃7a、miR⁃21、miR⁃34a、miR⁃223、miR⁃200b等在辐照之后表达水平升高,而miR⁃667、miR⁃155表现出辐射后下调趋势。其中,miR⁃21的表达水平随剂量增加而上升,并表现出良好的剂量相关性,并且其平均Ct值一直保持在18左右,说明miR⁃21在血清中的丰度很高,容易被检测到(表1)。所以本文选择miR⁃21作进一步验证。
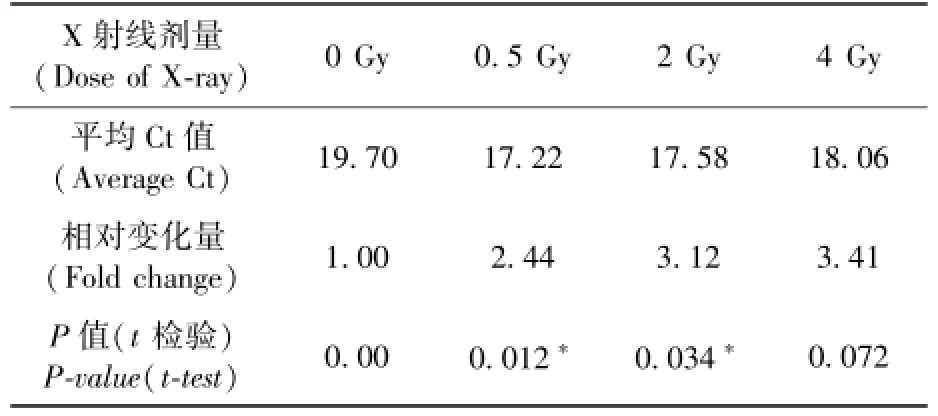
表1 miR⁃21的表达谱数据(∗P<0.05)Table 1 miR⁃21 expression data(∗P<0.05)
3.2 不同类型射线照射下的剂量效应关系
为验证循环血miR⁃21对不同类型射线的辐射敏感性,利用非致死剂量(低于2 Gy)的X射线、碳离子束和铁离子束对小鼠进行全身照射,24 h后取血并分离血清,利用实时定量PCR技术(qRT⁃PCR)检测血清中miR⁃21分别在不同种类射线照射下的剂量效应关系(图2)。如图2所示,在经过X射线、碳离子束和铁离子束照射之后,血清中miR⁃21的表达水平都呈现出升高趋势,且都与剂量成正相关。在对不同射线的敏感性方面,在分别受到X射线、碳离子射线和铁离子射线照射后,血清中miR⁃21的变化幅度为X射线>碳离子射线>铁离子射线,这种差异性可能与不同射线的穿透能力相关。由于X射线LET(线性能量传递)最小,所以穿透能力要大于重离子射线。从qRT⁃PCR的验证结果来看,miR⁃21对不同类型射线都具有较高的敏感性,特别是低剂量(0.1 Gy)射线照射下,也具有显著性差异,说明miR⁃21具有作为辐射标志物的充分条件。
3.3 不同类型射线照射下的时间效应关系
通过miR⁃21对不同射线的剂量效应(图2)可以得出,当X射线、碳离子束和铁离子束的照射剂量都为1 Gy时,miR⁃21的表达水平都有显著性上升,所以选取1 Gy剂量的X射线、碳离子和铁离子射线对小鼠进行全身照射,分别在照射后6 h、12 h、24 h、48 h、72 h取血并分离血清,利用qRT⁃PCR技术检测miR⁃21在不同时间点的表达水平,以未照射小鼠作为对照。如图3所示,在受到不同射线照射后6 h、12 h、24 h、48 h和72 h的时间点,miR⁃21的表达水平相比于对照组都有升高的趋势,说明miR⁃21在受到辐射的早期(6 h)就能快速有效地反映出个体受到的辐射损伤情况,并能在至少3天内维持显著性水平,为辐照后的样本采集及检测提供了时间。
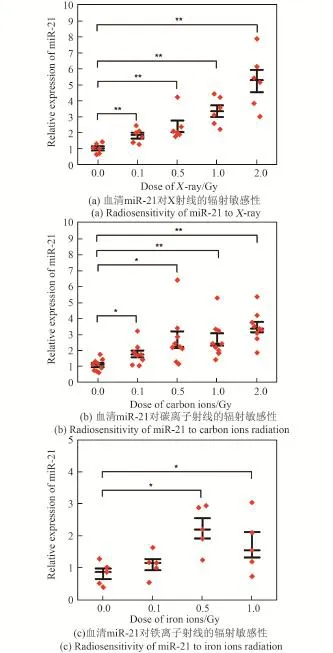
图2 不同类型射线照射下miR⁃21的剂量效应关系Fig.2 Dose⁃dependent effect of miR⁃21 related to different kinds of radiation
3.4 miR⁃21在不同小鼠个体间本底表达水平
作为普适性的标志物,其在不同个体间的本底表达水平需具有稳定性。通过检测相同鼠龄和不同鼠龄未处理小鼠血清中miR⁃21的表达水平,研究其在不同个体间的稳定性。首先,选取8周龄的身体状态健康的小鼠(n=9),取血并分离血清,利用qRT⁃PCR技术检测血清中miR⁃21的Ct值,并与外源内参(cel⁃miR⁃39)的Ct值进行归一化,得到ΔCt值(图4)。另外,选取3组4周龄小鼠(n=9),将其分别饲养到6周、8周和14周,同样方法检测其血清中miR⁃21的Ct值(图5)。从结果可以看出,在相同鼠龄小鼠中,miR⁃21归一化的ΔCt值方差为0.123,组内比较并无显著性差异;不同鼠龄小鼠间ΔCt值相比较也并无显著性差异。说明miR⁃21的本底水平在不同小鼠个体间是稳定的,具有作为普适性标志物的条件。
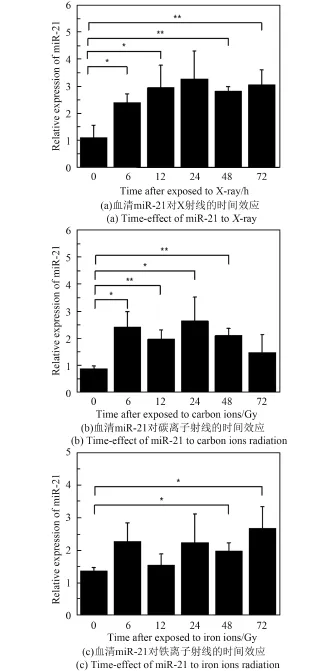
图3 1Gy不同类型射线照射下miR⁃21的时间效应关系Fig.2 Time⁃dependent effect of miR⁃21 to 1Gy dose of different kinds of radiation
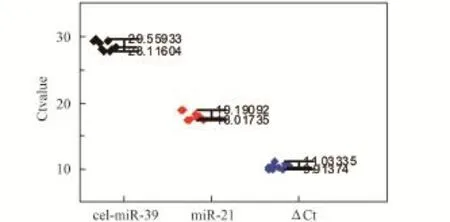
图4 相同鼠龄的未照射小鼠血清中miR⁃21的表达水平Fig.4 Expression level of serum miR⁃21 in the same age mice without radiation
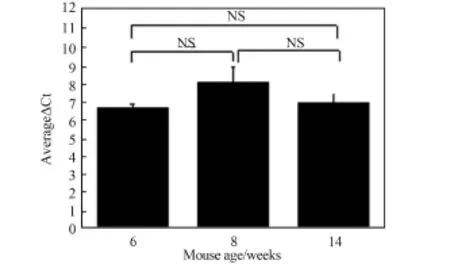
图5 不同鼠龄的未照射小鼠血清中miR⁃21的ΔCt值Fig.5 ΔCt value of serum miR⁃21 in the different age mice without radiation
4 讨论
miRNA作为一种重要的转录后调控因子,积极响应各种外界胁迫条件。在生物体受到辐射损伤时,身体各个器官的miRNA分子会进入循环血,所以循环血miRNA水平能反映机体受到的辐射损伤程度。前期研究结果表明,小鼠循环血中多种miRNA在受到包括X射线、碳离子和铁离子射线的照射后其表达水平都会出现显著变化,说明部分特异的循环血miRNA分子对各种剂量和类型的射线都具有较高的敏感性。本研究以miR⁃21为对象,进一步探索了miR⁃21作为一种辐射标志物进行实际应用的可能性。通过利用X射线、碳离子和铁离子射线对小鼠进行全身照射,发现miR⁃21对不同类型射线都具有相同的敏感性,并且具有较好的剂量效应关系(图2);在辐射后早期,miR⁃21能稳定维持在一个高表达的状态(图3);并且在不同小鼠中,miR⁃21的本底表达水平都是相似的(图4、5)。以上结果说明miR⁃21可以作为一种有效的辐射标志物来预测暴露于非致死剂量(低于2 Gy)的电离辐射后的辐射损伤风险。由于miRNA长度较短,并且在循环血中常被囊泡包裹的内在特点,相比于蛋白和基因类标志物,miRNA具有在不同物种和个体间的保守性较高[24]、在样本保存及提取过程中稳定性好[25]的优点。如果将多种辐射敏感的miRNA集中制成生物芯片,通过增加标志物数量和实验重复次数,将会有效提高预测的准确程度,使其成为一种简便有效的辐射损伤检测方法,有望在未来的辐射风险评估中发挥巨大的作用。
miR⁃21作为一种功能强大的miRNA,参与多种生物过程,并且直接调控P53、TGF⁃β、PTEN等与细胞凋亡及增殖相关的重要蛋白[26]。在细胞模型中的研究表明,辐照后表达水平上调的miR⁃21可以通过抑制P53、PDCD4等蛋白的表达,或者影响Akt蛋白磷酸化的过程来提高细胞的辐射抗性[27⁃28]。最近的研究表明,miR⁃21可以作为辐射旁效应信号分子进入到未受辐照细胞中,使之表现出类似辐射损伤效应[29]。辐照后循环血中表达升高的miR⁃21是否会通过旁效应影响其他器官中细胞的分子通路,甚至是增加致癌的风险,目前并没有相关的研究和报道。所以,进一步研究循环血中miR⁃21的去向及可能发挥的功能对探索辐射引起的长期效应具有重要意义。
(
)
[1]Kubancak J,Ambrozova I,Ploc O,et al.Measurement of Dose Equivalent Distribution on⁃Board Commercial Jet Aircraft[J].Radiation Protection Dosimetry,2014,162(3):215⁃219.
[2]Zeitlin C,Hassler D M,Cucinotta F A,et al.Measurements of Energetic Particle Radiation in Transit to Mars on the Mars Science Laboratory[J].Science,2013,340(6136):1080⁃1084.
[3]Coleman C N,Stone H B,Moulder J E,et al.Modulation of radiation injury[J].Science,2004,304(5671):693⁃694.
[4]Mountford P J and Temperton D H.Recommendations of the International⁃Commission on Radiological Protection(Icrp)1990[J].European Journal of Nuclear Medicine,1992,19(2):77⁃79.
[5]Semkova J,Dachev T,Koleva R,et al.Observation of radia⁃tion environment in the International Space Station in 2012⁃March 2013 by Liulin⁃5 particle telescope[J].Journal of Space Weather and Space Climate,2014,4.
[6]Caffrey J A and Hamby D M.A review of instruments and methods for dosimetry in space[J].Advances in Space Re⁃search,2011,47(4):563⁃574.
[7]Parker D D and Parkerf J C.Estimating radiation dose from time to emesis and lymphocyte depletion[J].Health Physics,2007,93(6):701⁃704.
[8]Goans R E,Holloway E C,Berger M E,et al.Early dose as⁃sessment following severe radiation accidents[J].Health Physics,1997,72(4):513⁃518.
[9]Andrievski A and Wilkins R C.The response of⁃H2AX in hu⁃man lymphocytes and lymphocytes subsets measured in whole blood cultures[J].International Journal of Radiation Biology,2009,85(4):369⁃376.
[10]Menard C,Johann D,Lowenthal M,et al.Discovering clini⁃cal biomarkers of ionizing radiation exposure with serum pro⁃teomic analysis[J].Cancer Research,2006,66(3):1844⁃1850.
[11]Ossetrova N I and Blakely W F.Multiple blood⁃proteins ap⁃proach for early⁃response exposure assessment using an in vivo murine radiation model[J].International Journal of Radiation Biology,2009,85(10):837⁃850.
[12]Joiner M C,Thomas R A,Grever W E,et al.Developing point of care and high⁃throughput biological assays for deter⁃mining absorbed radiation dose[J].Radiotherapy and Oncol⁃ogy,2011,101(1):233⁃236.
[13]Giordano S and Columbano A.MicroRNAs:New Tools for Di⁃agnosis,Prognosis,and Therapy in Hepatocellular Carcino⁃ma?[J].Hepatology,2013,57(2):840⁃847.
[14]Bartel D P.MicroRNAs:Genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281⁃297.
[15]Bertoia M L,Bertrand K A,Sawyer S J,et al.Reproducibili⁃ty of Circulating MicroRNAs in Stored Plasma Samples[J].Plos One,2015,10(8).
[16]Balzano F,Deiana M,Dei Giudici S,et al.miRNA Stability in Frozen Plasma Samples[J].Molecules,2015,20(10):19030⁃19040.
[17]Armand⁃Labit V,Meyer N,Casanova A,et al.Identification of a Circulating MicroRNA Profile as a Biomarker of Metastatic Cutaneous Melanoma[J].Acta Dermato⁃Venereologica,2016,96(1):29⁃34.
[18]Avigad S,Verly I R N,Lebel A,et al.miR expression profi⁃ling at diagnosis predicts relapse in pediatric precursor B⁃cell acute lymphoblastic leukemia[J].Genes Chromosomes&Cancer,2016,55(4):328⁃339.
[19]Do Canto L M,Marian C,Willey S,et al.MicroRNA analy⁃sis of breast ductal fluid in breast cancer patients[J].Inter⁃national Journal of Oncology,2016,48(5):2071⁃2078.
[20]Jacob N K,Cooley J V,Yee T N,et al.Identification of Sen⁃sitive Serum microRNA Biomarkers for Radiation Biodosimetry[J].Plos One,2013,8(2).
[21]QIAGEN.miScript miRNA PCR Array Date Analysis[DB/OL].https://pcrdataanalysis.sabiosciences.com/pcr/array⁃analysis.php.
[22]Templin T,Amundson S A,Brenner D J,et al.Whole mouse blood microRNA as biomarkers for exposure to gamma⁃rays and Fe⁃56 ions[J].International Journal of Radiation Biology,2011,87(7):653⁃662.
[23]Cui W C,Ma J F,Wang Y L,et al.Plasma miRNA as Bio⁃markers for Assessment of Total⁃Body Radiation Exposure Do⁃simetry[J].Plos One,2011,6(8).
[24]Du J F,Wu Y J,Zhang Y X,et al.Large⁃scale information entropy analysis of important sites in mature and precursor miRNA sequences[J].Science in China Series C⁃Life Sci⁃ences,2009,52(8):771⁃779.
[25]Quantification of Circulating miRNAs in Plasma Effect of Pre⁃analytical and Analytical Parameters on Their Isolation and Stability[J].Journal of Molecular Diagnostics,2013,15(6):827⁃834.
[26]Selcuklu S D,Donoghue M T A and Spillane C.miR⁃21 as a key regulator of oncogenic processes[J].Biochemical Society Transactions,2009,37:918⁃925.
[27]Chao T F,Xiong H H,Liu W,et al.MiR⁃21 Mediates the Radiation Resistance of Glioblastoma Cells by Regulating PD⁃CD4 and hMSH2[J].Journal of Huazhong University of Sci⁃ence and Technology⁃Medical Sciences,2013,33(4):525⁃529.
[28]Gwak H S,Kim T H,Jo G H,et al.Silencing of MicroRNA⁃21 Confers Radio⁃Sensitivity through Inhibition of the PI3K/AKT Pathway and Enhancing Autophagy in Malignant Glioma Cell Lines[J].Plos One,2012,7(10).
[29]Xu S,Ding N,Pei H L,et al.MiR⁃21 is involved in radia⁃tion⁃induced bystander effects[J].Rna Biology,2014,11(9):1161⁃1170.
Study on Potential of Circulating miR⁃21 as a Dosimeter for Space Radiation
WEI Wenjun1,2,HUA Junrui1,2,LIN Sulan1,2,WANG Jufang1
(1.Gansu Key Laboratory of Space Radiobiology,Institute of Modern Physics,Chinese Academy of Sciences,Lanzhou 730000,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
In deep space exploration,quick and simple assessment of the radiation injury and the risks of individuals in the early stage of radiation is a great challenge for the traditional radiation do⁃simeters.Circulating microRNA(miRNA)has good specificity and stability,and can positively re⁃spond to changes of the environment.So,screening miRNAs signatures in blood is of great signifi⁃cance for developing noninvasive dosimeters.In this study,kunming mice were whole⁃body exposed to X rays and serum was collected after 24 hours.Expression levels of 21 candidate circulating miR⁃NAs were detected by miRNA PCR array.It was found that many kinds of circulating miRNAs re⁃sponded to radiation,among which miR⁃21 had a bigger change.Then,the dose⁃dependent and time⁃dependent effects of miR⁃21 after exposure to X rays,carbon ions and iron ions radiation were validated.Moreover,the background expression level of miR⁃21 in different mice was detected.The results showed that the expression level of miR⁃21 was up⁃regulated with a significant dose⁃depend⁃ent after exposure to different kinds of radiation,especially responded to low dose radiation.Its ex⁃pression level kept in a stable threshold value within 6~72 hours.The background expression level of miR⁃21 had no significance in the same or different age mice.All the above results demonstrate that miR⁃21 has the potential to assess the radiation injury as a dosimeter.
circulating;miR⁃21;radiation;biomarker;risk assessment
R852.7;Q691.7
A
1674⁃5825(2016)06⁃0714⁃06
2016⁃05⁃26;
2016⁃10⁃14
国家自然科学基金(31270895);国家国际科技合作专项(2015DFR30940);载人航天预先研究项目(040101)
危文俊(1990-),男,博士研究生,研究方向为空间辐射防护及生物学效应。E⁃mail:wwwweiwenjun@163.com

