应用不同融合材料的腰椎后路椎体间融合术临床对比
符楚迪 葛云林 李战友
应用不同融合材料的腰椎后路椎体间融合术临床对比
符楚迪 葛云林 李战友
腰椎节段间的融合手术目前广泛应用于临床,手术方式有后路椎体间融合术(PLIF)、前路椎体间融合术(ALIF)、经椎间孔椎体间融合术(TLIF)、侧前方椎体间融合术(OLIF)等。融合材料有自体骨、同种异体骨及不同种类椎间融合器(CAGE)。不同椎间融合材料使用的目的都是为了提高融合率,降低失败率,以取得更好的临床疗效。笔者对椎间融合应用CAGE混合自体颗粒骨及单纯使用自体颗粒骨的两组患者进行长期随访,在融合率、椎间隙高度维持、内固定失败率及临床疗效方面进行了比较研究,现报道如下。
1 资料和方法
1.1 一般资料 2002年12月至2006年12月在我院住院患者共52例。融合节段集中在L4~5和L5~S1间隙,全部选择单间隙融合患者,其中L4~5共36个间隙,L5~S1共16个间隙。依据椎间融合材料不同分为CAGE组30例和颗粒骨组22例。CAGE组男14例,女16例,年龄35~76岁,平均50.63岁;术前疾病:退变性腰椎间盘突出症19例,腰椎滑脱症6例,腰椎管狭窄症5例。颗粒骨组男11例,女11例,年龄31~72岁,平均49.97岁;术前疾病:退变性腰椎间盘突出症14例,腰椎滑脱症5例,腰椎管狭窄症3例。随访时间CAGE组为术后8~10年,平均9年。颗粒骨组术后8~12年,平均10年。两组患者性别、年龄、术前疾病等资料比较差异均无统计学意义(均P>0.05)。
1.2 方法 CAGE组使用CAGE及自体颗粒骨组合进行椎体间融合,颗粒骨组使用自体颗粒骨进行椎体间融合。所有患者同时进行腰椎后路椎弓根螺钉内固定,手术全部由同一组医生主刀完成。椎弓根螺钉为韩国BK品牌系列,为钛合金材料。椎间融合材料应用CAGE及自体颗粒骨。CAGE由美国史塞克公司提供,为PEEK材料。自体颗粒骨来源为患者椎板碎骨及髂后上棘髂骨。两组患者均行腰椎CT检查,ODI评分[1]。
1.3 评估指标 包括融合率、椎间隙高度、内固定失败率、ODI评分(仅为随访时的评分对比)。
1.3.1 融合判断及融合率 CT是首选的评价椎体间融合的方法[2-3]。以螺旋CT薄层扫描观察存在或不存在连续的骨小梁通过相邻椎体终板和椎间隙移植骨作为融合或不融合的评价标准[4-5]。融合征象:在连续的多层切面上有连续的骨小梁通过相邻椎体终板和椎间隙移植骨;移植骨周围不存在连续多层切面的的骨小梁连续性中断;移植骨密度基本正常,允许少量及轻度硬化现象(图1、2)。不融合征象:椎间隙内骨小梁连续性中断。可分为:(1)萎缩性:间隙内移植骨大量吸收,有明显透光区;(2)断裂型:斜形和横形裂隙,骨小梁连续性上下中断(图3)。

图1 CT颗粒骨椎间融合图
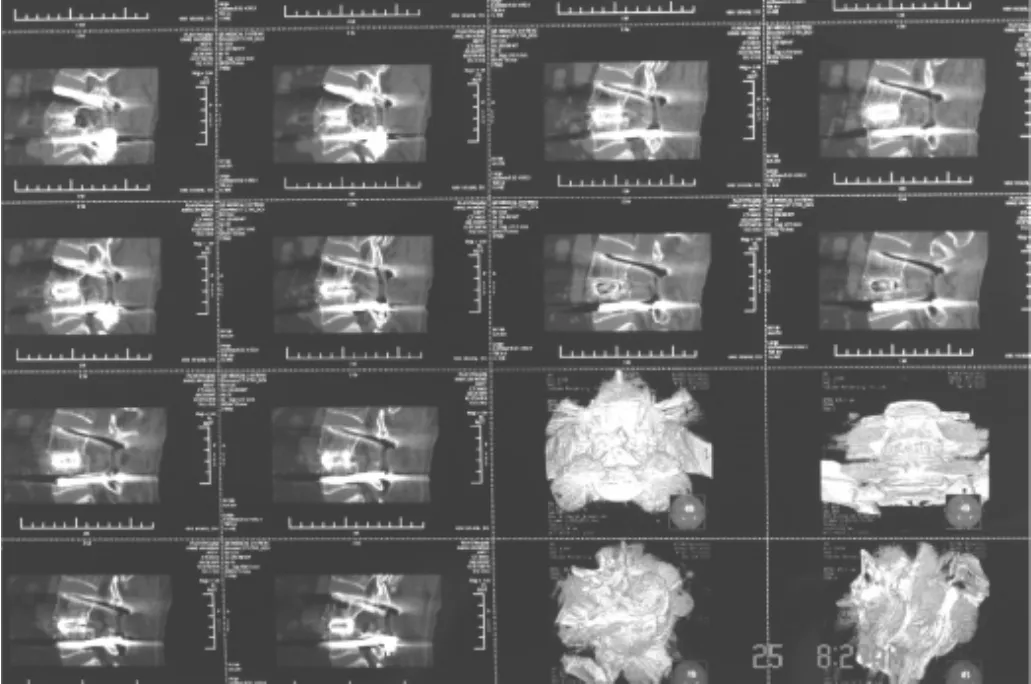
图2 CT CAGE椎间融合图

图3 CT颗粒骨不融合图
1.3.2 椎间隙高度测量标准及比较 所有患者均在CT矢状切面椎体中线图像上,测量相邻椎体上下终板中点的连线长度作为椎间隙高度值。
1.3.3 内固定失败 以X线平片上螺钉断裂、变形、移位、滑杆、螺帽松动、脱落等表现以及手术中证实为依据(图4)。

图4 螺帽脱落(内固定失败)
以上影像学资料由2位骨科医师,1位放射科医师双盲完成,测量数据取平均值,定性数据以2位及以上相同结果为准。
1.3.4 ODI评分 通过门诊复查填表方式完成ODI评分资料的收集评分。ODI评分由2位骨科医生共同完成。
1.4 统计学处理 应用SPSS 14.0统计软件,计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验。
2 结果
2.1 两组患者融合率比较 CAGE组30例,达到融合标准30例,融合率为100.00%;自体颗粒骨组共22例,达到融合标准15例,融合率68.18%;两组比较差异有统计学意义(P<0.05)。
2.2 两组患者椎间隙高度值比较 CAGE组椎间隙高度9.8~12.8mm,平均(10.57±0.53)mm;自体颗粒骨组为7.6~11.3mm,平均(9.56±0.48)mm,CAGE组高于自体颗粒骨组(P<0.05)。
2.3 两组患者内固定失败率比较 CAGE组发生0例,发生率为0;自体颗粒骨组为3例,发生率13.63%,CAGE组发生率低(P<0.05)。
2.4 两组患者ODI评分比较 CAGE组平均6.71分,自体颗粒骨组平均6.95分,两组比较差异无统计学意义(P>0.05)。
3 讨论
普遍认为腰椎减压融合手术所要达到的目标有:充分的神经减压消除神经压迫症状;良好的融合获得局部运动节段的稳定,防止复发;恰当有效的椎间隙高度维持,恢复并保持正常腰椎生理曲度;优良的临床疗效。
首先,要保证充分的神经减压,这是获得优良疗效的基础;然后要获得良好的节段融合,以消除局部不稳带来的腰痛症状。良好的支撑获得椎间隙高度维持,并且术后长期不丢失,有利于恢复并保持正常的腰椎生理曲度,使得腰椎整体和局部载荷分配更合理。生物力学研究证实,正常生理曲度时,腰椎前柱的承重载荷为总载荷的82%,小关节承载约18%[6]。生理曲度下的载荷分配是一种最低能耗的平衡状态,有利于防止肌肉、韧带、椎间盘、小关节及椎体的过载而出现累积性劳损,从而延缓退变的发生,减少术后慢性腰痛的发生率,降低临椎病的风险[7],对中远期疗效的提高有明显的作用。
椎间隙高度维持还可以增加椎管和椎间孔容积。有研究发现,椎间隙增高1mm,椎间孔出口面积增加20%~30%[8]。椎管和椎间孔容积增加,神经根出口扩大,使得神经根减压更加充分有效,非常有利于术后神经症状的进一步改善及恢复。
要达到椎体间融合需要许多必要条件:符合生物力学的局部结构稳定;合适的植骨材料;足够的植骨面积和植骨量。所谓结构稳定,在腰椎融合手术就是前柱的良好支撑,辅以椎体周围韧带的张紧,以及后柱椎弓根螺钉的张力带作用。比较CAGE和单纯颗粒骨植骨,CAGE有良好的前柱支撑并配合后路椎弓根螺钉的张力带作用,有很好的局部稳定性,而单纯颗粒骨则缺乏这个重要的特性。PEEK材料的CAGE有着与椎体骨相近的弹性模量,较钢性的金属CAGE下沉率更低,能更好的支撑并维持椎间隙高度。同时张紧了椎体间的纤维环和前后纵韧带,使得局部更加稳定。CAGE结合椎弓根螺钉更好的恢复腰椎生理曲度,所以能达到高融合率和低内固定失败率的结果。而自体颗粒骨最大的缺陷就是前柱支撑的问题。没有前柱支撑,局部载荷将重新分配,使得椎弓根螺钉因此承载支撑力量,从而容易产生内固定疲劳、断裂现象,即使短时间内椎弓根螺钉起到撑开作用,但长期持续负重,就容易出现切割、松动等现象,导致椎间隙高度丢失,以及内固定失败。本组中长期随访CAGE和自体颗粒骨融合率分别是100.00%和67.18%,椎间隙高度相差约1mm,内固定失败率CAGE组为0,自体颗粒骨组为13.63%,两者差异明显。证实使用CAGE比单纯自体颗粒骨在融合率、椎间隙高度维持、内固定失败率上的优越性。
当然,颗粒骨植骨也有自身的一些优点,比如费用较低,手术简便,尤其植入时所需操作空间较小,可以尽量少的破坏小关节等稳定结构,尤其神经根牵拉程度小,损伤风险较低。相反CAGE在安装时需要较大的空间,需要向外侧更多的切除小关节,不正确安装时对神经根刺激风险相对更大。有较多文献显示,术后出现神经根损害症状,主要就是发生在安装CAGE时,其发生率可达到5.77%[9]。
本组长期随访两组ODI评分无统计学差异,这与其他文献中报道的融合率与临床疗效不成正比的观点相符合。事实上,大约50.00%的不融合是没有症状的[10]。可能原因有:(1)坚强融合与不融合最后都达到了稳定的状态。本组不融合的患者CT扫描发现,椎间隙内骨粒有不同程度的部分融合,并且犬牙交错,椎间隙虽然存在微动,但并不存在失稳。(2)坚强融合可以导致应力集中在临近节段,导致临近节段退变加速而发生临椎病的风险增加,从而产生新的症状。而稳定的不融合状态可能类似于非融合手术所达到的效果,可以减少应力集中,甚至可能减少腰椎病的发生。如果能克服椎间隙高度维持不佳及内固定失败率高的问题,结果有可能甚至优于坚强融合。
只有当部分患者不融合间隙存在失稳时才可能会产生显著的症状,有一部分甚至需要翻修。文献报道的假关节失稳的诊断要素有:动力位脊柱侧位片显示椎间隙存在位移>4mm,或成角>10°[11]。本组没有患者存在上述失稳现象。
这种自体颗粒骨植骨不完全融合所形成的介于坚强融合与假关节之间的状态,或许是一种稳定的非融合状态。其内部组织结构是一种纤维连接和骨性连接的混合。动物测试证明:X线检查所示形成连续性骨痂证明发生坚强融合的脊柱,其坚强程度还不如椎体间有2~3mm纤维性连接的脊柱[12]。这种情况有待于进一步研究。
[1]蒋协远,王大伟,韩士章,等.骨科临床疗效评价标准[M].北京:人民卫生出版社,2005:119-121;123-124.
[2]Burkus J K,Dorchak J D,Sanders D L.Radiographic assessment of interbody fusion using recombinant human bone morphogenetic protein type 2[J].Spine,2003,28:2372-2377.
[3]Cook S D,Patron L P,Christakis P M,et al.Comparison of methods for determining the presence and extent of anterior lumbar interbody fusion[J].Spine,2004,29:1118-1123.
[4]Santos E R G,Goss D G,Morcom R K,et al.Radiologic assessment ofinterbody fusion using carbon fiber cages[J].Spine,2003, 28:997-1001.
[5]Shah R R,Mohammed S,Saifuddin A,et al.Comparison of plain radiographs with CT scan to evaluate interbody fusion following the use of titanium interbody cages and transpedicular instrumentation[J].Eur Spine J,2003,12:378-385.
[6]J K Scheer,J A Tang,J S Smith,et al.Cervical spine alignment, sagittal deformity,and clinical implications:a review[J].J Neurosurg Spine,2013,19(2):141-159.
[7]Jun S B,Sang-Ho L,Jin-Sung K,et al.Adjacent segment degeneration after lumbar interbody fusion with percutaneous pedicle screw fixation for adult low-grade isthmic spondylolisthesis [J].Neurosurgery,2010,67:1600-1607.
[8]范熙明.颈椎椎间隙狭窄和椎间孔的大小的关系[J].医学信息,2001, 14(7):433.
[9]Najmus S,Kamrul A.Comparison of the early results of transforaminal lumbar interbody fusion and posterior lumbar interbody fusion in symptomatic lumbar instability[J].Indian J Orthop,2013, 47(3):255-263.
[10]Lee C,Dorcil J,Radomisli T E.Nonunion of the spine:A review [J].Clin Orthop,2004,419:71-75.
[11]Villavicencio AT,Bumeikiene S,Bulsara KR,et al.Perioperative complications in transforaminal lumbar interbody fusion versus anterior-posterior reconstruction for lumbar disc degeneration and instability[J].J SpinalDisords Teck,2006,19(2):92-97.
[12]Mcaffee P C,Regan J J,Farey I D,et al.The biomechamicaland histomorphometric propertiesof anterior lumbar fusions:a canine model[J].J SpinalDisords,1998,1:101-110.
2016-09-08)
(本文编辑:田云鹏)
310007 杭州,解放军第117医院骨科中心

