控制哈茨木霉菌体形态提高β-1,3-葡聚糖内切酶活的研究
王 剑,郑志永,朱 莉,詹晓北
(1.江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,无锡 214122;2.江苏瑞光生物科技有限公司,无锡 214122)
控制哈茨木霉菌体形态提高β-1,3-葡聚糖内切酶活的研究
王 剑1,郑志永1,朱 莉2,詹晓北1
(1.江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,无锡 214122;2.江苏瑞光生物科技有限公司,无锡 214122)
哈茨木霉的深层培养菌体形态与β-1,3-葡聚糖内切酶酶活之间有密切关系。通过单因素试验优化了控制哈茨木霉菌球形态的培养条件为:摇瓶装液量100 mL/500 mL,接种量5%(V/V),初始pH 6.5,回旋式摇床转速180 r/min,在培养基中添加0.3%(m/V)的吐温-80或0.3%(m/V)的CMC-Na。在该条件下,菌球直径控制在(0.42±0.09)mm左右,β-1,3-葡聚糖内切酶酶活达到(111.9±7.5)U/mL。进一步通过正交优化,β-1,3-葡聚糖内切酶酶活提高到了135.2±8.3 U/mL,同时得出各种因素对菌球直径的影响顺序为:接种量>CMC-Na>吐温-80。
菌体形态;β-1,3-葡聚糖内切酶;哈茨木霉
丝状真菌具有代谢多样性、生产能力高及分泌效率高等优点,被广泛用于生物活性物质和重组蛋白等代谢产物的生产[1]。在深层培养中,大多数真菌以菌丝、菌团和菌球的形态存在。菌丝的形成会产生较高的黏度,影响传氧和传质[2]。过大的菌球导致溶氧和营养传质受到限制,从而影响菌体生长和产物的合成[3]。真菌的形态除受遗传因素影响之外,接种量、搅拌转速、培养基成分以及pH值、温度等因素都会对其产生影响[4]。
霉菌形成菌球有多种机制[5]。Carlsen等[6]和Grimm等[7]发现黑曲霉形成菌球的方式是孢子在生长初期慢慢聚集,随着培养的进行最后形成菌球,即菌球是由一小部分凝结的孢子萌发形成的。Vecht-Lifshitz等[8]发现链霉菌属的成球机制不同于黑曲霉,它是由单个孢子生长形成菌球。不同产物对菌体最优形态的要求是不同的,如形态为菌球或菌团时产柠檬酸效率较高[9];而产组织型纤溶酶原激活剂(t-PA )则是松散的菌丝体较好[2]。Wucherpfennig等[10]和Krull等[11]提出了形态工程的概念,并综述了营养环境条件、菌体形态和发酵液流变性与目标产物之间的关系。
β-1,3-葡聚糖酶分为内切酶和外切酶,广泛存在于真菌、细菌、软体动物和高等植物[12]。在食品、农业、生物技术、医药等领域有广泛的应用[13-15]。目前,利用哈茨木霉发酵得到的β-1,3-葡聚糖酶的总酶活已有很大提高,但β-1,3-葡聚糖内切酶占总酶量的比例仍较低,而提高β-1,3-葡聚糖内切酶活性的同时降低β-1,3-葡聚糖外切酶活性,对于制备β-1,3-葡寡糖至关重要,对降低β-1,3-葡聚糖内切酶纯化成本和大规模生产β-1,3-葡寡糖非常有意义。本研究拟通过控制培养条件来研究哈茨木霉菌体形态,进而提高β-1,3-葡聚糖内切酶酶活。
1 材料与方法
1.1 材料
1.1.1 菌种
哈茨木霉(TrichodermaharzianumGIM 3.442),购于中国广东省微生物菌种保藏中心,-20℃沙土管保藏。
1.1.2 培养基
孢子培养基 (g/L):马铃薯(去皮) 200.0,葡萄糖 20.0,KH2PO43.0,MgSO4·7H2O 1.5,硫胺素 0.008,琼脂 20.0,pH 6.5。
种子培养基 (g/L):葡萄糖 20.0,酵母浸粉 15.0,(NH4)2SO42.5,KH2PO46.0,MgSO4·7H2O 0.8,CaC120.5,pH 6.5。
发酵培养基 (g/L):茯苓多糖 40.0,胰蛋白胨 5.0,KH2PO45.0,MgSO4·7H2O 0.2,CaCl20.4,pH 6.5。
1.1.3 试剂
茯苓多糖、珍珠岩、豆粕粉、麦麸均为食品级;CaCO3、Al2O3、CMC-Na、吐温-80均购于国药集团化学试剂有限公司;滑石粉购于上海晶纯生化科技股份有限公司;热凝胶购于Takeda-Kirin Food Co.(日本)。
1.1.4 仪器与设备
普通光学显微镜LEICA S系列(德国徕卡公司);回旋式摇床HYL-C型(偏心距26 mm)、往复式摇床HYL-B(振幅80 mm,太仓市强乐设备有限公司)。
1.2 方法
1.2.1 孢子悬浮液的制备
哈茨木霉菌株在产孢子培养基上25℃培养5~7 d至形成孢子。用无菌生理盐水冲洗孢子,摇床振荡20 min,使孢子均匀分散,得到孢子悬浮液。
1.2.2 种子培养
接2.5 mL(106个孢子/mL)孢子悬浮液于种子培养基中[种子培养基装液量20% (V/V)],25 ℃,初始pH 6.5,100 r/min往复式摇床培养24 h。
1.2.3 摇瓶发酵培养
接5% (V/V)种子液于发酵培养基中[发酵培养基装液量20%(V/V)],25 ℃,初始pH 6.5,100 r/min往复式摇床培养6 d[16]。
1.2.4 反应底物制备
热凝胶溶解于1 mol/L的NaOH溶液至终浓度为10 g/L,20℃磁力搅拌6 h。然后用1 mol/L的HCl调溶液至pH 7.0,5000 r/min离心20 min并收集沉淀,然后用去离子水洗涤沉淀3次。向沉淀中加入去离子水至热凝胶浓度为20 g/L,然后匀浆5 min,4℃保存备用[17]。
1.2.5 粗酶液的制备
取发酵6 d后的哈茨木霉发酵液,8000 r/min、离心10 min,取上清液置于4 ℃冰箱保存备用。
1.2.6 酶反应条件
反应底物悬浊液2 mL,加1 mL酶液,温度50℃,pH 6.0,混匀,在水浴摇床(110 r/min)反应3 h。
1.2.7 生物量测定
菌体干重法。取10 mL发酵液于8000 r/min下离心10 min,去除上清液,所得沉淀用去离子水水洗2~3次,于105 ℃烘至恒重后称重。
1.2.8 菌体形态分析
在光学显微镜下观察菌体形态并拍照,根据菌球的大小和数量进行统计分析(标准差分析)。所有实验均重复5次。
1.2.9 β-1,3-葡聚糖酶活测定
反应体系5 mL,包含2 mL磷酸盐缓冲液(0.025 mol/L,pH 6.0),2 mL热凝胶悬浊液和1.0 mL粗酶液。50℃下反应3 h后,沸水浴10 min终止反应。
总酶活(Etotal)定义:在50℃条件下,每分钟水解热凝胶生成1 μg总产物的量为1酶活单位(U)。
β-1,3-葡聚糖内切酶活(Eendo)定义:在50℃条件下,每分钟水解热凝胶生成1 μg葡寡糖(2≤ DP <6)的量为1酶活单位(U)。计算出最佳内切酶活与总酶活的比值[16]。
薄层色谱分析(TLC):根据文献[18]酶水解液点样1.5 μL于Gel 60 F254薄层层析板(Merck KGaA,德国);以乙酸-乙酸乙酯-水(2:2:1,V/V/V)为展开剂,层析60 min。经显色剂[0.2%(m/V)地衣酚,11%(V/V)硫酸乙醇溶液]处理后于105℃显色5 min。用图像分析软件Image 基于TLC板的灰度计算葡寡糖(2≤ DP <6)的峰面积,并与标准样品进行对比,计算得到内切酶活。
2 结果与讨论
2.1 菌体形态和产β-1,3-葡聚糖内切酶的关系
哈茨木霉在液体发酵过程中会因为培养条件的不同而形成不同的菌体形态。如图1-a为大量菌丝体状态,此时发酵液黏度较高,发酵结束时β-1,3-葡聚糖内切酶酶活仅为(38.5±2.8)U/mL。在图1-b中,哈茨木霉在发酵液中形成直径(0.92±0.07)mm的菌球,培养液中散落的菌丝体较少,此时培养基流动性好,传质、传氧和传热均较好,发酵结束时β-1,3-葡聚糖内切酶酶活为(49.5±3.7)U/mL,比图1-a菌丝形态时高了28.6%。但是,当菌球直径超过一定值时也会导致β-1,3-葡聚糖内切酶酶活降低,如图1-c、d所示,此时的菌球直径为(1.20±0.23)mm。从图1-c可以看出,菌球有明显的分层现象,外围的菌丝体较松散,中心的菌丝体较为紧密。在图1-d中,培养到144 h的菌球,其中心形成空洞,原因可能是菌球中心长时间的缺少营养物质和氧气,使菌体发生自溶而形成中空内核[19],导致内切酶酶活降低。

图1 不同哈茨木霉菌体形态
A:发酵液中菌丝图片(取样时间72 h);b:发酵液中菌球图片(取样时间72 h);c:年轻菌球光学显微图片(取样时间72 h);d:衰老菌球光学显微图片(取样时间144 h)
图2是多组实验的菌球尺寸、生物量和β-1,3-葡聚糖内切酶酶活的数据统计,并进行了数据的拟合。从图2-a可以看出,菌球直径与哈茨木霉产β-1,3-葡聚糖内切酶酶活存在一定的相关性,当菌球直径很小(<0.2 mm)时,β-1,3-葡聚糖内切酶酶活较低,而当菌球直径在0.25~0.75 mm时,酶活性相对较高。从数据的横向趋势看,当菌球较小时,菌球尺寸比较均匀并且易控制,而当菌球发展为大菌球(>1.2 mm)时,菌球尺寸的均匀性变差,且不易控制,同时β-1,3-葡聚糖内切酶酶活也显著低于较小菌球时的状态。从图2-b可以看出,在一定范围内,生物量与内切酶酶活存在弱线性关系,生物量的增加有利于提高β-1,3-葡聚糖内切酶酶活。综上分析,控制哈茨木霉为一定大小的菌球形态,并同时提高生物量有利于β-1,3-葡聚糖内切酶酶活的提高。
菌球直径和生物量都不是生物发酵的自变量,归根结底受培养条件的影响。因此以下将对哈茨木霉的培养条件进行研究,以达到控制菌球尺寸,进而提高β-1,3-葡聚糖内切酶酶活水平的目的。

图2 哈茨木霉菌球直径、生物量与β-1,3-葡聚糖内切酶酶活关系的数据统计
Fig 2 Statistics analysis ofT.harzianumpellet diameter,biomass with endo-β-1,3-glucanase activity
2.2 培养条件对菌体形态和β-1,3-葡聚糖内切酶酶活的影响
2.2.1 孢子浓度的影响
菌体在种子液中的生长情况对发酵培养时的形态影响很大。当种子液以细小菌球为主,发酵培养时新的菌丝将围绕原菌球继续生长,最后仍为菌球状。将孢子悬液用玻璃珠打散,用血球计数板计数后,进行适当稀释,按每毫升102、103、104、105、106、107和108个孢子的浓度接种2.5 mL到种子培养基中,培养24 h,结果如表1所示。当斜面孢子浓度小于106个/mL 时,菌体呈菌球状生长,且斜面孢子浓度越低,菌球越大,生物量越小。当斜面孢子浓度大于106个/mL 时,菌体呈菌丝状生长且生物量也会所降低。综上所述,为使发酵培养时为菌球状,选取106的孢子浓度接种到种子培养基中较为合适。
表1 孢子浓度对菌浓及菌体形态的影响
Table 1 Effect of spore density on the morphology andconcentration ofT.harzianum

孢子浓度(个/mL)菌球大小和数量平均直径(mm)直径相对标准偏差(%)数量(个/mL)菌体干重(g/L)108菌丝13.1107菌丝13.41060.0815.9621±4014.21050.0917.8475±3013.41040.1522.6437±3012.51030.2426.4356±2013.01020.2828.4284±2012.7
2.2.2 液体种子接种量的影响
将上述种子液按不同的接种量接入发酵培养基中,振荡培养144 h,结果如表2所示。在接种量10%以下时,菌体形态主要为菌球,而且菌球的平均大小和接种量成反比;当接种量为3 %和5 %时,菌球大小的分布比较均匀;接种量为1%和2%时,菌球大小不均匀且生物量较低。当接种量为15%时,在菌体生长的早期阶段菌丝会相互作用形成网眼状,阻止了菌球的形成。图3为哈茨木霉培养144 h时的酶活与接种量的关系,可看出在5%接种量时β-1,3-葡聚糖内切酶(Eendo)和β-1,3-葡聚糖酶(Etoal)酶活较高,且内切酶酶活占总酶活的比例最高。因此,在5%接种量时能获得较高β-1,3-葡聚糖内切酶酶活,此时形成平均直径为(0.68±0.17)mm且较为均匀的菌球。

表2 种子接种量对菌体形态的影响
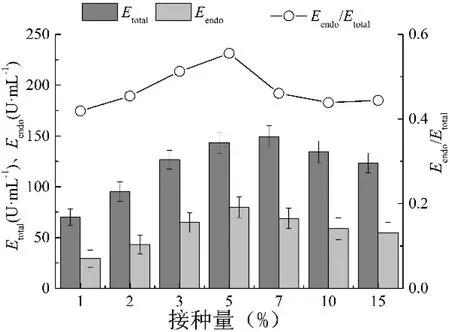
图3 接种量与β-1,3-葡聚糖内切酶酶活的关系
Fig 3 Relationship between inoculum volume and endo-β-1,3-glucanase activity ofT.harzianum
2.2.3 摇床振荡方式及速度的影响
菌体形态还受到培养方式的影响。在前面优化条件的基础上,我们对比了回旋式摇床和往复式摇床,在不同的转速下培养144 h的结果(5%接种量),结果如表3所示。在90 r/min往复式振荡与150 r/min回旋式振荡培养时,菌球直径较大且不均匀,生物量较低。随着转速的增加菌球直径逐渐变小且较均一,内切酶酶活也逐渐提高。但在120 r/min往复式振荡与240 r/min回旋式振荡培养时,β-1,3-葡聚糖内切酶酶活降低,分析可能原因是转速过高时形成菌球过于致密,从而影响了哈茨木霉的传质传氧,导致生物量和内切酶酶活降低。因此,采用180 r/min回旋式振荡培养有利于获得较高β-1,3-葡聚糖内切酶酶活,此时形成直径约为0.41 mm的菌球。
2.3 辅料对菌体的形态及产β-1,3-葡聚糖内切酶的影响
菌球的形成往往需要从一个核心开始,加入外源分散性固体辅料有助于菌球的形成。我们选取8种不同的辅料加入发酵培养基,分别是:碳酸钙、氧化铝、滑石粉、吐温-80、羧甲基纤维素钠(CMC-Na)、豆粕粉和麦麸。不同辅料的作用是不一样的,碳酸钙、氧化铝和滑石粉提供附着载体,吐温-80增加液体流动性,羧甲基纤维素钠作为附着载体,豆粕粉提供氮源并作为附着载体,麦麸提供碳源并作为附着载体。在培养基中加入0.3%(m/m)的不同辅料,回旋式振荡培养144 h,结果如表4和图4所示。添加碳酸钙、氧化铝时,生物量较低且菌体成团或片状,β-1,3-葡聚糖内切酶酶活较低。添加豆粕粉的发酵液中有较多的菌丝,生物量在20 g/L左右,其β-1,3-葡聚糖内切酶酶活有一定提高,但不明显。在含有麦麸、滑石粉的培养基中菌球较小且与菌丝混杂;含珍珠岩的发酵液中,菌体为絮状;添加吐温-80和羧甲基纤维素钠的培养基中,菌球大小均一,菌球直径为(0.42±0.09)mm,菌球松散且生物量高,β-1,3-葡聚糖内切酶酶活由(74.3±5.2)U/mL增加到(111.9±7.5)U/mL,且内切酶占总酶比例较高。因此,最终可选择添加0.3%吐温-80或羧甲基纤维素钠来控制菌体形态并提高内切酶酶活。
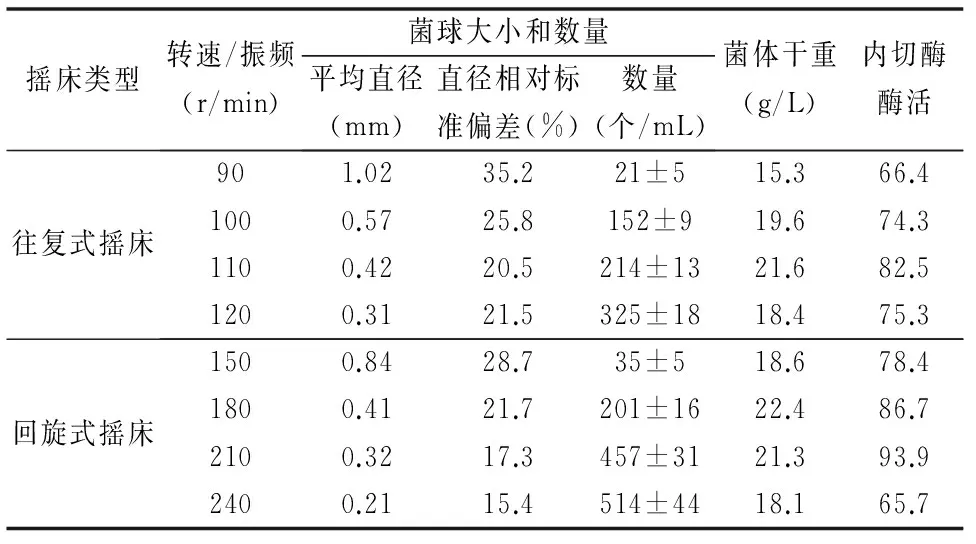
表3 振荡方式及速度对菌体形态的影响

表4 分散性辅料对菌球形态的影响
2.4 正交试验
选择L9(33)正交试验考察了接种量、CMC-Na、吐温-80、对菌体形态和β-1,3-葡聚糖内切酶酶活的影响,结果见表5。从表5中可以看出,接种量、CMC-Na和吐温-80添加量对菌体生长和β-1,3-葡聚糖内切酶酶活有一定的影响。显著性为接种量>CMC-Na>吐温-80。由表5中数据可知:在接种量为第三水平,添加CMC-Na量第二水平,添加吐温-80量第三水平时均值较高,故选取这3个水平做进一步做实验,得到β-1,3-葡聚糖酶酶活为(135.2±8.3)U/mL,此时菌球直径为(0.41±0.08)mm。
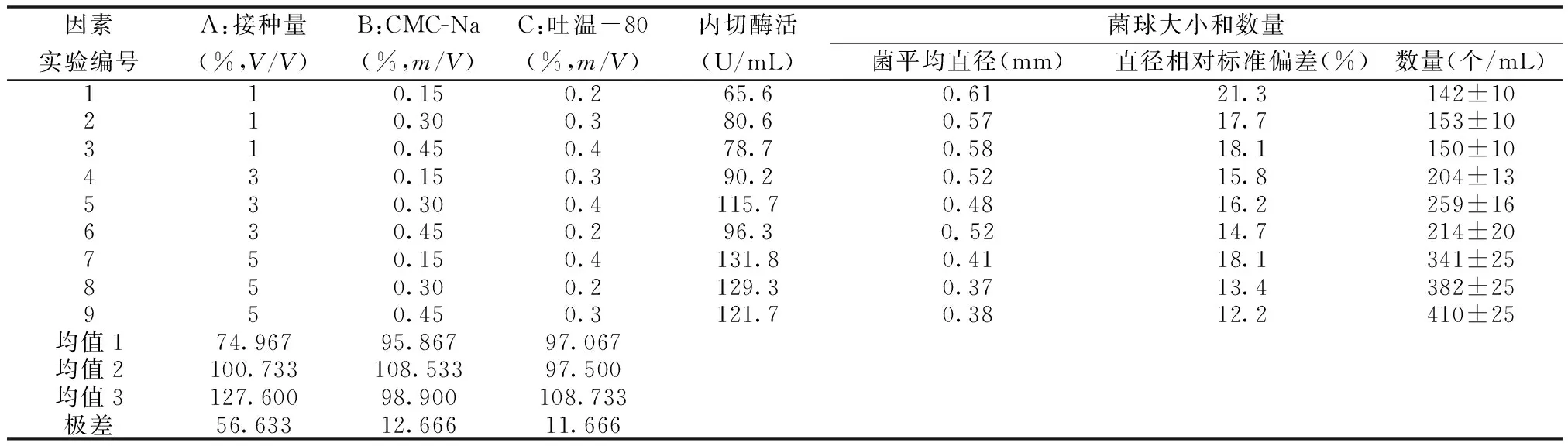
表5 L9(33)正交试验结果
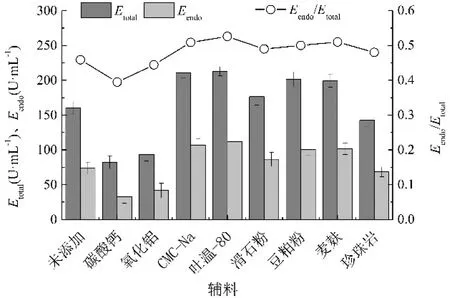
图4 分散性辅料对哈茨木霉产β-1,3-葡聚糖内切酶的影响
Fig 4 Effect of dispersing agent on the production of endo-β-1,3-glucanase byT.harzianum
3 结论
丝状真菌发酵过程中的形态控制一直是研究的热点与难点;生理学上的极性生长决定了其多细胞结构的复杂性。形态发育受环境中多因素的影响,单纯从基因工程角度来控制丝状真菌的宏观形态仍然难以实现。所以本研究主要通过培养条件来控制菌体形态进而研究哈茨木霉产β-1,3-葡聚糖内切酶的最佳菌体形态。当控制菌球直径为(0.41±0.08)mm时,β-1,3-葡聚糖内切酶酶活有显著提高,可达到(135.2±8.3)U/mL。因此,在发酵产酶过程中,对菌球形态的检测,可以作为产内切酶的一种关键指标。下一步工作是对哈茨木霉扩大培养时的菌体形态进行研究,发酵罐搅拌模式,搅拌桨形状,通气量大小等都会对菌体形态产生影响。目前丝状真菌形态的控制已有不少成功的先例,且随着理论基础研究的不断深入,建立不同培养条件下菌体形态和产物生成数学模型,优化丝状真菌的发酵过程,为丝状真菌的工业化应用提供更为精确的指导。
[1]KRULL R,WUCHERPFENNING T,ESFANDABADI M E,et al.Characterization and control of fungal morphology for improved production performance in biotechnology[J].Journal of Biotechnology,2013,163(2): 112-123.
[2]谢进霞,别松涛,刘逸寒,等.培养条件对赭曲霉菌球形成和坎利酮11α羟基化的影响[J].工业微生物,2011,41(6): 6-10.
[3]高 倩,刘 杰,刘立明,等.土曲霉菌体形态对衣康酸生产效率的影响[J].过程工程学报,2013,13(2): 281-286.
[4]王莉衡.土曲霉发酵条件对菌体形态与产物产量影响的研究[D].西安: 西北大学,2004.
[5]NIELSEN J.Modelling the morphology of filamentous microorganisms[J].Trends in Biotechnology,1996,14(11): 438-443.
[6]CARLSEN M,SPOHR A B,NIELSEN J,et al.Morphology and physiology of anα-amylase producing strain ofAspergihsoryzaeduring batch cultivations[J].Biotechnology and Bioengineering,1996,49(3): 266-276.
[7]GRIMM L H,KELLY S,HENGSTLER J,et al.Kinetic studies on the aggregation ofAspergillusnigerconidia[J].Biotechnology and Bioengineering,2004,87(2): 213-218.
[8]VECHT-LIFSHITZ S E,MAGDASSI S,BRAUN S.Pellet formation and cellular aggregation inStreptomycestendae[J].Biotechnology and Bioengineering,1990,35(9): 890-896.
[9]PAPAGIANNI M.Fungal morphology and metabolite production in submerged mycelial processes[J].Biotechnology Advances,2004,22(3): 189-259.
[10]WUCHERPFENNING T,KIEP K A,DRIOUCH H,et al.Morphology and rheology in filamentous cultivations[J].Advances in Applied Microbiology,2010,72: 89-136.
[11]KRULL R,CORDES C,HORN H,et al.Morphology of filamentous fungi: linking cellular biology to process engineering usingAspergillusniger[J].Advances in Biochemical Engineering/Biotechnology,2010,121: 1-21.
[12]VAN LIESHOUT J,FAIJES M,NIETO J,et al.Hydrolase and glycosynthase activity of endo-1,3-β-glucanase from the thermophile pyrococcus furiosus[J].Archaea,2004,1(4): 285-292.
[13]MANNERS D J,WILSON G.Purification of malted-barley endo-β-D-glucanases by ion-exchange chromatography: some properties of an endo-barley-D-glucanases[J].Carbohydrate Research,1976,48(2): 255-264.
[15]谭会泽,冯定远.饲料中的β-葡聚糖和β-葡聚糖酶的应用[J].畜禽业,2005,179(3): 18-21.
[16]李 珊.哈茨木霉发酵生产内切β-1,3-葡聚糖酶的工艺研究[D].无锡: 江南大学,2014.
[17]李 晶.热凝胶制备β-1,3-葡聚寡糖及其诱导抗真菌功能的研究[D].无锡: 江南大学,2014.
[18]陆光兴.高效定向水解制备热凝胶葡寡糖及其生物活性的研究[D].无锡: 江南大学,2015.
[19]BARRY D J,CHAN C,WILLIAMS G A.Morphological quantification of filamentous fungal development using membrane immobilization and automatic image analysis[J].Journal of Industrial Microbiology & Biotechnology,2009,36(6): 787-800.
[20]THEODORE K,PANDA T.Application of response-surface methodology to evaluate the influence of temperature and initial pH on the production of β-1,3-glucanase and carboxymethylcellulase fromTrichodermaharzianum[J].Enzyme and Microbial Technology,1995,17(12): 1043-1049.
Enhanced endo-β-1,3-glucanase produciton throughmorphology control ofTrichodermaharzianum
WANG Jian1,ZHENG Zhi-yong1,ZHU Li2,ZHAN Xiao-bei1
(1.Key Laboratory of Carbohydrate Chemistry and Biotechnology,School of Biotechnology,Jiangnan University,Wuxi 214122; 2.Jiangsu Rayguang Biotech Co.Ltd.,Wuxi 214122,China)
There is a close relationship between morphology ofTrichodermaharzianumand endo-β-1,3-glucanase production.The culture conditions for good morphology ofTrichodermaharzianuminwas optimized by single factor experiment,and the result showed as follow: 100 mL medium in 500 mL Erlenmeyer flask,5% (V/V) of inoculum volume.The initial pH of the medium was 6.5 and shaking speed was 180 r/min,0.3%(m/V) Tween-80 or 0.3%(m/V) CMC-Na was added into the medium as dispersing agents.The mycelia pellet diameter was about (0.42±0.09) mm and the activity of endo-β-1,3-glucan was (111.9±7.5) U/mL.In the further orthogonal optimization,the activity of endo-β-1,3-glucan reached (135.2±8.3) U/mL,and the influence order of culture conditions to mycelia pellet diameter was inoculum volume >CMC-Na> Tween-80.
morphology; endo-β-1,3-glucanase;Trichodermaharzianum
2016-02-25;
2016-03-07
收稿日期:国家自然科学基金项目(31171640,31271888);无锡市科技支撑计划(农业,CLE01N1208);无锡市130计划
王剑,硕士,主要研究方向为发酵工学,E-mail:wangjian597@163.com
郑志永,副教授,主要研究方向为微生物生理学和生物反应过程控制,E-mail: zhiyong@jiangnan.edu.cn
10.3969/j.issn.2095-1736.2016.06.099
TQ925;TS201.25
B
2095-1736(2016)06-0099-05

