鼠伤寒沙门菌rmlD缺失株的构建及生物学特性分析
黄 春,罗雅莉,李 沛,刘 青
(四川农业大学 动物医学院预防兽医研究所,成都 611130)
鼠伤寒沙门菌rmlD缺失株的构建及生物学特性分析
黄 春,罗雅莉,李 沛,刘 青
(四川农业大学 动物医学院预防兽医研究所,成都 611130)
为了研究rmlD缺失对鼠伤寒沙门氏菌(S.typhimurium)生物学特性及毒力的影响,利用自杀质粒介导的同源重组技术,构建了rmlD缺失株S100ΔrmlD,并对其生物特性进行了鉴定。结果显示,rmlD的缺失不影响鼠伤寒沙门氏菌的生长特性及对多黏菌素B、胆酸盐的敏感性,但黏附和入侵人肠黏膜细胞INT407能力显著增加。同时,rmlD缺失株毒力比野生株降低了约2000倍。以上结果表明,rmlD的缺失不影响鼠伤寒沙门氏菌的体外生长及对宿主抗菌活性物质的敏感性,但能显著降低菌株毒力。因此,rmlD的缺失可以作为一条有效的减毒途径。
鼠伤寒沙门氏菌;rmlD; 缺失; 毒力
沙门菌是一种非常重要的人兽共患病原菌,能够引起人和动物发热、肠炎、败血症等多种疾病症状,呈全球性分布,是世界上引起食物中毒最多的病原菌[1-3]。沙门菌除感染人外,还感染很多动物,包括各种家畜、家禽及犬、猫等,严重危害着人类和畜禽的健康[4-5]。
脂多糖(LPS)是细菌重要毒力因子,也是细菌维持群集运动[6-7]、入侵细胞及胞内复制[8-9]、肠腔定殖[10-11]、血清抵抗力[12-14]、抵制宿主巨噬细胞杀伤[15-16]等功能所必需的,以上功能直接关系到病原菌对机体的感染能力。研究表明,粗糙型的沙门氏菌(脂多糖LPS缺乏O抗原链)毒力低于光滑型的沙门氏菌(具有完整LPS)[17-18]。截断沙门氏菌LPS上O抗原和阻止O抗原在体内表达都是开发沙门氏菌疫苗的重要策略[19]。L-鼠李糖(L-Rhamnose)是沙门菌O抗原链上的组成成分,rmlD是位于O抗原基因簇上L-Rhamnose活性前体dTDP-L-rhamnose合成途径中的最后一个基因,编码dTDP-6-脱氧-L-来苏糖-4-酮糖-还原酶[20-22]。我们推测,rmlD的缺失很可能会导致细菌LPS上O抗原的缺失,从而使细菌毒力减弱。本研究利用自杀质粒介导的同源重组对S.typhimurium的rmlD进行敲除,研究rmlD对细菌生长、运动等基本生物特性影响。同时,对rmlD突变株抵抗宿主机体活性物质(阳离子抗菌肽多黏菌素B和胆盐DOC为代表)能力、黏附入侵能力及毒力影响等方面进行了研究,为构建理想的沙门氏菌减毒疫苗提供参考。
1 材料与方法
1.1 菌株、质粒、细胞及实验动物
鼠伤寒沙门氏菌菌株S100由本实验室分离鉴定;自杀质粒pYA4278及大肠杆菌宿主菌χ7232、χ7213由Curtiss实验室构建[23],本实验室保存;同源重组所需的质粒pQK246由本实验室构建;人肠黏膜上皮细胞INT407由本实验室保存;6周龄雌性BALB/c小鼠,购自成都达硕实验动物有限公司。
1.2 主要试剂
PrimeSTAR®Max DNA聚合酶、T4 DNA连接酶均购自TakaRa公司;限制性内切酶购自NEB公司;质粒小量提取试剂盒和DNA凝胶回收试剂盒均购自天根生化科技(北京)有限公司。
1.3 引物设计与合成
根据GenBank (CP002614.1)公布的rmlD序列设计用于扩增同源重组序列(即同源臂)的引物,并由华大基因合成。
1.4 同源重组质粒pQK246的构建
以鼠伤寒沙门氏菌野生株S100基因组为模板,分别用引物DrmlD-UF/ DrmlD-UR和DrmlD-DF/ DrmlD-DR扩增rmlD上游(458 bp)和下游(451 bp)同源臂。用DrmlD-UF/ DrmlD-DR引物进行overlap-PCR,将上、下游同源臂融合。将同源臂融合产物连接到质粒pYA4278,转化到感受态χ7232中,得到阳性克隆。将阳性克隆进行质粒抽提,测序。将测序正确的阳性重组质粒命名为pQK246。
1.5 S100ΔrmlD缺失株的构建及鉴定
将重组自杀质粒pQK246转化入χ7213(缺失asd,需DAP才能成长)菌株。分别挑取含pQK246的χ7213菌株和亲本S100菌株单克隆接种到新鲜液体LB中培养至D600 nm为0.8左右,按一定比例取菌液加到LB (DAP+)平板混匀后倾斜于37℃培养箱过夜培养,进行质粒的接合转移。将接合转移得到的菌苔接种于LB (Cm+)平板进行抗性筛选。挑取具有氯霉素抗性的单克隆接种到新鲜的液体LB培养基中培养(37℃,180 r/min) 3 h后,取100 μL菌液按一定比例稀释后涂布于LB (5%蔗糖)平板,置于28 ℃温箱培养。将在平板上长出的单菌落进行LB (Cm+)、LB (5%蔗糖)同时划板筛选。PCR鉴定对氯霉素敏感而对蔗糖抗性的单菌落,扩增得到同源臂融合片段大小的条带(899 bp)即表明缺失株构建成功。缺失株命名为S501。
1.6 回补株S501(pQK247)的构建
以野生株S100基因组为模板,用引物rmlD-F/rmlD-R通过PCR扩增出rmlD,将rmlD片段与质粒pYA4518进行连接,通过氯霉素抗性筛选得到阳性克隆,抽提质粒后测序,将测序正确的回补质粒命名为pQK247。最后将质粒pQK247转化到突变株S501中,得到回补株S501(pQK247)。
1.7 S100ΔrmlD缺失株LPS表型鉴定
银染方式:参考文献[24]的处理方法,将样品进行SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)。然后,将胶通过固定、氧化、银染、显影等步骤后,终止显影,凝胶成像系统照相。Western blot:按上述步骤处理好的样品经SDS-PAGE后,用半干转印法将凝胶上的LPS分子转移到硝酸纤维膜上,经5%的牛血清白蛋白(BSA)封闭,以沙门氏菌兔源一抗O4血清(宁波天润药业有限公司)为一抗,山羊抗兔BIOT-IgG (SouthernBiotech)为二抗,通过碱性磷酸酶AP-NBT/BICP显色进行Western blot鉴定。
1.8 S100ΔrmlD缺失株生长曲线的测定
将S100和S100ΔrmlD菌株分别挑单菌落接种到含3 mL新鲜液体LB培养基的试管中过夜培养,次日取1 mL菌液,分别转接到含150 mL LB培养基的三角瓶中,置于37℃摇床震荡培养,每隔1 h取菌液测定D600 nm值,纪录并整理数据,绘制菌株生长曲线。
1.9 运动性检测
取37℃过夜培养的S100和S100ΔrmlD菌株菌液,次日转接到新鲜LB培养基中培养到其D600 nm至0.8左右,分别取3 μL菌液滴于含0.3% 琼脂的新鲜半固体LB平板中央,置于37℃恒温培养箱静置培养,5 h后测量细菌运动直径并记录数据。该实验重复3次,进行统计分析。
1.10 抗菌肽、胆酸盐敏感性检测
取37℃过夜培养的S100和S100ΔrmlD菌株菌液,次日按1:100的比例加入3 mL新鲜的LB培养基中培养到其D600 nm值为0.8,取100 μL菌液稀释100倍后,取100 μL菌悬液于新的EP管中,加入多黏菌素B (终浓度0.5 μg/mL)或脱氧胆酸盐(终浓度10 mg/mL)于37℃条件下孵育1 h,然后将菌液进行适当倍比稀释,取稀释后的菌液100 μL涂布于LB平板上,置于37℃温箱培养18 h后进行菌落计数。该实验重复3次,进行统计分析。
1.11 黏附与入侵实验
将生长状态良好的INT407细胞进行消化和细胞计数,按5×105个细胞/孔的数量将细胞转移至24孔细胞培养板中,培养16 h后,按感染指数(MOI) 20的比例向细胞孔中加入新鲜培养的野生株S100和缺失株S100ΔrmlD,继续培养,1 h后用无菌PBS清洗3次,加入100 μL 1% Triton X-100裂解细胞10 min,释放细菌。用无菌PBS稀释细胞裂解液,选择100倍和1000倍稀释梯度涂布于LB平板上,置于37℃恒温箱(5% CO2)培养18 h后对菌落计数。侵袭检测试验,在细菌与细胞孵育1 h,用无菌PBS清洗3次以后,每孔加入含100 μg/mL庆大霉素的10%胎牛血清DMEM培养基1 mL,置于37℃恒温箱继续培养1 h,余下操作与黏附试验相同。
1.12 半数致死量(LD50)的测定
取37℃过夜培养的S100和S100ΔrmlD菌株菌液,次日将其按1:100的比例重新接种于含100 mL新鲜LB液体培养基的三角瓶中,于37℃振荡培养至D600 nm为0.9左右,将全部菌液离心(4000 r/min,10 min),倒掉上清,用500 μL BSG悬浮细菌沉淀,然后进行倍比稀释至相应剂量要求。将6周龄雌性BALB/c小鼠随机分成3组,每组5只,进行口服攻毒,每只小鼠口服剂量为20 μL,同时将细菌适度稀释后涂布LB平板进行菌落计数。连续观察一个月,并纪录小鼠症状和死亡情况。采用Bliss方法计算野生株和缺失株对雌性BALB/c小鼠的LD50。
2 结果
2.1 鼠伤寒沙门氏菌rmlD缺失株的PCR鉴定
用引物DrmlD-UF/ DrmlD-DR对筛选出的疑似突变株进行PCR鉴定。如图1所示,缺失株可扩增出大小约900 bp的片段(理论大小899 bp),而野生株则扩增出大小约1700 bp的片段(理论大小1799 bp),表明rmlD缺失株构建成功。

图1 rmlD缺失株的PCR鉴定
M:DL4500 Marker; 1: S100 (ΔrmlD); 2: The wild-type strain S100
2.2 回补株S501(pQK247)的构建
PCR扩增得到大小约900 bp的片段(理论大小900 bp),表明回补株S501(pQK247)构建成功,如图2。
图2 PCR鉴定S501 (pQK247)
M:DL4500 Marker; 1: S501 (pQK247)
2.3rmlD缺失株及回补株的LPS表型鉴定
通过银染(图3 A)和Western blot (图3 B)的方法对rmlD缺失株S501 LPS合成情况进行检测。结果显示,rmlD缺失导致细菌O抗原合成失败,LPS不完整。而经过回补质粒pQK247对rmlD突变株进行回补后,LPS表达量恢复到与野生株S100相当的水平。结果表明,rmlD突变株的构建并未影响到细菌基因组上、下游基因的表达。

图3 野生株S100、缺失株S501和回补株S501(pQK247)的 LPS表型
A:Silver staining; B:Western blot
2.4 生长曲线及运动性检测
生长曲线检测结果显示,rmlD缺失株与野生株S100的生长趋势一致,没有显著差异(图4)。运动性检测结果显示,rmlD突变株较野生株基本失去了运动能力,缺失的运动直径极显著小于野生株(表2)。表明rmlD的缺失并不影响细菌的生长,但严重降低了细菌的运动能力。
2.5rmlD缺失株对胆盐、多黏菌素B的敏感性的检测
分别用工作浓度为0.5 μg/mL的多黏菌素B和10 mg/mL的胆酸盐检测缺失株S100 ΔrmlD对这两种活性物质的敏感性。结果显示,缺失株S100 ΔrmlD和亲本株S100的存活率相似(图5),这表明rmlD缺失并未改变沙门氏菌对多黏菌素B和胆酸盐的抵抗力。
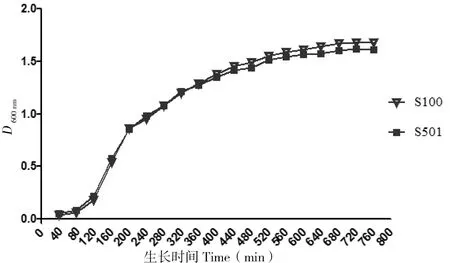
图4 野生株S100和缺失株S501(S100ΔrmlD)的生长曲线

表2 野生株S100与 rmlD缺失株S501的运动性及LD50检测

图5rmlD突变株对多粘菌素B和胆酸盐敏感性
Fig 5 Polymyxin B and DOC sensitivity assay of wild type strain S100 andrmlDdeleted strain.
2.6rmlD缺失株的黏附与入侵
黏附试验的结果显示,野生株S100的平均黏附率为1.23%,rmlD缺失株为3.5%,与野生株相比,缺失株S100 ΔrmlD黏附能力显著升高(P<0.001,图6);入侵试验的结果显示,野生株的入侵率为0.72%,而突变株的入侵率为1.99%,亦呈现显著升高(P<0.01,图6)。以上结果表明,rmlD缺失增加了沙门氏菌黏附、入侵INT407细胞的能力。
2.7 野生株S100及突变株S100 ΔrmlD对BALB/c小鼠的LD50测定
按推算的剂量口服攻毒小鼠,连续观察一个月。经Bliss法计算得到缺失株S100 ΔrmlD对小鼠的半数致死量为9×108CFU,S100对小鼠的半数致死量为4×105CFU(表2),rmlD突变株的半数致死量较亲本株降低了约2000倍,表明缺失株的毒力明显降低。

图6 rmlD缺失株黏附、入侵能力的检测
3 讨论
L-鼠李糖是沙门氏菌组成O抗原单位必需的单糖之一,而rmlD是合成鼠李糖通路中的一个必需基因[25,27]。鼠伤寒沙门氏菌S100rmlD缺失后,结果证明,rmlD的缺失确实导致细菌O抗原合成的失败,LPS不完整。我们对rmlD突变株相关生物特性和毒力进行研究。rmlD缺失株和野生株的生长曲线研究结果表明,缺失株与野生株的生长趋势相当,rmlD的缺失并不会影响野生株S100的生长特性,推测rmlD的缺失并不影响细菌的代谢和能量供应。对突变株运动性的研究表明,rmlD的缺失严重影响了细菌的运动性,缺失株基本丧失了其运动能力,可能LPS成分的不完整(O抗原的缺失)导致细菌鞭毛的合成发生障碍[28]。通过对rmlD突变株多黏菌素B和DOC的敏感性检测,结果显示,rmlD缺失株与野生株对多粘菌素B和DOC的敏感性相似,表明rmlD的缺失并未影响细菌对这两种活性物质的敏感性。
为了检测rmlD的缺失对细菌黏附和入侵的影响,我们评估了突变株和野生株对人肠黏附细胞INT407的黏附和入侵能力。结果证实,与野生株S100相比,rmlD缺失株的黏附、入侵能力显著提高,差异极显著(P<0.01)。表明截断O抗原后促进了鼠伤寒沙门氏菌黏附、入侵肠上皮细胞。West等[29]研究报道,在志贺杆菌中截断的LPS通过糖基化增强细菌III型分泌系统功能,进而促进其进入肠上皮细胞。
本研究中,rmlD的缺失导致鼠伤寒沙门氏菌S100菌株黏附、入侵人肠上皮细胞INT407的能力增强,但毒力却降低,可能由于细菌对宿主细胞黏附、入侵能力并非与细菌的毒力一定是正相关,虽然黏附、入侵是病原菌感染机体的先决因素,但病原菌对机体的致病性是复杂的动态过程,对细胞的黏附、入侵只是其中众多因素之一。具体的机制有待进一步的研究。
综上所述,本研究以鼠伤寒沙门氏菌S100为背景株,构建了rmlD缺失株,该菌株生长速度并未受到影响,对肠上皮细胞的黏附、入侵能力增强,毒力显著降低,rmlD突变可以考虑作为一条有效的减毒途径,为研制安全有效的沙门氏菌疫苗或载体奠定了基础。
[1]KWON Y M,COX M M,CALHOUN L N.Salmonella-based vaccines for infectious diseases[J].Expert Review of Vaccines,2007,6(2): 147-152.
[2]THIENNIMITR P,WINTER S E,BUMLER A J.Salmonella,the host and its microbiota[J].Current Opinion in Microbiology,2012,15(1): 108-114.
[3]MAJOWICZ S E,MUSTO J,SCALLAN E,et al.The global burden of nontyphoidalSalmonellagastroenteritis[J].Clinical Infectious Diseases,2010,50(6): 882-889.
[4]PASETTI M F,LEVINE M M,SZTEIN M B.Animal models paving the way for clinical trials of attenuatedSalmonellaentericaserovartyphilive oral vaccines and live vectors[J].Vaccine,2003,21(5-6): 401-418.
[5]MUGHINI-GRAS L,BARRUCCI F,SMID J H,et al.Attribution of humanSalmonellainfections to animal and food sources in Italy (2002 2010): adaptations of the Dutch and modified Hald source attribution models[J].Epidemiology and Infection,2014,142(5): 1070-1082.
[6]SARDAR R K,KAVITA K,JHA B.Lipopolysaccharide of marinobacter litoralis inhibits swarming motility and biofilm formation inPseudomonasaeruginosaPA01[J].Carbohydrate Polymers,2015,123: 468-475.
[7]MIRELES J R2Ⅱ,TOGUCHI A,HARSHEY R M.Salmonellaentericaserovartyphimuriumswarming mutants with altered biofilm-forming abilities: surfactin inhibits biofilm formation[J].Journal of Bacteriology,2001,183(20): 5848-5854.
[8]NEVOLA J J,LAUX D C,COHEN P S.In vivo colonization of the mouse large intestine and in vitro penetration of intestinal mucus by an avirulent smooth strain ofSalmonellatyphimuriumand its lipopolysaccharide-deficient mutant[J].Infection and Immunity,1987,55(12):2884-2890.
[9]JONES G W,RABERT D K,SVINARICH D M,et al.Association of adhesive,invasive,and virulent phenotypes ofSalmonellatyphimuriumwith autonomous 60-megadalton plasmids[J].Infection and Immunity,1982,38(2): 476-486.
[10]SHAIO M F,ROWLAND H.Bactericidal and opsonizing effects of normal serum on mutant strains ofSalmonellatyphimurium[J].Infection and Immunity,1985,49(3):647-653.
[11]ILG K,ENDT K,MISSELWITZ B,et al.O-antigen-negativeSalmonellaentericaserovartyphimuriumis attenuated in intestinal colonization but elicits colitis in streptomycin-treated mice[J].Infection and Immunity,2009,77(6): 2568-2575.
[12]NAGY G,DANINO V,DOBRINDT U,et al.Down-regulation of key virulence factors makes theSalmonellaentericaserovartyphimuriumrfaHmutant a promising live-attenuated vaccine candidate[J].Infection and Immunity,2006,74(10):5914-5925.
[13]GROSSMAN N,SCHMETZ M A,FOULDS J,et al.Lipopolysaccharide size and distribution determine serum resistance inSalmonellamontevideo[J].Journal of Bacteriology,1987,169(2): 856-863.
[14]MURRAY G L,ATTRIDGE S R,MORONA R.Inducible serum resistance inSalmonellatyphimuriumis dependent onwzzfepE-regulated very long O antigen chains[J].Microbes and Infection,2005,7(13): 1296-1304.
[15]KONG Q,YANG J,LIU Q,et al.Effect of deletion of genes involved in lipopolysaccharide core and O-antigen synthesis on virulence and immunogenicity ofSalmonellaentericaserovartyphimurium[J].Infection and Immunity,2011,79(10):4227-4239.
[16]MURRAY G L,ATTRIDGE S R,MORONA R.Altering the length of the lipopolysaccharide O antigen has an impact on the interaction ofSalmonellaentericaserovartyphimuriumwith macrophages and complement[J].Journal of Bacteriology,2006,188(7): 2735-2739.
[17]MURRAY G L,ATTRIDGE S R,MORONA R.Regulation ofSalmonellatyphimuriumlipopolysaccharide O antigen chain length is required for virulence; identification of FepE as a second Wzz[J].Molecular Microbiology,2003,47(5): 1395-1406.
[18]NAGY G,PALKOVICS T,OTTO A,et al."Gently rough": the vaccine potential of aSalmonellaentericaregulatory lipopolysaccharide mutant[J].Journal of Infectious Diseases,2008,198(11): 1699-1706.
[19]CURTISS R3Ⅲ,XIN W,LI Y,et al.New technologies in using recombinant attenuatedSalmonellavaccine vectors[J].Critical Reviews in Immunology,2010,30(3): 255-270.
[20]LI Q,REEVES P R.Genetic variation of dTDP-L-rhamnose pathway genes inSalmonellaenterica[J].Microbiology,2000,146(Pt9): 2291-2307.
[21]VAN DEN BOSCH L,MORONA R.The actin-based motility defect of aShigellaflexnerirmlDrough LPS mutant is not due to loss of IcsA polarity[J].Microbial Pathogenesis,2003,35(1): 11-18.
[22]BLANKENFELDT W,KERR I D,GIRAUD M F,et al.Variation on a theme of SDR: dTDP-6-deoxy-L-lyxo-4-hexulose reductase (RmlD) shows a new Mg2+-dependent dimerization mode[J].Structure,2002,10(6): 773-786.
[23]LIU Q,LI Y,ZHAO X,et al.Construction ofEscherichiacolimutant with decreased endotoxic activity by modifying lipid A structure[J].Marine Drugs,2015,13(6): 3388-3406.
[24]HITCHCOCK P J,BROWN T M.Morphological heterogeneity amongSalmonellalipopolysaccharide chemotypes in silver-stained polyacrylamide gels[J].Journal of Bacteriology,1983,154(1):269-277.
[25]MA Y,PAN F,MCNEIL M.Formation of dTDP-rhamnose is essential for growth of mycobacteria[J].Journal of Bacteriology,2002,184(12): 3392-3395.
[26]GIRAUD M F,MCMIKEN H J,LEONARD G A,et al.Overexpression,purification,crystallization and preliminary structural study of dTDP-6-deoxy-L-lyxo-4-hexulose reductase (RmlD),the fourth enzyme of the dTDP-L-rhamnose synthesis pathway,fromSalmonellaentericaserovarTyphimurium[J].Acta Crystallographica cection D: biological crystallography,1999,55(Pt12): 2043-2046.
[27]KAMINSKI L,EICHLER J.Haloferax volcanii N-glycosylation: delineating the pathway of dTDP-rhamnose biosynthesis[J].Plos One,2014,9(5): e97441.
[28]TOGUCHI A,SIANO M,BURKART M,et al.Genetics of swarming motility inSalmonellaentericaserovartyphimurium: critical role for lipopolysaccharide[J].Journal of Bacteriology,2000,182(22): 6308-6321.
[29]WEST N P,SANSONETTI P,MOUNIER J,et al.Optimization of virulence functions through glucosylation ofShigellaLPS[J].Science,2005,307(5713): 1313-1317.
Construction and biological characterization of armlDmutant ofSalmonellatyphimurium
HUANG Chun,LUO Ya-li,LI Pei,LIU Qing
(College of Veterinary Medicine,Sichuan Agricultural University,Chengdu 611130,China)
To study the influence ofrmlDdeletion on phenotype and virulence ofSalmonellatyphimurium,S.typhimuriumΔrmlDmutant of S100 ΔrmlDwas constructed by suicide plasmid-mediated homologous recombination.The biological characteristics of the ΔrmlDmutant showed that no difference was observed for the growth curve,sensitivity to polymyxin B and DOC ofrmlDstrain and the wild-type strain S100.However,the ability of adhesion and invasion was significantly increased compared to that of the wild-type strain.In addition,thermlDmutant strain showed approximately 2000-fold decrease in virulence.In conclusion,deletion ofrmlDgene had no effect on the growth and the sensitivity to polymyxin B or DOC,but significantly decreased the virulence.These data indicated thatrmlDgene deletion could be an efficient way to reduce the virulence ofSalmonellatyphimuriumfor vaccine development.
S.typhimurium;rmlDgene; deletion mutant; virulence
2016-03-10;
2016-03-23
收稿日期:国家自然科学基金( No.31472179); 国家自然基金青年科学基金项目(No.31200697)
黄春,硕士研究生,主要从事微生物免疫学研究,E-mail: huangchuncn@163.com
刘青,副教授,研究方向为微生物学和疫苗学,E-mail: Qing.liu.2@sicau.edu.cn
10.3969/j.issn.2095-1736.2016.06.033
S852.61
A
2095-1736(2016)06-0033-05

