洋山港海域浮游植物群落结构特征及演变趋势
李晓琳,薛俊增,吴惠仙
(1.上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;2.上海海洋大学 港航生态安全研究中心,上海 201306)
洋山港海域浮游植物群落结构特征及演变趋势
李晓琳1,2,薛俊增1,2,吴惠仙1,2
(1.上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;2.上海海洋大学 港航生态安全研究中心,上海 201306)
研究期间(2011年—2013年)洋山港近岸水域浮游植物的主要组成类群为硅藻,占浮游植物总密度的66%~83%。硅藻中的中肋骨条藻(Skeletonemacostatum)为绝对优势种(Y≥0.1),其次是具槽帕拉藻(Paraliasulcata),其他主要优势种包括近岸低盐性种类扁圆卵形藻(Cocconeisplacentula)、具边线形圆筛藻(Coscinodiscusmarginato-lineatus)和格氏圆筛藻(C.granii),以及广布性种类尖刺伪菱形藻(Nitzschiapungens)和菱形海线藻(Thalassionemanitzschioides)。冬季的优势种类较多,种类个数皆大于10;优势种种类最少的季节是夏秋季,种类个数在2~6之间。总磷总氮浓度的季节变化明显,夏季浓度较高,冬季浓度较低。方差分析显示,3年间的浮游植物密度差异显著(P<0.05,F(2,69)=6.22),3年的浮游植物平均密度变化无稳定规律与港口潮汐变化有关。Pearson相关性分析显示,硅藻密度与悬浮物、总磷呈极显著正相关(P<0.01),洋山港海域的浮游植物密度受到磷营养盐影响极大。自20世纪80年代以来,洋山港浮游植物密度剧烈上升,20世纪80年代至20世纪90年代平均密度增幅高达103倍,20世纪90年代至2000年增幅约102倍,2000年后虽然增幅有所降低但密度仍在上升,约10倍。甲藻的优势种类数量增多且组成发生改变,硅藻的优势种类个体偏小型化。结合历史数据表明,洋山港浮游植物密度的升高及群落结构的改变与港口水质富营养、营养盐结构不平衡及磷营养盐不足密切相关。
洋山港;浮游植物;群落结构;富营养化;演变
浮游植物是水环境中的初级生产者,是对水环境变化最为敏感的生物群落,其光合作用和细胞的生长依赖水体中的光照和营养物质[1]。在自然海域中,浮游植物群落受到海洋季候、潮动力等自然因素影响[2],然而在港口及其周边海域中,浮游植物不仅受到自然因素,同时受到多种特殊的人为因素的影响。港口的航道清淤和填海工程等人类活动对水生生物营养链造成巨大冲击,底层生物和表层的浮游生物群落结构皆会发生改变[3]。同时港口运输业发展迅速,船舶往来密集使港口水域污染日趋严重[4],压载水携带的外来物种入侵也影响港口生态环境,船舶压载水给当地港口带来的有害浮游植物中,部分种类可能会发生大量爆发[5]。
洋山港是全球最繁忙的集装箱港口之一,船舶往来频繁,入境的船舶压载水存在较高的潜在生物入侵风险[6]。该海域海水浑浊度高且营养盐浓度高,近年来水体富营养化日趋严重[7],浮游植物群落年际变化多样[8],洋山港及邻近海域的生态学状况备受关注[9-10]。2001年首次在对崎岖列岛附近海域的浮游植物和赤潮生物的研究中发现,该海域水质已处于严重富营养化状态[11]。王宝强等[12]将洋山港海域大洋山岛和圣姑礁的大型底栖动物群落结构与15年前进行了对比研究,结果显示圣姑礁大型底栖动物的密度和生物量皆大幅度降低,这与洋山港海域盐度的升高和生态环境变化以及人为干扰强度增强有关。本文结合多年的文献资料,分析20世纪80年代以来洋山港浮游植物群落特点及其演变趋势,阐明洋山港海域生态环境的变化对浮游植物群落的影响,并为洋山港及邻近海域生态环境的保护和外来物种入侵的防控提供理论基础。
1 材料与方法
1.1 样品采集与处理
在港口两侧的小洋山岛(XY)和大洋山岛(DY)设长期定位观测点(图1),于2011年—2013年每月进行连续监测。现场使用多参数探测仪(YSI,型号85-25)监测表面水体盐度、温度和溶解氧。依照《海洋监测规范》[13],将水样装入1 L的聚乙烯瓶中常温保存,并在24 h内对样品进行营养盐和悬浮物浓度的测定。浮游植物的样品采集和处理参照《海洋监测规范》[13],采集表层水1 L后立即滴加15 mL鲁哥试剂固定,带回实验室静置沉淀48 h去除上清浓缩至50 mL后滴加福尔马林保存,显微镜镜检,进行浮游植物的定性和定量分析。

图1 洋山港采样样点图(YE:长江口)
1.2 数据分析
浮游植物优势度的确定:
式中:Y为优势度,n为第i种物种个体数,N为总个体数,fi为第i种物种出现频率。当Y值大于0.1时,表示该物种为绝对优势种,当Y值大于0.01时,表示该物种为主要优势种[14]。
应用SPSS 16.0的单因素方差分析(one-way ANOVA)进行浮游植物群落平均密度差异性分析,环境因子和浮游植物密度的相关性分析应用Pearson相关性分析。数据作图软件采用GraphPad Prism 5.0。
2 结果
2.1 2011年—2013年洋山港环境因子变化
3年中,洋山港近岸水域表层温度具有明显的季节特征,温度的变化范围是5.60℃~27.30℃,夏季温度升高,冬季温度较低。盐度的变化范围是0.014 35~0.023 15,其变化趋势与温度相反。悬浮物浓度每年季节变化明显,夏秋季的悬浮物浓度较低,春季的悬浮物浓度较高。2011年—2013年硅酸盐浓度无明显的变化规律,平均浓度分别为1.31、1.79和1.01 mg/L(图2)。3年中总磷总氮浓度的季节特征明显,总磷浓度夏季较高,夏季总磷浓度分别是2.09(2011年)、1.10(2012年)和0.87 mg/L(2013年);冬季浓度较低,冬季总磷浓度分别是0.66(2011年)、0.30(2012年)和0.56mg/L(2013年),总氮浓度夏季和秋季较高,冬季浓度较低。
2.2 浮游植物群落特征变化
2011年—2013年洋山港浮游植物全年平均密度范围分别是1.05×105~ 4.12×105cells/L,3.29×104~3.05×105cells/L和4.63×104~ 4.36×105cells/L,每个年份的浮游植物密度全年变化特征不同,无稳定的变化规律(图3-a)。单因素方差分析结果表明,3年间的浮游植物密度差异显著(P<0.05,F(2,69)=6.22),其中2011年与2012年之间的浮游植物密度具有显著性差异(P<0.05,LSD法),2012年与2013年以及2011年与2013年之间的差异不显著(P>0.05,LSD法)。此外,硅藻是浮游植物的主要组成类群,平均密度范围在3.52×104~5.60×105cells/L,占浮游植物总密度的66%~83%。甲藻的年均水平较低,平均密度范围在0~5.33×103cells/L,每年夏季和冬季都出现上升现象(图3-b)。

图2 2011年—2013年洋山港水环境因子[温度,盐度,悬浮物(TSS),溶氧(DO)]和营养盐[总氮(TN),总磷(TP),硅酸盐(SiO3-Si)]的逐月变化(平均数±标准误)

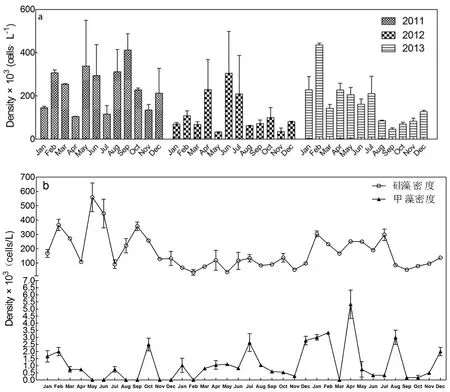
图3 2011年—2013年洋山港浮游植物平均密度
2011年—2013年洋山港海域发现浮游植物群落共6门,硅藻(Bacillariophyta)255种,绿藻(Chlorophyta)13种,裸藻(Euglenophyta)8种,甲藻(Pyrrophyta)15种,黄藻(Xanthophyta)3种,金藻(Chrysophyta)1种。以硅藻为主要类群,种类数占总体的77.14%~100%,多为半咸水类群。本文对洋山港3年中各个季节的优势种进行了分析,从表1中可以看出,2011年—2013年冬季的优势种类较多,种类个数皆大于10;优势种种类最少的季节是夏秋季,种类个数在2~6之间。3年中各个季节大部分的优势种均来自硅藻门,中肋骨条藻和具槽帕拉藻为常年优势种。中肋骨条藻为绝对优势种,各季节优势度在0.43~0.91之间,夏季优势度最大。小环藻属也是主要的优势种,2013年的春季和冬季优势度均大于0.1(表1)。其他主要优势种包括近岸低盐性种类扁圆卵形藻、具边线形圆筛藻和格氏圆筛藻,以及广布性种类尖刺伪菱形藻和菱形海线藻。

表1 2011年—2013年洋山港优势种优势度
续表1 (Continuedtable1)

优势种拉丁名2011春夏秋冬2012春夏秋冬2013春夏秋冬中肋骨条藻Skeletonemacostatum0.450.60.670.510.630.910.570.460.360.690.690.43热带骨条藻S.tropicum0.110.090.110.06————————念珠直链藻Melosiramoniliformis————————0.050.020.05卵形褶盘藻Tryblioptychuscocconeiformis——————0.010.02——0.01—六幅辐裥藻Coscinodiscusjonesianus———————0.02————菱形海线藻Thalassionemanitzschioides0.02—0.020.02————0.03——0.03具翼漂流藻Planktoniellablanda0.01——————————具槽帕拉藻Paraliasulcata0.040.04—0.060.080.010.070.090.070.050.030.08尖刺伪菱形藻Nitzschiapungens0.02——0.01——0.02———0.03—成列菱形藻N.seriata———0.01————————海洋菱形藻N.marina————————0.02——0.05碎片菱形藻N.frustulum——————0.020.03————海洋舟形藻Naviculamarina——————0.01———格氏圆筛藻Coscinodiscusgranii0.080.050.020.06————————辐射圆筛藻C.radiatus——————0.010.01————具边线形圆筛藻C.marginato-lineatus0.01——0.010.01—0.020.020.010.01维廷圆筛藻C.wittianus———————————0.01地中海细柱藻Leptocylindrusmediterraneus———0.02———————丹麦细柱藻L.danicus———0.01————————扁圆卵形藻Cocconeisplacentula0.020.040.030.02———0.010.02——0.01爱氏辐环藻Actinocyclusehrenbergii————0.01—0.010.02————矮小短棘藻Detonulapumila0.02———————————细小卵囊藻Oocystispusilla——————0.02—————叶状褐球藻Phaeoplaxmarinus——————0.02—————
注:“—”为该物种优势度<0.1或未出现
2.3 2011年—2013年洋山港浮游植物密度与环境因子相关性
将3年洋山港的每月浮游植物、硅藻和甲藻平均密度与温度、盐度、悬浮物、溶解氧、总氮、总磷和硅酸盐等环境因素进行Pearson相关性分析,样本量n值为36(表2)。结果显示,温度与盐度(P<0.01)呈极显著负相关,与总氮(P<0.05)、总磷(P<0.01)呈正相关。硅藻与悬浮物、总磷呈极显著正相关(P<0.01),甲藻与总氮呈显著负相关性(P<0.05)。

表2 2011年—2013年洋山港浮游植物密度与环境因子的Pearson相关性分析(n=36)
**:P<0.01相关性极显著(两侧检验);*:P<0.05相关性显著(两侧检验)
3 讨论
3.1 洋山港海域浮游植物密度变化
水体中营养盐影响着水中浮游植物的生长和繁殖[15-16],与以往资料对比发现,近30年洋山港浮游植物密度剧烈上升,20世纪80年代至20世纪90年代平均密度增幅高达103倍[21],20世纪90年代至2000年增幅约102倍[22],2000年后密度仍在上升但增幅有所降低,约10倍[11](表3),这种变化与长江口及邻近海域的浮游植物密度的研究结论相似[18,23]。营养盐浓度的持续上升促使浮游植物大量繁殖,洋山港位于长江口邻近海域,长江径流中营养盐输入对洋山港海域影响很大[20]。20世纪80年代以来,社会经济发展迅速,长江流域及支流的水质发生剧烈变化。有研究表明,20世纪80年代以前长江中下游地区的湖泊水库普遍水质较好,而80年代后期至今大部分湖泊已经呈现中营养或中富营养化以上水平[17],长江径流中营养物质的输入使长江口邻近海域营养盐浓度不断上升。长江口及邻近海域营养盐状况历年变化研究发现,1980年—2000年期间DIN增加了近2倍,1980年至2010年DIP增加了1.5倍左右,但在2000年后DIN微弱下降;2000年—2010年期间DIP呈下降趋势[18]。多年来氮磷营养盐浓度的上升使得洋山港海域水质富营养化严重,2001年时崎岖列岛附近海域水质已处于严重富营养化状态[11],2004年—2008年期间洋山港近岸海域表层硝酸盐和无机氮浓度均超过4类海水水质标准[19]。水体富营养化成为洋山港海域近30年浮游植物密度增长迅速的主要原因。
表3 1980年—2013年洋山港海域的浮游植物平均密度(cells/L)
Table 3 The average density of phytoplankton in Yangshanport during 1980-2013(cells/L)

1980s[21](1981年—1982年)1990s[22](1990年)2000s[11](2001年)2010s(2011年—2013年)冬0.025—5×1032.3×105春0.05502.5×1042.4×105夏0.1—5×1042.6×105秋0.0751005×1042.2×105
营养盐氮、磷是河口生态系统中浮游植物群落的重要影响因素,洋山港夏季总氮和总磷的浓度较高(图2)。夏季长江径流增大,径流中大量营养盐输入使长江口及邻近海域氮磷浓度升高。同时径流也影响到长江口及邻近海域营养盐结构,在Riga湾的研究中就发现河水影响小的区域呈现氮限制,河水影响大的区域呈现磷限制[24]。洋山港海域受长江径流影响很大[20],边佳胤等[7]对洋山港的营养盐结构分析发现洋山港海域营养盐结构不平衡,氮磷比例远远高于Redfiled值16,氮含量相对过剩,磷含量相对不足,因此洋山港磷限制的营养盐状况可能是受到径流的影响。本研究显示硅藻是洋山港浮游植物的主要组成类群,硅藻密度与总磷呈极显著正相关性(P<0.01),见表2,说明洋山港海域的浮游植物密度的变化受到磷营养盐影响极大。另外,悬浮物是洋山工程影响该海域生态环境的关键因子之一[25],徐兆礼等[26]通过试验发现悬浮物影响水体的透明度,从而影响浮游植物的光合作用,对浮游植物的生长起到抑制作用,但表2显示硅藻密度与悬浮物极显著正相关关系(P<0.01),可能由于悬浮物中含有大量磷[27],在磷相对不足的洋山港海域中,一定程度上促进了浮游植物的生长。
洋山港浮游植物密度变化与潮流、地理位置及人类活动等密切相关。朱根海等研究发现,2001年洋山港浮游植物密度有明显的季节变化,夏季密度升高,冬季密度降低[11],但到了2009年洋山港浮游植物密度变化呈双峰型,峰值在3月和11月[28]。本研究中,2011年—2013年洋山港近岸浮游植物密度变化不稳定,3年中密度峰值分别在9月、6月和2月(图3)。浮游植物密度不稳定的变化可能受到洋山港港区建设的影响。洋山港港区建设自2002年开始分期建设,洋山港工程中大规模的封堵陆连工程改变了该海域的地形边界条件,海域潮动力特征也随之响应,随着工程的进行,洋山港海域平均潮差逐渐增大[29],潮差越大,水体交换越强的海域水体环境越不稳定,同时影响浮游植物的聚集和生长繁殖[30]。这可以较好地解释本研究中每月采样时受到潮汐条件的影响,使得浮游植物密度每月变化不稳定。
3.2 洋山港海域优势种变化
浮游植物的优势种类组成取决于浮游植物的生态习性以及温度、盐度和营养盐等外界环境因素。本研究发现洋山港海域浮游植物优势种类冬季多,夏季少(表1)。中肋骨条藻在夏季的优势度最高,有研究发现在氮磷营养盐充足的环境里中肋骨条藻具有较强的竞争优势[31]。洋山港海域总氮、总磷浓度与温度呈正相关(表2),可以认为夏季洋山港海域营养盐浓度上升,中肋骨条藻在夏季大量繁殖抑制了其他种类的浮游植物生长,使得洋山港海域浮游植物优势种类冬季增多,夏季减少。
多年来,洋山港海域浮游植物优势种类群发生了显著变化,20世纪80年代硅藻中主要物种有中肋骨条藻和圆筛藻属(Coscinodiscussp.),主要的甲藻是三角角藻(Ceratiumtripos)和梭角藻(C.fusus)。2001年硅藻中出现了具槽帕拉藻,圆筛藻的种类减少,甲藻有齿原甲藻(Prorocentrumdentatum)、具尾鳍藻(Dinophysiscaudata)、链状亚历山大藻(Alexandriumcatenella)、裸藻(Euglenasp.)、塔玛亚历山大藻(A.tamarense)及夜光藻(Noctilucascientillans)等有害赤潮藻类,甲藻种类增多。2011年—2013年硅藻的主要物种包括中肋骨条藻、扁圆卵形藻(Cocconeisplacentula)、碎片菱形藻、格式圆筛藻(C.granii)、海洋菱形藻、具槽帕拉藻和条纹小环藻,多数是个体较小的硅藻种类,甲藻主要有裸甲藻(Gymnodiniumsp.)、塔玛亚历山大藻、小等刺硅鞭藻(Dictyochafibula),见表4。近30年洋山港甲藻优势种类增多,多年来洋山港海域虽然没有发生严重甲藻赤潮,但洋山港海域靠近东海赤潮高发区[32]。近30年东海海域硅藻赤潮占的比例从33%降低到了24%,而甲藻赤潮占的比例则从12.5%升高到了36%[33],受东海赤潮种类变化的影响,洋山港海域甲藻种类增多。与历史研究对比发现,近年洋山港海域优势物种的个体偏小型化,原因可能是以往调查漏采了一些个体小于网目的藻类[21],另外一个原因可能是受到洋山港海域营养盐结构的影响。有报道称,浮游植物粒级组分的这种变化与因半径的改变导致的营养盐吸收动力学半饱和常数变化有关,营养盐在细胞表层扩散限制层使得大细胞在低营养盐情况下失去竞争力,反之,高营养盐条件下小细胞浮游植物竞争处于劣势[34]。洋山港近岸海域营养盐处于磷限制状态[7],使得浮游植物在生长过程中,营养盐的成分和含量不足,小个体种类增加。

表4 1980年—2013年浮游植物群落主要物种分布
通过3年的周年调查和年际间的对比研究,我们可以发现,洋山港海域浮游植物种类主要由小型硅藻组成,浮游植物的密度受到总磷、总氮和悬浮物的影响明显,营养盐的增加和磷限制促进了近30年浮游植物种群结构的演变。
[1]KATZ M E,FINKEL Z V,GRZEBYK D,et al.Evolutionary trajectories and biogeochemical impacts of marine eukaryotic phytoplankton[J].Annual Review of Ecology Evolution & Systematics,2004,35:523-556.
[2]SMALL H,LUE K,WEBBER D,et al.The planktonic communities of the Jamaican south-east coast; a comparison of harbor,shelf and oceanic areas[J].Revista De Biolog a Tropical,2014,62:259-272.
[3]DAUVIN J C,PEZY J P.Long-term changes of the Seine estuary suprabenthos (1996 2012)[J].Journal of Experimental Marine Biology & Ecology,2013,448:93-103.
[4]尹艳娥,沈新强,蒋 玫,等.长江口及邻近海域富营养化趋势分析及与环境因子关系[J].生态环境报,2014,23(4):622-629.
[5]BUTRóN A,ORIVE E,MADARIAGA I.Potential risk of harmful algae transport by ballast waters: the case of Bilbao Harbour[J].Marine Pollution Bulletin,2011,62(4):747-757.
[6]薛俊增,刘 艳,王金辉,等.洋山深水港入境船舶压载水浮游动物种类组成分析[J].海洋学报,2011,33(1):138-145.
[7]边佳胤,袁 林,王 琼,等.洋山深水港海域水质变化趋势分析及富营养化评价[J].海洋通报,2013,32(1):107-112.
[8]陈立婧,张 薇,边佳胤,等.2012年小洋山近岸水域浮游植物群落结构的特征[J].上海海洋大学学报,2014,23(3):395-402.
[9]王 琼,陈 辰,吴惠仙,等.洋山港浮游桡足类群落的周年变化特征[J].海洋科学,2013,37(2):61-69.
[10]薛俊增,王宝强,庒 骅,等.洋山港码头污损生物的群落结构和多样性研究[J].科技导报,2011,29(3):66-70.
[11]朱根海,施青松,张 健,等.崎岖列岛附近海域浮游植物与水环境状况研究[J].海洋学报,2009,31(4):149-158.
[12]王宝强,薛俊增,庄 骅,等.洋山港海域大型污损生物生态特点[J].海洋学报,2012,34(3):155-162.
[13]GB17378,海洋监测规范[S].北京:中国标准出版社,2007.
[14]HABIB O A,TIPPETT R,MURPHY K J.Seasonal changes in phytoplankton community structure in relation to physic-chemical factors in Loch Lomond[J].Hydrobiologia,1997,350(1): 63-79.
[15]ARRIGO K R.Marine microorganisms and global nutrient cycles[J].Nature,2005,437(7057):349-355.
[16]李夜光,李中奎,耿亚红,等.富营养化水体中N、P浓度对浮游植物生长繁殖速率和生物量的影响[J].生态学报,2006,26(2):317-325.
[17]舒金华,黄文钰,吴延根.中国湖泊营养类型的分类研究[J].湖泊科学,1996,8 (3):193-200.
[18]王江涛,曹 婧.长江口海域近50a来营养盐的变化及其对浮游植物群落演替的影响[J].海洋环境科学,2012,31(3):310-315.
[19]张正龙,束 炯,张 勇.长江口邻近洋山港工程海域无机氮和磷的时空变化特征[J].海洋科学,2011,35(5):47-52.
[20]李玉中,陈沈良.洋山港海域与长江口相似性研究[J].地理学报,2002,57(6):662-670.
[21]蔡如星,张庆生.浙江省海岛海洋生物资源调查报告[M].杭州:浙江省水产局,1993:52-67.
[22]施仁德,边远慈.浙江省海岸带资源综合调查报告-海洋生物[M].浙江:浙江省海岸带资源综合调查队,1985:16-27.
[23]YANG S,HAN X,ZHANG C,et al.Seasonal changes in phytoplankton biomass and dominant species in the Changjiang River estuary and adjacent Seas: general trends based on field survey data 1959-2009[J].Journal of Ocean University of China,2014,13(6):926-934.
[24]MAESTRINI S Y,BALODE M,BÉCHEMIN C,et al.Nutrients limiting the algal growth potential (AGP) in the Gulf of Riga,eastern Baltic Sea,in spring and early summer 1996[J].La Mer,1997,35:49-68.
[25]徐兆礼,李 鸣,高 倩,等.洋山工程影响海洋环境关键因子的分析[J].海洋环境科学,2010,29(5):617-622.
[26]徐兆礼,易翠萍,沈新强,等.长江口疏浚弃土悬沙对2种浮游植物生长的影响[J].中国水产科学,1999,6(5):33-36.
[27]杨逸萍,胡明辉.河口悬浮物中磷的化学形态分布与转化[J].台湾海峡,1995,14(4):313-319.
[28]孙玲霜,薛俊增,庄 骅,等.洋山港浮游植物群落特征研究[J].海洋湖沼通报,2012(3):50-57.
[29]杨忠勇,程和琴,朱建荣,等.洋山港海域潮动力特征及其对工程的响应[J].地理学报,2012,67(9):1282-1290.
[30]徐家声.水动力状况与赤潮生物的聚集和扩散[J].海洋环境科学,1994(3):19-22.
[31]王宗灵,李瑞香,朱明远,等.半连续培养下东海原甲藻和中肋骨条藻种群生长过程与种间竞争研究[J].海洋科学进展,2006,24(4):495-503.
[32]王修林,孙 霞,韩秀荣,等.2002年春、夏季东海赤潮高发区营养盐结构及分布特征的比较[J].海洋与湖沼,2004,35(4):323-331.
[33]赵冬至.中国典型海域赤潮灾害发生规律[M].北京:海洋出版社,2010:100-150.
[34]FALKOWSKIP P G,WOODHEAD A D,VIVIRITO K.Primary productivity and biogeochemical cycles in the sea[M].//Environmental Science Research,New York :Plenum Press,1992(43):213-237.
The community succession and structure characteristicsof phytoplankton in Yangshan port
LI Xiao-lin1,2,XUE Jun-zeng1,2,WU Hui-xian1,2
(1.Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Shanghai Ocean University,Ministry ofEducation; 2.Research Center of Harbor Ecological Security,Shanghai Ocean University,Shanghai 201306,China)
Diatom was the dominant taxa of phytoplankton with a total phytoplankton density of 66%-83% during the study period (2011-2013).Skeletonemacostatumwas the dominant species in diatom taxa (Y≥0.1),and the following dominant species wasParaliasulcata.The other major dominant species were nearshore protosalt species,includingCocconeisplacentula,Coscinodiscusmarginato-lineatus,C.granii,NitzschiapungensandThalassionemanitzschioides.There were more dominant species in winter,whose species number were greater than 10,whereas those were less in summer and autumn with a species number of 2-6.The seasonal variations of total nitrogen and total phosphorus concentrations were significant with a higher level in summer and lower level in winter.Analysis of variance indicated the difference of phytoplankton density between three years was significant (P<0.05,F(2,69)=6.22).The monthly average density of phytoplankton change each year without stable rule was related to the tidal changes in harbor.Pearson correlation analysis showed the diatom density had significant positive correlation with suspended solids and total phosphorus (P<0.01),thus phytoplankton density was affected by phosphorus greatly.Since the 1980s the density of phytoplankton increased significantly and the increasing rate of phytoplankton density was up to 103,102and 10 in 1980s,1990s and after 2000s,respectively.The number of dominant species in dinoflagellates was increased and the species composition was also changed while the size of dominant species in diatom was minimized gradually.Compared to the historical data,the increment of phytoplankton density and the change of community structure were closely associated with eutrophication,imbalance of nutrient structure and phosphorus deficiency in Yangshan port.
Yangshan port; phytoplankton; community structure; eutrophication; succession
2016-02-15;
2016-03-08
收稿日期:上海市自然基金(15ZR1420900);上海高校知识服务平台项目(ZF1206)
李晓琳,硕士研究生,主要从事海洋浮游生物生态学研究,E-mail:260955213@qq.com
吴惠仙,教授,主要从事微生物学、海洋生态学研究,E-mail:hxwu@shou.edu.cn
10.3969/j.issn.2095-1736.2016.06.062
Q948.8
A
2095-1736(2016)06-0062-06

