同步热放化疗对中晚期宫颈癌的临床疗效及对CD4+T细胞平衡失调的影响
曹 锋 任瑞美
(1.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250022;2.山东省肿瘤医院,山东 济南 250117; 3.泰山医学院附属新泰医院,山东 新泰 271200)
同步热放化疗对中晚期宫颈癌的临床疗效及对CD4+T细胞平衡失调的影响
曹 锋1,2,3任瑞美2
(1.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250022;2.山东省肿瘤医院,山东 济南 250117; 3.泰山医学院附属新泰医院,山东 新泰 271200)
目的 探究同步热放化疗对中晚期宫颈癌的治疗效果以及对患者外周血中CD4+T细胞平衡失调的影响。方法 将本院2011年01月—2013年12月确诊收治的中晚期宫颈癌患者67例随机分成2组:传统放化疗治疗(CRT组)33例,热疗加同步放化疗组34(H+CRT组),比较两组患者的近期临床疗效和累积生存率曲线;择健康体检女性30例作为健康对照,检测三组外周血中的Th1、Th2、Th17以及Treg细胞百分比变化,及相关细胞因子的浓度变化。结果 (1)H+CRT组和CRT组的临床总有效率分别为88.24%、72.73%,H+CRT组1、2、3年生存率分别为79.41%、70.58%、64.70%,CRT组为69.69%、66.67%、60.60%,H+CRT组高于CRT组,两组差异无统计学意义(P>0.05)(2)两组宫颈癌患者外周血中,Th1百分比降低,Th2百分比和健康对照组比较无统计学差异(P>0.05),Th17、Treg百分比升高,Th1/Th2和Th17/Treg比值均显著低于健康对照组。经过治疗干预后,两组患者外周血Th1、Th17 、Treg细胞百分比和Th1/Th2、Th17/Treg比值均有所恢复,且H+CRT组的恢复更加显著。(3)两组宫颈癌患者外周血中IL-4和IL-17的表达水平均升高,经治疗干预后,两组IL-4和IL-17的表达水平均有所下降,但仍高于健康对照组,H+CRT组的下降趋势较CRT组更明显。结论 同步热放化疗临床疗效优于传统放化疗,有可能通过纠正患者外周血中的CD4+T细胞失衡达到抗肿瘤作用。
中晚期宫颈癌;CD4+T细胞;热疗;放化疗
随着思维方式和生活理念的变化,宫颈癌已成为导致女性死亡的高发恶性肿瘤之一,并且呈现年轻化趋势。中晚期宫颈癌的治疗较为困难,肿瘤局部未得到有效控制或者复发是治疗失败的主要原因。目前研究尚无法完全阐明宫颈癌的发病机制,但“肿瘤患者机体处于免疫抑制状态”这一说法得到广泛认同。CD4+T细胞在抗肿瘤免疫上具有凸显作用,有证据表明CD4+T对肿瘤产生毒副作用,可直接遏制或灭杀肿瘤细胞。如果我们通过各种干预措施,重新激活宫颈癌患者体内的CD4+T 细胞,就有可能提高机体的抗肿瘤作用,从而达到清除肿瘤细胞的目的。近30年来,热疗技术发展迅速,逐渐成为又一治疗肿瘤的全新方法,不但灭杀肿瘤细胞,而且增强机体免疫。热疗联合同步放化疗对宫颈癌的疗效如何,其疗效是否以提升CD4+T细胞为桥接呢?本研究以我院收治的67例中晚期宫颈癌患者为研究对象,希望为同步热放化疗的临床应用提供可靠的理论依据。
1 资料和方法
1.1 临床病例
选择2012年1月—2015年1月在我院住院治疗的经病理学检查确诊的宫颈癌患者67例,随机分2组:同步放化疗33例(CRT组),热疗加同步放化疗34例(H+CRT组)。H+CRT组患者,最高年龄72岁,最低年龄24岁,中位年龄48岁;鳞癌30例,腺癌3例,腺鳞癌1例。CRT组患者,最高年龄71岁,最低年龄26岁,中位年龄46岁;鳞癌29例,腺癌3例,腺鳞癌1例。两组患者的病理类型、年龄、FIGO分期等一般情况进行比较,无统计学差异(P<0.05),具有可比性。选择同期健康体检女性30例作为健康对照,比较三组人员的年龄结构无统计学差异(P<0.05)。本研究方案经过医院医学伦理学委员会审查批准,所有受试对象均知情同意。
1.2 纳入标准、排除及退出标准
纳入标准:①年龄<75岁且为初治患者;②Karnofsky评分≥70;③组织病理学确诊的宫颈癌,并参照FIGO分期标准处于IIb期~IIIb期患者;④无心、脑、肾等重大脏器疾病者,且无远处转移;⑤签署知情同意书者。 排除及退出标准:①不符合上述标准者;②具有免疫缺陷性疾病者;③出现严重并发症者;④治疗过程不予合作者。
1.3 治疗方法
CRT组:采用全盆野常规分割外照射放疗法,1.8 Gy/次,每周连续治疗5 d,1次/d。当照射量达到DT30.6 Gy后,全盆野中央挡铅(4~5)cm×(10~11)cm,继续照射DT14.4 Gy,照射剂量为DT45 Gy(1.8 Gy/次×25次)。当照射25次后行常规妇科检查,若宫旁消退情况不理想,则增加全盆野中央挡铅照射3次,照射量波动在45~50.4 Gy。当外照射DT27 Gy(放疗15次)后增加腔内照射,每周1次,6 Gy/次,连续治疗7次,A 点剂量42 Gy。如果患者瘤体较大,则放疗前先行阴道盒消瘤2次,源旁1 cm,10 Gy/次。照射放疗1周后同步行化学治疗,顺铂(DDP)40 mg/m2,1次/周,静脉滴注,连续治疗6周。H+CRT组:放化疗方案同CRT组,在化疗开始当天,静注顺铂结束1 h后,接受盆腹腔深部局部热疗(UHR-2000型微波热疗机 湖南华源医疗设备有限公司),60 min/次,体心温度波动于41.8~42 ℃,1次/周,连续治疗4周。
1.4 临床疗效判定
治疗结束后根据实体瘤疗效评价标准RECIST判定疗效:①完全缓解(CR):治疗后所有肿瘤病灶全部消失,且未见新病灶,并维持4周;②部分缓解(PR):治疗后病灶体积缩小程度超过30%,并维持4周;③稳定(SD):治疗后病灶体积缩小程度未达到30%,或者治疗后病灶体积出现增大,但未超过20%;④进展(PD):治疗后病灶体积增大超过20%,或出现新病灶。
1.5 流式细胞检测
1.5.1 主要试剂与仪器 RPMI 1640培养基(美国Thermo公司)、胎牛血清(美国Thermo公司);人淋巴细胞分离液 (天津市灏洋生物制品科技有限责任公司);佛波酯(PMA)、离子霉素(Ion 美国Sigma公司)、布雷杆氏菌素A(BFA 美国eBiosclence公司)、破膜剂、流式染色缓冲液、CD4-FITC、CD25-PE-Cy7、IFN-γ-PE、IL-4-APC、IL-17-APC、Foxp3-PerCP-Cy5.5等抗体(均购自美国eBiosclence公司);流式细胞仪(Partec GmbH 德国 产品型号:YZB/GEM 946-40)。
1.5.2 标本采集 抽取受试者外周血10 ml,分成两管,各5 ml,一管肝素抗凝处理,用于制备外周血单个核细胞 (PBMC);另一管用于制备血清,检测IL-4和IL-17。
1.5.3 流式细胞检测方法 严格按照实验步骤,进行流式细胞检测。如分离单个核细胞、铺板,检测Th1、Th2、Th17细胞,以及Treg细胞。
1.5.4 ELISA法检测血清IL-4和IL-17 酶联免疫吸附试验(ELISA)试剂盒为美国eBioscience公司产品。采集受检者晨起空腹外周血5 ml/次制备血清,实验步骤按照试剂盒说明书严格操作。
1.6 统计学处理
采用SPSS17.0统计软件对实验数据进行分析,P≤0.05为有统计学差异意义。计数资料组间比较采用χ2检验,计量资料比较采用单因素方差分析。
2 结 果
2.1 疗效及生存率比较
近期疗效(见表1),H+CRT组与CRT组的临床总有效率(CR+PR),分别为88.24%和72.73%,两组差异具有统计学意义(P<0.05)。累积生存率比较:H+CRT组1年、2年、3年生存率分别为79.41%、70.58%、64.70%,CRT组为69.69%、66.67%、60.60%,H+CRT组高于CRT组,但是两组差异无统计学意义(P>0.05)。
2.2 近期不良反应
根据美国国家癌症研究所通用毒性标准(NCI-CTC)3.0版进行毒性反应评价。两组的早期不良反应主要为恶心、呕吐、中性粒细胞下降、皮炎、膀胱炎,CRT组及H+CRT组差异无统计学意义(P>0.05)。不良反应均经积极对症处理后好转,无放化疗相关死亡。具体见表2。
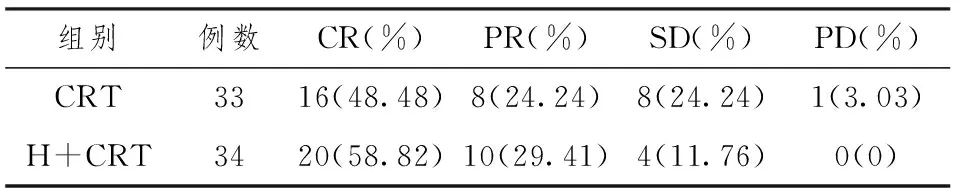
表1 两组放射治疗近期疗效比较[n,(%)]
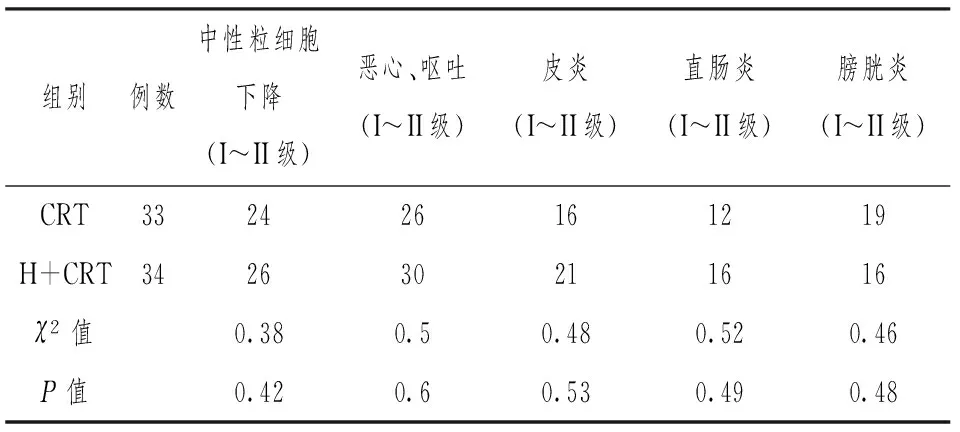
表2 两组间近期不良反应的比较
2.3 远期不良反应
经过3年随访,直肠反应一般在放疗后1年左右开始出现,表现为轻重不等的便血,膀胱反应在放疗后2~3年间发生,为轻重不等的尿中带血。见表3。
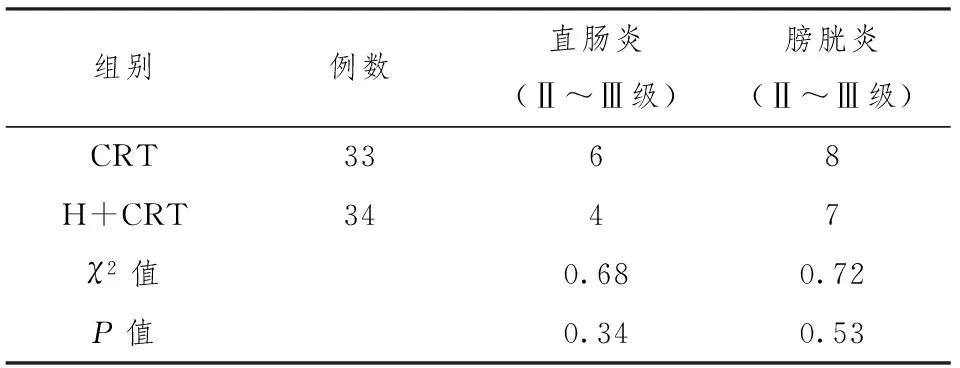
表3 两组间远期不良反应的比较
2.4 同步热放化疗能显著上调中晚期宫颈癌患者外周血中Th1/Th2比值
(1)流式细胞检测显示,中晚期宫颈癌外周血中的Th1细胞百分率显著低于健康对照组(5.21±1.03%,t=4.19,P=0.002<0.01),且H+CRT组与CRT组之间无统计学差异(t=3.92,P=0.228>0.05)。经干预治疗后,H+CRT组与CRT组 Th1细胞百分率均有所提升,显著高于治疗前,但仍比健康对照组低(t= 5.18,P= 0.016<0.05);两组相比较,H+CRT组Th1细胞百分率的提升幅度更加显著(t= 2.71,P= 0.03<0.05)。治疗前后,H+CRT组与CRT组的Th2细胞百分率均与健康对照组无明显差异(P>0.05)。(2)分析Th1/Th2比值,可见:经干预治疗后,两病患组Th1/Th2比值均得到提升,且H+CRT组的上升幅度更加显著;比较干预治疗后两病患组Th1/Th2比值,差异具有显著(t= 4.94,P= 0.021<0.05)(具体见表4)。
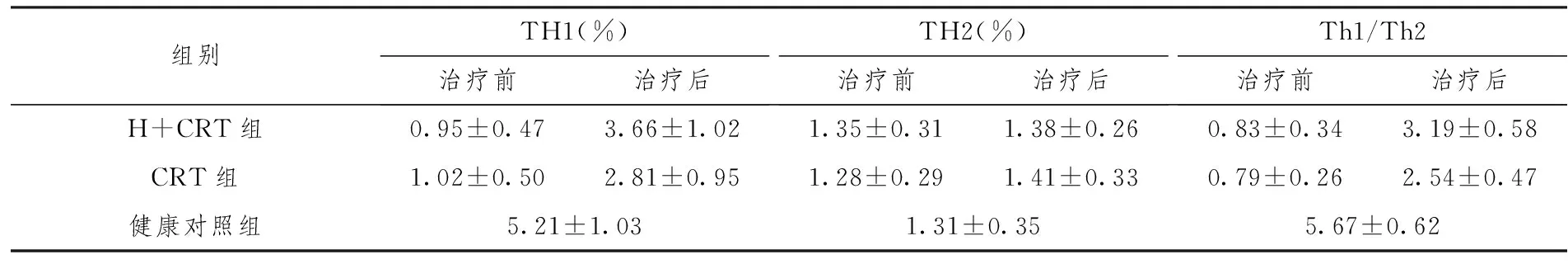
表4 Th1(%)、Th2(%)及Th1/Th2治疗前后变化
2.5 同步热放化疗能显著升高中晚期宫颈癌患者外周血中Th17/Treg比值
(1)流式细胞检测显示:与健康对照相比,中晚期宫颈癌患者外周血中Th17百分率显著升高;经干预治疗后,H+CRT组与CRT组Th17细胞百分率均下降,显著低于治疗前(P<0.01),但仍然高于健康对照组(t=3.68,P=0.02<0.05);比较H+CRT组与CRT组Th17细胞百分率,经干预治疗后,H+CRT组下降趋势更显著(t=3.40,P=0.031<0.05)。与健康对照相比,两病患组外周血中Treg百分率显著升高;经干预治疗后,H+CRT组与CRT组的Treg细胞百分率均下降,显著低于治疗前(P<0.05);比较H+CRT组与CRT组Treg百分率,经干预治疗后,H+CRT组下调更加明显,差异显著(t=3.77,P=0.011<0.05)。分析Th17/Treg,可见:与健康对照相比组,H+CRT组与CRT组的Th17/Treg比值均显著降低(P<0.01),经干预治疗后,两病患组比值均得到提升,且H+CRT组的上升幅度更加显著,但仍低于健康对照;比较H+CRT组与CRT组Th17/Treg,经干预治疗后,H+CRT组升高更加显著(P<0.05)(具体见表5)。

表5 Th17(%)、Treg(%)及Th17/Treg治疗前后变化
2.6 同步热放化疗对IL-4、IL-17表达的影响
接受治疗前,H+CRT组与CRT组IL-4表达水平分别为(39.23±3.67) pg/ml、(41.81±5.03)pg/ml,显著高于健康对照组(17.14±1.02)pg/ml(P﹤0.001);完成治疗后,两组的IL-4表达水平显著下调,分别为(24.68±2.27) pg/ml、(31.12±2.56)pg/ml,与治疗前相比差异显著(P﹤0.001),同时,比较两病患组之间的IL-4表达水平,亦具有显著性差异(P﹤0.001)。接受治疗前,H+CRT组与CRT组IL-17表达水平均显著高于健康对照组(42.73±0.83)pg/ml,分别为(100.23±4.07)pg/ml和(100.19±4.03)pg/ml;完成治疗后,两组的IL-17表达水平亦显著下调,分别为(50.03±2.58) pg/ml、(68.12±2.41)pg/ml,与治疗前相比差异显著(P﹤0.001),同时,比较两病患组之间的IL-17表达水平,差异亦具有显著性(P﹤0.01)。可见,经过治疗干预后,IL-4、IL-17表达水平虽然仍比健康对照组高,但均显著下降,尤其是H+CRT组(P﹤0.001)。
3 讨 论
对于中晚期宫颈癌来说,手术治疗效果比较差。近年来,以顺铂为基础的同步放化疗已成为中晚期宫颈癌治疗的标准模式[1]。放射治疗宫颈癌以体外照射配合腔内照射最为普遍,在肿瘤的生长过程中,处于不同时期的肿瘤细胞对放疗的敏感性不同,单纯的放射治疗,不能有效杀灭所有时期的肿瘤细胞。采取同步化疗,可以使肿瘤细胞趋于同步化,从而增加放疗的敏感性。目前,顺铂是单药治疗宫颈癌最有效的化疗药物,有效率可达25%以上。
热疗是继外科手术、放化疗及生物治疗之后,又一全新的抗肿瘤“绿色疗法”。利用物理能量在人体组织中所产生的热效应,使肿瘤细胞变性坏死,从而杀灭恶性肿瘤[2]。热疗可以改变细胞膜的通透性,改善肿瘤周边的血液循环,有利于药物进入肿瘤,从而提高局部药物浓度。热疗能抑制化疗后癌细胞DNA的修复和合成,抑制耐药基因的表达,增加癌细胞对化疗药物的敏感性[3]。热疗主要作用于细胞周期的S期,并且对瘤组织中的乏氧细胞具有较强杀伤作用。而正是这一点,弥补了放化学治疗的不足。因为化疗对非S期细胞杀伤作用强,放疗对乏氧细胞表现为抗拒。因此,三者联合应用能产生协同作用,使治疗效果更好。
目前,热、放、化三联疗法多用于治疗食管癌、直肠癌,关于宫颈癌的报道尚少。在本研究中,H+CRT组临床总有效率达到88.24%,明显高于单纯放化疗组(CRT组为72.73%),差异具有统计学意义(P<0.05),说明热放化疗对中晚期宫颈癌患者具有理想的近期疗效。结果提示热疗的使用促进了宫颈癌患者肿瘤组织的消退,该疗法与放化疗具有明显的协同效应。在随后的累积生存率调查中,我们发现H+CRT组患者1年、2年、3年生存率明显较CRT组延长,但是差异无统计学意义(P>0.05)。通过列表,我们可以看出,在急性毒性反应及晚期并发症方面,两试验组无显著差别。其不良反应主要表现在胃肠道反应、骨髓抑制、直肠炎与膀胱炎,病人经过对症处理后可以耐受,没有1例病人因为不良反应而退出治疗。热放化疗三者联合是一种安全可靠、病人可以耐受的治疗方法。
肿瘤的主要病理特征之一是免疫失调。正常机体Th1/Th2处于动态平衡的状态,两类Th细胞通过刺激分泌不同的细胞因子,形成一个庞大的细胞网络,彼此交叉应答又相互制约。Th1/Th2免疫平衡是维持机体内正常生理性防御、内环境稳定及免疫监视的重要机制[4]。当Th1细胞水平下调,Th2表达优势偏重时,Th1/Th2比值漂移,可促发肿瘤细胞逃逸机体的免疫监视,从而导致肿瘤发生,甚至病情发展恶化。本研究发现,两组患者外周血中的Th1细胞百分率明显较健康对照组下降,Th2百分比虽未发生明显改变,但Th1/Th2比值明显降低;IL-4的高表达,进一步说明Th2细胞机能亢进;提示中晚期宫颈癌患者外周血中有Th1介导的细胞免疫受到明显抑制。经进行治疗干预后,两组患者的Th1细胞百分比均有所上调,IL-4的高表达有所逆转, Th1/Th2比值得到改善,而且同步热放化疗组的改善更为显著。因此,我们认为增加热疗可促进机体调整恢复Th1/Th2平衡,有利于宫颈癌的治疗。
Th17和Treg细胞是近几年新发现的CD4+T细胞亚群,前者因高分泌IL-17而得名,在不同免疫环境中通过促炎性因子、抗肿瘤细胞因子呈现不同免疫功能;后者拥有免疫无能、免疫抑制效应,参与肿瘤免疫耐受性调节。两者之间存在竞争平衡关系[5]。正常情况下,Th17/Treg的动态平衡是机体免疫环境稳定的前提。越来越多的成果证实,Th17和Treg失衡与自身免疫性疾病和肿瘤发生之间存在密切关系。很多研究表明,Th17和Treg在宫颈癌的外周血及组织中表达升高,并且随着临床分期的升高而增高,两者在宫颈癌的发生发展过程中起重要促进作用。本研究发现:中晚期宫颈癌患者外周血中的Th17、Treg细胞百分比以及IL-17表达水平明显高于健康对照组,而Thl7/Treg比值明显低于健康对照组,这一结果与文献数据相符合。据此,我们认为肿瘤发生后随着Th17及Treg分化均明显增强,破坏了Th17/Treg动态平衡。随着肿瘤进展,肿瘤细胞免疫逃逸现象更加明显,Th细胞的生长远不及Treg细胞,两者平衡出现明显漂移。经治疗干预后,两组患者外周血中的Th17比例均有所下降,H+CRT组的下降趋势尤为明显,这说明放化疗尤其增加热疗的介入,有利于促进恢复患者体内Th17/Treg动态平衡,从而发挥抗肿瘤作用。
综上所述,同步热放化疗可明显提高中晚期宫颈癌的临床疗效,提高患者的累积生存率。同时,Thl、Th2、Thl7、Treg细胞均与宫颈癌患者存在密切的关联,同步热放化疗可以有效的调节CD4+T 细胞群的动态平衡,从而实现清除肿瘤细胞的目的。
[1] Benjamin E,Wui-Jin Koh,Nadeem R.et al.Cervical cancer-NCCN clinical practice guidelines oncology [J].Nat Comprehensive Cancer Network,2010,1: 10.
[2] Pawlik A,Nowak JM,Grzanka D.et al.Hyperthermia inducers cyto.skeletal alterations and mitotic catastrophe in p53-deficient H1299 lung cancer cells[J].Acta Histochemica,2013,115(1): 8-15.
[3] Marchebeltini P,Sugar baker PH.Thermal enhancement of new chemotherapeutic agenels at moderate hyperthemia[J].Ann Surg Oncol,2003,10(4): 463-468.
[4] Ssito S.Nakashima A.Shima T.et.al.Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy[J].Am J Reprod Immunol,2010,63(6): 601-610.
[5] Dorota Darmochwal-Kolarz,Magdalena Kludka-Stemik,Jacek Tabarkiewicz,et al.The predominance of Th17 lymphocytes and decreased number and function of Treg cells in preeclampsia[J].Journal of Reproductive Immunology,2012, 93(2): 75-81.
The clinical efficacy of concurrent hyperthermia and radiochemotherapy and its influence on CD4+T cells imbalances in patients with advanced cervical cancer
CAO Feng1,2,3REN Rui-mei2
(1.Jinan University of Shandong Academy of Medical Sciences Institute of Medicine and Life Science,Jinan 250022,China;2.Shandong Provincial Cancer Hospital,Jinan 250117,China;3.Mount Tai Xintai Hospital Affiliated to Medical School,Xintai 271200,China.)
Objective:To explore the clinical efficacy of concurrent hyperthermia and chemoradiotherapy in the treatment of advanced cervical cancer at stage IIb~IIIb, and study its influence on CD4+T cells imbalances.Methods 67 cases with advanced cervical cancer were enrolled in this study, randomly divided into the CRT group and the H+CRT group.The CRT group received conventional chemoradiotherapy, while patients of H+CRT group received local deep hyperthermia combined with concurrent radiochemotherapy.Meanwhile, we also selected 30 healthy females as control from people of physical examination.We compared the total clinical effective rate, the cumulative survival curve, and the median survival time in the two experimental groups.To all the cases of the three groups, we also detected the distribution of Th1, Th2, Th17, Treg cells, the ratio of Th17/Treg, Th1/Th2, and the concentration of IL-4, IL-17 in peripheral bloods.Results (1) The total effective rate of H+CRT group and CRT group were 88.24% and 72.73% respectively, There had significant statistical differences between the two groups(P<0.05).The 1-year、2-year and 3-year survival rates of the H+CRT group were 79.41%、70.58%、64.70%,the CRT group were 69.69%、66.67%、60.60%.there had no statistical difference between the two groups (P>0.05).(2) In the two experimental groups, compared with the healthy control, the percentage of Th1 cells and the ratio of Th17/Treg decreased, the percentage of Th17 and Treg cells increased, while the change of Th2 distribution had no statistical difference; interestingly, the ratio of Th1/Th2 not only significantly decreased but also drifted.After intervention, the percentage of Th1, Th2, Th17 and Treg cells could partially recover, and the recovery degree of the H+CRT group was more obvious.(3) The expression level of IL-4, IL-17 was significantly higher in the two experimental groups, after intervention, the concentration of IL-4, IL-17 all decreased, especially in the H+CRT group.Conclusion Concurrent hyperthermia and chemoradiotherapy can promote the regression of local tumor and increase the remission rate, its anti-tumor efficacy may well be achieved by correcting the level of CD4+T cells.
advanced cervical cancer; CD4+T cells; hyperthermia; chemoradiotherapy
曹锋(1976—),男,山东新泰人,主治医师,在读硕士,主要从事临床肿瘤工作。
任瑞美。
R737
A
1004-7115(2016)10-1104-05
10.3969/j.issn.1004-7115.2016.10.008
2016-07-02)

