丁苯酞对大鼠神经细胞凋亡的保护作用及其机制研究
齐凡星 胡莹 卢军栋 康丽娟 李志安 张会朵
(1.保定市第一中心医院神经内二科,河北 保定 071000;2.保定市第一中心医院心内三科,河北 保定 071000)
丁苯酞对大鼠神经细胞凋亡的保护作用及其机制研究
齐凡星1胡莹2卢军栋1康丽娟1李志安1张会朵1
(1.保定市第一中心医院神经内二科,河北 保定 071000;2.保定市第一中心医院心内三科,河北 保定 071000)
目的 探讨丁苯酞对大鼠神经细胞凋亡的保护作用及其机制研究。方法 选用90只SD大鼠,随机分为给药组、对照组和健康组,每组30只。对给药组和对照组大鼠使用10%水合氯醛麻醉(剂量为0.5 mL/100 g),麻醉完成后,对大鼠双侧海马区位置进行准确定位后,将浓度为5 μL(1 μg/μL)Aβ1-42注入造模。将配置的丁苯酞与食用麻油混合配制成悬浊液。造模完成后,分别给予不同的处理方法,给药组按75 mg/kg比例对大鼠进行灌胃给药,1次/d。对照组按同等比例灌胃给予生理盐水,1次/d。健康组为正常健康组,不给予任何手术和药物处理。取大鼠脑组织分为两部分,一部分经固定、脱水、石蜡包埋后制得厚度约5 μm切片。采用TUNEL染色法对脑组织细胞凋亡进行检测;并使用H&E染色法观察各组大鼠脑组织细胞;采用Western Blot法检测各组脑组织MAPK、Erk和P38的蛋白表达水平,并使用RT-PCR法检测MAPK、Erk和P38的mRNA表达水平。结果 30 d后,给药组大鼠脑组织细胞凋亡明显少于对照组及健康组。给药组大鼠MAPK、Erk和P38的蛋白表达水平明显低于对照组但高于正常健康组(P<0.05)。使用RT-PCR法检测MAPK、Erk和P38的mRNA表达水平发现,给药组大鼠MAPK、Erk和P38的mRNA水平明显低于对照组但高于正常健康组(P<0.05)。对照组大鼠达到学会标准次数与健康组比较明显升高(P<0.05)。与对照组比较,给药组大鼠达到学会标准次数明显降低(P<0.05)。结论 丁苯酞对Aβ1-42处理的大鼠脑组织细胞凋亡具有保护作用,通过抑制大鼠脑组织MAPK,Erk和P38的表达发挥作用。
阿兹海默; 凋亡; 丁苯酞; MAPK
埃尔茨海默病(alzheimer’s disease,AD)是一种中枢神经系统退行性疾病,其临床症状主要表现为进行性认知功能障碍和记忆力退化,但其发病原因未能明确。丁苯酞(又称丁基苯酞,3-n-butylphathlide,NBP),是一类对急性缺血性脑卒中,具有显著治疗效果的新型抗脑缺血药物,对脑细胞损伤具有保护作用[1]。目前为止,丁苯酞对AD疾病中神经细胞的作用效果及机制研究相对有限,有鉴于此,本次课题针对丁苯酞对AD模型中神经细胞凋亡作用效果及机制进行研究。
1 材料与方法
1.1 实验材料 Taq Master Mix (SinoBio,美国)、 琼脂糖 (Biowest)、无菌生理盐水、无菌双蒸水、抗磷酸化MAPK(p-MAPK)(1∶1 000;Cell Signaling,美国),β-actin抗体(1∶5 000; Invitrogen,美国),磷酸化MAPK(p-MAPK抗体1∶1 000;Cell Signaling,美国)。0.9%无菌生理盐水(大冢制药,日本),Trizol(Invitrogen,美国),病理切片机(leica,德国)。
1.2 实验设备 PCR扩增仪(Bio-Rad)、凝胶成像仪(Bio-Rad)、电泳仪(北京市六一仪器厂)、离心机(Eppendorf,德国)、微量移液器 (Eppendorf,德国)、海尔制冰机,Western Blot 电泳仪(Rad-Bio,美国),-80 ℃冰箱(Thermo),10 mL注射器,5 mL注射器(哈那好,天津),实验动物专用手术器械(北京医疗器械厂),NanoDrop2000光度仪(Thermo,美国),EP管(Eppendorff,德国),水浴锅(北京医疗器械厂)。
1.3 研究方法 选用90只SD大鼠,随机分为给药组、对照组和空白组,每组30只。对给药组和对照组大鼠使用10%水合氯醛麻醉(剂量为0.5 mL/100 g),麻醉完成后,对大鼠双侧海马区位置进行准确定位后,将浓度为5 μL(1 μg/μL)Aβ1-42注入造模。将丁苯酞与食用麻油按0.1 g/12.5 mL的比例混合配制成悬浊液。造模完成后,分别给予不同的处理方法,给药组按75 mg/kg比例对大鼠进行灌胃给药,1次/d。对照组按同等比例灌胃给予生理盐水,1次/d。空白组为正常健康组,不给予任何手术和药物处理。三组大鼠共同喂养30 d,第30天,对三组大鼠使用Y型电迷宫检测各组大鼠学习记忆能力:电刺激参数为:电压50~70 V,电流强度0.7 mA,电击延时5 s。电迷宫实验程序:(1) 筛选; (2) 学习记忆测试。本实验采用随机休息不固定训练次数法,所有训练在一个实验日内完成。将各组大鼠处死后,使用BPS对大鼠进行灌流,直至流出BPS无血色为止。取大鼠脑组织分为两部分,一部分经固定、脱水、石蜡包埋后制得厚度约5 μm切片。另一部分先置于液氮中,之后放置于-80 ℃冰箱中保存待测。采用TUNEL染色法对脑组织细胞凋亡进行检测;并使用H&E染色法观察各组大鼠脑组织细胞;采用Western Blot法检测各组脑组织MAPK、Erk和P38的蛋白表达水平,并使用RT-PCR法检测MAPK、Erk和P21的mRNA表达水平。

2 结 果
2.1 丁苯酞保护大鼠脑组织凋亡 TUNEL染色在倒置显微镜下观察发现,给药组大鼠脑组织凋亡水平明显减低,与对照组相比差异具有统计学意义(P<0.05)。400×大鼠脑组织海马C1区神经元TUNEL染色结果显示,健康组见少量TUNEL阳性细胞表达,对照组TUNEL阳性细胞率明显增加[(72.4±2.67) VS (5.76±0.22),P<0.01],给药组TUNEL阳性细胞表达较对照组显著减少[(42.3±1.53) VS (72.4±2.67),P<0.01。见图1。

图1 大鼠脑组织海马C1区神经元TUNEL染色结果( 400×)
2.2 丁苯酞抑制MAPK、Erk和P38 mRNA表达水平 在给药组中,大鼠脑组织MAPK信号通路表达水平明显减低(P<0.05),而Erk和P38 mRNA水平无明显变化(P>0.05)。Erk和P38无明显差异,但对照组MAPK水平与健康组比较明显增高,差异具有统计学意义(P<0.05)。与对照组比较,给药组MAPK水平明显减低,差异有统计学意义(P<0.05)。见表1。
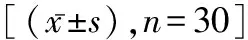
表1 三组大鼠脑组织MAPK、Erk和P38 mRNA荧光强度比较
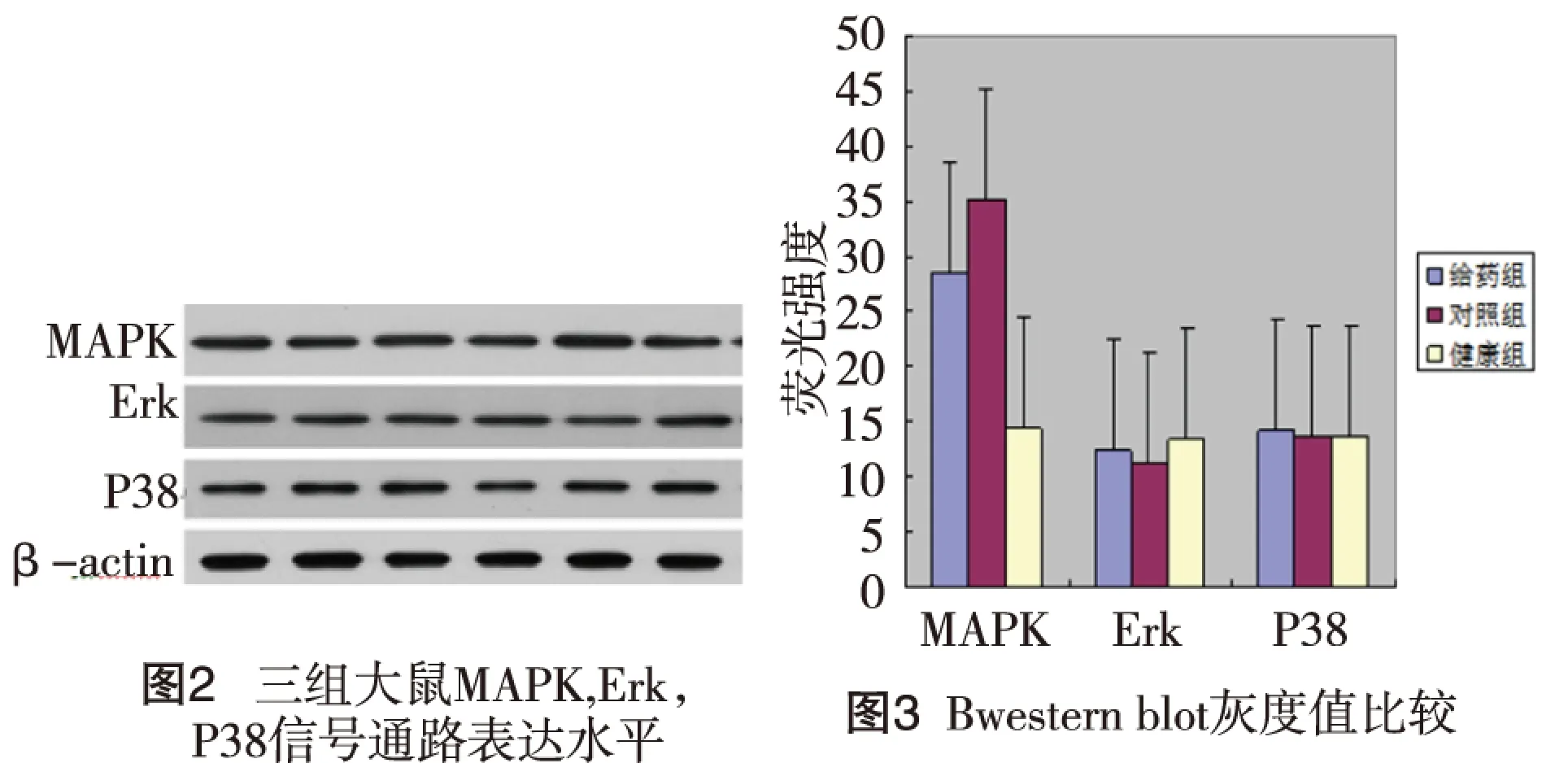
2.3 丁苯酞抑制MAPK、Erk和P38蛋白表达水平 进一步,我们对三组大鼠MAPK,Erk以及P38蛋白表达水平进行检测和比较,结果发现,三组Erk以及P38蛋白表达水平无明显差异(P>0.05),对照组大鼠MAPK水平比健康组明显增高,而给药组大鼠MAPK水平明显低于对照组大鼠。差异具有统计学意义(P<0.05)。见图2~3。
2.4 Y-型电迷宫评价 对照组大鼠达到学会标准次数(57.2±5.6)次。给药组大鼠达到学会标准次数(31.1±5.1)次。健康组大鼠达到学会标准次数(19.7±1.6)次。对照组大鼠达到学会标准次数与健康组比较明显升高,差异具有统计学意义(P<0.05)。与对照组比较,给药组大鼠达到学会标准次数明显降低,差异具有统计学意义(P<0.05)。
3 讨 论
对于AD发病机制目前未能得到完整的阐述,并且提出的不同的假说,其中被学术界认可的假说有:基因突变假说、胆碱能损伤假说、tau蛋白假说、氧化应激假说以及细胞凋亡假说等。目前对因突变假说、胆碱能损伤假说tau蛋白假说以及氧化应激假说研究相对较多,其中有对基因突变研究指出AD的发病与β淀粉样前体蛋白(APP)基因、早老素-1,-2(PS-1,PS-2)基因和载脂蛋白E(ApoE)基因有着密切的相关性。胆碱能损伤假说中证实由于乙酰胆碱酯酶(AChE)的活性发生降低,使得AD患者记忆、认知等多方面能力发生损伤[2]。大脑内tau蛋白的磷酸化平衡一旦破坏,从而对神经元轴突的稳定性造成影响,进而导致神经纤维发生功能性退化而诱发AD[3]。在氧化应激假说中,相关研究证实一氧化氮(NO)、一氧化氮合酶(NOS)以及超氧化物歧化酶(SOD)等氧化应激物在AD模型动物中呈现出高表达状态[4]。然而这些研究大多集中在分子生物或者组织中,而对神经细胞在AD发病中的作用及其机制研究相对有限[5]。
丁苯酞(消旋-3-正丁基苯酞),是一种与自然界存在的左旋芹菜甲素具有相同结构,但经过人工消旋的人工合成药物,伊始是一类治疗抗脑缺血药物,对急性缺血性脑卒中具有显著的治疗效果[6]。丁苯酞可以有效的增强缺血区微血管循环和血流量、保护线粒体等功能[7]。此外,丁苯酞还可以调控脑中三磷酸腺苷(ATP)和磷酸肌酸(Pcr)的含量,对脑组织缺血部分进行保护并改善脑部能量代谢[8]。研究[9]发现,丁苯酞还可对神经细胞胞浆内cGMP水平,以及ChAT活性具有一定的调节作用。之前的研究[10]发现,丁苯酞对阿尔茨海默病动物模型具有一定的治疗效果。本研究发现,使用丁苯酞后,大鼠神经组织凋亡明显减少,与对照组相比,差异具有统计学意义(P<0.05)。TUNEL染色结果提示,凋亡细胞明显减少(P<0.05),进一步,我们检测大鼠脑组织MAPK、Erk和P38的蛋白表达水平发现,上述蛋白在给药组大鼠的脑组织中明显低于对照组但高于正常健康组,差异具有统计学意义(P<0.05)。使用RT-PCR法检测MAPK、Erk和P38的mRNA表达水平发现,给药组大鼠MAPK、Erk和P38的mRNA水平明显低于对照组但高于正常健康组,差异具有统计学意义(P<0.05)。因此,我们认为丁苯酞对脑组织细胞凋亡的保护作用是通过抑制MAPK、Erk和P38的转录和翻译发挥作用的。文献表明[10],MAPK对内质网应激导致的肝脏星状细胞凋亡中发挥促进作用,此外,在肺癌中,通过促进P38 MAPK信号通路的表达也可以促进肺癌细胞的凋亡,达到治疗目的[11]。本研究中,我们再次证明了,MAPK-P38信号通路也可以在大鼠脑组织凋亡中发挥作用。但是,这一结论还需要进一步的研究数据支持,如在对照组中设置使用MAPK抑制剂,并研究其保护作用,从而进一步说明MAPK是脑组织凋亡的主要信号通路。对照组大鼠达到学会标准次数与健康组比较明显升高,差异具有统计学意义(P<0.05)。与对照组比较,给药组大鼠达到学会标准次数明显降低,差异具有统计学意义(P<0.05)。提示丁苯酞给药治疗对改善大鼠学习记忆能力有一定作用。
综上所述,我们认为,丁苯酞对Aβ1-42处理的大鼠脑组织细胞凋亡具有保护作用,通过抑制大鼠脑组织MAPK,Erk和P38的表达发挥作用。
[1] 陶瑞松.老年痴呆症(AD)发病的Aβ假说及相关药物研究进展[J].安徽教育学报,2007,25(3):99-101.
[2] 钟朝忠,冯亦璞.丁基苯酞对缺血组织中及低糖低氧刺激后培养的神经细胞中胆碱乙酰化酶的影响[J].中国药学杂志,1999,34(8):519-522.
[3] 董雯,郑爽,冯志强.阿尔茨海默病病因及发病机制的研究[J].中国保健医学,2011,9(1):37-39.
[4] 姜哲浩,夏永良,李德新.老年性痴呆病因和发病机制的研究概况[J].辽宁中医杂志,2001,28(7):446-448.
[5] Court JA,Piggott MA,Lloyd S,et al.Nicotine binding in human striatum:elevation in schizophrenia and reductions in dementia with Lewy bodies,Parkinson’s disease and Alzheimer’s disease and in relation to neuroleptic medication[J].Neurosci,2000,98(1):79-87.
[6] Roberson ED,Scearce-Levie K,Palop JJ,et al.Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer disease mouse model[J].Science,2007,316(5825):750-754.
[7] 侯雪芹,陈云波,陈淑意,等.补肾益智提取物对AD小鼠空间学习记忆及氧化应激-凋亡相关机制的研究[J].中华中医药杂志,2015,30(5):1640-1643.
[8] 刘人凯,杨春永,肖波,等.GLP-1对AD转基因鼠氧化应激的保护作用[J].海南医学院学报,2013,19(7):865-875.
[9] 周阳,严丽荣,袁少飞,等.氧化应激与阿尔茨海默病[J].生命科学研究,2015,19(3):265-275.
[10] Yan Huang,Xiaohui Li,Yarui Wang,et al.Endoplasmic reticulum stress-induced hepatic stellate cell apoptosis through calcium-mediated JNK/P38 MAPK and Calpain/Caspase-12 pathways[J].Molecular and Cellular Biochemistry,2014,394:1-12.
[11] Deguang Mu,Wei Zhang,Dongling Chu,et al.The role of calcium,P38 MAPK in dihydroartemisinin-induced apoptosis of lung cancer PC-14 cells[J].Cancer Chemotherapy and Pharmacology,2008,61 (4),639-645.
Protective effect and mechanism of butadiene on apoptosis of neutral cells in rats
QiFanxin1,HuYing2,LuJundong1,KangLijuan1,LiZhian1,ZhangHuiduo1.
1.TheSecondDepartmentofNeurology,theFirstCenterHospitalofBaodingCity,Baoding071000,China. 2.TheThirdDepartmentofCardiology,theFirstCenterHospitalofBaodingCity,Baoding071000,China.
Objective To investigate the protective effect and mechanism of butylphthalide on nerve cell apoptosis in rats. Methods 90 SD rats were randomly divided into the medication administration group, control group and the healthy group in which 30 rats in each group. The medicine group and control group were anesthetized with 10% chloral hydrate (at a dose of 0.5 mL/100 g). After successful anesthesia, bilateral hippocampal area of in rats were accurate positioned, a 5 μL (1 μg/μL) concentration of Aβ1-42was injected for molding. The configuration of butylphthalide and oil was mixed into suspension. After the model was completed, the rats were given different treatment, and the drug group was administered with 75 mg/kg for 1 time per day. The control group was given normal saline by the same ratio for 1 times a day. The healthy group was deal with the normal meal, without any operation and drug treatment. The brain tissue of rats was divided into two parts, one part was fixed, dehydrated, and embedded in paraffin, and the thickness of 5 μm was obtained. TUNEL staining was used to detect the apoptosis of brain tissue; and H&E staining was used to observe the rat brain tissue cells; Western blot was used to detect the MAPK, ERK and P38 protein expression level and RT-PCR was detected the expression level of MAPK and ERK and P38 mRNA expression levels. Results After 30d, the apoptosis of the brain tissue of rats in the administration group was significantly less than that in the control group and the blank group. The protein expression levels of MAPK, Erk and P38 were significantly lower in the control group than in the control group but higher than those in the control group (P<0.05). The P38 expression levels of MAPK, Erk and mRNA were detected by RT-PCR , and the levels of MAPK, Erk and mRNA of P38 in rats were significantly lower than those in the control group but higher than those in the normal healthy group (P<0.05). In control group, the number of standards and health group was significantly higher (P<0.05). Compared with the control group, the rats in the treatment group were significantly reduced (P<0.05). Conclusion butylphthalide has a good effect on Aβ1-42 pretreated rats who protects the apoptosis of brain tissue through the inhibition of mitogen activated protein kinase (MAPK) by mediating the expression of ERK and p38 signaling pathway.
Alzheimer's disease; Apoptosis; Dl-3n-butylphthalide; MAPK
R-332;R749.1+6
A
1000-744X(2016)11-1132-03
2016-07-19)

