汗液中美托洛尔及其代谢物的提取与检测
汗液中美托洛尔及其代谢物的提取与检测
生物样本由于能够提供样本供体的生物特征和生物信息,是公安、司法鉴定的重要证据之一。汗液是人体的重要排泄产物之一。正常情况下,汗液残留物中99%为水分,此外还有少量的盐分、尿素、乳酸和脂肪酸等[1]。服药后,药物经吸收、分布、代谢等体内过程,原型药物及其代谢物会从汗腺分泌,通过汗液排出体外,从而引起汗液成分的微小变化。因此,通过检测汗液中的遗留药物成分,能够间接获得排汗人的服药信息,从而协助缩小犯罪嫌疑人范围,为侦查提供线索。
目前,关于现场遗留汗液的成分研究主要集中在毒品及爆炸物成分检测。检测方法包括红外光谱法(FTIR)、气质联用法(GC-MS)、液质联用法(LCMS)、荧光光谱法(AFS),及基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)[2-6]。其中,MALDITOF MS可同时实现汗潜指纹的显现和指纹汗液中毒品来源的分析。本研究探索的汗液中药物的提取与检测方法对于侦查方向的指导作用有二:通过对汗液中原型药物或其代谢物进行检测,推测排汗人的服药行为,缩小侦查范围;另外,当现场的汗潜指纹遭到破坏,其形态学特征不足以提供侦查线索时,通过汗液中的药物成分检测能够继续为侦查提供方向。
本研究选择降压药物美托洛尔为模型药物,建立了汗液中美托洛尔(Metoprolol,MET)及其代谢物α-羟基美托洛尔(α-hydroxyl-metoprolol,α-MET)的提取及液相色谱-质谱联用(LC-MS)检测方法,并考察了此提取检测方法对于含药汗液的辨识效果。
1 材料与方法

图1 美托洛尔(A),α-羟基美托洛尔(B)和普萘洛尔(C,内标)的MS/MS全扫描图
1.1 仪器与试剂
液相色谱-电离喷雾离子阱质谱联用仪:由Thermo Finnigan液相色谱仪(San Jose,CA,USA)和Thermo Fisher LXQ离子阱质谱仪 (San Jose,CA,USA)组成;KQ-200VDE型双频数控超声波清洗器(昆山市超声仪器有限公司);XW-80A微型涡旋混合器(上海医科大学仪器厂);HC-3018R型高速冷冻离心机 (河南兄弟仪器公司);BYN200-2型电动氮气吹干仪(上海秉越电子仪器有限公司);酒石酸美托洛尔标准品(99%,中国食品药品检定研究院);α-羟基美托洛尔标准品(99%,TRC,加拿大);盐酸普萘洛尔标准品(99%,中国食品药品检定研究院);倍他乐克Ⓡ(酒石酸美托洛尔片,25mg);甲醇、乙腈为色谱纯,甲酸为分析纯,试验用水为纯净水。一次性聚乙烯(PE)塑料手套、载玻片、金属格尺、塑料板、复印纸、纸巾、桦木棒、棉布背心。
1.2 方法
1.2.1 美托洛尔的LC-MS检测条件
色谱条件:Thermo Gold ODS C18色谱柱 (150mm× 2.1mm,5μm);柱温35℃;流动相为乙腈-甲醇-0.1%甲酸水溶液(20∶20∶60,v/v/v);流速为0.2mL/min;进样量10μL。
质谱条件:电喷雾离子源(ESI),正离子检测,SRM模式,扫描范围为70~280 Da;毛细管温度为350℃。在上述的质谱条件下,美托洛尔、α-羟基美托洛尔和普萘洛尔主要生成[M+H]+准分子离子峰,分别为m/z 268、m/z 284和m/z 260。选择性对[M+H]+进行MS2产物离子全扫描质谱分析(图1),美托洛尔的主要碎片离子为m/z 191和m/z 116,α-羟基美托洛尔的主要碎片离子为m/z 116,普萘洛尔的主要碎片离子为m/z 183和m/z 116。根据碎片离子的丰度,美托洛尔、α-羟基美托洛尔、普萘洛尔的定量离子m/z分别为:268→191,284→116,260→183。
1.2.2 相关溶液的配置
精密称取酒石酸美托洛尔12.8 mg,用甲醇溶解,配置成质量浓度为50 μg/mL-1的美托洛尔储备液。移取美托洛尔储备液,用甲醇稀释成质量浓度分别为 0.05、0.10、0.20、0.40、1.00 μg/mL-1的美托洛尔标准溶液;精密称取α-羟基美托洛尔5.0 mg,用甲醇溶解,配置成质量浓度为50 μg/mL-1的α-羟基美托洛尔储备液,移取α-羟基美托洛尔储备液,用甲醇稀释成质量浓度分别为 0.05、0.10、0.20、0.40、1.00 μg/mL-1的α-羟基美托洛尔标准溶液;精密称取盐酸普萘洛尔11.4mg,用甲醇溶解,配置成普萘洛尔质量浓度为100μg/mL-1的储备液,用甲醇将储备液定量稀释至0.05μg/mL-1作为普萘洛尔工作液。
1.2.3 标准曲线与检出限
分别移取相同浓度的美托洛尔及α-羟基美托洛尔标准溶液各0.25mL,按照1∶1的比例混合加入至1 mL离心管内,另加入0.5 mL的普萘洛尔工作液,涡旋混合。取200μL混合液滴加在湿棉签上,依次得到载药量为2.5、5、10、20、50 ng的含药湿棉签。按照2.5项方法处理,经液质联用仪分析,测得药物MET的峰面积(Amet),代谢物α-MET的峰面积(Aα-met)和内标物普萘洛尔的峰面积(Apro)。分别以Amet/Apro和Aα-met/Apro的值(Y)为纵坐标,各自药物溶液浓度(X)为横坐标,绘制标准曲线。
1.2.4 采样方法选择
分别考察采用干燥滤纸、湿润滤纸、干燥棉签和湿润棉签等不同方法,对塑料表面粘附汗液中药物及其代谢物的提取效率。湿润滤纸和湿润棉签分别为用提取剂甲醇润湿的滤纸和棉签。在空白PE塑料手套内表面上分别滴加1.0 mL美托洛尔标准溶液(50 ng/mL-1)与α-羟基美托洛尔(50 ng/mL-1)的1∶1等体积混合溶液,及1.0mL普萘洛尔工作液。自然干燥后,分别用上述不同方法对PE塑料表面的药物进行采样,按照2.5的优化方法进行后续处理,以MET和α-MET检出量比较几种采样方法的提取效率。
1.2.5 提取剂
分别考察以水、甲醇、乙醇为提取剂,对塑料表面粘附汗液中药物及其代谢物的提取效率。在空白PE塑料手套内表面上分别滴加1.0 mL美托洛尔标准溶液(50 ng/mL-1)与α-羟基美托洛尔标准溶液(50 ng/mL-1)的1∶1等体积混合溶液,及1.0 mL普萘洛尔工作液。自然干燥后,采用湿润棉签法,分别用棉签通过1 mL的上述三种溶剂将塑料表面的药物转移至离心管中,按照2.5的优化方法进行后续处理,以MET和α-MET检出量比较几种提取剂的提取效率。
1.2.6 提取条件优化
采用五因素三水平的正交试验设计,分别以MET和α-MET的检出量为指标,对汗液中MET其代谢物α-MET的提取工艺进行优化。提取温度的3个水平分别为15、25、35℃;提取时间的3个水平分别为2、5、10min;超声功率的3个水平分别为1000、1600、2000W。离心速度的3个水平分别为2000、5000、10000rpm,离心时间的3个水平分别为1、3、5min。
1.2.7 提取客体的影响
根据提取客体的渗透性和表面的光滑程度,分别选择玻璃、光滑金属、光滑塑料、粗糙塑料、光滑纸张、粗糙纸张、木头、棉布背心等几种客体,对不同客体上的汗液药物提取效率进行考察。采用前述的湿润棉签转移法提取非渗透客体表面的药物。对于渗透性客体采取直接超声提取。具体方法为将渗透客体的汗液部分取下后,直接放入定量甲醇溶液中超声,超声的参数及后续操作同湿润棉签转移法。以MET的检出量对不同的提取客体进行比较,结果见图2。

图2 不同客体的MET检出量
1.2.8 显现粉末的影响
当汗液或汗渍没有位于衣领、手套等常规位置,而是粘附到作案工具、墙体或者滴落到地面上,汗液的显现可以帮助侦查人员快速锁定汗液的位置。我们选择最为常见的粉末显现法,考察显现粉末对于汗液中药物检测结果的影响。选择三种市售粉末(金粉,铝粉,和磁性粉末)进行玻璃表面的指纹显现。服用倍他乐克Ⓡ的受试者于服药后的相同时间分别用左右手的相同位置在玻璃板上以相同的方式平行留下两枚汗潜指纹。以左手为对照,在右手遗留汗潜指纹上分别用三种不同的粉末进行显现,用前述2.5的方法进行提取处理,并用LC-MS于同一天内进行检测,每个样品检测三次。以MET的检出量对施加不同显现粉末后的提取效果进行比较,结果见图3。
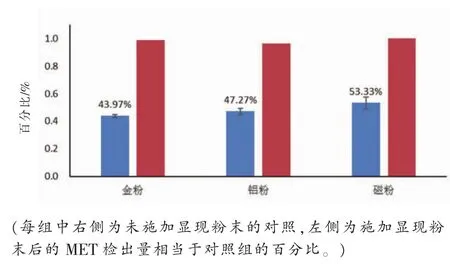
图3 显现粉末对于提取的影响
1.2.9 含药汗液的区分检测
4名受试者按顺序编号,1号、2号为对照组,3号、4号为测试组,于3号、4号受试者单剂量口服25 mg倍他乐克Ⓡ后开始计时。所有受试者分别用一次性PE塑料手套在各时间点采集汗液。根据美托洛尔缓释片的体内代谢特点和其血液样品的采集时间,确定其汗液收集时间间隔为初期1 h,中后期为2 h,手套佩戴时间为1 h。采集的时间点为1、2、3、4、5、6、7、8、10、12、14、16、18、20 h。按照2.5的优化方法以棉签转移法处理手套内部汗液。实验期间受试者可以自由活动,并正常进食饮水。实验室温度为30℃。LC-MS测得各点采集汗液中的MET及α-MET含量,结果见图4。
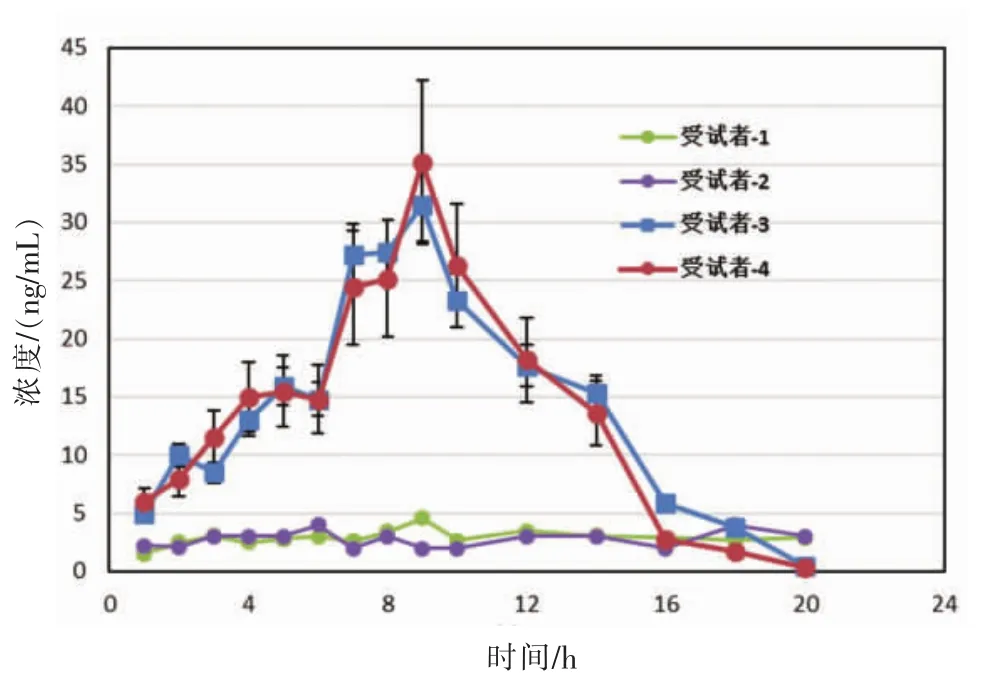
图4 受试者汗液中MET随时间变化曲线
2 结果和讨论
2.1 标准曲线与检出限
经最小二乘法进行线性回归,得回归方程分别为,美托洛尔:y=0.0902x-0.0566(R2=0.9997);α-羟基美托洛尔:y=0.0629x+0.0541(R2=0.9982)。结果表明,美托洛尔在5.0~500ng/mL范围内线性关系良好,α-羟基美托洛尔在浓度为25~500 ng/mL范围内线性关系良好。当信噪比(S/N)为10时,MET的定量限为10ng/mL,α-MET的定量限为5.0ng/mL。当S/N为3时,MET的检出限为2.0 ng/mL,α-MET的检出限为1.0ng/mL。
2.2 采样方法选择
无论对于MET还是α-MET,湿润采样物的提取效率均明显高于干燥采样物的提取效率。在几种不同的采样方法中,提取效率最高为湿润棉签,其次为湿润滤纸,干燥棉签和干燥滤纸的提取效率均较低。结果表明,物体的表面湿润有助于汗液中药物客体间的转移。试验最终采用湿润棉签作为采样材料对PE塑料手套内表面的药物进行提取。
2.3 提取剂
提取剂考察结果为,以甲醇为提取剂的MET和α-MET的检出量最高,乙醇次之,用水转移的检出量最低。这可能是由于美托洛尔和其代谢产物在不同溶剂中的溶解度差异导致。试验最终采用甲醇作为提取剂PE塑料手套内表面的药物进行提取。
2.4 提取条件优化
提取条件优化结果表明,温度对药物的提取率的影响最大,温度越高,药物的提取效率越高;过长的超声时间会降低药物的提取效率;超声功率和离心时间对药物的提取率影响不大。试验最终选择提取温度为35℃,提取时间为3 min,超声功率为2 000W,离心速度为5000rpm,离心时间为5min。
优化后的提取条件为:采用甲醇湿润的棉签进行转移,并采用超声法对棉签上的汗液中的药物进行提取。将提取有药物的棉签完全浸入一定量的甲醇中,用超声波进行提取,提取温度为35℃,超声时间为3min,超声功率为2000W。超声后将溶解有样品的甲醇溶液高速离心,离心速度为5 000 rpm,离心时间为5 min,结束后将上清液过0.22 μm微孔滤膜(此步骤为粉末显现汗液特有),转移至另一离心管中,室温下氮气吹干富集,并用0.1mL甲醇复溶。
2.5 客体考察
由图2可知,无论是渗透客体还是非渗透客体,光滑客体的药物提取效率均显著高于粗糙客体的药物提取效率。非渗透客体的光滑表面能够使棉签与客体的有效接触面积达到最大。对于粗糙的非渗透性客体,如硬塑料,汗液中的药物可能会富集在塑料表面的粗糙纹理的死角中,从而降低药物的提取效率;采用直接超声提取法的不同光滑程度的渗透性客体,其药物提取效率受超声的有效撞击和药物分子的扩散阻力双重影响。纸巾由于其内部的纤维素成线状,结构疏松错乱,药物更易进入而难于释放。复印纸的纤维素成较致密板状排列,药物难于快速进入纸张深层,因此提取效率较高。
对于相同光滑程度的客体来说,客体的渗透程度对于药物的提取效率影响不大。实验原先采用棉签转移法提取渗透客体表面的汗液药物,但提取率极低(图表中未显示)。改为直接超声法后显著提高了渗透性客体的提取效率。说明不同客体需要采用不同的提取方法,而超声提取法是提取渗透性客体表面药物的有效方法。
2.6 显现粉末对于提取的影响
由图3可知,金粉,铝粉,和磁性粉末组的MET检出量分别为各自对照组的43.97%、47.27%、53.33%。各组显现粉末均不同程度地降低了MET的检出量,这是由于微米化的显现颗粒会对药物颗粒产生吸附,被吸附药物颗粒随显现颗粒的离心去除而部分损失。值得注意的是,磁性粉末的药物检出量高于金粉和银粉的检出量,这可能是由于磁性粉末的质量较小,因此在离心分离过程中药物损失少。
2.7 含药汗液的区分检测
由图4可知,3号、4号受试者的汗液样品中均检出MET,而1号、2号受试者的汗液样品中均未检出MET,这与受试者实验前的服药情况吻合,说明此方法能够有效地识别遗留汗液中的药物。从3号、4号受试者的汗药时曲线可以看出,满足最低检出限(2 ng/mL)和最低定量限(10 ng/mL)的时间范围分别约为1~19 h和3~15 h。倍他乐克Ⓡ需一日服药两次(12 h口服一次),服12 h后汗液中的MET浓度约为17 ng/mL,由于其稳态血药浓度范围与此相近,且大于其最低定量限,因此本方法对于美托洛尔的单次服药患者的汗液具有灵敏的识别能力。汗液中还可同时检出MET的代谢物α-MET,这是作为药物是通过汗液分泌排泄,而非外源性接触或其他污染干扰所致的有力证据。
3 结论
综上所述,本文建立了汗液中美托洛尔及其代谢物α-羟基美托洛尔的提取及液相色谱-质谱联用检测方法。结果表明,采用甲醇湿润棉签提取效果最好;光滑客体的提取效率显著高于粗糙客体;显现粉末会不同程度地干扰药物的检出。单次口服25mg美托洛尔后3~15h仍可检出原药及代谢物。本方法适用于汗液中美托洛尔和α-羟基美托洛尔的提取与检测,可依据汗液中美托洛尔和α-羟基美托洛尔的检测对排汗人进行识别。
[1]Saima Jadoon,Sabiha Karim,Muhammad Rouf Akram,et al. Recent Developments in Sweat Analysis and Its Application[J].International Journal of Analytical Chemistry,2015,2015:1-7.
[2]Paul Benfield,Stephen P,Clissold-Rex N.Metoprolol.An Updated Review of Its Pharmacodynamic and Pharmacokinetic Properties,and Therapeutic Efficacy,in Hypertension,Ischaemic Heart Disease and Related Cardiovascular disorders[J].Drug Evaluation,1986,31:376-429.
[3]Aqil M,Ali A,Ahad A,et al.A validated HPLC Method for Estimation of Metoprolol in Human Plasma[J].Acta Chromatogr,2007,19:130-140.
[4]Zhang Y,Wu H-L,Xia A-L,et al.Fluorescence Determination of Metoprolol in Human Plasma by Trilinear Decomposition-Based Calibration Techniques[J].Anal Bioanal Chem,2006,386:1741-1748.
[5]Yilmaz B,Arslan S,Akba V.Gas Chromatography-Mass Spectrometry Method for Determination of Metoprolol in the Patients with Hypertension[J].Talanta,2009,80(1):346-351.
[6]Kimberly Kaplan-Sandquist,Marc A.Lebeau,Mark L.Miller. Chemical Analysis of Pharmaceuticals and Explosives in Fingermarks Using Matrix-Assisted Laser Desorption Ionization/ time-of-Flight Mass Spectrometry[J].Forensic Science International,2014,235:68-77.
(本文编辑:施 妍)
张文骥1,陈 卓1,张 婷2,许英健2,林子清1
(1.中国刑事警察学院 法医学系,辽宁 沈阳110035;2.中国刑事警察学院 法化学系,辽 宁 沈阳110035)
目的 建立汗液中美托洛尔和α-羟基美托洛尔的提取与检测方法。方法 汗液样品提取处理后采用Finnigan液相色谱仪串联LXQ离子阱质谱仪检测,流动相为乙腈-甲醇-0.1%甲酸水溶液(20∶20∶60,v/v/v);质谱采用SRM模式,正离子模式监测。以美托洛尔含量为指标,考察采样方法,提取溶剂种类,提取客体种类及显现粉末种类对于汗液中药物提取效率的影响。结果 采用甲醇湿润棉签采样。光滑客体的提取效率显著高于粗糙客体。显现粉末不同程度地干扰了药物的检出。单次口服25mg美托洛尔后3~15h仍可检出原药及代谢物。结论 本方法适用于汗液中美托洛尔和α-羟基美托洛尔的提取与检测,可依据汗液中美托洛尔和α-羟基美托洛尔的检测对排汗人进行识别。
汗液;液质联用;美托洛尔;α-羟基美托洛尔
Detection of Metoprolol and α-hydro-metoprolol in Human Sweat
ZHANG Wen-ji1,CHEN Zhuo1,ZHANG Ting2,XU Ying-jian2,LIN Zi-qing1
(1.Department of Forensic Medicine,National Police University,Shenyang 110035,China; 2.Department of Forensic Chemistry,National Police University,Shenyang 110035,China)
Objective To establish a method for the extraction and detection of metoprolol and α-hydro-metoprolol in human sweat.Method The sweat sample was prepared and analyzed by LC-MS with the mobile phase of acetonitrile-methanol-0.1%formic acid aqueous solution (20∶20∶60,v/v/v).The sample was operated at SRM mode (ESI+).The extraction method,extracting agent,developing powder,and substrate were assessed based on the amount of metoprolol detected. Result The metoprolol was extracted using methanol moistened swabs.The extraction efficiency on smooth substrates was significantly higher than that on rough substrates.The developing powder reduced the extraction of metoprolol.The timewindow of this method after a single oral administration is 3-15 hours.Conclusion The established method can be applied in the detection of metoprolol and its metabolite α-hydro-metoprolol in human sweat,and the analyzing results of sweat samples could be used to differentiate the objects.
sweat;LC-MS;metoprolol;α-hydro-metoprolol
DF795.1
A
10.3969/j.issn.1671-2072.2016.06.006
1671-2072-(2016)06-0028-05
2016-07-11
国家中央高校基本科研业务费专项基金
张文骥(1986—),男,讲师,博士,主要从事毒物及药物代谢及相关检测研究。E-mail:syphuzwj@163.com。
林子清(1961—),男,教授,主要从事法医物证学和法医人类学的研究。E-mail:ziqing2002@sohu.com。

