人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架修复山羊膝关节全层软骨缺损的实验研究
张雨,刘舒云,郭维民,郝春香,王明杰,苑志国,黄靖香,眭翔,张莉,卢世璧,郭全义
人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架修复山羊膝关节全层软骨缺损的实验研究
张雨,刘舒云,郭维民,郝春香,王明杰,苑志国,黄靖香,眭翔,张莉,卢世璧,郭全义
目的 探索人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架构建组织工程软骨,用于修复山羊膝关节负重区全层软骨缺损的可行性。方法 从人脐带中分离、扩增培养人脐带间充质干细胞,并进行鉴定;以猪源脱细胞软骨细胞外基质取向支架为组织工程软骨支架载体;在成年山羊膝关节负重区股骨髁处造全层软骨模型;实验分为两组,以人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架修复组为实验组,单纯全层软骨缺损造模作为对照组,每组 3 只山羊。术后7 d、14 d 分别抽取关节液涂片行 H&E 染色,观察炎症反应。在术后 3、6 个月后分别处死两组实验动物,取材进行大体形态学观察及评分、组织学染色及评分、软骨特异性基质成分定量检测。结果 ①关节液涂片 H&E 染色结果显示,术后两组膝关节炎症反应未见明显差异。②大体形态学观察及组织学染色结果均证实,实验组修复区再生的关节软骨更加接近天然软骨,且与周边整合良好,获得更好的修复效果。大体形态学及组织学评分均证实,实验组的评分均要明显高于对照组(< 0.05);③糖胺多糖定量检测结果显示实验组明显高于对照组(< 0.05)。结论 人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架构建组织工程软骨,可用于修复山羊膝关节负重区全层软骨缺损,是未来治疗软骨损伤较有应用前景的方法之一。
充质干细胞; 细胞外基质; 组织支架; 组织工程; 软骨,关节
关节软骨在关节中发挥着重要的功能,如润滑关节、缓冲振荡及传递负荷等[1]。由于软骨组织缺乏血管、神经的特殊性,导致其一旦损伤将不能自愈。往往伴随着膝关节的肿胀、疼痛、功能障碍,极大地影响患者的身心健康和社会功能[2-3],远期不可避免地发生骨性关节炎。组织工程理念的提出给组织再生与修复带来了新的希望,并展现了巨大的应用潜能。特别是软骨组织工程方面,有望成为软骨修复与再生最具有希望的策略之一。种子细胞和支架材料是软骨组织工程中最为重要的部分,寻找一种便于临床转化的优良软骨组织工程种子细胞,并复合适合种子细胞生长、分化的支架材料,用于构建组织工程软骨更是当前软骨组织工程研究的热点之一。
软骨组织工程最理想的种子细胞自然是来源于自体的软骨细胞[4],但是由于其来源受限且体外扩增易发生去分化,给患者带来二次的软骨损伤等缺点,于是寻找一种便于临床转化的优良软骨组织工程种子细胞显得尤其重要。近年来,来源于围产期组织的人脐带间充质干细胞因其具有独特的优势而受到广泛的关注。前期的基础研究证实,人脐带间充质干细胞不但具有和成体间充质干细胞相似的多系分化潜能,还具有更好的细胞活性、增殖能力和极低的免疫原性等优点[5-6]。另外,由于其在孕妇生产后视为遗弃物,所以其来源更为广泛,不会对患者造成二次损伤,无伦理争议,更加利于临床的转化和应用。我们实验室前期制备了猪源脱细胞软骨细胞外基质取向支架,该支架一方面来源于软骨组织,可以为种子细胞提供更加优良的生长、分化微环境;另一方面仿生天然软骨的垂直取向结构,可以很好地引导种子细胞的取向性再生。前期的体内、外实验均证实该支架具有良好的软骨损伤修复效果。
本实验在前期的研究基础上,应用人脐带间充质干细胞复合脱细胞软骨细胞外取向支架构建的三维组织工程软骨,探索其在山羊体内修复全层膝关节负重区软骨缺损的可行性,旨在为未来的软骨再生与修复提供一种具有希望和应用前景的组织工程软骨修复策略。
1 材料和方法
1.1 材料
1.1.1 材料来源 于本院产科经患者知情同意后获得足月产健康人脐带适量。取本实验室制备好的猪源脱细胞软骨细胞外基质取向软骨支架[7-8],切为直径与厚度分别为 6.5 mm 和1.5 mm大小,并进行60Co 消毒备用。
1.1.2 试剂 DMEM/F12 购自美国 Corning 公司;胰蛋白酶-EDTA 购自美国 Sigma 公司;CD45-PE 购自英国 Abcam 公司;速眠新 II 购自长春市军需大学兽医研究所;盐酸丁卡因购自武汉大华伟业医药化工有限公司;组织糖胺多糖比色法定量检测试剂盒购自上海杰美基因医药科技有限公司。
1.1.3 实验动物 8 ~ 12 个月龄健康成年雄性普通山羊,体重 30 ~ 40 kg。大动物手术通过解放军总医院动物伦理委员会的论证。
1.2 实验方法
1.2.1 人脐带间充质干细胞的分离培养及鉴定获取足月产产妇新鲜脐带,经无菌处理及去除血液后,置于 DMEM/F12培养基培养皿中剔除动静脉血管。培养基再次清洗数次,剪为 1 mm3大小组织块,以适当的密度接种于直径 15 cm 的培养皿中,加 5.0 ml DMEM/F12(含 10% 胎牛血清)培养基,置于 37 ℃,5% CO2饱和湿度的培养箱内培养。次日加入 10.0 ml 相同培养基,继续培养3 ~ 5 d 更换培养基,10 ~ 14 d 后剔除组织块。待细胞贴壁融合至 80% 时,用 0.25% 胰蛋白酶-EDTA 消化收集细胞,按 1:3 的比例传代至第 3 代后,用 0.25% 胰蛋白酶-EDTA 消化收集细胞,每管加 100 μl 密度为 1 × 106/ml 的单细胞悬液,然后分别加入 CD29-PE、CD90-PE、CD105-PE、CD14-PE、CD34-PE、CD45-PE 抗体各 10 μl,室温避光孵育30 min,PBS 洗涤重悬,流式细胞仪上机检测,Cell-Quest(Mac)软件分析,每个样本至少收获20 000 个细胞。
1.2.2 人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架体外构建组织工程软骨修复体 取第 3 代经流式细胞仪鉴定的目的人脐带来源间充质干细胞,弃去培养液,PBS 洗涤 3 遍,0.25% 胰蛋白酶-EDTA 消化收集细胞并计数。每管加 1 × 107个细胞悬液,以 1200 r/min离心 5 min,小心弃去上清液,加入 l00 μl DMEM/F12(含 10% FBS)培养基,再次混匀细胞呈细胞悬液,用移液枪吸取细胞悬液以滴种方法种植在已经消毒的脱细胞软骨细胞外基质取向支架上,成功构建组织工程软骨复合体,2 h 后加 5 ml 同样培养液,继续培养 3 d 后准备移植至山羊膝关节全层软骨缺损处。
1.2.3 组织工程软骨复合体修复山羊膝关节负重区全层软骨缺损体内试验 具体手术过程见图 1,待手术的山羊在手术实施前禁食 12 h,禁水 4 h,右膝关节备皮。所有实验动物均在速眠新II(0.15 ml/kg)肌肉注射麻醉后联合盐酸丁卡因(1 mg/kg)膝关节局部浸润麻醉,仰卧固定于手术台上将右侧膝关节剪毛及消毒,铺巾,取膝关节内侧切口切开皮肤,沿髌旁内侧入路切开关节囊,将髌骨连同髌韧带一起推向外侧,充分暴露股骨内、外侧髁,用眼科角膜环钻分别在股骨内、外侧髁处旋转式切下一直径为 6.5 mm,深度约 1.5 mm 的圆形软骨组织,造成全层关节软骨缺损。注意在旋转切割时应一边旋转环钻,一边由助手协助用无菌生理盐水沿环钻周边滴注,防止旋转产热损伤周边软骨组织,同时注意钻切的缺损深度,防止损伤软骨下骨结构。在全层软骨缺损造模完成的基础上,根据实验分组进行不同处理。实验组手术:取准备好的无菌的复合人脐带间充质干细胞的组织工程软骨复合体放在软骨缺损处并用生物蛋白胶粘贴固定。对照组手术:在全层软骨缺损造模的基础上不做处理。清理关节腔,髌骨复位,逐层缝合关节囊、筋膜及皮肤。术后把羊放置于温暖环境,做好分组标记,肌肉注射青霉素 160 万单位/d,连续 5 d,预防感染发生。术后实验动物圈养,自由活动。

图 1 人脐带间充质干细胞复合在脱细胞软骨细胞外基质取向支架构建的组织工程软骨修复山羊膝关节全层软骨缺损的手术过程(A:正常膝关节;B:膝关节股骨髁造直径为 6.5 mm 的全层软骨缺损,右上角为切下的软骨组织;C1:空白对照组;C2:实验组)
Figure 1 The operation process showed hUCSCs combined with ACECM oriented scaffold was transplanted to repair articular cartilage defects in caprine model [A: Normal knee joint; B: Cartilage damaged model with 6.5 mm diameter and removed cartilage tissue (top right corner); C1: Blank control group; C2: Experimental group]
1.2.4 主要观察指标
1.2.4.1 炎症反应水平:在手术后第7和 14 天,分别在无菌操作下抽取山羊手术膝关节关节液进行外观观察和关节液涂片 H&E 染色,观察关节液细胞类型和任意 3 个视野内炎症细胞所占的比例,分析炎症反应程度。
1.2.4.2 大体观察及形态学评分 分别在术后的第3、6 个月通过安乐死的方式处死山羊,取材观察山羊膝关节软骨缺损处的软骨修复情况,并通过国际软骨修复大体形态学评分进行评分。
1.2.4.3 组织学染色 将取材的标本用 4% 中性甲醛缓冲液固定1周,配制 100 g/L 的 EDTA 和 40 g/L 的 NaOH 混合溶液脱钙,再经梯度酒精脱水,常规石蜡包埋,切片。分别作H&E、甲苯胺蓝和天狼猩红染色,检测软骨缺损的修复情况,并采用 MODS(Modified O’Driscoll Score)评分系统对修复组织进行组织学评分。
1.2.4.4 糖胺多糖定量检测 将取材新鲜的标本用与实验手术所用的同一大小的角膜环钻以损伤区为中心环形旋转切割缺损修复区,除去软骨下骨组织,用蒸馏水洗干净。参照组织糖胺多糖比色法定量检测试剂盒步骤测定每个标本中糖胺多糖的含量,比较分析两组间的差异。
1.3 统计学处理
采用 SPSS 19.0 软件对各组、各时间点的数值进行单因素方差分析,以< 0.05 表示差异有统计学意义。

图 2 人脐带间充质干细胞的获取、培养及鉴定(A:人脐带组织;B:分离、培养的人脐带间充质干细胞光镜下细胞形态结果)
Figure 2 The resource, culturing and identification of hUCSCs (A: Human umbilical cord; B: The result of hUCSCs in light microscope)
2 结果
2.1 人脐带间充质干细胞的培养、鉴定及死活细胞染色
光镜下人脐带间充质干细胞呈细长纺锤形,处于分裂期细胞较多,细胞生长旺盛,见图 2。第三代人脐带间充质干细胞流式细胞仪检测结果报告显示细胞表面抗原高表达 CD44、CD73、CD90、CD105(阳性率均≥ 95%),不表达造血细胞标记 CD34、CD45、HLA-DR(阳性率均 < 2%),具有干细胞生物学特性,见图 3。第三代的脐带间充质干细胞复合到生物软骨支架后第 3 天,经死活细胞染色(FDA-PI)后激光共聚焦显微镜三维扫描成像观察细胞生长良好,均匀分布在三维取向软骨支架中,很少有死细胞存在,可见支架具有很好的生物相容性,见图 4。

图 3 人脐带间充质干细胞的流式细胞仪鉴定结果(CD44、CD105、CD90 及 CD73 的阳性率均在 95% 以上)
Figure 3 The surface markers of hUCSCs (flow cytometry, CD44+, CD105+, CD90+and CD73+> 95%)

图 4 人脐带间充质干细胞复合在脱细胞软骨细胞外基质取向支架后 3 d 的死活细胞染色(FDA/PI)共聚焦结果,红色荧光为死细胞,绿色荧光为活细胞
Figure 4 The live/dead cells test results of hUCSCs after seeded in ACECM oriented scaffold was performed by FDA/PI after 3 d, confocal microscopy, red means dead cells, green means live cells
2.2 炎症反应
在术后第7 天和 14 天两组实验动物膝关节关节液 H&E 染色结果显示以少量中性粒细胞为主,散在巨噬细胞分布,平均每个低倍镜视野炎性细胞的数量没有明显的差异,实验组较对照组没有明显的炎症反应差异,见图 5。
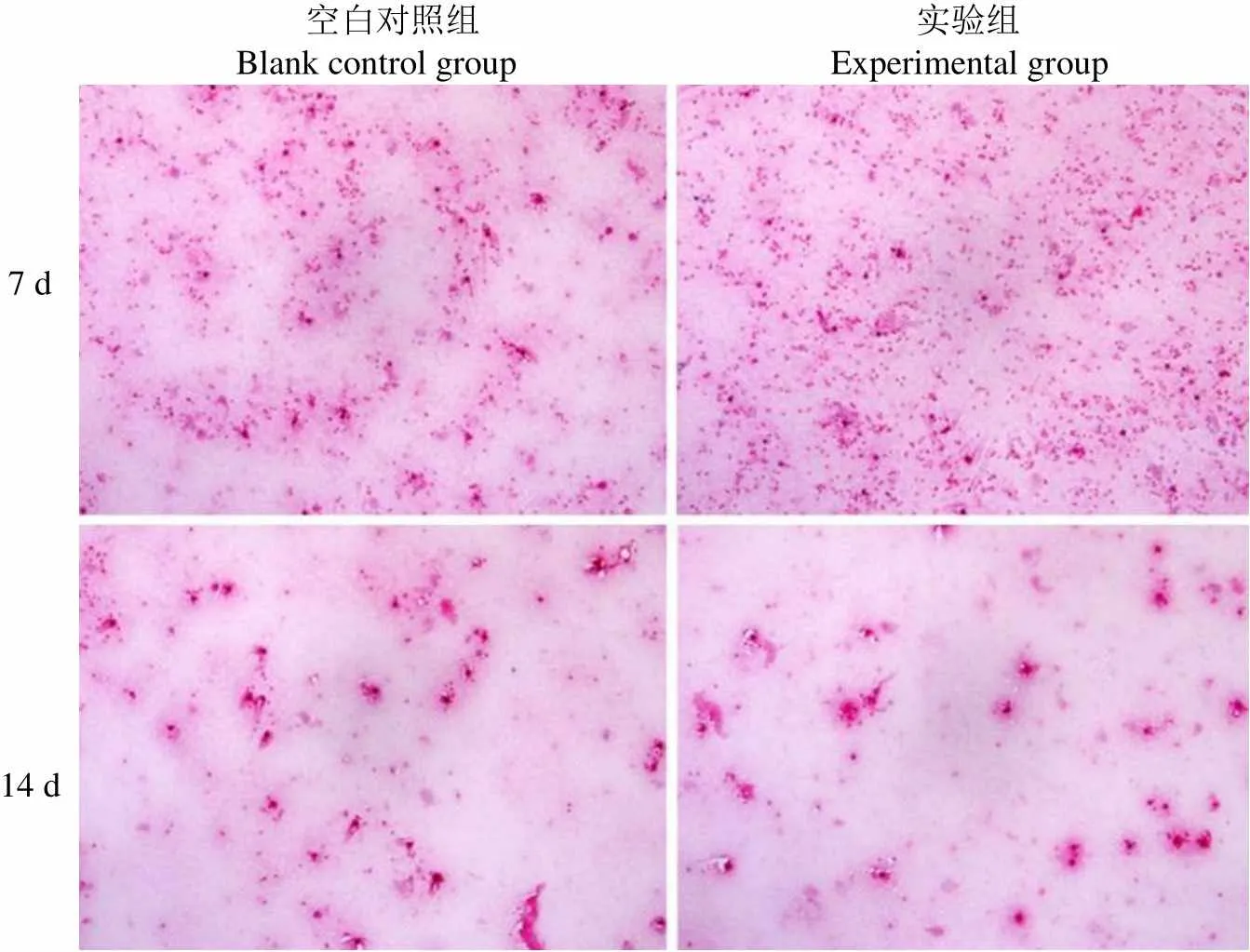
空白对照组 实验组 Blank control group Experimental group 7 d14 d
Figure 5 The H&E staining results of knee joint fluid after operation (× 100, optical microscope)
2.3 标本大体观察及大体形态学评分
所选用普通成年雄性山羊 6 只,无一只动物术后发生感染或死亡,均在第一次手术后 3 或6 个月取材进入结果分析。3 个月的实验结果显示,在实验组可见软骨缺损尺寸较对照组已经明显减小,新生软骨样组织覆盖了软骨下骨,缺损处与正常软骨边缘整合良好;对照组缺损处暴露的全层软骨缺损大小与最初造模时相近,只有缺损边缘可见极少量纤维结缔组织生成。在术后 6 个月,实验组的软骨缺损处几乎完全被新生软骨组织所填充修复,表面光滑,周边与宿主组织整合完好;而对照组缺损还较大,新生组织较少(图 6)。国际软骨修复协会-软骨修复大体评分结果也证实实验组(3 个月:5.4 ± 1.2;6 个月:18.7 ± 2.2)修复效果明显优于对照组(3 个月:0.6 ± 0.1;6 个月:2.3 ± 1.6),差异具有统计学意义(< 0.05)。

空白对照组 实验组 Blank control group Experimental group 3 个月3 months6 个月6 months国际软骨修复大体形态学评分ICRS score2520151050空白对照组Blank control group实验组Experimental group 3 个月 6 个月 A3 months 6 monthsB
Figure 6 The gross morphology (A) and ICRS score (B) of repaired knee joints in 3-month and 6-month (*significant different between two groups,< 0.05)
2.4 组织学染色及组织学评分
H&E 染色结果显示,3 个月时,实验组缺损处已被新生组织部分填充并覆盖软骨下骨,新生组织与周边组织过渡整合自然且紧密,空白对照组缺损处无新生组织,软骨下骨暴露;6 个月时,实验组新生组织已经填充软骨缺损处,并与周边组织界面齐平,可见有早期的软骨陷窝形成,空白对照组缺损处有一薄层新生组织覆盖于软骨下骨表面,见图 7A。
甲苯胺蓝染色结果显示,3 个月时,对照组与实验组染色均为阴性,实验组新生组织为不成熟软骨组织;在 6 个月结果中,实验组甲苯胺蓝染色较深,明显优于空白对照组,其新生组织表现为较为成熟的软骨组织,见图 7A。
天狼猩红染色结果显示,在偏光镜下观察,实验组在 3 个月时修复区呈现为紧密排列,强双折光性的黄色或红色为主要的I型胶原纤维;6 个月时,实验组呈现为弱双折光,多种色彩的疏松网状分布为主的II型胶原纤维,空白对照组则呈现红色的强双折光的 I型胶原纤维为主的修复,见图 7A。
组织学评分结果进一步得出实验组(3 个月:6.3 ± 2.3;6 个月:15.0 ± 1.9)相对于空白对照组(3 个月:2.1 ± 1.9;6 个月:5.1 ± 0.5)在不同的时间点都获得了更好的修复效果,差异具有统计学意义(< 0.05)(图 7B)。

3 个月 6 个月3 months 6 months空白对照组 实验组 空白对照组 实验组Blank control group Experimental group Blank control group Experimental group H&E甲苯胺蓝Toluidine blue天狼猩红Sirius redA
Figure 7 H&E staining, toluidine blue staining, sirius red staining (A) and histologcal grading results of repair region of knee joints (B) (*significant different between two groups,< 0.05)
2.5 糖胺多糖的测定
糖胺多糖的定量检测结果证实,实验组(3 个月:68.7 ± 5.1 μg/样本;6 个月:132.7 ± 9.0 μg/样本)无论在术后 3 个月还是 6 个月,均要显著高于空白对照组(3 个月:18.3 ± 7.1 μg/样本;6 个月:38.3 ± 10.0 μg/样本),差异具有统计学意义(< 0.05)(图 8)。

糖胺多糖含量(μg/样本)Quantification ofglycosaminoglycan (μg/sample)150100500空白对照组Blank control group实验组Experimental group 3 个月 6 个月 3 months 6 months
Figure 8 The quantification of glycosaminoglycan of repair region results (*< 0.05)
3 讨论
关节软骨损伤的修复至今仍是医学界面临的重大难题之一。尽管软骨修复方法很多,但是尚缺乏能够获得长期有效修复效果的再生策略。本实验立足于组织工程再生理念,以人脐带来源间充质干细胞为种子细胞,复合脱细胞软骨细胞外取向支架,构建的组织工程软骨复合体,成功地实现了山羊膝关节负重区的全层软骨缺损的修复,证实了脐带间充质干细胞复合脱细胞软骨细胞外取向支架构建的组织工程软骨用于软骨损伤修复的可行性。
近年来,人脐带间充质干细胞因其不但具有成体干细胞多项分化潜能的一般特性,还具有多方面的优势,如细胞的分离操作简单、不需酶的消化或其他的提纯步骤就能够获得细胞表型更均一的细胞、对宿主无侵入性损伤、无伦理学争议、细胞来源不受限等,迅速成为组织工程领域研究热点之一[9-10]。在分离培养过程中,不需经过体外酶的组织消化,这使得获得的种子细胞表型更加均一。光镜下观察呈现纤维细胞样形态,细胞表面抗原高表达CD44、CD73、CD90、CD105,不表达造血细胞标记 CD34、CD45、HLA-DR。且细胞分离过程简单,干细胞的获取效率高。在我们实验中证实,细胞复合在支架后 3 d,共聚焦显微镜观察细胞已经布满整个支架,且死/活细胞染色结果证实细胞在三维支架中生长良好,几乎无死亡细胞出现。异种细胞的移植实验往往存在免疫排斥反应,但是本实验术后3 d 的关节液检测结果却显示,实验组和对照组的关节炎症无明显差异。这可能和人脐带间充质干细胞相对于成体间充质干细胞更为幼稚,免疫原性更低有关。
另外,和传统应用间充质干细胞修复软骨损伤的研究方法不同,本实验的人脐带间充质干细胞没有进行成软骨诱导。但是从体内修复结果中证实,实验组较对照组获得了很好的修复效果。从大体观察及组织学层面结果均证实,未经过诱导成软骨的人脐带间充质干细胞复合脱细胞软骨细胞外取向支架构建的组织工程软骨能够实现全层软骨缺损的修复。在 6 个月甲苯胺蓝组织学染色结果中可见实验组修复区已有大量的成熟细胞外基质分泌;天狼猩红染色结果可见实验组修复区组织胶原成分和正常组织非常相近。另外,糖胺多糖定量检测结果也显示,实验组糖胺多糖含量远高于对照组。这说明不经过成软骨诱导的人脐带间充质干细胞也能够获得较好的体内软骨修复效果。这一研究结果与前期研究,认为人脐带间充质干细胞较其他成体组织来源间充质干细胞具有更好的软骨分化潜能结论相吻合[11-12]。研究认为这可能与人脐带组织中富含透明质酸有密切关联。透明质酸也是软骨组织中的固有的天然成分,体外实验发现在添加透明质酸的细胞培养微环境中能够增强间充质干细胞的成软骨分化作用[13-14],这可能是人脐带间充质干细胞更容易向软骨分化的原因之一。在我们的试验中,人脐带间充质干细胞是复合在脱细胞软骨细胞外基质取向支架中,该支架材料包含了大量的软骨细胞外基质成分,如胶原成分、糖胺多糖及透明质酸等,有利于细胞的黏附、增殖和分化[15]。支架的取向仿生结构有利于引导种子细胞定向分布,提高新生组织的力学性能[16]。因此,人脐带间充质干细胞复合脱细胞软骨细胞外基质取向支架构建的组织工程软骨是很有应用前景的组织工程软骨修复策略。另外一些研究结果也显示,脐带间充质干细胞也具有很好的生物调节作用,通过分泌生物活性物质,如趋化因子和分化因子,促进周围组织细胞的迁移、增殖和分化,为软骨修复提供良好的微环境,促进损伤软骨的修复[17-18]。综合以上各种因素,共同促进了人脐带间充质干细胞复合脱细胞软骨细胞外取向支架构建的组织工程软骨对损伤软骨的修复作用。
本实验旨在探讨人脐带间充质干细胞复合脱细胞软骨细胞外取向支架构建组织工程软骨修复大动物(山羊)膝关节负重区软骨损伤的可行性,实验结果证实该方法行之有效,而且极具临床转化和应用前景。但本研究没有进行人脐带间充质干细胞修复软骨损伤的体内转归机制方面的探索,修复有效性的观察时间也相对较短。因此,我们下一步研究重点将主要关注在人脐带干细胞的体内转归机制,并进一步观察其远期的修复效果,为临床的转化与应用提供更为有力的证据。
[1] Hunziker EB. Articular cartilage repair: are the intrinsic biological constraints undermining this process insuperable? Osteoarthritis Cartilage, 1999, 7(1):15-28.
[2] O’Driscoll SW. The healing and regeneration of articular cartilage.J Bone Joint Surg Am, 1998, 80(12):1795-1812.
[3] Buckwalter JA, Mankin HJ. Articular cartilage: degeneration and osteoarthritis, repair, regeneration, and transplantation. Instr Course Lect, 1998, 47:487-504.
[4] Brittberg M. Autologous chondrocyte transplantation. Clin Orthop Relat Res, 1999, 367 Suppl:S147-S155.
[5] Majore I, Moretti P, Stahl F, et al. Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord. Stem Cell Rev, 2011, 7(1):17-31.
[6] Liu S, Hou KD, Yuan M, et al. Characteristics of mesenchymal stem cells derived from Wharton's jelly of human umbilical cord and for fabrication of non-scaffold tissue-engineered cartilage. J Biosci Bioeng, 2014, 117(2):229-235.
[7] Yao J, Lu SB, Peng J, et al. Preparation of articular cartilage extracellular matrix derived oriented scaffold for cartilage tissue engineering. J Clin Rehabil Tissue Eng Res, 2009, 13(3):432-436. (in Chinese)
姚军, 卢世璧, 彭江, 等. 关节软骨细胞外基质源性软骨组织工程取向支架的制备. 中国组织工程研究与临床康复, 2009, 13(3):432- 436.
[8] Lu L, Guo QY, Yang QY, et al. Research of biological safty of porcine articular cartilage extracellular matrix derived scaffold. Chin Med Biotechnol, 2010, 5(1):19-23. (in Chinese)
鹿亮, 郭全义, 杨启友, 等. 猪来源关节软骨脱细胞支架的生物安全性研究. 中国医药生物技术, 2010, 5(1):19-23.
[9] Can A, Karahuseyinoglu S. Concise review: human umbilical cord stroma with regard to the source of fetus-derived stem cells. Stem Cells, 2007, 25(11):2886-2895.
[10] Troyer DL, Weiss ML. Wharton's jelly-derived cells are a primitive stromal cell population. Stem Cells, 2008, 26(3):591-599.
[11] Baksh D, Yao R, Tuan RS. Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow. Stem Cells, 2007, 25(6):1384-1392.
[12] Jo CH, Kim OS, Park EY, et al. Fetal mesenchymal stem cells derived from human umbilical cord sustain primitive characteristics during extensive expansion. Cell Tissue Res, 2008, 334(3):423-433.
[13] Chung C, Burdick JA. Influence of three-dimensional hyaluronic acid microenvironments on mesenchymal stem cell chondrogenesis. Tissue Eng Part A, 2009, 15(2):243-254.
[14] Wu SC, Chang JK, Wang CK, et al. Enhancement of chondrogenesis of human adipose derived stem cells in a hyaluronan-enriched microenvironment. Biomaterials, 2010, 31(4):631-640.
[15] Yao J, Lu SB, Peng J, et al. Effect of oriented cartilage extracellular matrix-derived scaffold on biological behavior of in vitro cultured chondrocytes. Acad J PLA Postgrad Med Sch, 2009, 30(3):375-377. (in Chinese)姚军, 卢世璧, 彭江, 等. 取向性关节软骨细胞外基质源性支架对负载软骨细胞生物学行为的影响. 军医进修学院学报, 2009, 30(3): 375-377.
[16] Yao J, Lu SB, Peng J, et al. In vitro short term cartilage tissue engineering with oriented cartilage extracellular matrix scaffolds and bone marrow mesenchymal stem cells. Chin J Orthopaedics, 2010, 30(12):1217-1222. (in Chinese)姚军, 卢世璧, 彭江, 等. 软骨细胞外基质源性取向支架与骨髓基质干细胞体外软骨组织工程的初步研究. 中华骨科杂志, 2010, 30(12):1217-1222.
[17] Caplan AI, Dennis JE. Mesenchymal stem cells as trophic mediators.J Cell Biochem, 2006, 98(5):1076-1084.
[18] Meirelles Lda S, Fontes AM, Covas DT, et al. Mechanisms involved in the therapeutic properties of mesenchymal stem cells. Cytokine Growth Factor Rev, 2009, 20(5-6):419-427.
Repair of goat full-thickness cartilage defects using tissue engineering cartilage constructed by the ACECM-oriented scaffold seeded with hUCSCs
ZHANG Yu, LIU Shu-yun, GUO Wei-min, HAO Chun-xiang, WANG Ming-jie, YUAN Zhi-guo, HUANG Jing-xiang, SUI Xiang, ZHANG Li, LU Shi-bi, GUO Quan-yi
Gj
Objective To explore the effectiveness of human umbilical cord derived stem cells (hUCSCs) combined with the acellular cartilage extracellular matrix oriented scaffold on the repair of full-thickness cartilage defects in big animal (goat).Methods hUCSCs were acquired from human umbilical cords. The oriented scaffold was made from acellular cartilage extracellular matrix of swine in our laboratory. The full-thickness and 6.5 mm diameter cartilage defects were made in the knee weight-bearing area (medial and lateral articular condyle) of adult goats. All of goats were randomly divided into two groups, including control group and experimental group (hUCSCs combined with the acellular cartilage extracellular matrix oriented scaffold treatment group). 7 and 14 d after operation, synovial fluid was extracted to demonstrate the inflammation. After 3 or 6 months, the two groups of animals were euthanized to analysis on gross morphology and histopathology.Results ①The results from H&E staining of synovial fluid smears showed that there was no significant difference in the inflammatory response of knee joint between the two groups. ②The gross morphology and histology staining confirmed that the regenerated articular cartilage of the experimental group was closer to the natural cartilage and had better integration with the surrounding area and better repairing effect. What’s more, the grade scores of the gross morphology and histopathology were higher in the experimental group than that of the control group in both 3 and 6-month (< 0.05). ③The results of quantitative detection of glycosaminoglycans in the experimental group were significantly higher than those in the control group (< 0.05).Conclusion The tissue engineering cartilage is constructed by hUCSCs combined with the acellular cartilage extracellular matrix oriented scaffold and repairs successfully the full-thickness cartilage defect in caprine model, and this method is a promise strategy on regeneration of cartilage in future.
Mesenchymal stem cell; Extracellular matrix; Tissue scaffolds; Tissue engineering; Cartilage, articular
GUO Quan-yi, Email: doctorguo_301@163.com
10.3969/j.issn.1673-713X.2016.06.004
国家自然科学基金(81472092);国家高技术发展研究计划(863 计划)(2015AA020303)
100853 北京,中国人民解放军总医院骨科研究所/骨科再生医学北京市重点实验室/全军骨科战创伤重点实验室(张雨、刘舒云、郭维民、王明杰、苑志国、黄靖香、眭翔、张莉、卢世璧、郭全义),麻醉科(郝春香)
郭全义,Email:doctorguo_301@163.com
2016-10-10
Author Affiliations: Institute of Orthopaedics, Beijing Key Lab of Regenerative Medicine in Orthopaedics, Key Lab of Musculosketal Traums & Injurious PLA (ZHANG Yu, LIU Shu-yun, GUO Wei-min, WANG Ming-jie, YUAN Zhi-guo, HUANG Jing-xiang, SUI Xiang, ZHANG Li, LU Shi-bi, GUO Quan-yi); Anesthesia Department (HAO Chun-xiang), Chinese PLA General Hospital, 100853 Beijing, China

