济宁市耳聋基因普遍筛查模式探索
孙磊
济宁市妇幼保健院听力诊断中心(济宁272100)
·临床研究·
济宁市耳聋基因普遍筛查模式探索
孙磊
济宁市妇幼保健院听力诊断中心(济宁272100)
目的 通过对济宁市新生儿进行耳聋基因普遍筛查,了解新生儿耳聋基因的携带情况,探讨地市级妇幼保健院开展耳聋基因普遍筛查的模式。方法2015年4月20日至11月20日在济宁市助产机构出生的38903名新生儿接受了耳聋基因筛查,与另外29种遗传代谢病同步采集血片;对照组为2013年耳聋基因单独筛查组和2015年4月1日至10月31日听力筛查组。应用飞行时间质谱技术对中国人常见GJB2、GJB3、SLC26A4和线粒体12srRNA等4个耳聋易感基因共20个热点突变位点进行检测[GJB2(35delG、167delT、176_191de116、235delC、299_300delAT),GJB3(538C→T、547G→A),SLC26A4(281C→T、589G→A、IVS7-2A→G、1174A→T、1226G→A、1229C→T、IVS15+5G→A、1975G→C、2027T→A、2162C→T、2168A→G),线粒体12S rRNA(1494C→T、1555A→G)]。对于耳聋基因携带者在3个月内采用自动听性脑干反应(auto auditory brainstem response,AABR)筛查随访或接受常规听力诊断,听力诊断检查项目包括:声导抗、诊断型耳声发射、脑干诱发电位(ABR)、40Hz听觉事件相关电位(40Hz-AERP)。结果 含耳聋基因的30种遗传代谢病筛查率85.47%,高于耳聋基因单独筛查率59.61%,差异有统计学意义(P<0.001)。38903例新生儿中携带有耳聋基因突变者2179例,耳聋基因突变携带率为5.60%(2179/38903),其中GJB2纯合突变8例,复合杂合6例,杂合1028例,共1042例,携带率为2.68%(1042/38903);GJB3杂合突变162例,携带率为0.42%(162/38903);SLC26A4纯合突变2例,复合杂合6例,杂合突变843例,共851例,携带率为2.19%(851/38903);线粒体12SrRNA同质突变85例,异质性突变11例,共96例,携带率为0.25%(96/38903);GJB2合并SLC26A4突变共18例,GJB2合并GJB3突变共2例,GJB3合并SLC26A4突变共4例,SLC26A4合并线粒体12SrRNA同质突变3例,GJB2合并SLC26A4和线粒体12SrRNA同质突变1例,GJB2 167delT,TT位点未发现突变。1557例耳聋基因杂合携带者做到了召回听力随访,随访率71.45%(1557/2179),低于同期听力筛查组的随访率95.14%(431/453),差异有统计学意义(P<0.001)。3个月内最终确诊听力损失25例。结论 耳聋基因与29种遗传代谢病同步筛查更易被家长接受,筛查后的随访有待加强,筛查的位点可以适当调整。
新生儿,听觉损失,耳聋基因,普遍筛查
听力和耳聋基因联合筛查近年受到重视[1-2],在全国逐步开展起来,耳聋基因筛查主要集中在直辖市、省会城市和经济较为发达的地区,筛查的例数多少不一,有的只在本地区的少数医院开展,而且筛查的耳聋基因种类和位点不统一[3-14]。目前,耳聋基因筛查的准入和收费缺乏统一的标准,前期的耳聋基因筛查多采用免费方式,但是免费增加了当地的财政负担,不利于耳聋基因普遍筛查,尤其是筛查的可持续性发展。什么样的耳聋基因筛查模式适合地级市,尤其是经济不是特别发达的地区,是我们思考的问题[15,16]。经2015年济宁市人民代表大会审议,济宁市耳聋基因普遍筛查列入为民办的实事,于2015年4月启动,经过对全市助产机构集中培训,县市区妇幼保健院强化培训,济宁市妇幼保健院牵头督导,济宁市的耳聋基因普遍筛查取得了初步经验,希望对地市级妇幼保健院的耳聋基因普遍筛查工作起到借鉴作用。
1 对象和方法
1.1 对象
2015年4月20日至2015年11月20日耳聋基因普遍筛查组,夫妻一方为济宁市户籍且在济宁市助产机构生产的,自愿接受耳聋基因筛查的,签署知情同意书,市级财政每例补偿130元,自己负担130元,共筛查38903例。对照组:2013年6月至12月,夫妻一方为济宁市户籍且在济宁市妇幼保健院听力中心接受听力诊断的新生儿,自愿接受耳聋基因免费筛查,签署知情同意书,市级财政每例补贴600元,共筛查245例。
1.2 方法
30种遗传代谢病同步采集血片;耳聋基因筛查采集新生儿的足跟血2滴,样本送深圳华大公司,应用飞行时间质谱技术对新生儿进行耳聋基因筛查[17-19],对GJB2、GJB3、SLC26A4和线粒体12srRNA等4个常见耳聋易感基因进行检测,检测位点包含4个基因的20个热点突变:[GJB2(35delG、167delT、176_191del16、235delC、299_300delAT),SLC26A4( 281C>T、589G>A、IVS7-2A>G、1174A>T、1226G>A、1229C>T、IVS15+5G>A、1975G>C、2027T>A、2162C>T、2168A>G),GJB3(538C>T、547G>A),MT-RNR1(12S rRNA)(1555A>G、1494C>T)]。
1.3 随访模式
耳聋基因阳性报告一般集中发送,济宁市妇幼保健院听力中心接到阳性报告后,转发给助产机构。阳性报告中,如果孩子出生医院位于济宁市区,由济宁市妇幼保健院听力中心负责通知家长;其余的由各县市区妇幼保健院通知,济宁市妇幼保健院负责定期督导检查,督导结果与各县市区的评优挂钩。听力初筛通过的,在3个月内采用自动听性脑干反应(auto auditory brainstem response,AABR)筛查随访;初筛未通过的,加做畸变产物耳声发射(DPOAE),如果AABR和DPOAE筛查均通过,嘱每6个月复诊1次,直至3周岁;如果AABR和DPOAE筛查均未通过,嘱3月龄时复诊,接受听力诊断;如果AABR通过而DPOAE筛查未通过,嘱5月龄时复诊,接受听力诊断;对复筛未通过的、纯合、复合杂合突变及直系亲属有聋哑人的采用常规听力学诊断,检查项目包括:声导抗、诊断型耳声发射、脑干诱发电位(ABR)、40Hz听觉事件相关电位(40Hz-AERP)。嘱如果发现孩子对声音反应不灵敏,及时复诊。
2 结果
2.1 耳聋基因及突变位点的频数和比率:2015年4月20日至2015年11月20日活产新生儿46349例,听力初筛45515例,耳聋基因采血筛查38903例,2179例携带耳聋基因突变位点(按人计算,单个基因与两种及以上基因不重复计算);如果每种基因单独计算,基因的总突变例数是2206例。耳聋基因及突变位点的频数和比率分别见表1、表2。
每种基因单独计算,例数增加,在总突变例数和总人数中所占比率略提高,差异无统计学意义(P>0.05)。截至2015年11月20日GJB2 167delT,TT位点未发现突变。GJB3的538C>T CT位点比547G>A GA位点携带率高,在总突变例数和总人数中所占比率的差异均有统计学意义(P<0.001)。MT-RNR1(12S rRNA)1494C>T TT位点只发现一例。11个SLC26A4 (PDS)的位点均发现携带者,6例SLC26A4(PDS)复合杂合突变,3例有281C>T CT杂合突变位点。
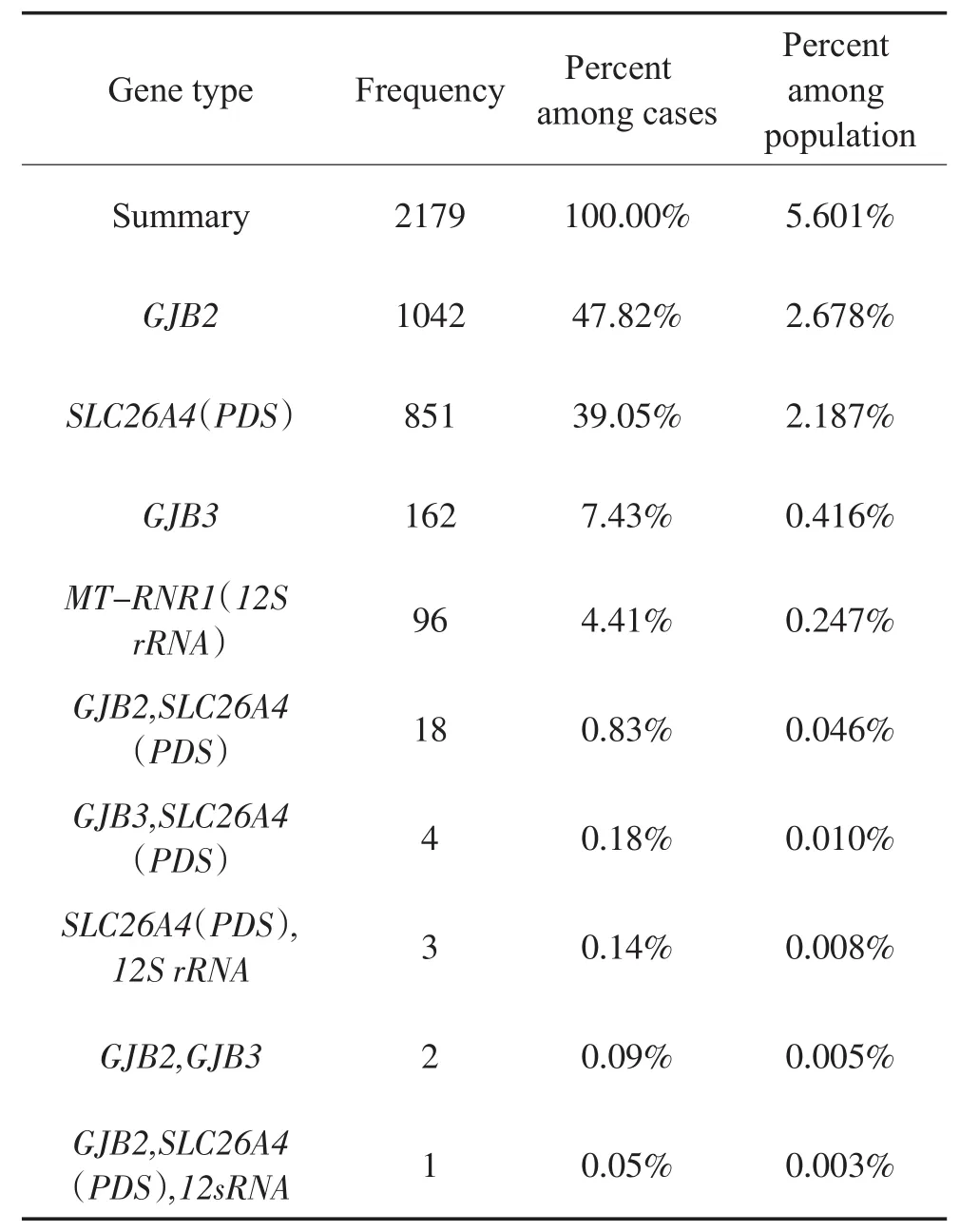
表1 四种基因的突变频数及在总突变例数和总人数中所占比率(降序排序)Table 1 Mutation frequency and percentage among whole mutation cases or population(descending)
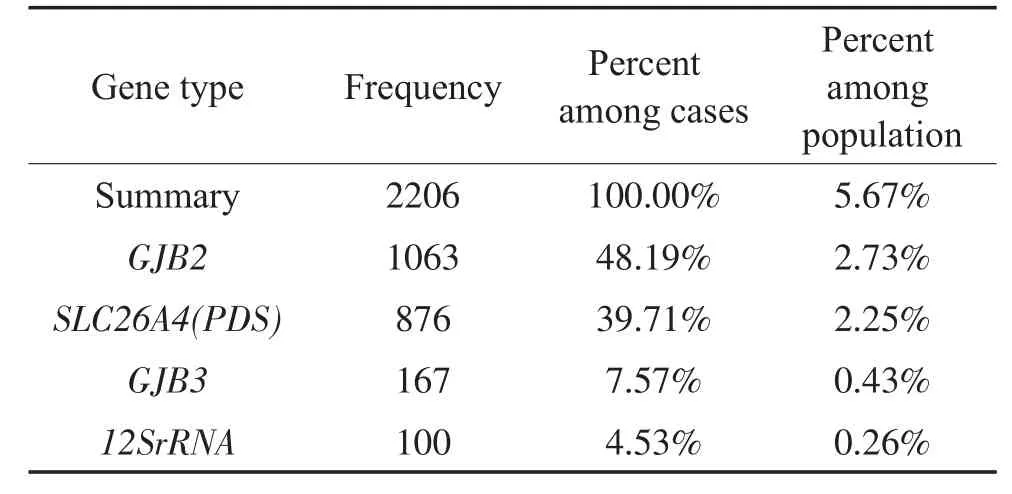
表2 四种基因的突变频数(每种基因单独计算)及在总突变例数和总人数中所占比率(降序排序)Table 2 Mutation frequency and percentage among whole mutation cases or population(every gene counted individually, descending)
2.2 携带耳聋基因的聋儿特例
一例SLC26A4(PDS)复合杂合突变,初筛双侧通过,经过听力诊断,目前听力正常;一例SLC26A4 (PDS)杂合突变,已经在县妇幼复筛,双侧未通过,经听力诊断,确诊双侧感音神经性聋,脑干诱发电位左侧40dBnHL,右侧50 dBnHL,3月时于外院复查,双侧50 dBnHL;另一例SLC26A4(PDS)杂合突变,已经在县妇幼初筛,双侧通过,经AABR筛查,双侧未通过,当时给予听力诊断,确诊双侧极重度感音神经性聋。一例235delC C.DEL,IVS7-2A>G AG,1555A>G GG同质性突变,经听力诊断,确诊双侧感音神经性聋,脑干诱发电位双侧60dBnHL。一例GJB2杂合突变,已经在县妇幼复筛,双侧未通过,经听力诊断,确诊双侧感音神经性聋,脑干诱发电位双侧55dBnHL。
2.3 筛查率和随访
从2015年4月20日至2015年11月20日,耳聋基因普遍筛查率85.47%;2013年6月至12月,济宁市妇幼保健院听力中心诊断新生儿411例,其中245例接受耳聋基因筛查,筛查率59.61%(245/411),与耳聋基因单独筛查相比,同步采血的耳聋基因普遍筛查提高了筛查率,差异有统计学意义(P<0.001)。同期听力筛查率98.20%,高于耳聋基因普遍筛查率85.47%,差异有统计学意义(P<0.001)。1557例耳聋基因杂合携带者做到了“召回”听力随访,随访率71.45%(1557/2179);2015年4月1日至2015年10月31日,听力筛查复筛未通过453例,听力诊断431例,听力筛查的随访率95.14%(431/453),耳聋基因普遍筛查的随访率低于听力筛查的随访率,差异有统计学意义(P<0.001)。1557例耳聋基因携带者初筛未通过56例,未通过率3.60%,同期听力初筛45515例,未通过3187例,未通过率7.00%,耳聋基因携带者初筛未通过率低于总人群的未通过率,差异有统计学意义(P<0.001)。3个月内最终确诊听力损失25例,另外16例拒绝AABR筛查,签字拿走耳聋基因报告单。
3 讨论
3.1 定期督导、同步采血
济宁市妇幼保健院牵头定期督导,内容包括政策执行、技术辅导和软件指导、服务监督等,及时发现采血率(筛查率)的问题,2015年5月督导一次,当时筛查率最低96%,最高100%,平均98%,后来未再督导,至2015年11月20日,筛查率85.47%,筛查率降低,说明定期督导的重要性;耳聋基因普遍筛查率低于听力筛查率,提示耳聋基因筛查刚起步。30种遗传代谢病同步采血,筛查率大于耳聋基因单独筛查,这提示与29种遗传代谢病同步采血筛查,家长易于接受。
3.2 随访模式
从济宁市的实际情况看,电话通知是不可替代的手段,尤其是各县市区妇幼保健院专人负责,对于“召回”新生儿是不可缺少的一环。如果只是咨询,不做检查,难以消除家长的疑虑;对听力筛查通过、单杂合突变的孩子采用AABR,是家长不能接受听力诊断情况下的一种尝试,也是济宁市耳聋基因普遍筛查后,随访工作的一个缺陷,因为AABR存在假阴性[20]。耳聋基因携带者的初筛未通过率低于总人群的初筛未通过率,从一个侧面反映了开展耳聋基因筛查的难度,召回随访比苯丙酮尿症、先天性甲状腺功能低下症难,因为没有检测数值的高低或者不通过,家长难以接受召回。2例GJB2复合杂合突变和1例SLC26A4(PDS)复合杂合突变初筛均通过,1例重度聋儿SLC26A4(PDS)杂合突变初筛通过,提示耳聋基因筛查、召回及脑干诱发电位检查的必要性。截至目前,通过耳聋基因筛查只发现了上述3例携带GJB2或SLC26A4双等位基因突变(纯合或复合杂合突变)通过了听力筛查;除了1例3种基因突变未通过听力筛查,其余99例携带线粒体突变的新生儿均通过了听力筛查。MT-RNR1(12S rRNA)携带者,均提供药物性聋贴卡。随访到的GJB3携带者,未发现AABR未通过的例子,向家长说明GJB3杂合突变也可能导致高频听力下降,定期随访。在知情同意书上写明、对随访到的家长进一步强调、目前开展的耳聋基因筛查只查常见的热点突变、非热点突变需要做基因全测序。本文聋儿特例中,单基因杂合突变、3种基因的突变也出现了程度不等的耳聋,因为单基因的杂合突变也存在迟发性听力损失的可能性[21,22],对于听力初筛未通过的,只要是耳聋基因携带者,争取做听力诊断;即使AABR双侧通过,也让家长签字、嘱家长密切观察、定期随访,建议做相关基因位点的全测序,避免医疗纠纷;对于拒绝接受听力诊断和/或AABR筛查的,或者要求到外院检查的,都要求家长签字。耳聋基因随访率71.16%,低于2015年同期听力筛查随访率95.14%,原因可能如下:听力筛查已经通过,对耳聋基因不熟悉等,后期的遗传咨询、听力检查随访模式还有待改进[23-25]。
3.3 位点选择
GJB2 167delT,TT位点未发现突变,可能筛查的例数还不够多或者济宁市少数民族人口比例低,已经与深圳华大公司沟通,建议调整GJB2筛查位点。11个SLC26A4(PDS)的位点均发现携带者,6例SLC26A4(PDS)复合杂合突变,3例有281C>T CT杂合突变位点,提示如果耳聋基因只筛查9个或者15个位点,特别是SLC26A4(PDS),如果筛查位点少,就显得不够充分,容易漏诊,在成本能接受的前提下,SLC26A4(PDS)的位点查的越多越好。虽然MT-RNR1(12S rRNA)1494C>T TT位点只发现一例,但不检查这个位点,将导致漏诊。
从济宁市耳聋基因普遍筛查的初步探索,可以得到以下启示:经过地级市人民代表大会审议,列入为民办的实事,耳聋基因的普遍筛查就有了制度保证;争取财政补贴,减轻家长的负担,家长易于接受;与其他遗传代谢病同步采血筛查,家长易于接受。当然,从长远来看,地级市妇幼保健院自己购置设备、获取资质,是保证耳聋基因普遍筛查可持续发展的必由之路。
1 韩德民.新生儿听力及耳聋基因联合筛查[J].中国医学文摘-耳鼻咽喉科学,2012,27(6):290-292. Demin Han.Newborn Hearing Concurrent Deafness Genetic Screen⁃ing[J].Chinese ENT News and Reviews,2012,27(6):290-292.
2 王秋菊.新生儿聋病基因筛查-悄然的革命[J].听力学及言语疾病杂志,2008,16(2):83-87 Qiuju Wang.Newborn Deafness Genetic Screening-Quiet Revolution [J].Journal of Audiology and Speech Pathology,2008,16(2):83-87
3 韩冰,王秋菊.新生儿听力和基因联合筛查研究现状[J].中华耳科学杂志.2013,11(2):309-312 Bing Han,Qiuju Wang.Review of Newborn Hearing Concurrent Ge⁃netic Screening[J].Chinese Journal of Otology,2013,11(2):309-312
4 陈亚秋.天津市新生儿听力和基因联合筛查与诊治工作[J].中国医学文摘-耳鼻咽喉科,2015,30(4):202-204.Yaqiu Chen.TianJin Neonatal Hearing and the Combination of Genet⁃ic and Make a Diagnosis and Give Treatment Work Situation[J].Chi⁃nese ENT News and Reviews,2015,30(4):202-204.
5 王智楠,李隽,胡艳玲,等.湖北地区新生儿听力与基因筛查模式的转变与发展[J].中国医学文摘-耳鼻咽喉科学,2012,30(4): 208-211. Zhinan Wang,Jun Li,Yanling Hu,et al.The Change and Development the Model of Hearing and Deafness Gene Screening of the Newborn in Hubei Region in China[J].Chinese ENT News and Reviews,2012, 30(4):208-211.
6 相丽丽,林倩,聂文英,等.济南市部分新生儿听力和耳聋基因联合筛查结果分析[J].中华耳鼻咽喉头颈外科杂志,2015,50(5):401-405.LIli Xiang,Qian Lin,Wenying Nie,et al.Study of Newborn Hearing and Genetic Screening in Jinan[J].Chinese Journal of Otorhinolaryn⁃gology Head and Neck Surgery,2015,50(5):401-405.
7 云中燕,沈碧云,王艳华,等.黑龙江省新生儿听力与基因联合筛查总结[J].中国医学文摘-耳鼻咽喉科学,2015,30(4):205-207. Zhongyan Yun,Biyun Shen,Yanhua Wang,et al.A Summary on Hear⁃ing and Genetic Screening of Newborn in Hei Longjiang Province[J]. Chinese ENT News and Reviews,2015,30(4):205-207.
8 周怡,刘海红,郝津生,等.15343例新生儿耳聋基因普遍筛查结果分析[J].中国听力语言康复科学杂志,2014,50(2):109-112.Yi Zhou,Haihong Liu,Jinsheng Hao,et al.An Analysis of the Deaf⁃ness-related Gene Screening Rerults of 15343 Newborns[J].Chinese Scientific Journal of Hearing and Speech Rehabilitation,2014,50 (2):109-112.
9 胡书君,历建强,张鹏,等.新生儿听力与聋病易感基因联合筛查的临床研究[J].听力学与言语疾病杂志,2010,18(3):222-224. Shujun Hu,Jiangqiang Li,Peng Zhang,et al.A Clinical Study of 2788 Newborns Screened for Hearing and Gene[J].Journal of Audiology and Speech Pathology,2010,18(3):222-224.
10 李振安,梁淑贞,余凤慈,等.佛山市10238例新生儿听力与耳聋易感基因联合筛查分析[J].听力学与言语疾病杂志,2014,22(6): 585-588. Zhenan Li,Shuzhen Liang,Fengci Yu,et al.An Analysis of Newborn Hearing Concurrent Genetic Screening Results[J].Journal of Audiolo⁃gy and Speech Pathology,2014,22(6):585-588.
11 周佳霖,历建强,罗仁忠,等.听力复筛未通过的新生儿常见聋病易感基因筛查结果分析[J].听力学与言语疾病杂志,2011,19(1): 14-17 Jialin Zhou,Jianqiang Li,Renzhong Luo,et al.The Susceptibility Genes in Failed Newborns in Hearing Screening Programs[J].Journal of Audiology and Speech Pathology,2011,19(1):14-17
12 黄美琼,葛晶晶,张广清,等.1674例新生儿耳聋基因筛查结果分析[J].国际检验医学杂志,2015,36(10):1398-1399. Meiqiong Huang,Jingjing Ge,Guangqing Zhang,et al.Screening Anal⁃ysis of Deafness Gene in Neonatus[J].Int J Lab Med 2015,36(10):1398-1399.
13 史桂芝,宫露露,林倩,等.新生儿非综合征型听力损失的GJB2基因突变分析[J].中华医学杂志,2005,85(10):689-692. Guizhi Shi,Lulu Gong,Qian Lin,et al.Mutations of GJB2 Gene in In⁃fants with Non-syndromic Hearing Impairment[J].Natl Med J China, 2005,85(10):689-692.
14 张章,范联,余凤慈,等.新生儿听力和聋病易感基因联合筛查报告[J].实用医学杂志,2014,30(17):2754-2756. Zhang Zhang,Lian Fan,Fengci Yu,et al.Combined Screening Report of Hearing Screening and Deafness Susceptibility Genes Screening for Newborns[J].The Journal of Practical Medicine,2014,30 (17):2754-2756
15 韩冰,李倩,枞亮,等.新生儿听力及基因联合筛查临床实践和筛查模式研究[J].中华耳科学杂志,2013,11(3):380-383. Bing Han,Qian Li,Liang Zong,et al.An Clinical Research Newborn Hearing Concurrent Genetic Screening in 106,513 Neonates[J].Chi⁃nese Journal of Otology,2013,11(3):380-383.
16 Junqing Zhang,Peng Wang,Bing Han.Newborn hearing concurrent genetic screening for hearing impairment—A clinical practice in 58,397 neonates in Tianjin,China[J].International Journal of Pedi⁃atric Otorhinolaryngology,2013,08(038):1-7.
17 曾云,姜丹,冯大飞等.飞行时间质谱检测技术在非综合征型耳聋基因检测中的应用[J].中华耳鼻咽喉头颈外科杂志,2013,48 (12):985-990. YunZeng,DanJiang,DafeiFeng,etal.Application of MAL⁃DI-TOF-MS in Gene Testing for Non-syndromic Hearing Loss[J]. Chinese Journal of Otorhinolaryngology Head and Neck Surgery, 2013,48(12):985-990.
18 孟西娜,张婷,臧嘉,等.无锡地区新生儿耳聋基因的MAL⁃DI-TOF-MS筛查分析[J].中华检验医学杂志,2015,38 (2):102-105. Xina Meng,Ting Zhang,Jia Zang,et al.MALDI-TOF-MS Based Diag⁃nosis and Analysis of Newborn Hereditary Deafness Screening in Wuxi Jiangsu Province[J].Chin J Lab Med,2015,38(2):102-105.
19 余红,刘丹,杨晶群.新生儿听力及耳聋易感基因联合筛查结果评价[J].浙江预防医学,2015,27(1):28-31. Hong Yu,Dan Liu,Jingqun Yang.An Evaluation on Newborn Screen⁃ing of Hearing Combined with Deafness Predisposing Genes[J].Zheji⁃ang Prov Med,2015,27(1):28-31.
20 李晓璐.自动脑干诱发电位在听力筛查中的应用[J].中国儿童保健,2008,16(1):47-50 Xiaolu Li.Automatic Auditory Brainstem Response in Neonatal Hearing Screening[J].Chinese Journal of Child Care,2008,16(1): 47-50
21 林海波,刘庆仪.2109例新生儿听力和GJB2基因联合筛查分析[J].牡丹江医学院学报,2014,35(3):73-75. Haibo Lin,Qingyi Liu.Analysis on Hearing Concurrent Genetic GJB2 Screening in 2109 Newborns[J].Journal of Mudanjiang Medi⁃cal University,2014,35(3):73-75.
22 吴皓.儿童迟发性听力障碍的听力与基因联合筛查[J].中国医学文摘-耳鼻咽喉科学,2015,30(4):189-191 Hao Wu.Combined Depistage of Hearing Screening and Deafness Gene for Childhood Late Onset Hearing Impairment[J].Chinese ENT News and Reviews,2015,30(4):189-191
23 黄丽辉,杜亚婷,崔庆佳,等.新生儿耳聋基因筛查未通过者的遗传咨询模式初探[J].中国医学文摘-耳鼻咽喉科学,2015,30 (04):192-194 Lihui Huang,Yating Du,Qingjia Cui,et al.A Preliminary Study of Ge⁃netic Counseling Mode on the Newborn Who Failed in Deafness Gene Screening[J].Chinese ENT News and Reviews,2015,30 (04):192-194
24 陈晓巍,高儒真.耳聋易感基因及遗传咨询在新生儿群体中的应用[J].中国医学文摘-耳鼻咽喉科学,2015,30(4):195-198. Xiaowei Chen,Ruzhen Gao.Combined Application of Deafness Gene Screening and Genetic Counseling in Newborns[J].Chinese ENT News and Reviews,2015,30(4):195-198.
25 高儒真,陈晓巍,历东东,等.新生儿聋病基因筛查及咨询的临床意义[J].中国听力语言康复科学杂志,2015,13(3):166-171. Ruzhen Gao,Xiaowei Chen,Dongdong Li,et al.The Clinical Applica⁃tions of Newborn Deafness Gene Screening and Genetic Counseling [J].Chinese Scientific Journal of Hearing and Speech Rehabilitation, 2015,13(3):166-171.
The Jining model of universal newborn deafness gene screening
SUN Lei
Hearing center,Jining Maternal and Children Care Hospital,12 Gongxiao Road,Jining 272100
To report universal deafness gene screening among newborns in Jining for evaluating carrying status of deafness genes,and discuss models of universal screening at local maternal and children care facilities.Methods Deafness gene screening was administered to 38,903 newborns at maternal care centers in Jining between mid-April and mid-November,2015.Blood samples were collected as part of screening that included another 29 hereditary and metabolism diseases.Deafness gene screening data completed from 2013 and hearing screening data in 2015 were used as controls.Matrix-Assisted Laser Desorption Ionization Time of Flight Mass Spectrometry(MALDI-TOF-MS) was used to detect four common deafness genes including twenty hot mutation points[GJB2(35delG,167delT,176_ 191de116,235delC and 299_300delAT),GJB3(538C→T and 547G→A),SLC26A4(281C→T,589G→A,IVS7-2A→G,1174A→T,1226G→A,1229C→T,IVS15+5G→A,1975G→C,2027T→A,2162C→T and 2168A→G),12S rRNA (1494C→T and 1555A→G)].Auto auditory brainstem response(AABR)testing was used to screen,and acoustic im-pedance,otoacoustic emissions,auditory brainstem responses and 40Hz-AERPs were used to complete diagnosis.The diagnosis time was under 3 months of age.Results The rate of screening of the 30 diseases including deafness was higher than that of deafness gene screening alone(P<0.001).Gene mutations were detected in 2179 cases(5.60%,2179/ 38903),including homozygote GJB2 mutations(n=8),compound heterozygote GJB2 mutations(n=6),heterozygote GJB2 mutations(n=1028),heterozygote GJB3 mutations(n=162),homozygote SLC26A4 mutations(n=2),compound heterozygote SLC26A4 mutations(n=6),heterozygote SLC26A4 mutations(n=843),homogeneous 12SrRNA mutations(n=85),and heterogeneous12SrRNA mutations(n=11).Total mutation carrier frequency was 2.68%for GJB2,0.42%for GJB3,2.19%for SLC26A4 and 0.25%for 12SrRNA.Simultaneous detection of GJB2 and SLC26A4 mutations were identified in 18 cases,GJB2 and GJB3 mutations in 2 cases,GJB3 and SLC26A4 mutations in 3 cases, SLC26A4 and 12SrRNA mutations in 4 cases,and GJB2,SLC26A4 and 12SrRNA mutations in 1 case.GJB2 167delT,TT mutation was not found.Recalls were made for 1557 neonates carrying gene mutations.The follow-up rate(71.45%, 1557/2179)was lower than that in the hearing screening group(95.14%,431/453)(P<0.001).Permanent hearing loss was confirmed in 25 cases within 3 months.Conclusion Deafness gene screening is more acceptable to parents if administered as part of screening with other 29 hereditary and metabolic diseases.Follow-up should be enforced on deafness gene carriers.Mutation points being screened may be optimized.
Newborn,Hearing loss,Deafness gene,Universal screening
R764.43
A
1672-2922(2016)05-649-5
2015-12-24审核人:翟所强)
10.3969/j.issn.1672-2922.2016.05.019
孙磊,研究生,副主任医师,研究方向:临床听力学、耳聋基因
孙磊,Email:enptsun@163.com
——山东省济宁市老年大学之歌

