陕西省某规模化猪场仔猪腹泻病原的分离鉴定
王爱玲 , 蔡俊波,2 , 李春燕 , 李海敏 , 郭抗抗
(1.西北农林科技大学动物医学院 , 陕西杨凌712100 ; 2.陕西省安康市石泉县畜牧兽医中心 , 陕西石泉725200)
陕西省某规模化猪场仔猪腹泻病原的分离鉴定
王爱玲1, 蔡俊波1,2, 李春燕1, 李海敏1, 郭抗抗1
(1.西北农林科技大学动物医学院 , 陕西杨凌712100 ; 2.陕西省安康市石泉县畜牧兽医中心 , 陕西石泉725200)
腹泻是由传染性因素和非传染性因素引起的以腹泻为主要症状的一种综合征,是规模化猪场仔猪常见的一种疾病。传染性因素主要包括各种引起腹泻的病原微生物,目前国内猪场常见的有病毒和细菌所引起。为确定发生腹泻的原因,采取针对性的防控措施,本试验对3 只来自不同发病圈舍的腹泻仔猪,进行病理剖检和猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻病毒(PEDV)的PCR 检测,进行细菌的分离鉴定,选敏感性药物进行治疗使本次病情得以控制,也为临床上类似病例的诊治提供参考,报告如下。
1 发病情况
2015年4月陕西省某规模化猪场发生了仔猪腹泻病情,排黄色浆糊状稀粪、部分患猪发生死亡,经诺氟沙星等抗生素治疗,未见明显效果。
2 临床检查
患病仔猪消瘦,精神不振,被毛粗糙,排黄色浆糊状稀粪;剖检发现该猪肠道臌胀并有黄色液体内容物,肠黏膜脱落,肠系膜淋巴结有弥漫性出血小点,肠壁菲薄呈半透明状。
3 实验室检验
3.1 病毒学检测 无菌采集3只发病仔猪的小肠组织100 mg于匀浆器中充分研磨后加入1 mL灭菌生理盐水提取总RNA,产物溶解于20 μL DEPC水中,-20℃备用。对提取的RNA按照反转录试剂盒说明书进行cDNA合成。参照GenBank公布的TGEV(DQ8117881.1)M基因、PEDV(EU302820.1)M基因利用Primer5.0基因分析软件分别设计PEDV、TGEV 的检测引物。引物序列如下:PEDV-F:5′-TTCCCGTTGATGAGGTGAT-3′;PEDV-R:5′-AAGCATTGACTGAACGACC-3′;TGEV-F:5′-AAACTTCTAAATGGCCAACCAGGGACAAC-3′;TGEV-R:5′-GCATCTCGTTTAGTTCGTTACCTCATCAATTATC-3′。PEDV 和TGEV 预扩增产物片段分别为552bp、1 168 bp,引物由北京华大基因科技服务有限公司合成。检测结果:通过PCR 扩增,取10 μLPCR 产物经1.0%琼脂糖凝胶电泳观察,对采集小肠中PEDV和TGEV的PCR检测结果均为阴性,如图1

图1 病料中流行性腹泻病毒和传染性
胃肠炎病毒的PCR检测
M:DNA Marker ;1:病料中PEDV ;2:PEDV阳性对照;3:病料中TGEV ;4:TGEV阳性对照
3.2 细菌学检测
3.2.1 细菌分离 无菌取患猪肝脏、肠内容物划线于血平板培养基上,37 ℃培养24 h。观察菌落形态并取单个菌落进行革兰染色、镜检从肠内容物和肝脏中各分离获得一株细菌,在血平板上可见到针尖大小的白色单一菌落,无溶血现象;革兰染色镜检下可看到红色。短小、单杆菌形态。根据培养特性、菌落形态和染色镜检初步确定该菌为大肠埃希菌。
3.2.2 分离菌的生化鉴定 将疑似大肠埃希菌菌落接种于肠杆菌科细菌微量生化管中,37 ℃培养24 h后观察结果。结果表明,该分离的菌对葡萄糖、麦芽糖、乳糖试验均为阳性,对枸橼酸盐等试验为阴性,结果见表1。

表1 分离菌的生化试验结果
+:阳性;
-:阴性
3.2.3 分离菌的测序及分析 根据参考文献[1],以细菌的DNA为模板,来扩增16s rRNA,测序并将测序序列登陆GenBank。测序结果经Blasten分析后,对测序结果进行系统进化分析。基因测序结果经BLAST分析表明该分离株与埃希大肠菌的16S rRNA基因同源性为98%,与志贺菌的16SrRNA基因同源性为98%,经过进一步的进化分析(如图2)结果表明,该分离株与大肠埃希菌相近。
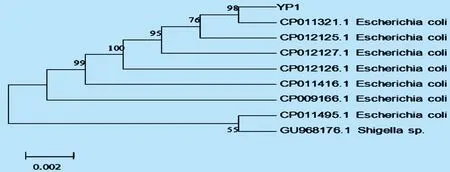
图2 分离菌基因组核酸序列进化树分析
处于同一类群中,而与志贺菌的亲缘关系较远,因此将该分离株归类为大肠埃希菌。
3.2.4 分离菌的药敏试验 调整细菌浓度约5×107-8CFU/mL,取1 mL 菌悬液均匀涂布在MH 琼脂平板上,将14 种常用药敏纸片(10~30 μg/片)贴培养基上,37 ℃培养24 h 观察抑菌圈大小。采用纸片扩散法来检测分离的大肠埃希菌对抗菌药物的敏感性,结果发现,该菌对头孢噻吩等药物高度敏感;对头孢唑林中度敏感;对氨苄西林、链霉素等药物产生耐药性,结果见表2。
4 讨论
仔猪腹泻是规模化猪场常见的疾病,治疗不及时造成严重的经济损失。引起腹泻的病因最常见的有病毒和细菌。秦谷雨等对2011 年10月-2012年5月安徽地区37个规模化猪场采集腹泻仔猪的186 份病料进行TGEV 和PEDV 的PCR检测,发现阳性率分别为59.1%和5.4%[2]。薛瑞雪等对2013-2014 年采集山东省部分地区猪场腹泻仔猪的226 份病料进行PEDV、TGEV 和PRoV 的PCR 检测发现阳性率分别为34.96%、2.21%、28.76%[3]。也有大肠埃希菌为主要病原引起仔猪腹泻的报道[4-5]。在发生腹泻时及时确定病原是制定针对性防控措施的前提,盲目用药、不对因治疗,将会贻误治疗时机,造成疫情的扩大。本文报道的猪场发生仔猪腹泻后,在没有确定病因的情况下,先用本场常用的抗菌药物进行治疗,但未见到明显效果,进而怀疑为病毒感染引起,使用抗病毒药物后依然没有效果,使得疫情扩大。实验室诊断发现引起本次疫情的病原为大肠埃希菌,只是在前期治疗中没有用到敏感的药物。所以在发生仔猪腹泻时及时确定病因,筛选敏感性药物,采取针对性的措施是控制疫情的关键。
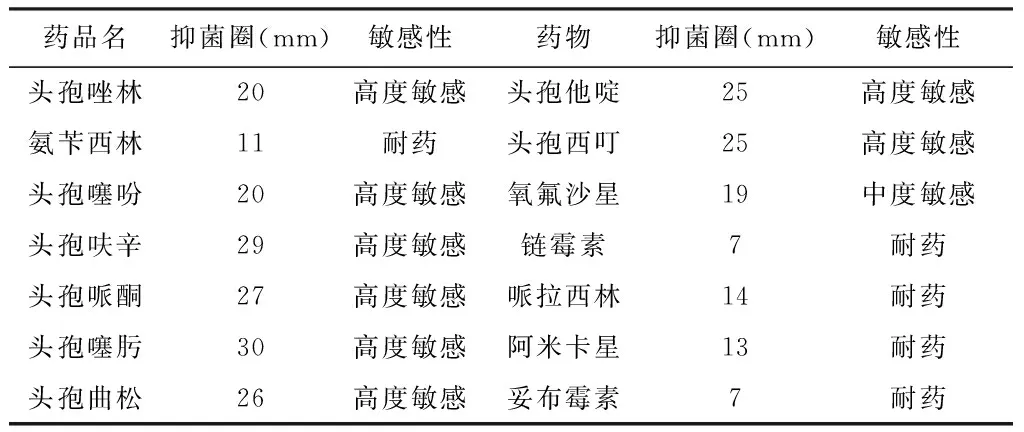
表2 分离菌的药敏试验
注:抑菌圈(mm)d≥20 mm为高敏;15≤d≤20为中敏;d<15为耐药
在回顾性调查中我们也发现,该猪场长期在饲料中添加一种抗菌药物以防控细菌感染,使细菌耐药性增加,治疗效果降低或没有效果。所以为避免这种情况的发生,提高抗菌药物的疗效,要合理使用抗菌药物,需要轮换用药和定期进行药敏试验,防止发生长期使用对同一类抗菌药物产生交叉耐药。由于引起腹泻的病因复杂,及时确定病原,采取针对性的防治措施,做好生物安全措施,是防控病原性腹泻的关键。
[1] 朱飞舟,陈利玉,陈汉春,等.16S rRNA基因序列分析法鉴定病原细菌[J].中南大学学报(医学版),2013,38(10):1035-1041.
[2] 秦谷雨,杨勇,李郁,等.安徽省仔猪腹泻5 种病毒感染情况的调查研究[J].动物医学进展,2012,33(12):59-63.
[3] 薛瑞雪,田野,田夫林,等.山东省部分地区仔猪病毒性腹泻流行病学调查[J].中国预防兽医学报,2015,37(4):255-257.
[4] 廖红,郝中香,张曼丽,等.仔猪大肠杆菌病病原分离鉴定及自家苗的制备[J].养猪,2014(06):115-117.
[5] 薛原,张秀英,陈建飞,等.猪源大肠杆菌多重耐药性的检测与分析.中国兽医杂志.2010.46(3):41-43.
2015-08-19
陕西省重点农业科技推广及示范项目(ZDKJ2014-33);陕西省科技统筹创新工程计划项目(2014KTCQ02-02)
王爱玲(1990-),女,硕士生,研究方向为猪重要疫病防控技术研究,E-mail:1256028246@qq.com
郭抗抗,E-mail:guokk2007@nwsuaf.edu.cn
S858.28
B
0529-6005(2016)10-0040-02

