高效液相色谱法同时测定止咳片中白花前胡甲素和白花前胡乙素含量
赵万晴,戚继红
(安徽省淮北市食品药品检验中心,安徽 淮北 235000)
高效液相色谱法同时测定止咳片中白花前胡甲素和白花前胡乙素含量
赵万晴,戚继红
(安徽省淮北市食品药品检验中心,安徽 淮北 235000)
目的 建立同时测定止咳片中白花前胡甲素和白花前胡乙素含量的高效液相色谱(HPLC)法。方法 采用Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 m),流动相为甲醇-水(77∶23),检测波长为321 nm,流速为1.0 mL/min,进样量为10 L。结果 白花前胡甲素质量浓度在21.98~219.8 mg/L范围内与峰面积积分值线性关系良好(r=0.999 5);白花前胡乙素质量浓度在5.895~58.95 mg/L范围内与峰面积积分值线性关系良好(r=0.999 9)。白花前胡甲素的平均加样回收率为100.75%,RSD为1.44%(n=9);白花前胡乙素的平均加样回收率为99.11%,RSD为1.68%(n=9)。结论 该方法操作简便、准确、稳定、灵敏度高,适用于止咳片中白花前胡甲素和白花前胡乙素的质量控制。
高效液相色谱法;止咳片;白花前胡甲素;白花前胡乙素
止咳片是由百部、前胡、苦杏仁组方的复方制剂,具有润肺定喘、祛痰止咳的功效[1]。前胡为主要成分之一,最早产地及历史上前胡道地产区在长江以南的江浙与皖南一带,历代均以白花前胡作为前胡的正品[2]。现代药理学研究表明,白花前胡具有祛痰、改善心肌功能、抗菌、抗氧化及抗癌的作用[3-5],还具有双重抑制乙酰胆碱酯酶和丁酰胆碱酯酶的作用[5-6],其主要成分为白花前胡甲素、白花前胡乙素[6]。笔者采用高效液相色谱(HPLC)法同时测定止咳片中白花前胡甲素和白花前胡乙素的含量,现报道如下。
1 仪器与试药
1.1 仪器
Thermo U-3000型 HPLC色 谱 仪 (W Thermo DAD-3000检测器);JAC-300N型超声波处理器(济宁奥波超声电气有限公司);Mettler AE-240型电子分析天平(精度为0.1 mg/0.01 mg)。
1.2 试药
白花前胡甲素对照品(批号为111711-200602)、白花前胡乙素对照品(批号为111904-201203)均购于中国食品药品检定研究院,含量以98.0%计;止咳片(批 号 分 别 为 20140103,20140114,20140208,20140509,吉林省康福药业有限公司);甲醇为色谱纯;水为重蒸馏水。
2 方法与结果
2.1 色谱条件及系统适用性试验[7-8]
色谱柱:十八烷基硅烷键合硅胶为填充剂,Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(77∶23);检测波长:321 nm;流速:1.0 mL/min;进样量:10 μL;柱温:25℃。
2.2 溶液制备
2.2.1 对照品溶液
称取白花前胡甲素对照品21.98 mg,精密称定,置50 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,作为白花前胡甲素对照品贮备液。
称取白花前胡乙素对照品12.03 mg,精密称定,置100 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,作为白花前胡乙素对照品贮备液。
2.2.2 供试品溶液[9-10]
取样品除去糖衣,研细,精密称取2.80 g(约10片重),置50 mL具塞锥形瓶中,精密加入氯仿25 mL,精密称定质量,超声处理30 min,放冷至室温,再称定质量,用氯仿补足减失的质量,摇匀,滤过,蒸干,残渣用甲醇溶解,并转移至10 mL,加甲醇稀释至刻度,摇匀,即得供试品溶液。
2.3 方法学考察
阴性干扰试验:按照止咳片质量标准制备工艺制备不含对照药材的阴性对照样品,研细,称取粉末1.684 5 g,按供试品制备方法制备阴性对照品溶液。在拟订色谱条件下,阴性对照品溶与对照品溶液相同保留时间处无色谱峰出现,见图1。
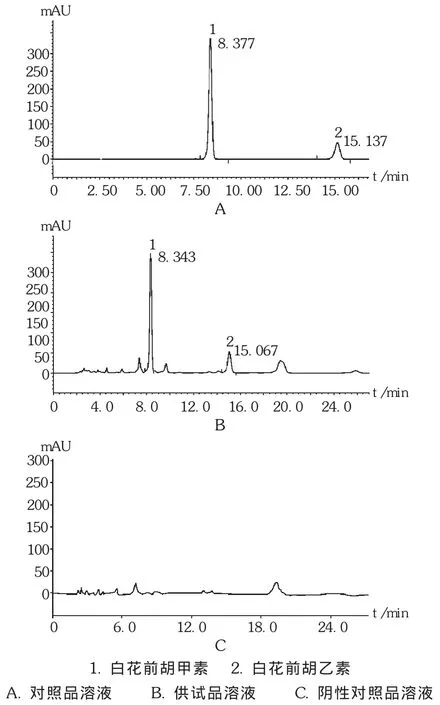
图1 高效液相色谱图
线性关系考察:精密量取白花前胡甲素对照品、白花前胡乙素对照品贮备液0.5,1.0,2.0,3.0,4.0,5.0 mL,分别置同一10 mL容量瓶中,加甲醇稀释至刻度,摇匀,按拟订色谱条件,精密量取10 μL注入液相色谱仪,以峰面积(Y)为纵坐标、质量浓度(X)为横坐标,进行线性回归,得白花前胡甲素回归方程为 Y=0.395 9 X-1.253 8(r=0.999 5),质量浓度在21.98~219.8 mg/L范围内与峰面积积分值线性关系良好;白花前胡乙素为Y=0.338 6 X-0.070 8(r=0.999 9),质量浓度在5.895~58.95 mg/L范围内与峰面积积分值线性关系良好。
精密度试验:分别精密量取白花前胡甲素对照品、白花前胡乙素对照品贮备液2.0 mL,置同一10 mL容量瓶中,加甲醇稀释至刻度,摇匀。取上述对照品混合溶液,按拟订色谱条件,精密量取10 μL注入液相色谱仪,连续进样6次,测定峰面积。结果白花前胡甲素和白花前胡乙素的 RSD分别为0.16%和0.26%(n=6)。
重复性试验:取同一批(批号为20140103)样品,按供试品溶液制备方法制备6份,照拟订色谱条件测定。结果白花前胡甲素和白花前胡乙素的 RSD分别为1.71%和1.83%(n=6),表明方法重复性良好。
稳定性试验:取同一批(批号为20140103)供试品溶液,于0,4,8,12,16,20,24 h时分别进样测试,记录色谱峰面积。结果白花前胡甲素和白花前胡乙素的RSD分别为0.23%和0.18%(n=7),表明供试品溶液在24 h内稳定。
加样回收试验:精密称取已知含量样品(批号为20140103),共9份,分成3组,置具塞锥形瓶中,每组分别精密加入含白花前胡甲素87.92 mg/L、含白花前胡乙素23.58 mg/L的对照品贮备液4.0,5.0,6.0 mL,照供试品溶液制备方法制备溶液,精密量取10 μL注入液相色谱仪,按拟订色谱条件测定,计算回收率。结果见表1。
2.4 样品含量测定
取3批(批号分别为20140114,20140208,20140509)样品,各2份,精密称取适量,置具塞锥形瓶中,依法制备供试品溶液。精密量取10 μL注入液相色谱仪,记录色谱图,计算含量。结果见表2。
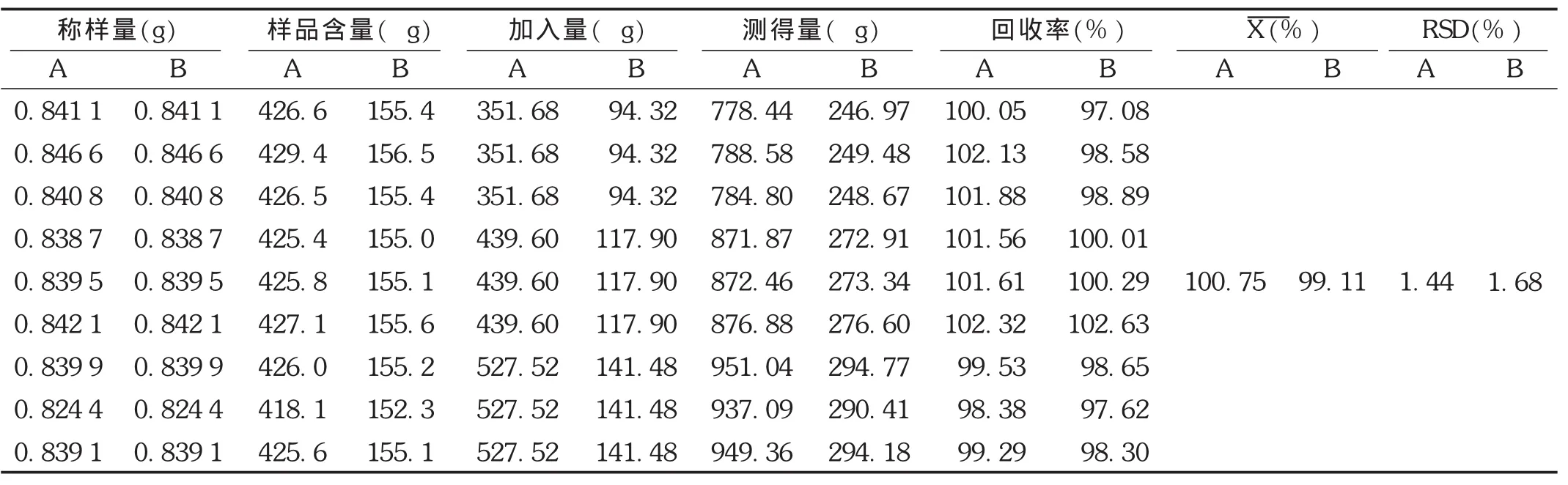
表1 白花前胡甲素和白花前胡乙素加样回收试验结果(n=9)
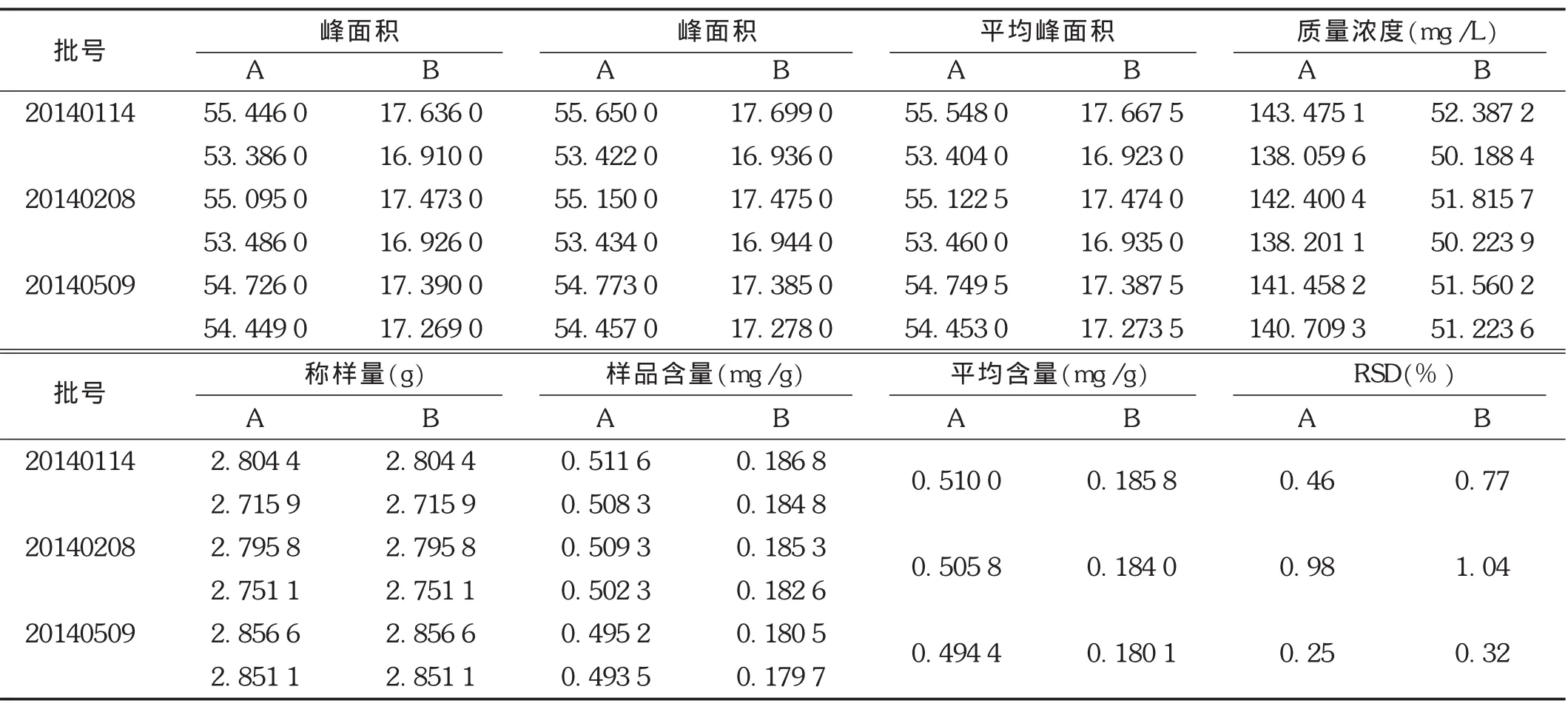
表2 样品中白花前胡甲素和白花前胡乙素含量测定结果
3 讨论
3.1 波长选择
考察质量浓度为0.10 g/L白花前胡甲素和白花前胡乙素对照品77%的甲醇水溶液,分别进行紫外扫描,结果均于320 nm波长处有最大吸收,参照2010年版《中国药典(一部)》前胡药材检验项下的波长为321 nm,故波长选择为321 nm。
3.2 提取超声时间选择
考察白花前胡甲素、白花前胡乙素提取时间,分别处理20,30,40 min[10]后进行考察,结果超声30 min能达到满意的效果。
3.3 流动相选择
前胡甲素含量测定使用流动相大多为甲醇-水或乙腈-水[11-13],考虑到甲醇毒性比乙腈小,选择甲醇-水作流动相。为了白花前胡甲素、白花前胡乙素及杂质组分能完全分离,调节甲醇-水的比例,发现采用甲醇-水(77∶23)为流动相时效果较好。
[1]WS3-B-0700-91,中华人民共和国卫生部药品标准·中药成方制剂(第四册)[S].
[2]单 锋,郝近大,黄璐琦.2010年版《中国药典》中“紫花前胡”功效描述的商榷[J].中国中药杂志,2015,40(12):2 464-2 469.
[3]吴 霞,毕 赢,王一涛.前胡化学成分及药理作用的研究进展[J].食品与药品,2010,12(11):442-444.
[4]孟德玉,毛子成,何兴金,等.药用前胡研究进展[J].中国野生植物资源,2005,24(3):10-13.
[5]宋亚旻,宋 波,李宗阳,等.前胡挥发油胆碱酯酶抑制作用及化学成分研究[J].天然产物研究与开发,2012,24(11):1 508-1 512.
[6]张 村,肖永庆,谷口雅彦,等.白花前胡化学成分研究[J].中国中药杂志,2005,30(9):675-676.
[7]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:248.
[8]陈 建.HPLC法测定含化上清片中白花前胡甲素和白花前胡乙素的含量[J].西北药学杂志,2015,30(3):251-252.
[9]刘 慧 .止咳片的质量控制[J].医药导报,2015,34(6):811-813.
[10]李红燕,张 蕊,冯晓川.HPLC测定除痰止咳丸中的桔梗皂苷D、桔梗皂苷E白花前胡甲素和白花前胡乙素[J].中国实验方剂学杂志,2014,20(2):78-82.
[11]刘海斌,苏荣芳,李雯姗,等.HPLC法测定清热镇咳糖浆中白花前胡甲素的含量[J].广东药学院学报,2014,30(1):57-59.
[12]代丽萍,李汉伟,董诚明.HPLC法测定不同产地白花前胡中白花前胡甲素的含量 [J].中国中医药现代远程教育,2010,8(11):258-259.
[13]杨红兵,陈科力,余婕婧,等.前胡药材的质量状况考察[J].中国药房,2012,23(39):3 701-3 702.
Simultaneous Content Determination of Praeruptorin A and Praeruptorin B in Zhike Tablets by HPLC
Zhao Wanqing,Qi Jihong
(Huaibei Food and Drug Inspection Center,Huaibei,Anhui,China 235000)
Objective To establish an HPLC method for the simultaneous content determination of praeruptorin A and praeruptorin B in Zhike Tablets.Methods Agilent ZORBAX SB C18column(250 mm×4.6 mm,5 μm)was used.The mobile phase was methanol-water (77∶23).The detection wavelength was 321 nm,the flow rate was 1.0 mL/min and the injection volume was 10 μL.Results The linear range of praeruptorin A was 21.98-219.8 mg/L(r=0.999 5),and the linear range of praeruptorin B was 5.895-58.95 mg/L (r=0.999 9).The average recovery rate of praeruptorin A were 100.75%(n=9),RSD=1.44%;the average recovery rate of praeruptorin B was 99.11%(n=9),RSD=1.68%.Conclusion The method is simple,accurate,stable and high sensitive,which is suitable for the quality control of praeruptorin A and praeruptorin B in Zhike Tablets.
HPLC;Zhike Tablets;praeruptorin A;praeruptorin B
R284.1;R286.0
A
1006-4931(2016)21-0060-04
2016-07-28)

