妊娠合并急性白血病化疗缓解后行异基因造血干细胞移植术后长期缓解2例
王晓刚 彭也 宋晓露 蓝建平
妊娠合并急性白血病化疗缓解后行异基因造血干细胞移植术后长期缓解2例
王晓刚 彭也 宋晓露 蓝建平
急性髓细胞白血病(acute myeloid leukemia,AML)是一种具有高度异质性的疾病群,不同分型的AML具有不同的生物学特征[1-2]。AML的发病率约占全部急性白血病的70%,患者完全缓解率仅为50%~70%。AML起病急骤、进展迅速,病情凶险,严重威胁患者健康。妊娠合并AML较为罕见,在孕妇中发生率为1.0/10万[3-4],对妊娠合并白血病患者的治疗既不能延误白血病的治疗,同时又必须考虑对胎儿的影响,给临床治疗方案和药物的选择带来诸多的难题。异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,Allo-HSCT)治疗白血病已有60余年历史,能明显改善患者的预后并潜在治愈白血病。笔者在临床上遇到2例妊娠合并急性白血病患者,经化疗缓解后行Allo-HSCT获得长期生存,现结合文献复习报道如下。
1 资料和方法
1.1 病例介绍例1 患者女,25岁。因“孕7+个月,气急1个月,发热、咽痛伴咳嗽3d”入院。查体:重度贫血貌,胸骨压痛(+),两肺呼吸音粗,两肺闻及湿性啰音,腹膨隆如7个月大,胎心率160次/min。入院诊断:(1)AML-M2a;(2)孕7+个月;(3)肺部感染。染色体核型46,XX,融合基因AML/ ETO-。在严密胎儿监测情况下予DA方案(柔红霉素40mg/m2,d1~3;阿糖胞苷150mg/d,d1~7)化疗。化疗后骨髓抑制,肺部感染加重,经亚胺培南西司他丁钠、万古霉素、氟康唑等抗细菌、抗真菌及粒细胞集落刺激因子(G-CSF)升白细胞及营养等对症支持治疗,病情好转。复查骨髓常规提示白血病缓解,原始粒细胞2%。患者于孕35+周行剖宫产术,手术顺利,娩出一男性活婴,体重2 240g,Apgar评分10分,体检未见畸形。患者产后再次入院化疗时肺部CT检查发现右肺感染伴空洞形成,多次痰培养示肺炎克雷伯菌肺炎亚种,予头孢哌酮舒巴坦抗炎7周后复查CT示肺部感染基本吸收。随后继续化疗2个疗程,大剂量阿糖胞苷(4.5g/d,d1、3、5)和MA方案(米托蒽醌10mg/m2,d1~3;阿糖胞苷150mg/d,d1~7)各1个疗程。每次化疗前给予甲氨蝶呤+阿糖胞苷鞘内注射预防中枢神经系统白血病。
例2 患者女,29岁。因“停经32+周,皮肤瘀斑1个月,头晕乏力4d”入院。入院诊断:AML-M4,染色体46,XX,融合基因CBFB/MYH11-。予DA方案化疗,复查骨髓常规提示部分缓解:原始+幼稚细胞15%,随后行剖宫产术,手术顺利,娩出一男性活婴,体重3 080g,Apgar评分10分。患者产后再予IA方案(伊达比星8mg/m2,d1~3;阿糖胞苷150mg/d,d1~7)化疗3个疗程,每次化疗前给予甲氨蝶呤10mg+阿糖胞苷50mg鞘内注射预防中枢神经系统白血病。
2例患者完成上述巩固、强化治疗后行Allo-HSCT。
1.2 方法
1.2.1 造血干细胞的动员及采集 采用G-CSF 7.5μg/(kg·d)皮下注射4~5 d进行造血干细胞动员,第4~5天以血细胞分离机采集外周血干细胞。例1外周血造血干细胞由中华骨髓库捐赠中心提供,HLA配型5.5/6位点相合,A亚位点不合,造血干细胞数量:单个核细胞(MNC)6.05×108/kg,CD34+细胞4.86×106/kg。例2外周血造血干细胞采自胞弟,HLA配型10/10位点相合,造血干细胞数量MNC为4.99×108/kg,CD34+细胞数为3.47× 106/kg。
1.2.2 预处理方案 2例患者均采用经典Bu+Cy预处理方案,即马利兰3.2mg/(kg·d)静脉输注×4d,-7d至-4d;环磷酰胺60mg/(kg·d)静脉输注×2d,-3d,-2d。
1.2.3 移植物抗宿主病(GVHD)的预防 例1采用短程MTX方案,环孢素A 5mg/(kg·d)从-7d开始,霉酚酸酯0.5 g/d,分2次口服,+1d至+28 d,然后减量,短期内停药,甲氨蝶呤10 mg/d分别在+1、+3、+6d应用。例2采用经典环孢素A联合短程MTX预防GVHD。
1.2.4 其余并发症的防治及支持治疗 患者移植前全面体检,清除口腔,耳鼻道,咽,肛周及呼吸道等感染灶;1∶2 000的氯己定药浴后进入百级层流洁净室,无菌饮食,口服肠道吸收抗生素,加强营养支持治疗。环磷酰胺当日始使用美司钠,并予水化,间断利尿,碱化尿液,使尿pH值维持在7~8以预防出血性膀胱炎。静脉前列腺素E1脂质微球预防肝静脉阻塞病(VOD)。更昔洛韦预防巨细胞病毒感染,复方新诺明预防卡氏肺孢子虫感染,丙戊酸钠预防癫痫。根据血常规情况给予成分输血治疗,维持血红蛋白≥70g/L、血小板≥20×109/L,所用血制品均经白细胞过滤及辐照后输注。
1.3 主要观察指标 移植后造血重建检测、移植后治疗疗效及随访、移植相关并发症及临床转归。
2 结果
2.1 移植后造血重建 2例患者均获得造血重建。例1移植后中性粒细胞绝对值增长超过0.5×109/L所需时间为13d,血小板增长超过20×109/L所需时间为16d。例2分别为11d和14d。患者移植后血型检查、短串联重复序列结合聚合酶链反应(STR-PCR)检测为完全供者型。2.2 移植相关并发症 例1患者+10 d出现皮疹,考虑皮肤Ⅱ度急性GVHD,予甲强龙、霉酚酸酯等多种药物治疗后皮疹消退。例2患者未见GVHD表现。2例均无VOD、巨细胞病毒感染等并发症出现,详见表1。
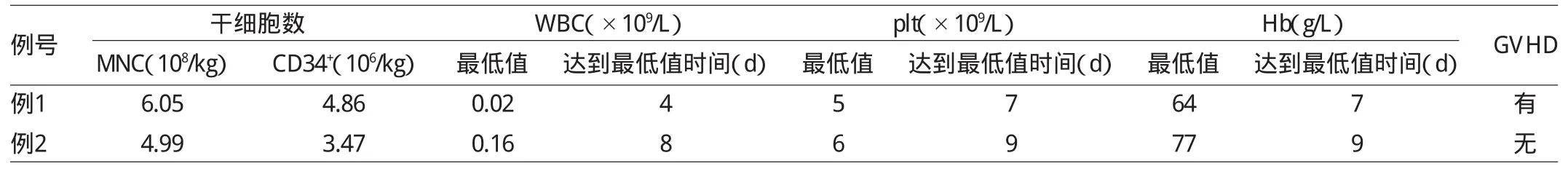
表1 患者移植结果和并发症观察
2.3 随访 随访自造血干细胞回输开始至2016年1月1日,2例患者均无病生存,时间分别为85、66个月,定期复查血常规及骨髓象未见异常,未出现慢性GVHD。2例患者所生男婴均生长发育正常,年龄分别为7、5岁,智力与同年儿童相仿。
2.4 临床转归 DNA多态性检查2例患者均转为供者型骨髓(完全嵌合),提示植入成功,患者均恢复正常工作生活。
3 讨论
妊娠期合并白血病临床表现与普通白血病无异,但由于其少见,妊娠反应又掩盖了部分白血病的症状与体征,常导致诊断延误。白血病对妊娠有明显损害,对母儿危害较大,主要表现为:(1)白血病患者常伴有血细胞异常,如贫血、血小板减少、白细胞过多及感染等情况,患者在孕期和围生期发生弥漫型血管内凝血(DIC)、颅内出血、产后出血、败血症、脑栓塞的风险明显增加。(2)患者合并病理性妊娠的机会增多,如妊高征,胎盘早剥、先兆流产等。(3)白血病容易导致胎盘机能不足,加上白血病治疗,患者发生流产、胎儿宫内生长迟缓、胎儿畸形、死胎、早产等的概率明显增加。综合文献报道[5-7],妊娠合并白血病的患者诊断后宜尽早治疗,拖延治疗反而容易导致患者病情恶化,丧失治疗机会,增加病死率,对胎儿也造成不利影响。
妊娠期合并白血病患者的治疗应根据不同的孕期采取不同的对策,目前主张早期妊娠合并白血病者应中止妊娠,中、晚期妊娠者联合化疗对胎儿影响较小,可化疗同时继续妊娠。化疗方案可选择AML的标准化疗方案(柔红霉素+阿糖胞苷)[4]。如果临近分娩时进行化疗可能造成新生儿全血细胞减少,所以建议患者化疗结束3周后分娩[4,8]。Avilés等[9]对84例母亲妊娠期间接受了化疗的儿童进行了长期随访,随访内容包括生长发育、神经发育、性成熟、生育能力、学习能力等方面,该研究认为化疗对子代没有影响。Cardonick等[10]也得出了类似的结论,认为母亲孕中晚期接受化疗的子代同正常人群没有区别。但有些学者持不同意见,Reynoso等[11]对58例合并急性白血病的妊娠患者(39例AML,19例急性淋巴细胞白血病)进行分析,共有53例母亲在孕期接受了化疗,其子代中早产28例,低体重新生儿4例,1例患儿先天性畸形最后发展成神经母细胞瘤。本文报道2例患者均为妊娠中晚期合并急性白血病,诊断后予以抗白血病治疗,例1获得完全缓解,例2获得部分缓解,贫血、血小板减少、感染等症状纠正,为继续妊娠和后期剖宫产创造了条件,同时也保证了胎儿的正常发育。患者结束妊娠后获得足量化疗获得缓解。2例患者分别为AML-M2和AML-M4,染色体核型正常,融合基因阴性,属于中危,具有移植适应症,并且均找到合适供者。例1为A位点的亚位点不合的无关供者,例2供者为胞弟且全相合,经Allo-HSCT获得长期无病生存,获得临床治愈。她们的子代随访至今生长发育也均正常。
对于妊娠合并急性白血病的患者,应及时诊断、尽早开始联合化疗以提高缓解率和可能的治愈率。由于例数尚少,随访时间不够长,妊娠期间接受化疗对子代有无影响可能需要进一步的病例积累及长期随访才能得出结论。
[1] 肖中平.老年人急性髓系白血病的临床特点及疗效分析[J].中国医药指南,2013,11(14):250-251.
[2] 王晓桃,刘玲.成人急性淋巴细胞白血病诊治进展[J].实用肿瘤杂志, 2013,28(4):343-347.
[3] Shapira T,Pereg D,Lishner M.How I treat acute and chronic leukemia in pregnancy[J].Blood Rev,2008,22(5):247-259.
[4] Firas A S,Demeckova E,Mistrik M.Leukemia in pregnancy[J]. BratislLek Listy,2008,109(8):364-366.
[5] Dilek I,Topcu N,Demir C,et al.Hematological malignancy and pregnancy:a single-institution experience of 21 cases[J].Clin Lab Haematol,2006,28(3):170-176.
[6] Niedermeier D M,Frei-Lahr D A,Hall P D.Treatment of acute myeloid leukemia during the second and third trimesters of pregnancy[J].Pharmacotherapy,2005,25(8):1134-1140.
[7] Chelghoum Y,Vey N,Raffoux E,et al.Acute leukemia during pregnancy:a report on 37 patients and a review of the literature [J].Cancer,2005,104(1):110-117.
[8] Ali S,Jones G L,Culligan D J,et al.Guidelines for the diagnosis and management of acute myeloid leukaemia in pregnancy[J].Br J Haematol,2015,170(4):487-495.
[9] Avilés A,Neri N.Hematological malignancies and pregnancy:a final report of 84 children who received chemotherapy in utero[J]. Clin Lymphoma,2001,2(3):173-177.
[10] Cardonick E,UsmaniA,Ghaffar S.Perinataloutcomes of apregnancy complicated by cancer,including neonatal follow-up after in utero exposure to chemotherapy:results of an international registry[J].Am J Clin Oncol,2010,33(3):221-228.
[11] ReynosoEE,Shepherd FA,MessnerHA,etal.Acute leukemia during pregnancy:the Toronto Leukemia Study Group experience with long-term follow-up of children exposed in utero to chemotherapeutic agents[J].J ClinOncol,1987,5(7):1098-1106.
2016-04-20)
(本文编辑:胥昀)
310014 杭州,浙江省人民医院血液科
蓝建平,E-mail:lanjp@163.com

