最大尿流率变化值在判断术后尿道狭窄中的应用价值
王周 任黎刚 谢波 程一宁 张心男 撒应龙 徐月敏
最大尿流率变化值在判断术后尿道狭窄中的应用价值
王周 任黎刚 谢波 程一宁 张心男 撒应龙 徐月敏
尿流率检测是泌尿外科常用的检查方法[1],通常用于良性前列腺增生症(BPH)的检测,以提供患者排尿方面的客观数据[2]。此外,尿流率检测也是评估男性尿道狭窄疾病的常用方法[3]。长期以来,临床上一直将膀胱、尿道造影视为尿道狭窄诊断的金标准[4];但是这项检查操作复杂、对患者有创伤、对医务工作者有辐射损害、部分患者对碘剂过敏等,越来越限制了其在临床的推广[5]。最近一项系统文献复习表明,尿流率检测是判断尿道狭窄的最常用方法[6]。尿流率检测项目包括尿流曲线图、最大尿流率、平均尿流率、排尿量、排尿时间和达到最大尿流率的时间等指标[1],其中尿流曲线图、最大尿流率和排尿量被认为是最有价值的观察指标[7]。但在实际尿流率检测中,Erickson等[3]发现单独静态尿流率检测值往往不能真实反映尿道狭窄的发生情况。故笔者对尿道修复手术后尿道狭窄患者进行常规尿道造影和尿流率检测,分析最大尿流率变化值在判断术后尿道狭窄中的应用价值。
1 资料和方法
1.1 一般资料 选取浙江省立同德医院、上海市第六人民医院泌尿外科2011年3月至2014年11月行尿道成形术的93例患者手术资料。纳入标准:手术前后均进行尿流率检测,尿流总量≥150ml,术前经尿动力检测均排除神经源膀胱引起的排尿困难。年龄13~68(14.3±43.7)岁;尿道狭窄长度0.8~6.6(2.5±3.4)cm,术前最大尿流率0~13.7(11.2±0.8)ml/s,术前尿容量0~368(342.4±18.0)ml,术前排尿时间12~67(35±16)s。术后随访时间6~38(16.0±3.9)个月。修复尿道位置:后尿道57例,阴茎段和球部尿道33例,两者都有3例。修复手术类型:尿道端端吻合术66例,口腔黏膜替代24例,结肠黏膜替代3例。术前最大尿流率、尿容量及排尿时间均未因尿道狭窄长度、患者年龄或狭窄位置变化而改变(P<0.05)。
1.2 方法 术前常规行尿流率检测及尿道造影,见图1a-b,且所有患者术前均经历过尿道修复手术[8-9];术后留置导尿管4周后拔除,行术后尿道造影;3个月后定期随访,复查尿流率,顺行及逆行膀胱尿道造影,见图1c-d;半年后再次随访,仅检测尿流率,除非患者表现出排尿困难症状或尿流率检测提示梗阻,则再次行尿道造影。术前尿流率检查在经培训的护士指导下进行,测试前要求患者屏住尿液,以达到最大尿量,提高本研究的准确性。通过尿流率检测获得尿量、最大尿流率和平均尿流率,且记录到一条随时间推移的尿流曲线,其中尿量、最大尿流率和尿流形状均记录在内。
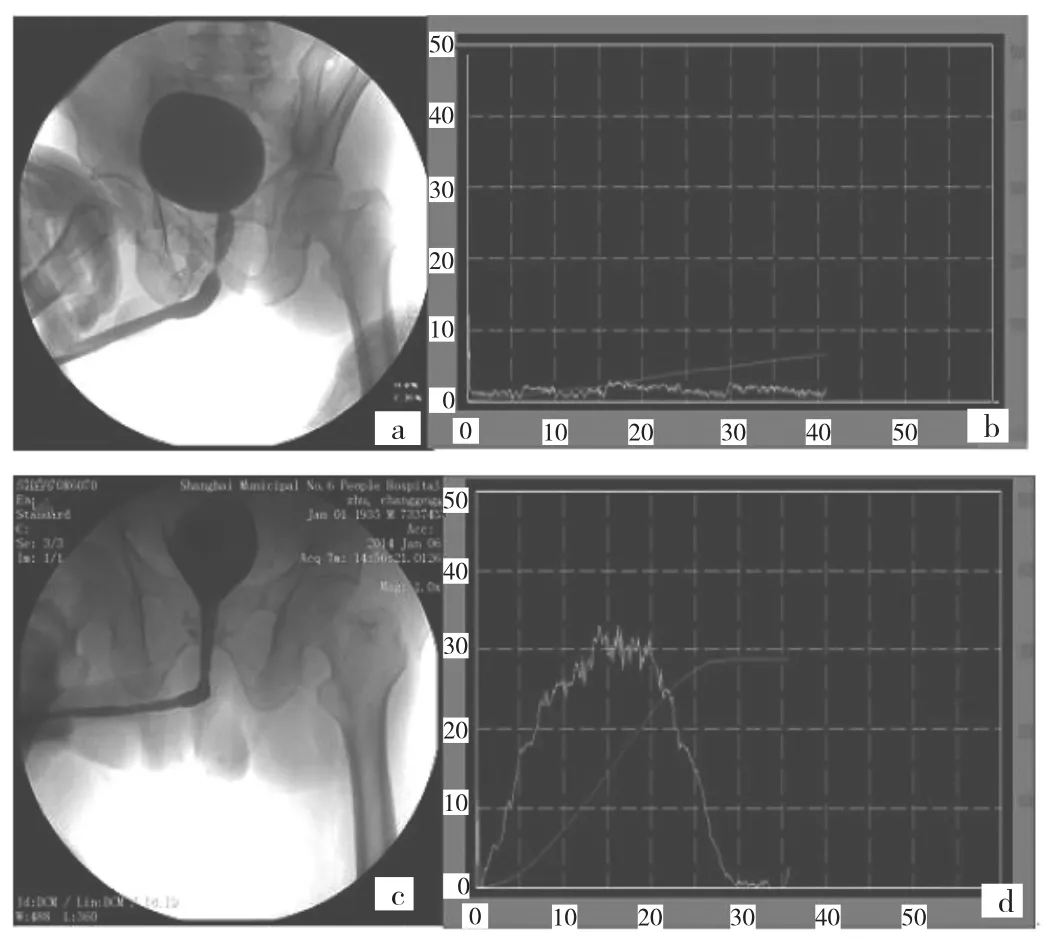
图1 术前尿道造影与尿流率图像(a-b:手术前,c-d:手术后)
1.3 统计学处理 应用SPSS 16.0统计软件。计量资料(最大尿流率、尿容量、排尿时间、尿道狭窄长度等)均符合正态分布,均用表示,手术前后比较采用配对t检验;并使用ROC曲线分析判别方法的准确性。
2 结果
2.1 尿道修复手术前后尿流率参数比较 尿道吻合术成功65例,膀胱顺行及逆行造影检查均未发现狭窄复发依据。术后最大尿流率由(11.2±0.8)ml/s明显提高到(22.6±1.3)ml/s(P<0.01),尿量容积亦由(342.4±18.0)ml提高到(363.9±16.3)ml(P<0.05),排尿时间由(35±16)s缩短至(23±9)s(P<0.01)。尿道造影检查发现术后再狭窄28例,最大尿流率[(11.2±0.8)、(10.6±7.2)ml/s]、尿量容积[(342.4±18.0)、(350.3±56.3)ml]手术前后比较差异均无统计学意义(P>0.05),但术后排尿时间由(35±16)s缩短至(29±22)s,差异有统计学意义(P<0.05)。
2.2 尿道修复手术前后最大尿流率变化值比较 尿道吻合术成功患者的最大尿流率变化值(手术前后最大尿流率差值)为(19.2±11.7)ml/s,明显高于不成功患者的(2.7±8.4)ml/s,差异有统计学意义(P<0.01)。
2.3 最大尿流率变化值截点值拟合的ROC曲线 当最大尿流率变化值=10ml/s时,特异度与灵敏度之和最大,此时最大尿流率变化值的对于尿道狭窄判别的准确性最强,灵敏度为92%,特异度为78%。AUC为0.922 25,与尿道顺行及逆行造影黄金标准比较,诊断符合率>90%。
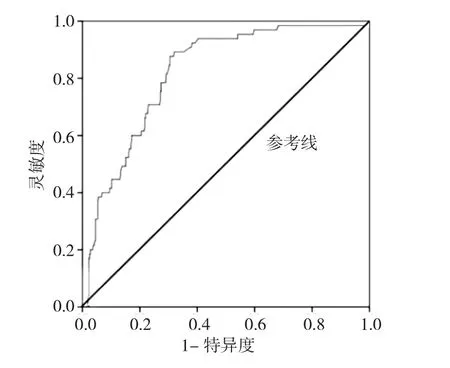
图2 根据最大尿流率变化值截点值拟合的ROC曲线
3 讨论
尿流率检测主要包括3个主要客观数据,即最大尿流率值、平均尿流率和总尿量[7]。目前就最大尿流率中能否诊断BPH真性梗阻已引起社会质疑,相关研究表明最大尿流率用于预测梗阻发生的灵敏度和特异度分别只有40%~60%和50%~90%[10]。外伤导致的尿道狭窄是一种常见疾病,常常需要治疗与术后随访观察[11-12]。尿流率检测一直被视为术后尿道狭窄最有价值的检查方式,然而国外Erickson等[3]研究发现,单一的尿流率数值不能可靠地评估尿道狭窄的发生,往往需要结合患者的临床症状及体征。
国外文献建议将最大尿流率<15ml/s作为筛查尿道狭窄的参考值[13],但实际中却存在大量尿道狭窄研究对象缺失的现象,如1例伴有BPH和尿道狭窄的患者通过尿道顺行及逆行造影证实尿道修复手术成功,但最大尿流率可能只有13ml/s。当单独使用这组数据时,可能考虑是尿路梗阻的尿流率值;与术前最大尿流率2ml/s比较,出现最大尿流率变化值11ml/s,提示排尿明显改善且可能是一次成功的手术。另一方面,1例尿道狭窄、膀胱正常健康且无BPH的年轻患者,术前最大尿流率可能18ml/s,行尿道修复手术后可能提高到20ml/s;单独考虑这组数据,可能认为是一次成功的尿道修复手术。然而最大尿流率变化值只有2ml/s,这个手术效果可能会被质疑。上述案例提示了在一个大样本里,静态的最大尿流率在设置尿道梗阻临界值时的局限性。Kelly等[7]发现尿流曲线、排尿总量等其他客观指标在预测尿道狭窄复发时均不如最大尿流率,笔者进一步研究发现影响静态尿流率参数的因素包括膀胱内在的收缩性、患者年龄和BPH梗阻程度等。
通过随访研究,笔者认为判断尿道修复手术成功与否的观察指标是最大尿流率变化值,而不是仅仅依靠静态的最大尿流率值比较[14]。本研究结果显示最大尿流率变化值>10ml/s时,尿流曲线明显提高,患者排尿困难症状明显改善;与尿道顺行及逆行造影黄金标准比较,诊断符合率>90%;以上提示最大尿流率变化值可作为尿道修复手术成功与否的参考值。临床实践中笔者发现狭窄复发的患者行尿道造影提示梗阻,但最大尿流率并无明显变化,这种吻合提示最大尿流率变化值可能是一种可行、无侵入性的诊断方法,可用于判断尿道修复手术成功与否。因此,长期随访检测尿流率是一种适用于尿道狭窄筛查的无创性方法[15];与静态的最大尿流率比较,最大尿流率变化值更能反映尿道狭窄患者排尿通畅情况,判别尿道狭窄情况等。
[1]Dheeraj K G,Satya N S,Apul G.Uroflowmetry Nomograms for Healthy Children 5 to 15 Years Old[J].J Urol,2013,190(3):1008-1013.
[2]Kang S C,Joo H K,Dong J K,et al.Relationship Between Prostatic Urethral Angle and Urinary Flow Rate:Its Implication in Benign Prostatic Hyperplasia Pathogenesis[J].Urology,2008,71(5):858-862.
[3]Erickson B A,Breyer B N,McAninch J W.The use of uroflowmetry to diagnose recurrentstricture afterurethral reconstructive surgery[J].J Urol,2010,184(4):1386-1390.
[4]El-Ghar M A,Osman Y,Elbaz E,et al.MR urethrogram versus combined retrograde urethrogram and sonourethrography in diagnosis ofurethralstricture[J].Eur J Radiol,2010,74(3):193-198.
[5]Osman Y,El-Ghar M A,Mansour O,et al.Magnetic resonance urethrography in comparison to retrograde urethrography in diagnosis of male urethral strictures:is it clinically relevant?[J].Eur Urol,2006,50(3):587-593.
[6]Meeks J J,Erickson B A,Granieri M A,et al.Stricture recurrence after urethroplasty:a systematic review[J].J Urol,2009,182(4): 1266-1270.
[7]Kelly C E.Evaluation of voiding dysfunction and measurement of bladder volume[J].Rev Urol,2004,6(Suppl1):S32-S37.
[8]Carney K J,Mc Aninch J W.Penile circular fasciocutaneous flaps to reconstruct complex anterior urethral strictures[J].Urol Clin North Am,2002,29(2):397-409.
[9]Santucci R A,Mario L A,Mc Aninch J W.Anastomotic urethroplasty for bulbar urethral stricture:analysis of 168 patients[J]. J Urol,2002,167(4):1715-1719.
[10]Belal M,Abrams P.Noninvasive methods of diagnosing bladder outlet obstruction in men.Part 2:noninvasive urodynamics and combination ofmeasures[J].J Urol,2006,176(1):29-35.
[11]Lumen N,Hoebeke P,Willemsen P,et al.Etiology of urethral stricture disease in the 21st century[J].J Urol,2009,182(3):983-987.
[12]Xu YM,Song LJ,Wang KJ,et al.Changing trends in the causes and management of male urethral stricture disease in China:an observationaldescriptive study from 13 centres[J].BJU Int,2015, 116(6):938-944.
[13]Barbagli G,Guazzoni G,Lazzeri M.One-stage bulbar urethroplasty:retrospective analysis ofthe results in 375 patients[J].Eur Urol,2008,53(4):828-833.
[14]Erickson B A,Breyer B N,Mc Aninch J W.Changes in uroflowmetry maximum flow rates after urethral reconstructive surgery as a means to predict for stricture recurrence[J].J Urol,2011, 186(5):1934-1937.
[15]Serge G,Wessels,Chris F.Prospective evaluation ofa new visual prostate symptom score,the international prostate symptom score,and uroflowmetry in men with urethralstricture disease[J]. Urology,2014,83(1):220-224.
2016-05-21)
(本文编辑:陈丹)
310012 杭州,浙江省立同德医院泌尿外科(王周、任黎刚、谢波、程一宁、张心男);上海市第六人民医院泌尿外科(撒应龙、徐月敏)
撒应龙,E-mail:sayinglong331@sina.com

