DCE-MRI在脑肿瘤临床诊治中的应用进展
韩苏阳 张佩佩
DCE-MRI在脑肿瘤临床诊治中的应用进展
韩苏阳 张佩佩
脑血管屏障(blood brain barrier,BBB)作为大脑的一个解剖和生理屏障,调整着中枢神经系统的渗透性,严格控制着通过毛细血管壁的分子,其完整性与中枢神经系统的疾病密切相关。脑肿瘤患者的BBB结构和功能均受到破坏,同时还伴有扭曲无序及高渗透性的肿瘤新生血管生成。应用T1加权成像的磁共振动态对比增强成像(dynamic contrast enhanced-MRI,DCE-MRI)可以提供微血管渗透性方面的信息,用来评估BBB功能的完整性,在脑肿瘤的鉴别诊断、分级、治疗监测、预后评估及跟踪随访等方面有广泛的应用。笔者就DCEMRI的基本原理、技术方法及在脑肿瘤临床诊治中的应用综述如下。
1 基本原理
BBB破坏时,低分子量的MRI对比剂可以通过BBB积聚在受累组织的血管外细胞外间隙(extravascular-extracellular space,EES),导致T1时间缩短和正性强化,DCE-MRI主要通过重复采集静脉注射对比剂后的T1加权图像,测量时间信号强度,通过药代动力学模型计算得出相关的微循环参数。
2 技术手法
2.1 图像采集 由于所测量的信号强度和对比剂浓度的关系是非线性的,所以需要在获得动态增强图像前先采集基线的T1图,来建立药代动力学模型[1]。最常用的扫描技术是多角度翻转梯度回波,反向或饱和恢复技术也有应用[2-3]。在几分钟之内迅速重复采集T1加权图像,贯穿团注对比剂之前、期间及之后。最常用的是梯度回波序列(SPGR、MPRAGE、VIBE),可以提供良好的时间分辨率、扫描范围和T1敏感度[4],尽管2D序列也可用于动态增强,但更多的还是选用3D序列,因为其信噪比更好且失真较少。
动态扫描采集时间至少3~5min,最佳时间分辨率在3.5~6s,推荐的矩阵为128×128,层厚根据扫描范围不同选择2~7mm。为了提高时间及空间分辨率,可以运用平行成像方法或其他采样方法。
2.2 对比剂注射方法 DCE扫描开始后20s内开始团注对比剂,来建立增强前的基线。用高压注射器通过外周静脉注射对比剂,速率2~5ml/s,完成后给予相同速率生理盐水冲洗。推荐对比剂剂量为0.1mmol/kg。
2.3 图像处理 药代动力学模型最早出现于90年代初,随着成像技术的提升和生理功能研究的发展,更多更复杂的药代动力学模型被研究出来,本文仅阐述3种最常用的药代动力学模型。
标准Tofts-Kety模型是一个单室模型,造影剂从其他血管流入后,进入到一个均匀混合的组织空间内,即认为毛细血管内容积Vp可被忽略(Vp=0)。因此标准Tofts-Kety模型只包含容积转运速率 Ktrans和细胞外间液容积Ve 2个参数,而回流速率Kep可以由Kep= Ktrans/Ve推倒得出[5]。
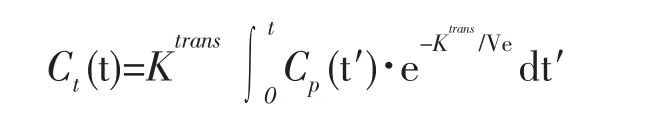
在脑部血脑屏障破坏的情况下,Vp可能很小(Vp 0),但在脑肿瘤的情况下,这个假设可能不成立。为解决这个问题,Extended Tofts-Kety模型被引入,即Vp项被考虑[6]。

Patlak可以认为是Extended Tofts-Kety模型的一个简化,即假设从EES到毛细血管内的回流速率Kep可被忽略,这个在低渗透性或者首过模型(回流还未开始)里是可行的[7]。

以上的模型均需要一个动脉输入函数(AIF),理想的AIF应该是在每次检查的感兴趣组织的局部动脉上测量,但是精确测量比较困难,许多研究组采用的是基于人群平均AIF得到的一个理想化的数学函数。
3 临床应用
3.1 脑肿瘤的鉴别诊断 传统MRI成像在鉴别一些肿瘤与非肿瘤疾病时比较困难,例如均表现为边缘环形强化脑脓肿与囊性脑肿瘤,肿瘤样脱髓鞘病变与胶质瘤等,一些研究表明肿瘤的Ktrans值和Ve值较高,非肿瘤的疾病Ktrans值和Ve值较低,有助于这类鉴别[8]。
3.2 胶质瘤分级和预后 组织病理学是胶质瘤分级的金标准,但其存在一定的采样误差,且一些肿瘤会进展,所以用组织活检来监测肿瘤发展是不切实际的。而脑肿瘤BBB破坏程度、肿瘤新生血管和肿瘤的级别相关,目前很多关于脑肿瘤的渗透率与肿瘤级别、预后相关的研究,提出可以将DCE-MRI作为一项影像生物学标记[9-13]。Nguyen等[10]证明用Ktrans来区别低级别胶质瘤与高级别胶质瘤敏感度和特异度>90%。Cao等[11]证明血管渗透率在预测高级别胶质瘤的肿瘤进展和生存率方面要好于形态学特征,Ktrans和疾病进展时间相关。Dhermian等[12]证明在低级别胶质瘤中,有微血管渗漏的无进展生存期较差;Jain等[13]评估了肿瘤的渗透率和相对脑血容量(rCBV),证实渗透率及血容量更高的高级别胶质瘤总体生存率较差,提出肿瘤的微血管参数可能在预测高级别胶质瘤生存率方面比病理学分级更好。
3.3 引导肿瘤活检、手术和放疗 肿瘤活检和放射手术常以T1增强图像作为参考,而肿瘤的最恶性区域可能不在胶质瘤的强化区域内,此时应用DCE-MRI技术,通过后处理可以得到病变的主要渗透性参数图像,勾画感兴趣区,取得相应区域的Ktrans值,通过Ktrans值的高低来判定肿瘤的恶性程度,DCE-MRI就能够指导外科医师找到肿瘤新生血管最多以及恶性程度最高的部分,还可在术中评估切除范围[14]。
3.4 脑肿瘤治疗的监测 脑肿瘤有多种不同组合的治疗方式,导致随访的MRI表现复杂难辨,常规增强MRI常难以区分残留/复发肿瘤和肿瘤治疗后改变:如放疗引起的坏死,假性进展-联合放化疗引起的早期坏死以及应用抗血管生成药物后的疗效监测。(1)放射性坏死:局部组织对放疗的一个严重反应。通常发生于放疗后的3~12个月,但也可发生在数年或数十年后。常规T1增强很难鉴别放射性坏死和肿瘤复发,但两者的微血管循环存在差异,复发肿瘤由于肿瘤的新生血管,故血容量和渗透性较高,相反放射性坏死由于血管透明变和凝固性坏死,导致局部灌注不足。一些DCE-MRI的研究证实Ktrans有助于鉴别放射性坏死和肿瘤复发[15-16]。(2)假性进展:高级别的胶质瘤经过结合替莫唑胺的联合放化疗后出现肿瘤强化区域增大,与肿瘤进展表现类似。常见于放疗-替莫唑胺的联合治疗后,也可见于单独放疗后。大约有20%的放疗-替莫唑胺联合治疗的患者会出现,通常见于治疗后的2~6个月[17-18]。DCE-MRI可以精确描述病灶的微血管循环和血管的渗透性,有望作为一种鉴别方法,而目前一些DCE-MRI的半定量研究结果也比较满意[19]。(3)抗血管生成药物的疗效监测:目前抗血管生成药物在脑肿瘤的治疗中运用得越来越多,特别是高级别肿瘤的复发患者[20]。应用抗血管生成药物后肿瘤病灶强化迅速减弱,但强化减弱可能是由于局部血管减少而并不一定是抗肿瘤的效应[21]。有些患者虽然MRI没有显示肿瘤的强化区域增加,但实际临床过程中疾病却在进展[20]。所以关于肿瘤渗透率来监测抗血管生成药物的治疗效果的研究也在增多。Batchelor等[21]证明在接受血管内皮生长因子(VEGF)受体酪氨酸激酶抑制剂治疗的患者中,Ktrans有助于预测肿瘤血管正常化。Lacerd等[22]研究表明,如果患者对贝伐单抗出现真性反应,那么rCBV和渗透率会降低。随后Sorensen等[23]证实早在西地尼布治疗后的第1天出现Ktrans变化的胶质母细胞瘤复发患者治疗效果较好。同样,对接受治疗的患者测量Ktrans值有助于预测肿瘤复发或进展,即Ktrans值明显增加可以间接说明肿瘤新生血管增加,肿瘤恶性程度进展。
4 DCE-MRI的不足
尽管DCE-MRI技术已发展了20余年,但迄今为止没有标准的扫描程序和统一的计算模型,目前关于DCE-MRI的文献报道的图像扫描方案、数据分析各不相同;另外,药代动力学的分析和动态数据的处理非常复杂,而且目前存在相当多的计算模型[24],要分析其参数的具体可用性,导致其临床应用有限。
DCE-MRI提供的一些渗透性参数可以反映BBB的功能完整性和渗透率,能够提供脑肿瘤的功能信息,特别是在脑肿瘤的诊治过程中应用较多。然而,为了临床上更广的应用,需要建立标准的扫描程序和统一的计算模型。
[1]Evelhoch J L.Key factors in the acquisition of contrast kinetic data for oncology[J].J Magn Reson Imaging,1999,10:254-259.
[2]Gowland P,Mansfield P,Bullock P,et al.Dynamic studies of gadolinium uptake in brain tumors using inversion-recovery echo-planar imaging[J].Magn Reson Med,1992,26:241-258.
[3]Parker G J,Suckling J,Tanner S F,et al.Probing tumor microvas-cularity by measurement,analysis and display of contrast agent uptake kinetics[J].J Magn Reson Imaging,1997,7:564-574.
[4]Brookes J A,Redpath TW,Gilbert F J,et al.Accuracy of T1 measurement in dynamic contrastenhanced breast MRI using twoand three-dimensionalvariable flip angle fast low-angle shot[J].J Magn Reson Imaging,1999,9:163-171.
[5]Tofts P S,Kermode A G.Measurement of the blood-brain barrier permeability and leakage space using dynamic MR imaging.1. Fundamentalconcepts[J].Magn Reson Med,1991,17:357-367.
[6]Tofts P S.Modeling tracer kinetics in dynamic Gd-DTPA MR imaging[J].J Magn Reson Imaging,1997,7:91-101.
[7]Patlak C S,Blasberg R G.Graphicalevaluation of blood-to-brain transfer constants from multiple-time uptake data.Generalizations[J].J Cereb Blood Flow Metab,1985,5(4):584-590.
[8]Haris M,Gupta R K,Singh A,et al.Differentiation of infective from neoplastic brain lesions by dynamic contrast-enhanced MRI[J]. Neuroradiology,2008,50:531-540.
[9]Roberts H C,Roberts T P,Brasch R C,et al.Quantitative measurement of microvascular permeability in human brain tumors achieved using dynamic contrast-enhanced MR imaging:correlation with histologic grade[J].Am.J.Neuroradiol,2000,21:891-899.
[10]Nguyen TB,Cron G O,Mercier J F,et al.Diagnostic Accuracy of Dynamic Contrast-Enhanced MR Imaging Using a Phase-Derived Vascular Input Function in the Preoperative Grading of Gliomas[J].AJNR Am J Neuroradiol,2012,33(8):1539-1545.
[11]Cao Y,Nagesh V,Hamstra D,et al.The extent and severity of vascular leakage as evidence of tumor aggressiveness in high-grade gliomas[J].Cancer Res,2006,66:8912-8917.
[12]Dhermain F,Saliou G,Parker F,et al.Microvascular leakage and contrast enhancement as prognostic factors for recurrence in unfavorable low-grade gliomas[J].J.Neurooncol,2010,97(1): 81-88.
[13]Jain R,Narang J,Griffith B,et al.Prognostic vascular imaging biomarkers in high-grade gliomas:tumor permeability as an adjunct to blood volume estimates[J].Acad.Radiol,2013,20(4): 478-485.
[14]Ulmer S.Intraoperative perfusion magnetic resonance imaging: Cutting-edge improvement in neurosurgical procedures[J]. World J Radiol,2014,6(8):538-543.
[15]Hazle J D,Jackson E F,Schomer D F,et al.Dynamic imaging of intracraniallesions using fast spinecho imaging:differentiation of brain tumors and treatment effects[J].J Magn Reson Imaging, 1997,7:1084-1093.
[16]Bisdas S,Naegele T,Ritz R,et al.Distinguishing recurrent high-grade gliomas from radiation injury:a pilot study using dynamic contrastenhanced MR imaging[J].Acad.Radiol,2011,18: 575-583.
[17]Clarke J L,Chang S.Pseudoprogression and pseudoresponse: challenges in brain tumor imaging[J].Curr NeurolNeurosciRep, 2009,9:241-246.
[18]Hygino da Cruz LC Jr,Rodriguez I,Domingues R C,et al.Pseudoprogression and pseudoresponse:imaging challenges in the assessment of posttreatment glioma[J].AJNR Am J Neuroradiol, 2011,32:1978-1985.
[19]Jain R,Narang J,Arbab S A,et al.Role of non-model-based semi-quantitative indices obtained from DCE T1 MR perfusion in differentiating pseudoprogression from true-progression[J]. Neuro Oncol,2011,13:140.
[20]Norden A D,Drappatz J,Muzikansky A,et al.An exploratory survivalanalysis of anti-angiogenic therapy for recurrent malignant glioma[J].J Neurooncol,2009,92:149-155.
[21]Batchelor T T,Sorensen A G,di Tomaso E,et al.AZD2171,a pan-VEGF receptor tyrosine kinase inhibitor,normalizes tumor vasculature and alleviates edema in glioblastoma patients[J]. Cancer Cell,2007,11:83-95.
[22]Lacerda S,Law M.Magnetic resonance perfusion and permeability imaging in brain tumors[J].Neuroimaging Clin N Am,2009, 19:527-557.
[23]Sorensen A G,Batchelor T T,Zhang W T,et al.A"vascular normalization index"as potential mechanistic biomarker to predict survivalafter a single dose ofcediranib in recurrent glioblastoma patients[J].Cancer Res,2009,69:5296-5300.
[24]Bergamino M,Bonzano L,Levrero F,et al.A review of technical aspects of T1-weighted dynamic contrast-enhanced magnetic resonance imaging(DCE-MRI)in human brain tumors[J].Phys Med,2014,30(6):635-643.
2015-12-24)
(本文编辑:马雯娜)
310002 杭州市肿瘤医院核医学科

