双源CT肺灌注血池容积成像诊断外周性肺栓塞的价值研究
单嫣娜 沈起钧 杨斌 陈文辉
双源CT肺灌注血池容积成像诊断外周性肺栓塞的价值研究
单嫣娜 沈起钧 杨斌 陈文辉
目的 探讨双源CT肺灌注血池容积(PBV)成像对于外周性肺栓塞的诊断价值。方法 对临床诊断肺栓塞的57例患者分别行CT肺动脉造影(CTPA)、肺段PBV成像及肺核素灌注显像(SPECT),所得图像以肺段为评价单位,计算肺段PBV成像灌注兴趣区的平均CT值,CTPA所得的栓塞肺段数、位置,SPECT灌注评分;所得肺段PBV成像结果分别与CTPA及SPECT结果进行相关性分析,对肺段PBV成像平均CT值进行ROC曲线分析。结果 存在肺栓塞的肺段PBV成像平均CT值(16.70±3.34)Hu,低于无肺栓塞肺段(28.8±4.62)Hu,差异有统计学意义(t=37.3,P<0.01)。PBV成像平均CT值与CTPA所得的栓塞肺段数呈正相关(r=0.44,P<0.01),PBV成像平均CT值与SPECT肺栓塞灌注评分呈正相关(r=0.72,P<0.01)。ROC曲线分析提示PBV成像定量分析对肺栓塞具有良好的诊断效能,曲线下面积(AUC)为0.932。当PBV成像平均CT值<23.9Hu临界值时,诊断肺栓塞的灵敏度、特异度、阳性预测值、阴性预测值分别为95.5%、86.9%、66.1%、98.6%。结论 双源CT肺PBV成像可提高外周性肺栓塞诊断的灵敏度和特异度。
外周性肺栓塞 体层摄影术 X线计算机 肺灌注 肺动脉造影 放射性核素显像
肺栓塞是以各种栓子阻塞肺动脉系统为其发病原因的一组疾病或临床综合征的总称[1-2]。肺栓塞被认为是心血管系统最常见的致死原因之一[3]。肺动脉主干分支血管栓塞至今已得到临床广泛认识及重视,且CT肺动脉造影(CTPA)目前已被公认为诊断肺栓塞有效且特异性较高的方法,可以媲美视为金标准的肺核素灌注显像(SPECT)[4],但是单纯的CTPA仅仅能够诊断肺段动脉(4级)及以上肺动脉的栓塞,而对亚段及以下(5~6级)肺动脉栓塞诊断效果不理想[5],有可能造成漏诊。近年来随着双源CT新技术的出现,双源CT肺灌注血池容积(PBV)成像提高了肺外周性血管栓塞的检出率[6]。本研究主要通过对肺外周血管栓塞肺段PBV成像的平均CT值进行统计,分析其与CTPA、SPECT结果的关系,探讨双源CT肺PBV成像对外周性肺栓塞的诊断价值,现报道如下。
1 资料和方法
1.1 一般资料 选择2012年5月至2015年5月入住本院且临床确诊为肺栓塞的患者57例,其中男36例,女21例,年龄22~71(57.6±16.2)岁。临床表现:咳嗽49例,胸腹痛40例,咯血27例,呼吸困难10例,烦躁不安及晕厥3例。其中下肢静脉血栓形成9例(均有单侧或双侧下肢水肿),肿瘤癌栓栓塞4例,骨折致脂肪栓塞2例。所有患者血液中D-二聚体阳性,7例患者出现血压下降。
1.2 方法 使用德国西门子 Somatom Definition双源CT机DE-Thorax扫描序列行胸部增强双能量扫描,得到CTPA及PBV图像,并于2~4d内进行SPECT检查。
1.2.1 CTPA图像采集 双源CT机2个球管的管电压分别为80、140kV,使用4D剂量实时控制系统降低辐射剂量,一个管球视野为50cm,另一个为26cm。X线球管旋转时间为0.33s/周,螺距为0.5,探测器准直为64× 0.6mm。对比剂选用优维显(370mg/ml),双筒高压注射器以4ml/s的注射速率经肘静脉团注对比剂70~90ml,随后按相同速率注射0.9%氯化钠溶液30ml以尽量减少上腔静脉内对比剂的残留。应用人工智能触发扫描系统进行监测,将监测区设在肺动脉主干,当其密度达到100Hu时,再延迟6s后自动启动扫描。扫描方向为头足方向,范围自肺尖到肺底。扫描结束后,原始图像数据按照1.0mm的层厚进行重建,分别得到80、140kV及两者按3∶7比例融合的3组CTPA图像。
1.2.2 PBV图像后处理 在后处理工作站打开Dual-Energy软件,将80、140kV的图像数据调入软件内,点击双能量肺灌注成像(Lung PBV)选项则得到伪彩色编码的3D双能量肺灌注图像。肺灌注伪彩图选择灰阶8bit和Hot Body 8bit。
1.2.3 SPECT检查方法 行SPECT检查时嘱患者仰卧位,静脉注射99mTc-聚合白蛋白(MAA,原子高科北京奶站提供),185~370MBq。嘱患者双臂抱头,使探头尽量贴近胸部。显像取8个体位,即前位、后位、左侧位、右侧位、左后斜位、右后斜位、左前斜位和右前斜位。采集条件:将双肺同时包括在探头视野内,选用低能高分辨率准直器,每个体位采集计数为5×105,采集矩阵256× 256,窗宽20%,放大倍数1.5。
1.2.4 数据分析及诊断标准 由2位经验丰富的放射诊断医师在工作站独立分析CTPA及PBV图像。图像经过严格筛选,对于兴趣区出现伪影,影响诊断者予以排除。CTPA图像观察两肺叶、段及亚段动脉的充盈情况,对比剂充盈良好的情况下,增强肺动脉的管腔内出现充盈缺损、管腔狭窄或梗阻即诊断为肺栓塞。对每例患者的18个肺段分别选取兴趣区测量肺段PBV成像平均CT值(图1)。SPECT图像由另2位高年资核医学医师独立分析,结果不一致时共同讨论得出统一意见。SPECT图像参照PIOPED标准诊断肺栓塞[7-8],0=正常肺段,1=肺栓塞呈低度可能的肺段,2=肺栓塞呈中度可能的肺段,3=肺栓塞呈高度可能的肺段;2和3为阳性,0和1为阴性。2位医师诊断不一致时共同阅读判定最终结果。57例患者除3例为支气管炎、肺气肿、肺间质纤维化、胸腔积液,双肺均表现为弥漫灌注降低,未纳入统计,其余54例患者以SPECT为金标准按有、无肺栓塞分组进行分析。

图1 CTPA与PBV融合图
1.3 统计学处理 应用SPSS V19统计软件,计量资料以表示,组间比较采用t检验。PBV成像所得肺段平均CT值与CTPA所得栓塞肺段数(如出现3级以上肺动脉栓塞记录其所发出的总肺段动脉数)及SPECT肺栓塞评分的相关性分析采用Pearson相关。ROC曲线分析肺段PBV成像平均CT值诊断肺栓塞的灵敏度、特异度、阳性预测值、阴性预测值。
2 结果
2.1 两组患者肺段PBV成像平均CT值比较 54例患者共有972个肺段和肺段动脉纳入分析,SPECT共检出肺段肺栓塞评分阳性203个(肺栓塞组),阴性769个(无肺栓塞组),肺栓塞组肺段PBV成像平均CT值(16.70±3.34)Hu,低于无肺栓塞组(28.8±4.62)Hu,差异有统计学意义(t=37.3,P<0.01)。
2.2 肺段PBV成像平均CT值与CTPA、SPECT诊断肺动脉栓塞的相关性分析 PBV成像检出肺栓塞肺段182个,无栓塞肺段790个;CTPA检出肺栓塞肺段194个,无栓塞肺段778个。肺段PBV成像平均CT值与CTPA、SPECT诊断肺动脉栓塞的相关性分析见图2-3。

图2 肺段PBV成像平均CT值与CTPA所得肺动脉栓塞肺段数的相关性分析散点图

图3 肺段PBV成像平均CT值与SPECT肺栓塞评分的相关性分析散点图
由图2、3可见,肺段PBV成像平均CT值与CTPA所得肺动脉栓塞肺段数、SPECT肺栓塞评分均呈正相关(r=0.441、0.717,均P<0.01)。
2.3 肺段PBV成像平均CT值的ROC曲线分析 见图4。

图4 肺段PBV成像平均CT值的ROC曲线图
由图4可见,肺段PBV成像平均CT值的ROC AUC为0.932(95%CI:0.912~0.953,P<0.05)。以肺段PBV成像平均CT值23.9Hu为评价临界值,诊断肺动脉栓塞的灵敏度、特异度、阳性预测值、阴性预测值分别为95.5%、86.9%、66.1%、98.6%。
2.4 典型病例分析
例1 患者男,56岁;胸闷3d。右下肺后基底段动脉内不完全性栓塞(图5细白箭头),PBV成像图示远端肺实质灌注异常(图6粗白箭头),兴趣区CT值约18.3Hu,对侧相应肺段视觉判断肺实质也出现灌注异常,兴趣区CT值约31.4Hu。SPECT发现右肺后基底段出现灌注降低,左肺后基底段未见明显灌注降低(图7)。
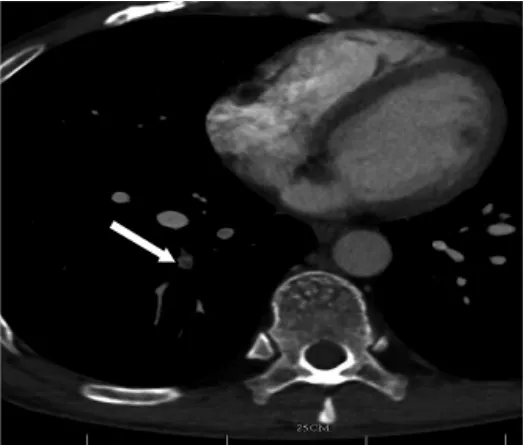
图5 CTPA原始轴位图

图6 PBV成像图
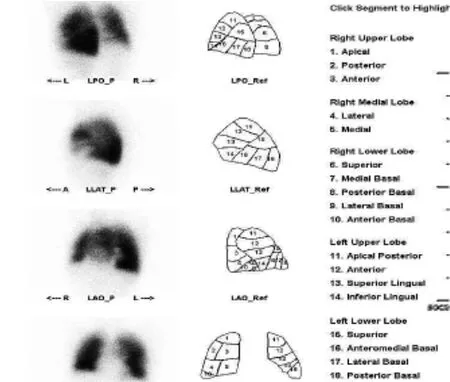
图7 SPECT图
例2 患者男,55岁;食管癌支架植入术后。左上肺前段肺动脉完全性栓塞(图8细白箭头)继发远端肺实质灌注缺损(图8粗白箭头),CT值约7.2Hu。
例3患者男,67岁;慢性支气管炎10余年,再发胸闷、气急3d。右上肺尖后段肺动脉完全性栓塞(图9细白箭头),远端肺实质内灌注异常(图9粗白箭头)。

图8 CTPA与PBV成像融合图
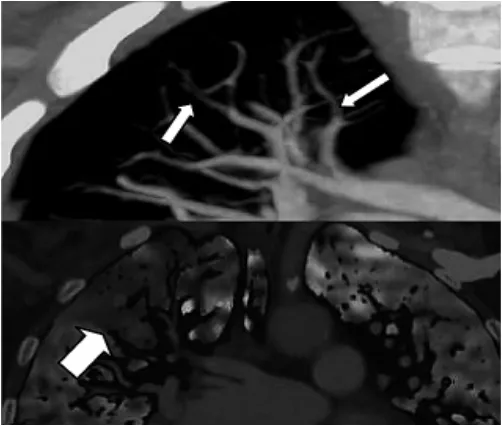
图9 CTPA图、CTPA与PBV成像融合图
3 讨论
CT肺动脉成像由于准确度较高,灵敏度达87.0%~90.0%,特异度达94.0%~96.0%,已取代肺动脉造影,成为诊断急性肺栓塞的主要手段[9],但是单纯的CTPA仅仅能够诊断4级肺动脉栓塞,而对于5~6级以下的肺动脉栓塞诊断无能为力[5],难以提供肺的功能信息,对周边肺组织较小范围的栓塞仍然无法显示,单纯依据CTPA判断肺栓塞容易造成漏诊。传统的肺CT灌注成像对于某一层面进行动态的CT扫描,以获得兴趣区的时间-密度曲线,根据曲线通过不同的数学模式计算出器官血流量,对比剂平均通过时间及达峰时间,用以评价局部组织的血流灌注量的改变,提供肺的供能信息[10]。然而目前CT灌注成像不易推广及统一的原因是由于在CT扫描方法、CT灌注值算法、CT灌注指标的评价因所用机型、参数则不尽相同,而存在诸多的不统一,而且CT肺动脉成像及灌注成像不能同时进行,这既增加了患者的检查时间同时增大了患者所受的放射剂量。
双源CT双能量成像在不重复增强扫描的前提下,一次扫描即可同时获得 CTPA、PBV及两者的融合图像,充分体现双源CT扫描速度快、范围大,时间、空间及密度分辨率高,提供全肺的薄层解剖信息并可进行多种后处理成像等诸多优势[6,11-12],特别对于肺分支小血管栓塞PBV成像能显示肺的灌注状态,直观地显示灌注减低的范围和程度[13],两者的融合图像将解剖信息和功能信息整合到一起,从而更加全面、准确评价肺小血管栓塞导致的肺血流受限程度及相应肺组织的功能改变,CT在同样噪声情况下双源一次扫描约(279±14)mGYcm,而单源CT肺动脉成像需要(573±11)mGYcm,其辐射剂量相当于单源CT的一半。
以往文献中对于肺段PBV成像往往基于视觉的评价,没有一个量化的过程[6,14-16]。这种方式往往受多种因素影响结果的判断,包括:后处理参数、操作员及诊断医师的主观判断。基于视觉评价(图5-7),两下肺均处于灌注缺损范围,然而量化后右下肺平均CT值约18.3Hu,左下肺平均CT值约31.4Hu,两者具有统计学差异,且SPECT显示右下肺有灌注降低,左下肺未见明显灌注降低,可见基于视觉的评价往往会出现假阳性或假阴性结果,缺乏客观性。
部分文献报道只基于整肺及肺叶的CT值量化[6,17],本次研究以肺段为评价单位进行细分,PBV图不仅可以显示极为典型的尖端指向肺门的缺损区(图8),而且能够通过PBV成像图回顾CTPA筛选出外周性血管的微小栓塞(图9)。结果显示肺动脉有无栓塞患者的肺段PBV成像平均CT值存在明显的统计学差异。肺段PBV成像平均CT值与CTPA所得肺动脉栓塞肺段数、肺段SPECT肺动脉栓塞评分均有相关性。ROC曲线分析肺段PBV成像平均CT值得出,当肺段PBV成像平均CT值<23.9Hu,诊断肺栓塞的灵敏度、特异度、阳性预测值、阴性预测值分别为95.5%、86.9%、66.1%、98.6%。
通过本次研究发现肺段PBV成像平均CT值在外周血管有无栓塞的患者中存在部分重叠的结果(图2、3),主要表现为“大栓子、小栓塞”及“小栓子、大栓塞”。前者表现为当肺动脉出现充盈缺损时,相应肺段以无明显灌注缺损为主。分析主要是肺组织分别由肺动脉及支气管动脉供血,因此一条供血通路受阻并不一定会引起肺组织灌注的减低,尤其是慢性肺栓塞患者,发病较缓慢有利于代偿机制的建立,因此可能并不引起严重心肺功能改变[18],肺PBV成像图反映了整肺的功能灌注情况,而非单纯肺动脉灌注情况。后者表现为远端肺实质内出现与栓塞程度不符的灌注减低,分析认为患者如果既往有心肺疾病,代偿能力降低,即使程度较轻的栓塞也可能导致严重的血流动力学变化。相比较两种重叠结果,后者显得尤为突出及重要,单纯的CTPA无法明确诊断外周性血管栓塞,导致临床重视程度不够,错失最佳的治疗方法及时机,最后导致疾病加重。PBV成像技术对肺血流灌注异常的量化能够有效弥补CTPA对于诊断外周性小血管栓塞的不足,通过PBV成像图回顾性分析CTPA可以提高其对于外周血管小栓子的检出,不仅减少了漏诊,提高了灵敏度,且不延长患者的检查时间。
本次研究中,57例患者中3例为支气管炎、肺气肿、肺间质纤维化、胸腔积液,双肺均表现为弥漫灌注降低,无法纳入统计;57例中有17例部分肺段也出现不同程度的伪影,影响测量数据及诊断,然而17例患者中在其余肺段中出现的血管内栓塞及肺叶的灌注缺损并无伪影干扰,因此纳入统计范畴。出现伪影因素较多,主要原因归纳为个体及受检者心功能的差异以及选择的触发后延迟时间。延迟时间过短,造成血管内浓度过高,出现放射伪影,影响诊断;时间过长,对于4级以下分支显示欠清。本研究中,肺动脉主干达到100Hu时,延迟6s再次扫描,能够得到相对较好的CTPA及PBV的图像,与文献报道基本一致[19],但是部分患者还是出现了伪影,笔者认为主要原因在于心功能的差异,由于伪影的影响导致部分肺段的测量出现偏差,最终导致阳性预测值偏低,所以在检查前对于受检者心功能的评估尤为重要。
本次研究存在一些局限性及不足,首先本研究是单中心研究,且样本量不大;其次研究中出现了对于受检者心肺功能估计不足,导致触发及延迟时间无法准确评估,最终引起图像出现伪影,影响诊断,需要以后扩大样本量进一步研究。
[1]Zhang LJ,Zhao YE,Wu S Y,et al.Pulmonary embolism detection with dual-energy CT:experimental study of dual-source CT in rabbits[J].Radiology,2009,252(1):61-70.
[2]Hoey E T,Gopalan D,Ganesh V,et al.Dual-energy CTpulmonary angiography:a novel technique for assessing acute and chronic pulmonary thromboembolism[J].Clin Radiol,2009,64(4):414-419.
[3]Lu G M,Zhao Y,Zhang L J,et al.Dual-energy CT of the lung[J]. Am J Roentgenol,2012,199(5 Suppl):S40-53.
[4]Ghaye B,Ghuysen A,Bruyere P J,et al.Can CT pulmonary angiography allow assessment of severity and prognosis in patients presenting with pulmonary embolism? Whatthe radiologist needs to know[J].Radiographics,2006,26(1):23-40.
[5]Hasegawa I,Boiselle P M,Hatabu H.Bronchialartery dilatation on MDCT scansof patientswith acute pulmonary embolism: comparison with chronic or recurrent pulmonary embolism[J].Am J Roentgenol,2004,182(1):67-72.
[6]Hagspiel K D,Flors L,Housseini A M,et al.Pulmonary blood volume imaging with dual-energy computed tomography: spectrum offindings[J].Clin Radiol,2012,67(1):69-77.
[7]Corbus H F,Seitz J P,Larson R K,et al.Diagnostic usefulness of lung SPET in pulmonary thromboembolism:an outcome study[J]. NuclMed Commun,1997,18(10):897-906.
[8]Collart J P,Roelants V,Vanpee D,et al.Is a lung perfusion scan obtained by using single photon emission computed tomography able to improve the radionuclide diagnosis ofpulmonary embolism[J]?NuclMed Commun,2002,23(11):1107-1113.
[9]Goldhaber S Z.Multislice computed tomography for pulmonary embolism--a technological marvel[J].N Engl J Med,2005,352 (17):1812-1814.
[10]Herzog P,Wildberger J E,Niethammer M,et al.CT perfusion imaging of the lung in pulmonary embolism[J].Acad Radiol, 2003,10(10):1132-1146.
[11]Ferda J,Ferdova E,Mirka H,et al.Pulmonary imaging using dual-energy CT,a role of the assessment of iodine and air distribution[J].Eur J Radiol,2011,77(2):287-293.
[12]Fink C,Johnson T R,Michaely H J,et al.Dual-energy CT angiography of the lung in patients with suspected pulmonary embolism:initialresults[J].Rofo,2008,180(10):879-883.
[13]沈起钧,单嫣娜,彭志毅,等.双源CT肺灌注血池容积技术对于肺分支小血管栓塞的量化与初步分析[J].浙江医学,2013,35(24):2176-2179.
[14]Zhang L J,Yang G F,Zhao Y E,et al.Detection of pulmonary embolism using dual-energy computed tomography and correlation with cardiovascular measurements:a preliminary study[J].Acta Radiol,2009,50(8):892-901.
[15]Zhang L J,Zhou C S,Schoepf U J,et al.Dual-energy CT lung ventilation/perfusion imaging fordiagnosing pulmonaryembolism [J].Eur Radiol,2013,23(10):2666-2675.
[16]张燕,张竹花,金征宇.急性肺栓塞双能CT肺灌注影像表现与CT肺动脉造影的比较[J].中国医学科学院学报,2009,31(2):166-170.
[17]Sueyoshi E,Tsutsui S,Hayashida T,et al.Quantification of lung perfusion blood volume (lung PBV)by dual-energy CT in patients with and without pulmonary embolism:preliminary results[J].Eur J Radiol,2011,80(3):e505-509.
[18]Renard B,Remy-Jardin M,Santangelo T,et al.Dual-energy CT angiography of chronic thromboembolic disease:can it help recognize links between the severity of pulmonary arterial obstruction and perfusion defects[J]?Eur J Radiol,2011,79(3): 467-472.
[19]Pontana F,Faivre J B,Remy-Jardin M,et al.Lung perfusion with dual-energy multidetector-row CT(MDCT):feasibility for the evaluation of acute pulmonary embolism in 117 consecutive patients[J].Acad Radiol,2008,15(12):1494-1504.
Diagnostic value of lung perfusion blood volume quantification by dual-energy CT in patients with peripheral pulmonary embolism
SHAN Yanna,SHEN Qijun,YANG Bin,et al.Department of Radiology,Hangzhou First People's Hospital,Hangzhou 310006,China
Objective To assess the diagnostic value of lung perfusion blood volume (PBV)quantification by dual-energy CT in patients with peripheral pulmonary embolism(PE). Methods Fifty seven patients with peripheral pulmonary embolism underwent PBV,CTPA and SPECT.All images were based on subbranches,the number and location of PE in CTPA, Average CT value of PBV in regions of interest and ranking in SPECT were determined.Correlation of lung PBV with CTPA and SPECT were analyzed.Receiver operating characteristic(ROC)curve was used to assess the diagnostic value of PBV in patients with PE. Results There was significant difference in CT value of PBV between patients with and without peripheral PE (t=37.3,P<0.01).The average CT value in PBV was significantly correlated with numbers of pulmonary segments with PE shown by CTPA (r=0.44,P<0.01).There was a significant correlation between average CT value in PBV and ranking in SPECT with PE(r=0.72,P<0.01).ROC analyses demonstrated moderator discriminatory power for using quantification of lung PBV to differentiate patients with and without PE.The area under the curve(AUC)is 0.932.With Hu<23.9 as the threshold for diagnosis PE,the sensitivity,specificity,positive predictive value and negative predictive value were 95.5%,86.9%,66.1%,98.6%, respectively. Conclusion Quantification of lung perfusion by dual-energy CT can improve the sensitivity and specificity in diagnosis of patients with peripheral pulmonary embolism.
Peripheral pulmonary embolism Tomography X-ray computed Lung perfusion Angiography of pulmonary artery SPECT
2016-01-12)
(本文编辑:马雯娜)
杭州市卫生科技计划一般项目(2013A13)
310003 杭州市第一人民医院放射科
沈起钧,E-mail:shenqijun@163.com

