鸡β-防御素-13(Gal-13)成熟肽序列的克隆及表达
周尧许国洋潘康成王承旭张钧利
(1.四川农业大学动物微生态研究中心,四川成都611130)(2.广州市中添生物科技有限公司,广东广州510470)(3.江苏无锡阿尔宝尔生物工程股份有限公司,江苏无锡214046)(4.重庆市畜牧科学研究院兽医研究所,重庆荣昌402460)
鸡β-防御素-13(Gal-13)成熟肽序列的克隆及表达
周尧1,2许国洋1,3潘康成1王承旭2张钧利2
(1.四川农业大学动物微生态研究中心,四川成都611130)
(2.广州市中添生物科技有限公司,广东广州510470)
(3.江苏无锡阿尔宝尔生物工程股份有限公司,江苏无锡214046)
(4.重庆市畜牧科学研究院兽医研究所,重庆荣昌402460)
本研究旨在克隆鸡成熟肽cDNA序列并构建原核和真核表达载体,研究其在大肠杆菌和毕赤酵母中诱导后融合蛋白的表达情况。利用PCR技术从pDM19-T-Gal-13质粒中扩增得到成熟肽cDNA序列,将其亚克隆到pGEX-4T-1和pPICZαA质粒中,构建重组原核表达质粒pGEX-4T-1-Gal-13和真核表达载体pPICZαA-Gal-13,转化大肠杆菌BL21(DE3)和毕赤酵母X-33,挑取阳性转化子用进行鉴定和诱导表达,(Tricine)SDS-PAGE检测产物的表达情况,以及真核诱导表达上清液对鸡白痢沙门氏菌和金黄色葡萄球菌。结果显示,成功克隆得到的成熟肽序列长为128bp,包含ATG片段和酶切位点与保护碱共20bp,共编码36个氨基酸;构建获得重组原核表达质粒pGEX-4T-1-Gal-13和真核表达载体pPICZα-A-Gal-13,并将重组质粒转化到大肠杆菌BL21和酵母X-33,进行诱导表达产物经电泳分析后结果显示,Gal-13融合蛋白在大肠杆菌和酵母中得到大量表达,原核表达分子量是31ku并以包涵体的形式存在,真核表达的分子量5.9 ku并分泌到发酵液中;抑菌试验表明,发现真核表达的发酵无菌上清对鸡白痢沙门氏菌和金黄色葡萄球菌具有抑菌活性。
鸡;防御素Gal-13;成熟肽;克隆;表达
防御素是一类富含半胱氨酸的阳离子抗菌肽,广泛分布于动物、植物、昆虫等体内,是机体先天免疫系统的重要组成部分,因其具有高效的抗菌活性和免疫增强作用,以及不会引起病原菌的耐药性的问题等优势而成为目前生物医学的一个研究热点(袁波等,2009;sugiano等,2004)。依据防御素的空间结构特点,可将其分为植物防御素、昆虫防御素、α-防御素、β-防御素和θ-防御素(王新卫等,2006)。1994年,Harrwing等(1994)最先从鸡的嗜中性粒细胞中分离提取到了β-防御素,并将其分别命名为Gal-1,Gal-1α,Gal-2。随着研究技术方法的不断成熟,其他种类的防御素也被相继发现(E-vans等,1994;Lynn等,2004),张辉华等(2008)研究了鸡的Gal-1~Gal-13序列信息及在组织中的分布情况,目前,在NCBI中已注册的鸡防御素共有14种,且均为β-防御素,国内报道的鸡的防御素主要是从丝羽乌骨鸡和三黄鸡的组织器官中获得(张祥斌等,2008;冀君等,2008),Gal-13是近年来刚发现的新种类,其被杨玉荣等(2008;2006)用乙酸提取的方法从鸡的肠道中分离得到,并证实了它的抑菌活性和对雏鸡免疫功能的影响,但提取工艺繁琐耗时,且提取量有限。而关于Gal-13在基因工程方面的研究相对较少,其在大肠杆菌和真核中的表达情况未见报道(王璟等,2007),本研究拟构建Gal-13成熟肽基因表达载体,以期望其在大肠杆菌和酵母中大量表达,弥补Gal-13在基因工程方面的空白,为进一步研究其活性奠定基础,也为其今后在畜牧业中的生产应用奠定一定的理论依据。
1 材料与方法
1.1菌株和载体
大肠杆菌DH5α和BL21(DE3)、携带鸡β-防御素-13基因质粒pMD18-T-Gal-13、表达载体pGEX-4T-1、分泌表达载体pPICZaA、毕赤酵母X-33,鸡白痢沙门氏菌(CVCC534)和金黄色葡萄球菌(ATCC25923),由本实验室提供。
1.2酶和试剂
T4DNA连接酶和RNA提取Trizol试剂盒均为Gibco公司产品;Prime Script RT-PCR Kit、2×Taq MasterMix(含染料)购自北京康为世纪生物科技有限公司;EcoR1和BamH1限制性内切酶均购于宝生物(大连)工程有限公司;Gel DNA Recovery Kit购自PUEX公司;Mini PlasmidKit、酵母基因组提取试剂盒购自TIANGEN公司;D-山梨醇、生物素和YNB均购自Solarbio公司;博莱霉素(ZeocinTM)为Invitrogen公司产品。
1.3 PCR引物设计与合成
参照张辉华等(2008)报道的Gal-13cDNA序列设计引物P1/P2,扩增Gal-13成熟肽基因序列。并依据载体pPICZaA序列合成一对检测重组菌株表型的引物5,AOX/3,AOX,引物由上海基康公司合成。
1.4原核表达载体pGEX-4T-1-Gal-13的构建及鉴定
以pMD18-T-Gal-13为模板,P1/P2为引物,扩增Gal-13成熟肽序列(扩增体系为2×TaqMaster-Mix12.5μL,DNA 2μL,ddH2O10.5μL;反应条件为94℃5min;94℃45s,55℃45s,72℃45s,共30个循环;72℃延伸10min)。PCR产物用1%的凝胶电泳鉴定,回收纯化产物,送上海生工公司测序。将pGEX-4T-1质粒与鉴定正确的成熟肽序列,分别用EcoR1和Kpn1双酶切,酶切产物经电泳后回收纯化,连接过夜,构建原核重组表达质粒,将扩增出成熟肽序列和pGEX-4T-1表达质粒进行双酶切,连接过夜,转化感受态DH5a,筛选阳性转化子,提取重组质粒进行PCR鉴定,并将PCR产物送上海生工公司测序,测序正确的阳性质粒命名为pGEX-4T-1-Gal-13。
1.5原核重组子的诱导表达与表达产物的鉴定
鉴定正确的重组质粒转化感受态BL21,涂布于LB琼脂培养基(含Amp+)上,筛选出的阳性转化子,进行PCR鉴定,将鉴定正确的重组菌株(命名为大肠杆菌BL-Gal-13),接种于200ml含氨苄青霉素的LB培养液中,在OD值达到0.3~0.5时加入终浓度为1.0mmol/L的诱导剂IPTG,37℃诱导表达4h后,取1mL菌液离心收集菌体,加入100μl电泳缓冲液水煮10min,进行SDS-PAGE和Westernblot凝胶电泳分析。
将诱导表达后的菌液4℃下12000r/min离心10min,收集沉淀,离心后用PBS悬浮菌体沉淀,冰水浴中超声裂解菌悬液(超声功率为300W,工作4s间歇5s,超声裂解15min)。取1ml裂解液4℃下12000r/min离心 10min,沉淀和上清分别做SDS-PAGE分析。
1.6真核pPICZαA-Gal-13重组质粒的构建及鉴定
方法1.4回收鉴定正确的PCR产物与pPICZaA质粒用EcoR1与Kpn1酶切消化处理,T4 DNA连接酶进行连接,连接产物直接转化DH5a感受态细胞,在含有Zeocin(25μg/μl)的LB平板上进行筛选,挑取单个菌落接种于LB液体培养基(含Zeocin)中37℃培养过夜,提取重组质粒,进行PCR和双酶切鉴定,构建成功的质粒送往上海博亚生物公司测序,重组质粒命名为pPICZαA-Gal-13。

表1 引物序列信息
1.7重组表达质粒pPICZαA-Gal-13的电击转化
提取重组质粒pPICZαA-Gal-13,用Sac1内切酶线性化处理,取100μl制备好的毕赤酵母X-33感受态细胞,与5~20μg线性化的目的片段混合,转移至一冰预冷无菌0.2cm电转杯中,冰水浴15min,放入电转仪中电击转化,然后取出电转化皿,立即加入1ml冰预冷的1mol/L Sorbitol,混匀后转到1.5ml无菌离心管,取600μl电转化菌体涂布于YPDS平板(含Zeocin),30℃培养3d左右,筛选转化子。
1.8真核重组菌株的诱导表达与鉴定
将阳性转化子(命名为重组酵母X-33-Gal-13)接种于3ml YPD液体培养基中,30℃,250r/min摇床培养至OD600=2~6,2500r/min离心2min,弃上清收集菌体,菌体用BMMY重悬,其中甲醇含量为1%,连续诱导表达培养4d,每24h取样并补充甲醇,使其终浓度为0.5%。对样品进行离心收集上清,并用上清进行Tricine-SDS-PAGE电泳。
1.9 Gal-13的抑菌活性试验
收集重组毕赤酵母X-33甲醇诱导72h后表达的上清液,以牛津杯法,分析真核表达的重组蛋白鸡白痢沙门氏菌和金黄色葡萄球菌的抑菌活性。
1.10耐热性分析
取诱导表达72h的重组酵母X-33-Gal-13菌株表达上清12mL,分为6管,分别在50℃,60℃,70℃,80℃,90℃,100℃的温度下水浴处理15min,参照方法1.9做抑菌试验。
2 结果
2.1重组表达质粒的构建与鉴定
以P1/P2为引物扩增出其成熟肽序列,经测序共128bp,包括引入ATG片段和酶切位点与保护碱基。对构建筛选的重组表达质粒进行菌落PCR鉴定和测序,所扩增的序列信息与目的基因一致,结果表明目的基因成功插入到表达质粒中(图1)。
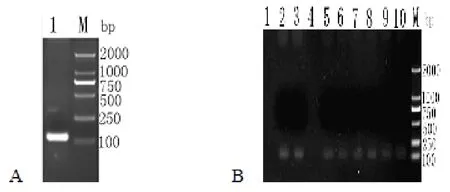
图1 Gal-13成熟肽cDNA序列的扩增及菌落PCR鉴定
2.2重组大肠杆菌BL-Gal-13表达产物的鉴定分析
诱导表达4h的菌液样品经SDS-PAGE和westernblot凝胶电泳分析显示,GST标签的分子量大小约为26ku,融合蛋白的分子量大小约为31KD,与预期结果一致,电泳结果如图2所示。对融合蛋白的经过表达形式分析后发现菌体经超声裂解后,只有在沉淀中检测到了目的蛋白。
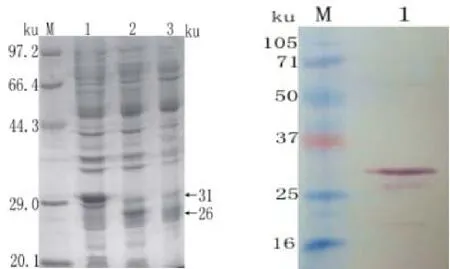
图2 表达产物的SDS-PAGE及western blot分析
2.3真核pPICZαA-Gal-13表达载体的构建与鉴定
成熟肽序列经PCR扩增的产物与pPICZaA质粒用EcoR1与Kpn1酶切,连接酶连接转化DH5a感受态细胞,随机挑取5个转化后的DH5a单菌落,进行菌落PCR鉴定,发现均在约120bp的位置出现预期条带,电泳结果如图3A所示,提取重组质粒后,进行双酶切鉴定,在图3B中出现了两个条带,结果表明成功构建了Gal-13成熟肽的真核分泌pPICZaA-Gal-13质粒。
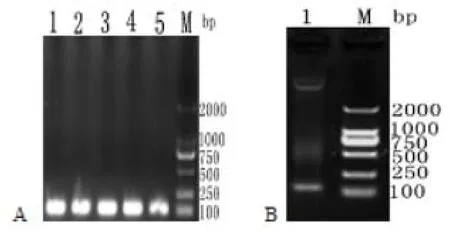
图3 pPICZαA-Gal-13阳性菌落PCR和重组质粒的双酶切鉴定
2.4高抗性菌株的筛选鉴定
对含有Zeocin的抗性平板中长出的转化子扩大培养,提取酵母基因组进行PCR鉴定,产物电泳结果如图4所示。由图可以看出,以P1/P2为引物扩增出了大小约为120bp的条带;重组菌株基因组用5’AOX1/3’AOX1扩增出约700bp和2200bp的条带,所获得的菌株,为阳性转化子,且表型为甲醇利用野生型Mut+,酵母基因组扩增出一条2200bp条带,结果表明,所获得的高抗性菌株,为阳性转化子,且表型为甲醇利用野生型。
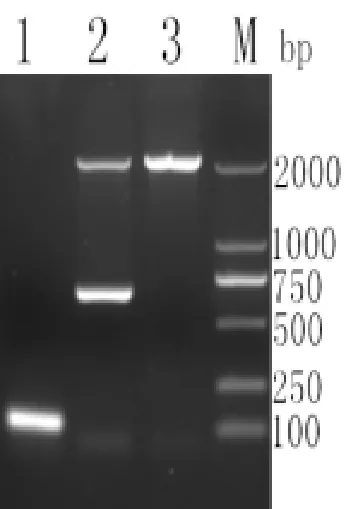
图4 高抗性菌株鉴定
2.5重组酵母X-33-Gal-13的诱导表达
利用甲醇对重组酵母X-33-Gal-13进行诱导表达,重组菌株在诱导表达24h,Tricine-SDS-PAGE电泳后在约5.9 ku的位置出现目的条带,该条带的蛋白中含有His标签,大小与预期结果一致(图5)。凝胶薄层灰度扫描结果显示,24~72h目的蛋白占菌体自身分泌总蛋白的百分比分别约为18.2%、20.0%、27.2%,诱导表达72h目的蛋白所占比例明显升高。

图5 毕赤酵母X-33-Gal-13诱导表达上清Tricine-SDS-PAGE
2.6表达产物的抑菌活性
重组酵母X-33-Gal-13诱导表达72h的表达产物对鸡白痢沙门菌的抑菌圈直径平均值为11.78mm,对金黄色葡萄球菌的抑菌圈直径平均值为12.56mm,比前者抑菌效果更加明显,结果如图6A,B所示。
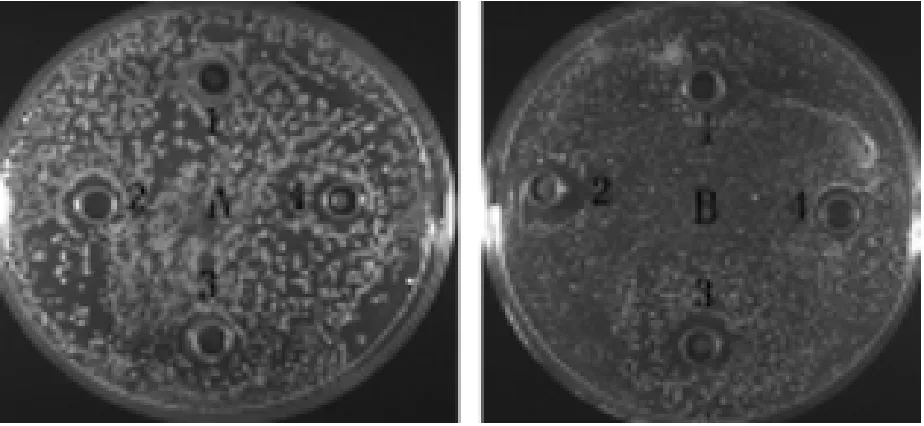
图6 Gal-13抑菌活性分析结果
2.7耐热性分析
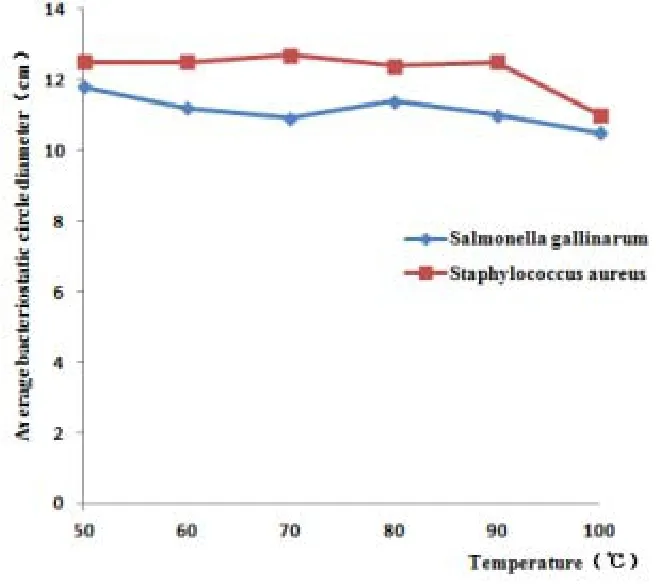
图7 耐热性分析
通过对不同温度处理重组酵母X-33-Gal-13诱导表达的上清液,处理Gal-13抑菌活性的分析,发现温度对Gal-13的抑菌效果无明显影响。图7表明Gal-13在100℃的条件下,处理15min后,对鸡白痢沙门氏菌和金黄色葡萄球菌依然具有抑菌活性,虽然均有所下降,但幅度较小,表现出较好耐热性。
3 讨论
防御素作为一种新型的生物活性肽,其抗菌谱广泛,与抗生素阻断大分子生物合成的作用机制完全不同,防御素能够快速杀灭广谱病原微生物,而且作为机体本身的一种活性物质,相对不具有免疫原性,对其具有抵抗性的细菌较少,病原菌也不易对其产生耐药性,因此可以替代抗生素发挥广谱高效的抗菌作用(Risso等,2000)。但防御素天然产量低,合成或从机体中提取步骤复杂、产量低,价格相当昂贵,利用基因工程技术生产防御素具有现实意义(冯兴军等,2006)。
从实验室构建的鸡pDM-19-T-Gal-13的质粒,通过对引物的设计,去掉其序列中的信号肽、前导肽序列,成功获得成熟肽序列,将其亚克隆到Gal-13的原核表达质粒中,首次实现了Gal-13大肠杆菌中得到高效表达,表达产物以包涵体形式存在,有利于避免其被宿主菌蛋白酶的降解,同时避免防御素对表达菌株的损伤。另外,Gal-13含有GST标签,便于目的蛋白的筛选、鉴定和纯化(吴静等,2013;王海英,2008)。同时,通过分离纯化目标蛋白并对鸡源大肠杆菌和金色葡萄球菌进行抑菌活性试验,结果纯化的目标蛋白对两株病原菌具有一定的抑制作用(另文报道)。结果为进一步研究重组蛋白Gal-13的生物学特性和其作为一种新型抗菌肽药物制剂在畜牧业中的应用奠定一定的基础。
毕赤酵母表达系统具有易于操作,发酵密度高,表达量高等优势,被越来越多的应用于外源基因蛋白的表达,并且已经成功表达了多种外源蛋白(Gil de Los Santos等,2012)。本试验以毕赤酵母X-33为宿主菌,用分泌表达载体pPICZαA构建了重组表达系统,目的蛋白以分泌形式表达于培养基中,这样不仅避免了产物被细胞内蛋白酶降解和因产物在细胞内堆积所造成的毒性作用而影响细胞代谢,而且大大简化了产物的分离纯化过程,为工业化大规模生产提供了便利条件。该成熟肽的抑菌活性试验表明,其对鸡白痢沙门氏菌和金黄色葡萄球菌菌具有一定的抑制作用,抑菌活性虽然较弱,但其对温度有较好的耐受性。本研究初步证实了其具有生物活性,弥补了Gal-13在真核表达系统方面的空缺,为防御素Gal-13生产工艺的建立提供了依据,也为进一步研究Gal-13的作用机制以及在生物体内的生物学功能奠定了理论基础。
4 结论
本研究成功构建获得重组原核表达质粒pGEX-4T-1-Gal-13和真核表达载体 pPICZα-A-Gal-13及重组质粒转化到大肠杆菌BL21和酵母X-33,Gal-13融合蛋白在大肠杆菌和酵母中得到大量表达,原核表达分子量是31ku并以包涵体的形式存在,真核表达的分子量5.9 ku并分泌到发酵液中,表达产物对病原菌具有抑菌活性和具有较好的耐热性。
[1]冯兴军,王建华,单安山,等.抗菌肽基因工程研究及其表达策略[J].中国生物工程杂志,2006,26(3):63-67.
[2]冀君,陈燕珊,张祥斌,等.广西黄鸡β-防御素基因的克隆、序列分析与组织分布[J].华南农业大学学报,2008,29( 3):61-65.
[3]王海英.鸡β-防御素2(Gal-2)基因在大肠杆菌中的融合表达与纯化[J].家禽科学,2008,12:7-10.
[4]吴静,史玉颖,等.鸡β-防御御素-1基因在大肠杆菌中的融合表达及其初步纯化与抗菌活性测定[J].家禽科学, 2013,(1):6-11.
[5]王璟,杨玉荣,梁红德等.禽类防御素作用机理及基因工程研究进展[J].动物医学进展,2007,28(10):82-84.
[6]王新卫,康相涛.禽类防御素研究进展[J].动物医学进展,2006,27(12)35-37.
[7]杨玉荣,等.鸡抗茵肽Gal-13的分离提取及其对雏鸡免疫的影响和作用机理研究[D].北京:中国农业大学,2006.
[8]杨玉荣,佘锐萍,彭开松.鸡肠道抗菌肽Gal-13的乙醇提取及其工艺优化 [J].西北农林科技大学学报,2008,36,(9): 22-25.
[9]袁雪波,郭荣富,陈恒灿等.β-防御素的研究进展及其应用前景[J].兽药与饲料添加剂2009,14(2)23-25.
[10]张辉华,毕英佐,曹永长,等.胡须鸡防御素Gal-1-Gal-13基因克隆、序列分析与组织分布[J].农业生物技术学报,2008,16(4):597-603.
[11]张祥斌,谢青梅,马静云,等.丝羽乌骨鸡β-防御素的克隆与序列分析[J].广东畜牧兽医科技,2008,33(4):22-25.
[12]Evans E w,Beach G G,wunderlich J,et al.Isolation of antimicrobial peptides fromavian heterophils[J].J Leukoc Biol, 1994,56(5):66l-665.
S916.7
A
1005-8613(2016)11-0038-05
2016-9-6

