分散固相萃取-气相色谱法测定花生及大豆中5种除草剂残留
刘 芳,马 琳
(1.通标标准技术服务(上海)有限公司,上海 200233;2.农业部农药质量监督检验测试中心(上海),上海 201103)
分散固相萃取-气相色谱法测定花生及大豆中5种除草剂残留
刘 芳1,马 琳2*
(1.通标标准技术服务(上海)有限公司,上海 200233;2.农业部农药质量监督检验测试中心(上海),上海 201103)
建立了分散固相萃取-气相色谱法同时测定花生及大豆中5种除草剂残留量,研究了花生和大豆样品中的基质效应。样品经乙腈提取,分散固相萃取净化,气相色谱仪ECD检测器定量分析。结果表明:5种农药在0.01~1.00 mg/L范围内均呈现良好的线性关系,相关系数均大于0.995。在高、中、低3个添加水平下,5种除草剂的平均回收率为80.88%~117.90%,相对标准偏差(n=5)小于15%,定量限为0.01 mg/kg。该方法简单、快速,灵敏度高,可满足花生和大豆中5种除草剂残留检测的要求。
分散固相萃取;基质效应;残留;除草剂;花生;大豆
甲草胺、乙草胺、异丙甲草胺、仲丁灵和二甲戊灵均属于选择性芽前除草剂,生产中被广泛用于大豆、棉花、甜菜、玉米、花生、油菜等旱地作物防除一年生禾本科杂草。目前农产品例行监测并未将这几种农药全部涵盖进去,且现行GB 2763—2014中也仅规定了其中部分农药的最大残留限量[1]。建立这些农药与其他常用农药同时检测的多残留检测方法,是农药残留监测要进行的技术工作。
分散固相萃取法(Dispersive Solid-Phase Extraction,DSPE)是一种新型、快速的农残检测预处理技术,2003年由美国农业部提出[2-3]。其主要应用于多种类多残留农药色谱-质谱联用检测的预处理过程,与传统固相萃取(SPE)相比,分散固相萃取法省时且操作简单,无需对操作者进行特别的培训[2,4]。本文在分散固相萃取法基础上对前处理过程进行改进[2-3,5],将该法应用于花生和大豆中甲草胺、乙草胺、异丙甲草胺、仲丁灵和二甲戊灵的残留检测,可在较短时间内完成检测的预处理过程。该方法简单、快速,灵敏度、准确度完全满足农残检测要求。
1 试验部分
1.1 材料与设备
GC 7890B气相色谱仪(带电子捕获检测器),美国Agilent公司;Milli-Q超纯水仪,美国Millipore公司;T18ULTRA-TURRAX高速匀浆机,德国IKA集团。
甲草胺、乙草胺、仲丁灵、异丙甲草胺、二甲戊灵标准品(1 000 mg/L),农业部环境质量监督检验测试中心(天津);乙腈、丙酮(色谱纯),德国Merck公司;PSA(N-丙基乙二胺)吸附剂、C18(十八烷基键合硅胶),Agilent公司;无水硫酸镁,分析前550℃烘2 h,冷却后置于密闭容器中备用;花生、大豆,购于农贸市场。
1.2 样品前处理
1.2.1 提取
准确称取10 g(精确至0.1 g)样品至100 mL聚四氟乙烯离心管中,加入2 mL去离子水,浸润20 min后,加入20 mL乙腈,在高速匀浆机中匀浆1 min,收集滤液至装有5~7 g NaCl的200 mL具塞量筒中,盖上盖子后,剧烈振荡1 min,室温下静置1 h。取上清液2 mL,待净化。
1.2.2 净化
在10 mL聚四氟乙烯离心管中,加入0.1 g PSA、0.15 g C18、0.3 g无水硫酸镁,取1.2.1中2 mL提取液于离心管中,在漩涡混匀器上混合1 min,再以3 000 r/min离心5 min,上清液过0.22 μm有机相滤膜,待检测。
1.3 色谱条件
色谱柱:HP-5石英毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度:260℃;进样量:1 μL,无分流进样;程序升温:起始温度100℃,保持1 min,然后以25℃/min升至210℃,以35℃/min升至280℃保持10 min;载气:高纯氮气;流量:1.9 mL/min;检测器温度:300℃。外标法定量。
1.4 添加回收率试验
以花生和大豆为代表基质,进行甲草胺等5种除草剂3个浓度的添加回收率试验,重复5次,确定方法的准确度和精密度。同时按照本方法预处理程序,选择三唑酮等6种常用农药在白菜中进行添加浓度为0.1 mg/kg的回收率试验,以验证本方法的适用性。
2 结果与讨论
2.1 5种除草剂的色谱分离及在ECD上的响应
配制质量浓度为0.5 mg/L的甲草胺、乙草胺、仲丁灵、异丙甲草胺、二甲戊灵单一农药标样溶液和混合标样溶液。按照1.3仪器检测条件,采用单针进样方式,确定每种农药的保留时间,再以甲草胺、乙草胺、仲丁灵、异丙甲草胺、二甲戊灵的混合标样溶液进样,明确各农药在HP-5柱上的保留时间和出峰顺序。图1为花生基质中添加浓度为0.1 mg/kg时5种除草剂混合标样色谱图。

图1 花生中5种除草剂混合标样溶液色谱图
2.2 净化方法选择
花生和大豆属于油料作物,油脂含量较高,检测过程中需要去除样品中油脂的干扰。试验发现仅采用PSA作为分散固相萃取剂,样品放置2 h后会有油脂析出。因此,本文参照AOAC 2007.01方法进行改进,在添加浓度为0.1 mg/kg时,将不同质量的C18加入到2 mL花生样品上清液中。随着C18用量的增加,5种除草剂的回收率呈现先上升后下降的趋势(见图2)。5种除草剂添加浓度为0.1 mg/kg时,2 mL上清液采用0.1 g PSA、0.15 g C18和0.3 g无水硫酸镁作为分散固相萃取剂净化,除草剂的添加回收率在80%~100%之间。
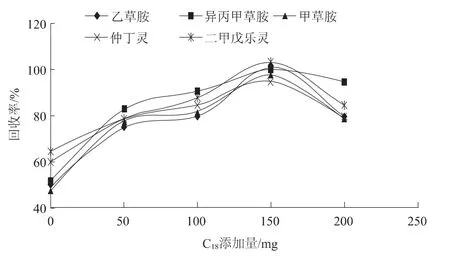
图2 回收率与C18添加量的关系
2.3 方法的线性范围、准确度和精密度
按照1.2中方法进行前处理,以添加回收的方法确定5种除草剂的定量限(LOQ)为0.01 mg/kg。在0.01~1.00 mg/L范围内,5种农药标样溶液的质量浓度与峰面积呈良好线性关系,相关系数均大于0.995。结果见表1。

表1 5种农药的检出限、线性范围、线性方程及相关系数
通过添加回收试验,评价本方法的准确度和精密度,结果见表2。结果显示:在高、中、低3种不同添加浓度(1.0,0.1,0.01 mg/kg)的5个平行试验中,5种除草剂在花生中的平均回收率为80.88%~117.90%,相对标准偏差(RSD)为2.9%~12.7%;在大豆中的添加回收率为83.25%~116.85%,RSD为2.0%~13.5%。
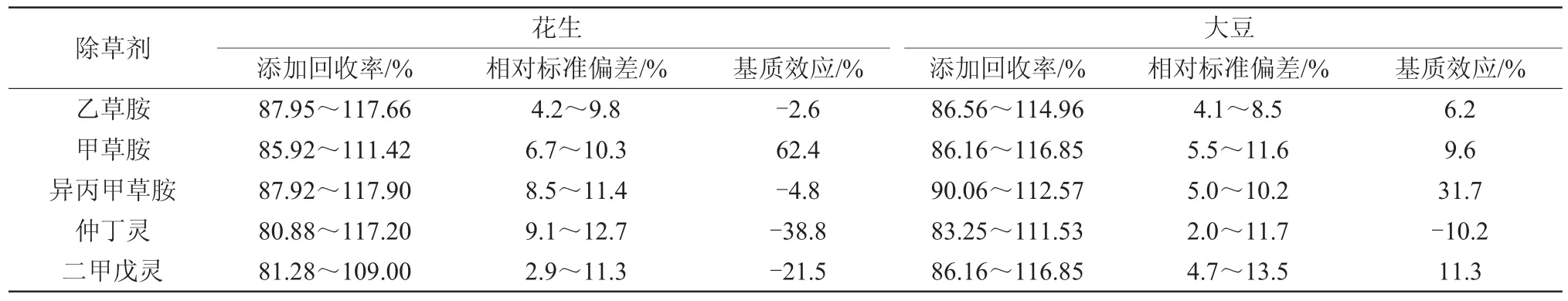
表2 花生、大豆基质中5种农药的添加回收率、相对标准偏差及基质效应
根据花生及大豆基质中进行的添加浓度为0.1 mg/kg回收率试验,计算2种基质的基质效应(Mi)[6]。当|Mi|<20%为弱基质效应,可忽略而无需采取补偿措施;20%≤|Mi|≤50%为中等程度基质效应;|Mi|>50%为强基质效应。基质效应在中等程度以上时,影响结果定量,需要对基质效应进行校正,通常采用的方法有基质匹配标样溶液校正法和样品稀释法。
在花生基质中,5种除草剂的基质效应差异较大,其中乙草胺和异丙甲草胺属于弱基质效应,仲丁灵和二甲戊灵属于中等强度基质效应,而甲草胺则属于强基质效应;在大豆基质中,仅异丙甲草胺显示出中等强度的基质效应,其余4种除草剂均表现出弱基质效应。这说明基质效应的大小不仅和农药的性质有关,而且与基质溶液自身的组成也有极大的关联性。因此,为提高定量的准确性,本实验采用基质匹配标样溶液校正方法对基质效应进行补偿。
2.4 方法的适用性
电子捕获检测器(ECD)是检测拟除虫菊酯类杀虫剂的常用检测器,为考察本方法对常用农药的适用性,选择了白菜为基质,进行三唑酮等6种农药品种的添加回收率试验(添加水平0.1 mg/kg),结果见表3。6种农药的平均回收率在81.13%~102.72%之间,相对标准偏差在2.5%~3.1%之间,满足农残检测要求。

表3 白菜基质中6种农药的添加回收率
3 结论
改进的分散固相萃取法能有效去除花生和大豆基质中基质干扰物。采用改进的分散固相萃取法,结合气相色谱检测技术,建立了花生及大豆中5种除草剂残留的分析方法。方法简便、灵敏、准确、环保,适用于花生及大豆中甲草胺、乙草胺、仲丁灵、异丙甲草胺、二甲戊灵残留的定性定量分析。
[1]中华人民共和国国家卫生和计划生育委员会,中华人民共和国
农业部. GB 2763—2014食品安全国家标准食品中农药最大残留限量[S].北京:中国标准出版社,2014.
[2]Anastassiades M,Mastovska K,Lehotay S J. Evaluation of Analyte Protectants to Improve Gas Chromatographic Analysis of Pesticides [J]. J Chromatogr A,2003,1015(1/2):163-184.
[3]Lehotay S J,Kok A D,Hiemstra M,et al. Validation of a Fast and Easy Method for the Determination of Residues from 229 Pesticides in Fruits and Vegetables Using Gas and Liquid Chromatography and Mass Spectrometric Detection[J].J Aoac Int,2005,88(2):595-614.
[4]Lehotay S J,Mastovska K,Lightfield A R,et al. Multi-analyst,Multi-matrix Performance of the QuEChERS Approach for Pesticide Residues in Foods and Feeds Using HPLC/MS/MS Analysis with Different Calibration Techniques[J]. J Aoac Int,2010,93(2):355.
[5]Lehotay S J,Mastovska K,Yun S J. Evaluation of Two Fast and Easy Methods for Pesticide Residue Analysis in Fatty Food Matrixes [J]. J Aoac Int,2005,88(2):630-638.
[6]汪传炳,黄秀根,樊晓青,等.微量叠加定量法校准蔬菜农药残留色谱分析中的基质效应[J].上海农业学报,2013,29(4):36-41.
[7]Rajski L,Lozano A,Ucles A,et al. Determination of Pesticide Residues in High Liquid Chromatography Tandem Mass Spectrometry[J]. J Chromatogr A,2013,1304(7):109.
Determination of Five Herbicides Residues in Peanut and Soybean by DSPE-GC
LIU Fang1,MA Lin2*
(1. SGS-CSTC Standards Technical Services Co.,Ltd.,Shanghai 200233,China;2. Pesticide Quality Supervision and Inspection Testing Center(Shanghai),Ministry of Agriculture,Shanghai 201103,China)
A modified method of DSPE for determination of 5 herbicides residues in peanut and soybean by GC-ECD was established. The samples were extracted by acetonitrile,cleaned up with DSPE cartridges,the analytes in the sample solutions were analyzed by GC-ECD on HP-5 column. Matrix effects of real peanuts and soybeans were studied. The results showed that the method had good linearity for the five herbicides at the concentration of 0.01-1.00 mg/L,with the linear relative coefficients more than 0.995. The fortified recoveries ranged from 80.88%to 117.90%,the relative standard deviations were less than 15%. The established analytical method was simple,efficient and sensitive,and could be suitable for the determination of the 5 herbicides in peanut and soybean.
DSPE;matrix effect;residue;herbicide;peanut;soybean
TQ 450.2+63
A
10.3969/j.issn.1671-5284.2016.02.010
2015-12-01;
2015-12-30
刘芳(1982—),女,河北省张家口市人,硕士,主要从事食品检测和食品法规相关工作。Tel:021-61402623;E-mail:liufang5139@163.com
马琳(1980—),女,河北省张家口市人,农艺师,主要从事农药残留检测工作。Tel:021-64052865;E-mail:ml800617@aliyun.com
柏亚罗)
◆品种介绍◆

