原发性胃腺鳞癌的临床病理及预后分析
王俊伟,张发强,金心富,杨 华
(四川省自贡市第四人民医院普外二科 643000)
·经验交流·
原发性胃腺鳞癌的临床病理及预后分析
王俊伟,张发强,金心富,杨 华
(四川省自贡市第四人民医院普外二科 643000)
目的 探讨原发性胃腺鳞癌(ASC)的临床病理特征、治疗及预后。方法 回顾性分析该院普外科2006年1月至2014年10月收治的9例原发性胃ASC患者的临床病理资料。结果 9例原发性胃ASC患者中,男7例,女2例;年龄43~70岁,中位年龄63岁。6例患者主要表现为上腹部疼痛不适,另3例患者分别表现为反酸、腹胀及黑便。7例患者行根治性近端或远端胃切除,2例行姑息性全胃切除。术后共4例患者接受放、化疗。所有患者均发生淋巴结转移,6例患者转移的淋巴结中均为腺癌成分,1例均为鳞癌,余2例证实为腺、鳞癌两种成分。肿瘤TNM分期,ⅡB期1例,ⅢA期2例,ⅢB期1例,ⅢC期3例,Ⅳ期2例。术后中位随访时间为15个月(范围1~41个月),共8例患者发生肿瘤复发或转移,中位无进展时间为6.5个月。共6例患者死亡,其中因肿瘤进展死亡5例,中位生存时间15个月。结论 原发性胃ASC的腺癌和鳞癌成分均可发生远处转移,其恶性程度高,预后差。治疗上应早期手术,同时结合放、化疗。
胃恶性肿瘤;腺鳞癌;临床病理;预后
腺鳞癌(adenosquamous carcinoma,ASC)是一种比较罕见的肿瘤,可发生于消化道不同部位,如胃、结肠及肝胆管等。原发的胃ASC极其少见,其发病率不足原发性胃恶性肿瘤的0.5%,恶性程度高,早期易发生转移、复发,预后差[1]。ASC的发病机制尚不明确,其临床病理特征及规范化的治疗手段也未建立。目前,关于ASC的研究多数为个案报道,故人们对其认识仍不够。本研究通过回顾性分析本院普外科收治的9例原发性胃ASC患者的临床病理特征、诊断、治疗及预后,以期能使临床医师加深对ASC的认识,现报道如下。
1 资料与方法
1.1 一般资料 回顾性收集本院普外科2006年1月至2014年10月收治的原发性胃ASC患者。所有患者均经术前胃镜活检或术后病理证实为ASC,其诊断必须包含腺癌和鳞癌细胞两种成分,且鳞癌所占比例至少占肿瘤的25%以上。所有患者术前均行腹部B超或CT检查,且术前未发现全身其他系统重大疾病。患者失访、非胃ASC或病历资料不完整者,予以剔除。参照以上标准,本研究共纳入9例ASC患者进行分析。本研究共纳入9例ASC患者,其中,男7例,女2例,年龄43~70岁,中位年龄为63岁;平均住院时间为(20.3±6.8)d;患者平均肿瘤大小为(5.6±2.2)cm。6例(66.7%)患者以上腹部疼痛不适为主要临床表现,另3例患者分别主要表现为反酸(11.1%)、腹胀(11.1%)及黑便(11.1%)。2例患者并发2型糖尿病,1例合并肝硬化。5例患者行根治性近端胃切除(病例1、3、6、8和9);2例患者行根治性远端胃切除;另2例患者均行姑息性全胃切除(病例2因肿瘤浸润胰腺及脾脏而行联合胰体部分假胰尾+脾脏切除术;病例5因发生肝转移合并肝硬化,无法手术切除转移灶)。术后5个月,1例患者发生肠梗阻,再次行手术治疗。4例患者术后给予SOX、FOLFIRI及替吉奥化疗方案治疗,其中,2例辅以腹部放疗,共3例患者获得部分缓解,见表1。
1.2 方法
1.2.1 手术及免疫组织化学 所有患者均于全身麻醉下行开腹手术治疗。根据肿瘤大小,部位行次全胃切除或全胃切除术,同时行各站淋巴结清扫。伴临近器官浸润者,术中行联合脏器切除。术后标本以10%福尔马林液固定,取材后,常规解剖淋巴结,石蜡包埋,行HE染色。本研究中共5例标本进行了P63、CEA、CK8、CgA及Syn免疫组织化学染色。全部切片均经两位及以上的病理医师证实为ASC。
1.2.2 数据收集及随访 收集所有患者的临床病理特征等资料,包括:临床症状、性别、年龄、住院时间、肿瘤大小、肿瘤部位、Borrmann分型、肿瘤浸润深度(T)、淋巴结转移、TNM分期及转移、复发等,肿瘤TNM分期参照AJCC第7版。患者出院后,所有患者通过定期门诊复查及电话进行随访,截止2014年10月,随访时间为4~41个月。
2 结 果
2.1 病理及免疫组化结果 所有患者术后均行HE染色,且证实包含腺癌和鳞癌细胞两种成分(图1)。表2总结了9例ASC患者的病理结果。本组肿瘤发生于胃的上1/3者共6例,1例位于胃的中1/3,另2例位于胃的下1/3。肿瘤TNM分期,ⅡB期1例,ⅢA期2例,ⅢB期1例,ⅢC期3例,Ⅳ期2例。浸透浆膜及以上者共7例患者(T4a和T4b)。所有患者均发生淋巴结转移,共清扫(14.5±4.8)枚,其中,转移(8.5±2.8)枚。转移的淋巴结中6例患者均为腺癌成分,1例为鳞癌,余2例证实为腺癌和鳞癌均存在(图1)。共5例患者行免疫组织化学分析,在腺癌成分中,2例P63阳性、5例CEA阳性、2例CK 8阳性、0例CgA阳性及0例Syn阳性;而鳞癌成分中,4例P63阳性、2例CEA阳性、5例CK8阳性、0例CgA阳性及0例Syn阳性。

表1 胃ASC患者的临床特点及治疗
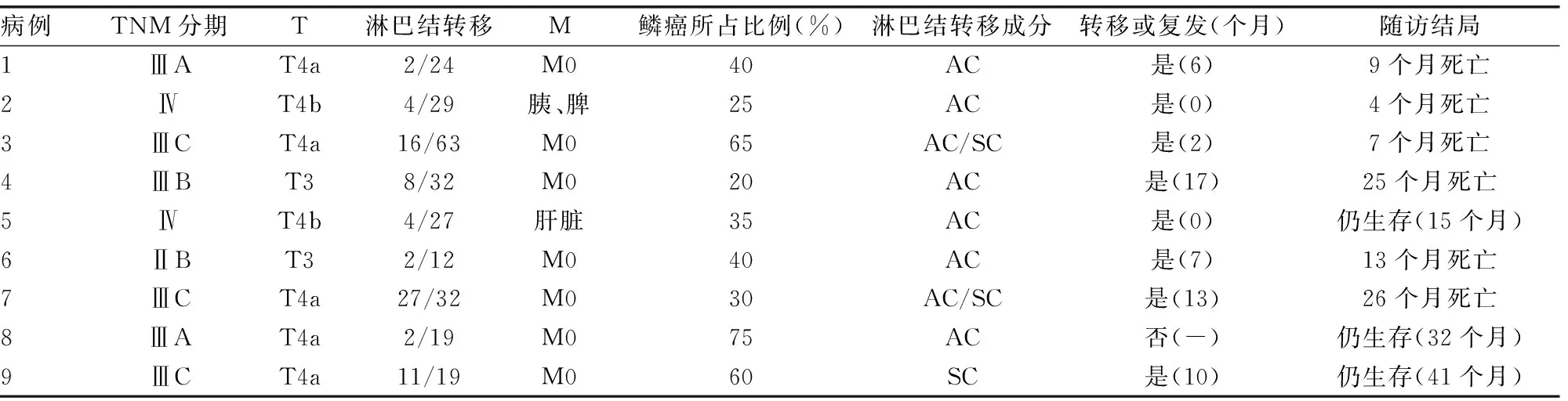
表2 9例胃腺鳞癌患者的病理特点及结局

A、B:病例2转移的淋巴结中含有鳞癌及腺癌成分(HE,×200,红色细箭头示腺癌成分,红色粗箭头示鳞癌成分);C:淋巴结中p63阳性(HE,×200);D:淋巴结中CK7阳性(HE,×400)。
2.2 随访结果 本组患者术后中位随访时间为15个月(范围4~41个月),共8例患者发生肿瘤复发或转移,中位无进展时间为6.5个月。2例患者发生腹腔广泛转移,1例发生肺转移,1例吻合口旁复发,4例患者发生肝脏转移(其中,1例行肝转移灶射频消融治疗,病例9)。共6例患者死亡,其中,因肿瘤进展死亡5例,1例因肺部疾病死亡,中位生存时间15个月。
3 讨 论
原发于胃的恶性肿瘤中以腺癌最多,ASC及鳞癌极其罕见。1905年,Rolleston等报道了原发性胃ASC。目前,临床医师仍对其临床病理、免疫组织化学特点、治疗及预后等知之甚少。多数患者确诊时多为进展期,其预后差,恶性程度高。文献报道原发性胃ASC常见于亚洲男性患者,好发于中老年人,且多发生于胃底[1]。本组病例中男女比例为3.5∶1.0,肿瘤好发于胃的上1/3者共6例,发病中位年龄为63岁(范围:43~70岁)。胃ASC的临床表现不尽一致,与胃腺癌患者类似,主要变现为腹痛[2]。本研究共6例(66.7%)患者以表现为腹部疼痛,少数患者表现为反酸、腹胀及黑便。
目前,对胃ASC组织起源的机制尚不明确,主要有以下几个假说:(1)胃良性鳞状上皮细胞化生导致;(2)起源于胃黏膜全能干细胞;(3)腺癌细胞发生鳞状化生;(4)胃黏膜内异位鳞状上皮岛癌变所致;(5)局部血管内皮细胞向鳞状细胞分化[3-4]。然而,国内外学者的关于其起源仍存在分歧,目前,多数学者赞同腺癌细胞发生鳞状化生这一假说。多数ASC肿瘤中鳞癌细胞成分与腺癌有一个明显的过渡区,紧临腺癌成分,并且鳞癌成分CK7和CEA表达阳性,支持鳞癌细胞成分来自于腺癌这一观点[5]。本研究中共5例患者行免疫组化检测,其中,鳞癌成分阳性表达CK8及CEA者分别有5例和2例患者。原发性胃ASC中2种癌细胞成分均可发生淋巴结或远处转移,巨检大多数肿瘤为Borrmann Ⅱ型和Ⅲ型,Ⅰ型很少见。与其报道一致,本组病例有2例患者的淋巴结查见腺癌和鳞癌成分,Borrmann分型仅1例为Ⅰ型。
胃ASC与其他的胃恶性肿瘤的临床表现差异不明显,需经病理及免疫组织化学染色确定诊断。临床上,胃鳞癌的诊断参考Boswell标准[6]:(1)角化细胞团伴癌珠形成;(2)细胞间桥;(3)免疫组织化学提示存在角蛋白;(4)癌细胞排列形成镶嵌状,细胞边界清楚,单个细胞或角化或早期癌珠形成;(5)排除其他脏器的癌症转移或浸润至胃。胃ASC的诊断必须包含腺癌和鳞癌细胞两种成分或过度共存,鳞癌所占比例至少占肿瘤的25%以上。根治性外科手术切除是原发性胃ASC主要治疗手段,也是惟一能治愈的方式。根据肿瘤大小、部位以及与邻近器官的关系,采用次全或全胃切除,必要时可行联合脏器切除术并按胃癌根治术的标准清扫各站区域淋巴结。由于胃ASC诊断时候,多为进展期,故术后应积极行辅助治疗。顺铂、氟嘧啶、紫杉醇、多烯紫杉醇,以及伊立替康等化疗药物可有效延长患者生存期[1,6-7]。由于鳞癌对放疗敏感,术后放疗也可作为综合治疗手段之一。本研究中术后接受辅助治疗者与未接受辅助治疗者中位生存期分别为20个月和13个月。
前期报道显示,胃ASC的预后较典型的胃腺癌更差,恶性程度高,诊断时多为进展期且多合并肝脏及腹腔转移[8-9]。其5年生存率不足10%,中位生存期为12~22个月。截止随访结束时,本组病例共6例患者死亡,其中因肿瘤进展死亡5例,1例因肺部疾病死亡,中位生存时间15个月。部分患者甚至在治疗后1个月内即因肿瘤进展而死亡[2-3]。前期研究结果显示,胃ASC转移通常以腺癌转移模式为主。本研究中,9例淋巴结转移的患者中共6例以腺癌细胞,而鳞癌细胞仅1例,与其报道一致。诸多因素影响原发性胃ASC的预后,包括TNM分期、肿瘤大小、手术根治切除程度、P53蛋白表达情况及Ki-67阳性指数等。由于该肿瘤的罕见,本研究纳入病例少,尚不能进行预后因素的多因素分析,这也是本研究的不足支持。
总之,原发性胃ASC发病率不高,其腺癌和鳞癌成分均可发生远处转移,其恶性程度高,预后差。临床上需提高警惕以达早期诊断,早期治疗的目的。治疗上应以外科手术为主,同时辅以放化疗,可提高患者生存期。
[1]Ebi M,Shimura T,Yamada S,et al.A patient with gastric adenosquamous carcinoma with intraperitoneal free cancer cells who remained recurrence-free with postoperative S-1chemotherapy[J].Intern Med,2012,51(22):3125-3129.
[2]Bansal RK,Sharma P,Kaur R,et al.Primary gastric adenosquamous carcinoma in an Indian male[J].Indian J Pathol Microbiol,2014,56(4):416-418.
[3]Mori E,Watanabe A,Maekawa S,et al.Adenosquamous carcinoma of the remnant stomach:report of a case[J].Surg Today,2000,30(7):643-646.
[4]He YT,Wang XJ,Gong J,et al.Primary adenosquamous carcinoma of the jejunum[J].Pathol Int,2005,55(9):590-595.
[5]Yoshida K,Manabe T,Tsunoda T,et al.Early gastric cancer of adenosquamous carcinoma type:report of a case and review of literature[J].Jpn J Clin Oncol,1996,26(4):252-257.
[6]Hirano M,Ozamoto Y,Ichinose M,et al.A case of gastric adenosquamous carcinoma with peritoneal dissemination in which treatment with S-1plus paclitaxel therapy resulted in improved long-term survival[J].Gan To Kagaku Ryoho,2014,41(7):885-888.
[7]Ishiguro A,Takahata T,Hirose K,et al.A case of gastric adenosquamous carcinoma successfully treated with second-line chemotherapy (CPT-11and CDDP)[J].Gan To Kagaku Ryoho,2010,37(8):1579-1582.
[8]Kim YS,Heo WS,Chae KH,et al.Clinicopathological features and differences of p53and Ki-67expression in adenosquamous and squamous cell carcinomas of the stomach[J].Korean J Gastroenterol,2006,47(6):425-431.
[9]蒋楠,邓靖宇,刘勇,等.淋巴结转移阴性的低分化和未分化胃腺癌的预后因素分析[J].中华消化外科杂志,2014,13(8):629-632.
王俊伟(1976-),主治医师,硕士,主要从事临床胃肠肿瘤研究。
10.3969/j.issn.1671-8348.2016.29.030
R735.2
B
1671-8348(2016)29-4125-03
2016-03-18
2016-06-06)

