NOX 与2型糖尿病肾功能及尿清蛋白排泄率的相关性研究
龙 敏,吴垣辕,赵 露,刘东方
(重庆医科大学附属第二医院内分泌科 400010)
NOX 与2型糖尿病肾功能及尿清蛋白排泄率的相关性研究
龙 敏,吴垣辕,赵 露,刘东方
(重庆医科大学附属第二医院内分泌科 400010)
目的 探讨2型糖尿病患者尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)的变化与肾功能及尿清蛋白排泄率(UAER)的关系,并分析比较氧化应激指标与糖尿病肾脏损害程度的相关性。方法 将100例2型糖尿病患者,排除感染应激和急慢性代谢紊乱,其中,50例为无肾病糖尿病组,另50例患者为糖尿病性慢性肾脏疾病(DKD)组,健康对照组50例。测定2组患者空腹血糖、肾小球功能、血和尿肌酐水平,以及血中糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、NOX、8-羟基脱氧鸟苷(8-OHdG)、丙二醛(MDA)、超氧化物歧化酶(SOD)水平。同时留取所有受试者3次不同时间清洁尿液检测尿清蛋白与尿肌酐比值,计算UAER。结果 无肾病糖尿病组体内NOX、8-OHdG、MDA明显高于健康对照组,SOD明显低于健康对照组;而DKD患者NOX、8-OHdG UAER明显高于无肾病糖尿病组,Logistic回归分析显示NOX与DKD更为紧密(OR=1.199,P<0.01)。结论 与3个氧化应激指标8-OHdG、MDA、SOD相比,NOX更能确切地反映2型糖尿病肾病患者体内的氧化应激水平,即NOX是反映氧化应激水平与2型糖尿病肾脏损害相关的更为理想的指标。
糖尿病,2型;肾功能;尿清蛋白排泄率;尼克酰胺腺嘌呤二核苷酸磷酸氧化酶
慢性肾脏疾病(chronic kidney disease,CKD)是糖尿病的常见并发症,其中,以糖尿病性肾脏疾病(diabetic kidney disease,DKD)最常见,据调查我国30岁以上的成人2型糖尿病中约63.9%的患者合并了慢性肾脏疾病,而国外的数据表明DKD是引起终末期肾脏疾病的首要原因[1-2]。DKD是遗传因素与环境因素等共同作用的结果,其发病机制较为复杂,高血糖引起的氧化应激在诸多机制中扮演重要角色。传统的氧化应激指标包括8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguanosine urin,8-OHdG)、丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)等。活性氧(reactive oxygen species,ROS) 被认为是氧化应激的主要原因,包括超氧阴离子(O2-)、羟自由基和过氧化氢等。尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NADPH oxidase,NOX)是人类发现的第1个主要产生ROS的酶,也被称为ROS产生的“心脏”[3-4]。研究发现,NOX的同工酶在肾脏的分布具有区域和细胞特异性,其与DKD的关系目前在国际上受到关注,国内相关的研究报道较少[5-7]。研究表明,NOX及其产物ROS通过改变肾脏血流动力学、影响肾内基质重损伤和肾小球基底膜等多方面对DKD的进展可能起关键作用,但具体机制仍不清楚。本研究拟探讨2型糖尿病患者其NOX的变化与肾脏功能及尿清蛋白排泄率(UAER)的关系,并比较NOX及传统氧化应激指标与糖尿病(DM)肾脏损害程度的相关性。
1 资料与方法
1.1 一般资料 本研究入组的所有患者均签署知情同意书,治疗方案均经过本院医学伦理委员会批准。按照WHO 1999年DM诊断标准,筛选2014年5月至2015年5年在本院内分泌科住院部及门诊就诊的100例2型糖尿病患者,男女各50例,UAER正常(男性UACR<2.5mg/mmoL,女性UACR<3.5mg/mmoL)的患者为无肾病DM(DM)组,而肾小球滤过率(eGFR)<60mL·min-1·1.73m-2和(或)男性UAER> 2.5mg/mmoL,女性UAER > 3.5mg/mmoL并排除其他原因肾病的患者为DKD组50例(具体资料见表1)。50例年龄性别匹配的健康自愿者(健康对照组)来自本院常规体检的市民,既往均无DM、慢性阻塞性肺疾病、原发性高血压、高脂血症及冠状动脉粥样硬化性心脏病等慢性病病史,体检及实验室检查各项指标均正常。两组患者在年龄、性别、症状及病程等方面相比,差异无统计学意义 (P>0.05),具有可比性。排除标准:(1)年龄小于18岁或大于70岁者;(2)1型糖尿病患者;(3)伴有DM急性并发症(高渗性非酮症糖尿病昏迷或糖尿病酮症酸中毒)者;(4)合并各种急慢性感染性疾病或急性代谢紊乱的患者;(5)有心脏、肝脏及其他肾脏疾病者;(6)近期有创伤病史、手术史或患有恶性肿瘤者;(7)已行透析的糖尿病肾病患者。
1.2 方法 被检者过夜禁食(8~10h),次日抽取空腹静脉血,离心后收集上层血清,测定空腹血糖、肾小球功能,用肌氨酸氧化酶法(四川迈克生物科技股份有限公司)检测血液和尿肌酐水平;用高效液相色谱法(美国Bio-Rad公司)检测糖化血红蛋白(HbA1c)、NOX和8-OHdG水平检测均采用酶联免疫吸附测定(ELISA,德国IBL公司);使用三酰甘油(TG)测定试剂盒(GPO-PAP法,四川迈克生物科技公司)测定TG;使用总胆固醇测定试剂盒(COD-CE-PAP法,四川迈克生物科技公司)测定总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C);使用水溶性四唑盐-1法(WST-1,德国IBL公司 )检测SOD;使用硫代巴比妥酸法(TBA,南京建成生物工程研究所)检测MDA。测量被检者血压、身高、体质量、腰围、臀围,采用校正简化的 MDRD公式计算eGFR,体质量指数(BMI)=体质量(kg)/身高2(m2)。所有受试者于抽血当日坐位休息30min后,清洁外阴,留取中段晨尿1次,间隔1或2周后再留取尿液1次,3次尿液均送生化室检测尿清蛋白与尿肌酐比值。使用尿微量清蛋白测定试剂盒(免疫比浊法,中生北控生物科技公司)检测尿微量清蛋白,计算UAER,如eGFR<60mL·min-1·1.73m-2和(或)男性UAER>2.5mg/mmoL,女性UAER>3.5mg/mmoL并排除其他原因肾病的定义为DKD[8]。

2 结 果
2.1 3组氧化应激和肾损害相关指标的变化 无肾病DM组与健康对照组比较,二者eGFR、UAER值差异无统计学意义(P>0.05),而无肾病DM组的NOX、8-OHdG、MDA指标均高于健康对照组(P<0.05),无肾病DM组的SOD低于健康对照组,差异有统计学意义(P<0.05);DKD组与健康对照组比较,二者eGFR、SOD值低于健康对照组,差异有统计学意义(P<0.05),而DKD组的NOX、UAER、8-OHdG、MDA指标均高于健康对照组,差异有统计学意义(P<0.05);DKD组与无肾病DM组比较,SOD、MDA值差异无统计学意义(P>0.05),而DKD组的eGFR值低于无肾病DM组,差异有统计学意义(P<0.05),DKD组的UAER、8-OHdG、NOX值均高于无肾病DM组,差异有统计学意义(P<0.05),见表2。
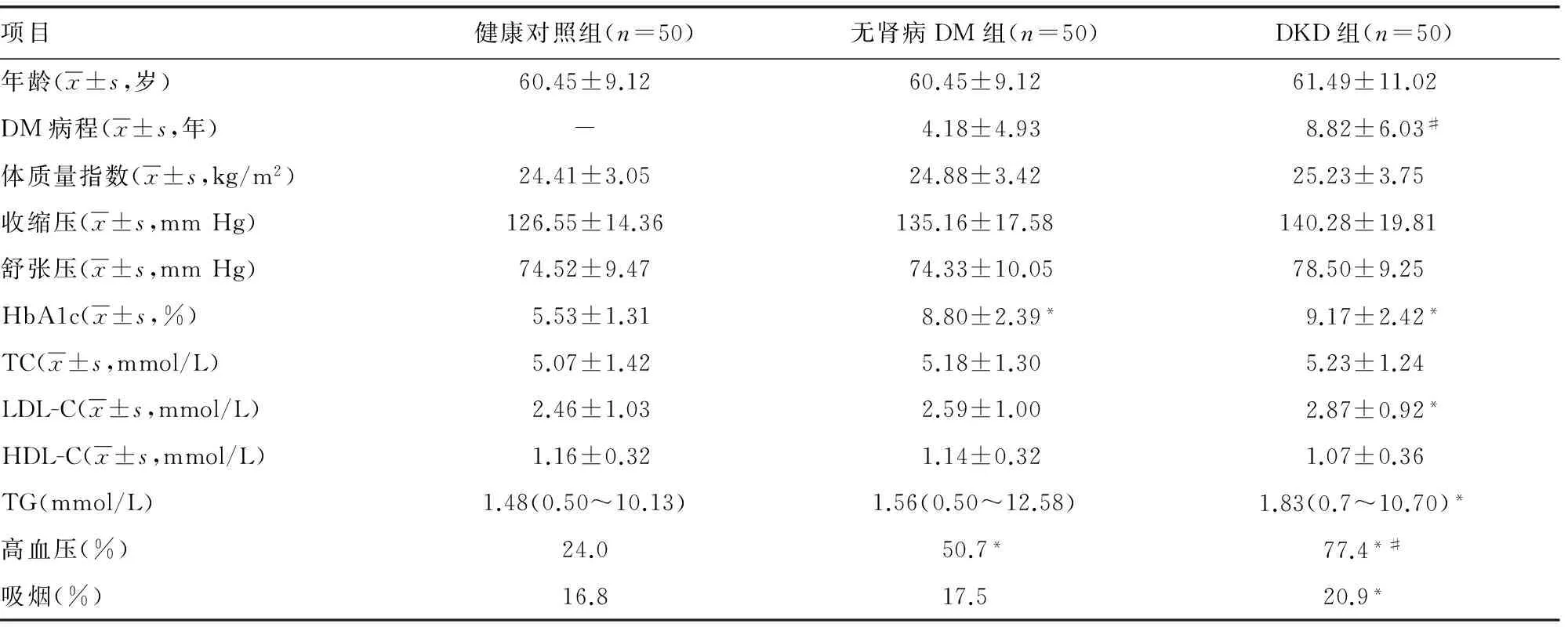
表1 临床资料和实验室指标比较
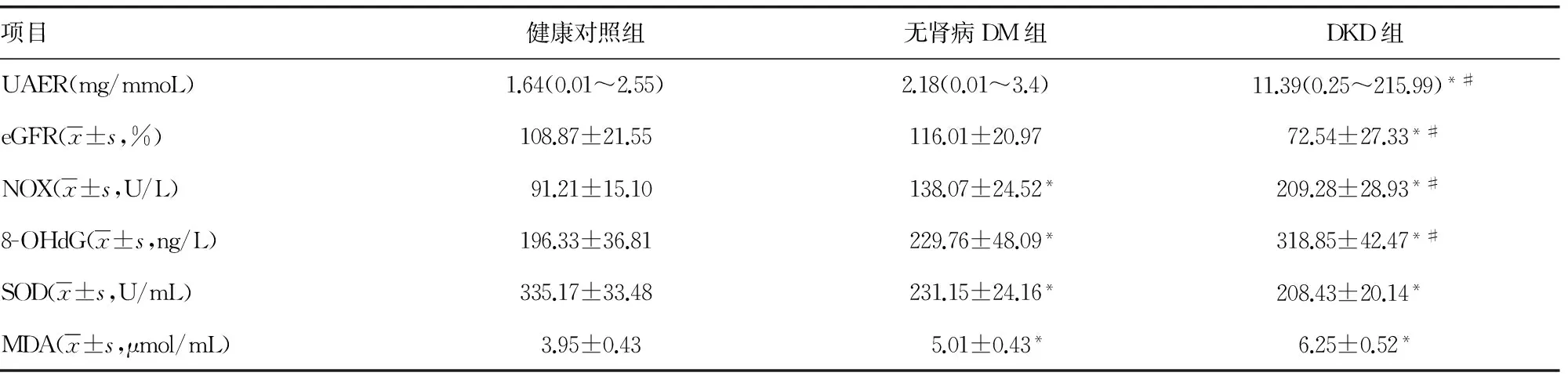
表2 各组氧化应激和肾脏损害相关指标比较
2.2 2型糖尿病肾病的Logistic回归分析 2型糖尿病肾病与BMI、高脂血症、吸烟无相关性(P>0.05),2型糖尿病肾病与患者年龄、高血压、DM病程、HbA1c、NOX、8-OHdG、SOD、MDA呈正相关(OR=1.025,1.720,1.028,1.137,1.199,1.791,1.067,0.940,P<0.05),而NOX与2型糖尿病肾病则更为紧密(OR=1.199,P<0.01),见表3。
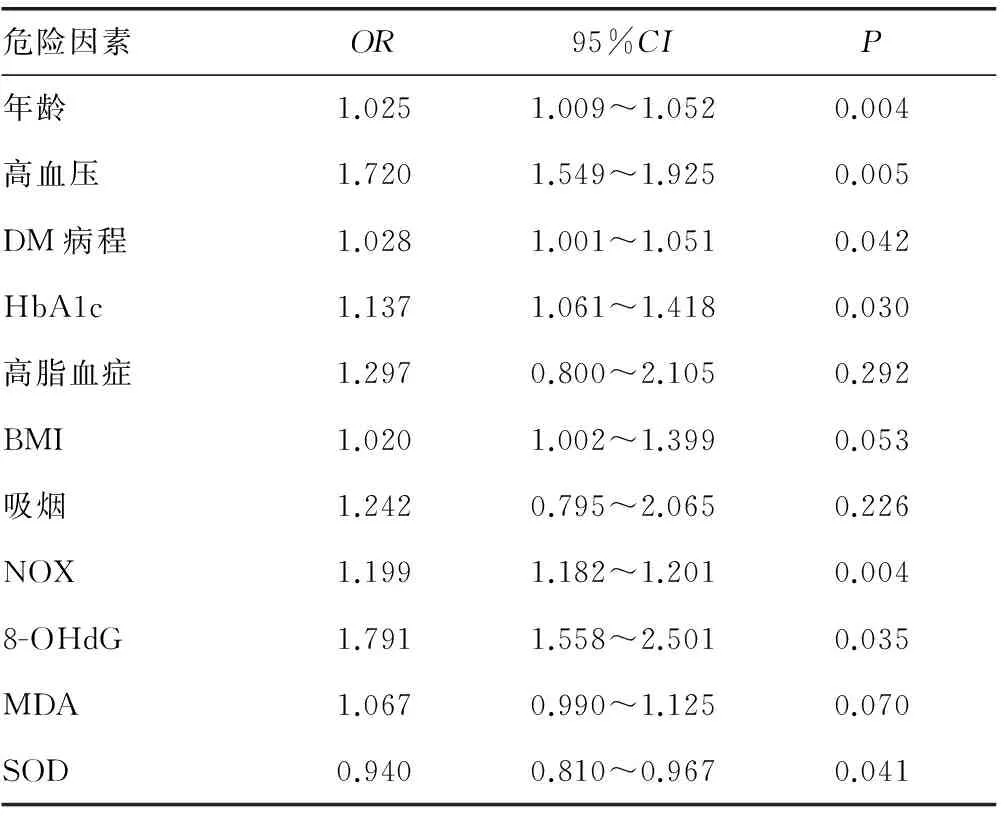
表3 相关因素在2型糖尿病肾病患者的Logistic回归分析
3 讨 论
氧化应激作用在2型糖尿病及其并发症的发生、发展过程中发挥着重要作用。既往研究表明,各种因素导致过强的氧化应激作用可通过抑制胰岛β细胞的分泌功能、促使胰岛β细胞凋亡及破坏胰岛素作用的信号转导通路等诸多机制,使机体的胰岛功能发生障碍,从而促进DM的发生、发展[7]。研究表明,MDA和SOD是较早和经典的氧化应激相关指标,SOD是体内主要的抗氧化物质之一,反映机体的抗氧化应激能力。而MDA是ROS过氧化反应的最终产物,其含量可体现机体过氧化反应的程度。8-OHdG是DNA氧化应激损伤的主要和特异性产物,可反映机体DNA氧化应激损伤水平。NOX广泛分布于体内多种非吞噬细胞,目前发现其有7种同工酶。NOX 产生的ROS 是线粒体外ROS 的主要来源。已有的研究表明,NOX在DM胰岛功能失调、胰岛素抵抗、血管功能紊乱等发病机制中都起重要作用[3-4,8]。
本研究采用NOX、8-OHdG、MDA及SOD 等氧化应激指标评估了单纯2型糖尿病和DKD患者体内氧化应激状态,同时探讨了这些氧化应激指标与DKD的关系。研究发现,在无肾病的DM患者体内氧化应激各指标水平已经明显高于健康对照组,伴DKD的患者氧化应激水平更进一步升高,以NOX升高更显著。本研究显示DM患者体内8-OHdG、MDA、NOX已经显著高于健康对照组,SOD低于健康对照组,表明DM患者氧化应激水平显著升高,而抗氧化能力显著降低。
本研究中的DM患者血糖控制不佳,平均HbA1c都在9%左右,高血糖使氧化应激处于高度活跃的状态,导致体内ROS水平增高。过多的ROS会通过不同机制进一步导致DM慢性并发症的发生。本研究表明,虽然8-OHdG、MDA、SOD和NOX 4个反映氧化应激水平的指标,在DKD患者中都有明显变化,但NOX和8-OHdG升高更显著,Logistic回归分析显示NOX与DKD联系更为紧密。表明与前3个氧化应激指标所反映的氧化应激水平相比,NOX能更好地反映机体氧化应激水平,表明NOX是反映机体氧化应激水平与DM肾脏损害之间更为确切的指标。在NOX的7种亚型中,目前研究发现与DKD 病理机制密切相关的NOX同工酶主要报道的是NOX4[9-10]。
研究表明,生理剂量的活性氧本身是在人体的生理功能中起重要作用,比如细胞功能,激素合成,基因的表达等,但是当氧化应激导致ROS产生过多就会引起炎症或者纤维化的发生,导致一系列病理机制的激活[11-12]。动物实验发现,高糖可促进机体肾脏NOX4和NOX5表达升高,从而引起足细胞的持续氧化应激损伤,继而产生大量蛋白尿[13]。DKD患者或者动物模型的肾脏局部p47phox等NOX重要功能亚基表达显著增加,从而引起活性氧产生过多。过多NOS损害肾脏的可能机制有:(1)过多的ROS引起肾脏血流动力学障碍,内皮舒张功能受损。当NOX激活,ROS产生过度时,一氧化氮的生物活性降低,从而导致内皮依赖性血管舒张功能下降,肾小球囊内压增高,继而导致内皮细胞功能损伤甚至肾血管性高血压。(2)NOX 过度表达时,ROS的表达相应升高,从而肾脏系膜细胞基质聚集、肾脏形成纤维化、继而导致足细胞损伤。基因敲除p47(phox-/-)或者抑制肾脏NOX的表达肾脏氧化应激损伤,系膜细胞增生及肾小球肥大等病理改变明显减轻[14-15]。
本研究通过检测多种氧化应激指标,评估其与DM肾脏损害的关系,发现NOX是与DM肾脏病变关系更密切的氧化应激标志物。由于NOX与DKD的密切关系,抑制NOX表达或许可以延缓DKD的进展,因此仍需要进一步深入研究。但由于本研究病例有限,关于NOX与DKD的密切关系还需进行大样本 、多中心临床试验进一步研究。
[1]Lu B,Song X,Dong X,et al.High prevalence of chronic kidney disease in population-based patients diagnosed with type 2diabetes in downtown Shanghai[J].J Diabetes Complications,2008,22(2):96-103.
[2]Tuttle KR,Bakris GL,Bilous RW,et al.Diabetic kidney disease:a report from an ADA Consensus Conference[J].Diabetes Care,2014,37(10):2864-2883.
[3]Subasinghe W,Syed I,Kowluru A.Phagocyte-like NADPH oxidase promotes cytokine-induced mitochondrial dysfunction in pancreatic β-cells:evidence for regulation by Rac1[J].Am J Physiol Regul Integr Comp Physiol,2011,300(1):12-20.
[4]Syed I,Kyathanahalli CN,Kowluru A.Phagocyte-like NADPH oxidase generates ROS in INS 832/13cells and rat islets:role of protein prenylation[J].Am J Physiol Regul Integr Comp Physiol,2011,300(3):756-762.
[5]Gill PS,Wilcox CS.NADPH oxidases in the kidney[J].Antioxid Redox Signal,2006(8):1597-1607.
[6]Nistala R,Whaley-Connell A,Sowers JR:Redoxcontrol of renal function and hypertension[J].Antioxid Redox Signal,2008(10):2047-2089.
[7]GracianoMF,SantosLR,CuriR,etal.NAD(P)Hoxidaseparticipatesinthepalmitate-inducedsuperoxideproductionandinsulinsecretionbyratpancreaticislets[J].JCellPhysiol,2011,226(4):1110-1117.
[8]Supale S,Li N,Brun T,et al.Mitochondrial dysfunction in pancreatic β cells[J].Trends Endocrin Met,2012,23(9):477-487.
[9]Sukumar P,Viswambharan H,Imrie H.Nox2NADPH oxidase has a critical role in insulin resistance-related endothelial cell dysfunction[J].Diabetes,2013(62):2130-2134,
[10]Thallas-Bonke V,Jha JC,Gray SP,et al.Nox-4deletion reduces oxidative stress and injury by PKC-α-associated mechanisms in diabetic nephropathy[J].Physiol Rep,2014,2(11):e12192-12197.
[11]Jay CJ,Stephen PG,David B,et al.Genetic targeting or pharmacologic inhibition of NADPH oxidase Nox4provides renoprotection in Long-Term diabetic nephropathy[J].J Am Soc Nephrol,2014(25):1237-1254.
[12]Yu P,Han W,Villar VA,et al.Villar,Unique role of NADPH oxidase 5in oxidative stress in human renal proximal tubule cells[J].Redox Biol,2014(2):570-579.
[13]Sedeek M,Nasrallah R,Touyz RM.NADPH oxidases,reactive oxygen species,and the kidney:friend and foe[J].J Am Soc Nephrol,2013(24):1512-1518.
[14]Eid AA,Gorin Y,Fagg BM,et al.Mechanisms of podocyte injury in diabetes:role of cytochrome P450and NADPH oxidases[J].Diabetes,2009,58(5):1201-1211.
[15]Liu GC,Fang F,Zhou J,et al.Deletion of p47phox attenuates the progression of diabetic nephropathy and reduces the severity of diabetes in the Akita mouse[J].Diabetologia,2012,55(9):2522-2532.
The relationship between NOX,kidney function and urinary albumin excretion rate in patients with type 2diabetes mellitus
Long Min,Wu Yuanyuan,Zhao Lu,Liu Dongfang
(Department of Endocrinology,the Second Affiliated Hospital of Chongqing Medical University,Chongqing 400010,China)
Objective To observe the relationship between the change of NOX and renal function and urinary albumin excretion rate(UAER) in type 2diabetes patients,and demonstrates the relationship of oxidative stress indicators and diabetic kidney damage.Methods Totally 100cases of patients with type 2diabetes mellitus,eliminated infection stress and acute and chronic metabolic disorder,of which 50cases for non diabetic nephropathy group and the other 50cases of patients for diabetic chronic kidney disease (DKD) group;healthy control group (50cases).The levels of FBG,renal function,Cr in blood and urine,HbA1c,TG,TC,LDL,NOX,8-OHdG,MDA,SOD were measured.While specimens from all subjects at three different time of clean urine urine albumin / creatinine ratio were calculated for UAER.Results Compared with healthy control group,diabetes with non kidney disease group had higher NOX,8-OHdG,MDA,and had significantly lower level in the serum SOD level;but compared with diabetes with non kidney disease group,the DKD group had even higher in UAER,NOX,8-OHdG,Logistic regression analysis revealed that NOX were positively associated with DKD(OR=1.199,P<0.01).Conclusion Compared with serum 8-OHdG,MDA and SOD,the serum NOX level can more accurately reflect the level of oxidative stress in the body,and can be as an ideal index to reflecting the relationship between oxidative stress and diabetes chronic kidney damage.
diabetes mellitus,type 2;renal functions;urinary albumin excretion rate;nicotinamide adenine dinucleotide phosphate oxidase
龙敏(1970-),主治医师,硕士,主要从事糖尿病与骨质疏松研究。
论著·临床研究
10.3969/j.issn.1671-8348.2016.29.011
R587.1
A
1671-8348(2016)29-4065-03
2016-02-18
2016-04-06)

