阿瑞吡坦三联疗法预防和改善顺铂恶心呕吐临床疗效
何永明,俞 晨,李伟兵
(江苏省肿瘤医院 中西医结合科,江苏 南京 210009)
阿瑞吡坦三联疗法预防和改善顺铂恶心呕吐临床疗效
何永明,俞 晨*,李伟兵
(江苏省肿瘤医院 中西医结合科,江苏 南京 210009)
目的:研究阿瑞吡坦三联疗法在预防和改善顺铂化疗导致恶心呕吐方面的疗效。方法:选择患有肺癌、食管癌、生殖系统肿瘤患者共40位,随机分为单独组和合并组,其中单独组使用大剂量顺铂化疗方案(60 mg/m2)加帕洛诺司琼联合地塞米松止吐治疗,合并观察组在使用大剂量顺铂化疗(60 mg/m2)方案化疗同时开始口服阿瑞吡坦,连用3 d,同时给予帕洛诺司琼以及地塞米松方案,比较两组使用后恶心呕吐的发生率以及生活质量、消化道反应情况。评估患者在整个治疗过程中达到CR(患者完全没有恶心呕吐)和CC(完全控制率)的百分比,其中没有呕吐或者干呕、没有恶心或者有轻微恶心感觉的患者我们都认为疗效评价为CC,在急性期(化疗第1 d)和延迟期(化疗第2~5 d)分别做了评估,同时对影响恶心和呕吐症状的危险因素进行了调查。结果:40例患者,在化疗急性期,合并组能达到CR的患者有30个,达到75%,而单独组患者为20个,达到50%,有明显统计学差异(P<0.05);而在延迟期,合并组能达到CR的患者有28个,单独组只有14个,合并组绝大多数病人在化疗后以及化疗过程中能正常进食,评估各组危险因子单因素方差分析后发现性别和怀孕期间妊娠反应大以及情绪容易波动接近于有统计学意义,而多因素方差分析均无统计学意义。结论:在恶性肿瘤患者化疗过程中,大剂量使用顺铂化疗后,阿瑞吡坦联合帕洛诺司琼以及地塞米松的三联疗法是优于单用帕洛诺司琼和地塞米松的,三联疗法对于以顺铂为基础药物的化疗方案是具有优势和发展前景的。
顺铂恶心呕吐;高致吐化疗;阿瑞吡坦;完全反应率
化疗引起的恶心呕吐是化疗后最严重以及最常见的并发症之一,它进一步诱发了水电解质紊乱和循环衰竭,阻止了化疗的延续。因此,持续的肿瘤治疗方案中也包括对化疗病人生活质量的评估以及化疗的整体性,对于化疗的患者来说,止吐是必须的。化疗药物诱导的恶心呕吐包括急性呕吐期(发生在化疗后0~24 h)以及延迟性呕吐(发生在化疗后至少24 h后),5-HT拮抗剂的出现广泛改善了化疗急性期的恶心呕吐反应,然而化疗延迟期的恶心呕吐反应仍然存在比较严重的问题。
在肿瘤诱导的恶心呕吐反应的病理生理学机制中,化疗药物刺激胃肠粘膜的嗜铬细胞释放5-HT3,与肠道部位的5-HT受体结合,该通路主要与急性恶性呕吐有关,另外它还刺激呕吐中枢的化疗感受器,释放神经递质P物质,通过诱导存在于大脑呕吐中枢密集区域的中枢介质神经激肽(NK-1)紧密结合在一起,该通路主要与迟发性恶心呕吐有关。因此在NCCN指南和ASCO指南以及MASCC指南中均建议同时抑制这两种介质[1-3],在这些所有的指南中,顺铂都是一种高致吐的化疗药,并且顺铂在化疗呕吐急性期(24 h内)以及延迟期(2~5 d)都有较强的致吐性[4-5],化疗药物可通过中枢和外周两条通路引起呕吐反射。止吐药的使用指南中推荐对于高致吐的化疗药使用一种NK1受体拮抗剂,一种5-HT3受体拮抗剂联合地塞米松。对于使用中度致吐化疗药来说,使用5-HT3受体拮抗剂联合地塞米松或者5-HT3受体拮抗剂联合地塞米松再加上阿瑞吡坦,一种NK1拮抗剂。选择性5-羟色胺拮抗剂的出现,有报道对于顺铂引起的恶心呕吐的患者来说格拉司琼联合地塞米松优于胃复安联合地塞米松[6],后来发现NK-1受体和化疗导致的恶心呕吐有关联[7],P物质在中枢神经系统中和NK-1受体联合在一起,NK-1受体被认为是止吐治疗的一个新的靶点[8-9]。NK-1受体拮抗剂阿瑞吡坦并列入NCCN指南,阿瑞吡坦是一种有新的作用机制的NK-1受体拮抗剂[10],它在中枢神经系统中抑制P物质和NK-1受体结合,高亲和性的占领大脑中NK-1受体,可穿过血脑屏障,高效拮抗P物质,当它和传统止吐药联合应用时同时抑制了急性期和延迟期化疗诱导恶心呕吐反应[11]。阿瑞吡坦被列入日本药品价格表,它的优势性在于对延迟性恶心呕吐效果较好,而延迟性恶心呕吐目前为止控制效果欠佳[12-13],另一种5-羟色胺阻滞剂帕洛诺司琼,它有较长的半衰期,治疗化疗引起的延迟性恶心呕吐更加有效[14],目前这两种止吐药已经获批,但在国内外很少有关于这两药联合的报道,尤其是关于大规模的临床实验[15]。
有鉴于此,本实验选择患有肺癌、食管癌、生殖系统肿瘤患者共40位,随机分为单独组和合并组,其中单独组使用大剂量顺铂化疗方案(60 mg/m2)加帕洛诺司琼联合地塞米松止吐治疗,合并观察组在使用大剂量顺铂化疗(60 mg/m2)方案化疗同时开始口服阿瑞吡坦,连用3 d,同时给予帕洛诺司琼以及地塞米松方案,比较两组使用后恶心呕吐的发生率以及生活质量、消化道反应情况。评估患者在整个治疗过程中达到CR(患者完全没有恶心呕吐)和CC(完全控制率)的百分比,其中没有呕吐或者干呕、没有恶心或者有轻微恶心感觉的患者我们都认为疗效评价为CC,在急性期(化疗第1 d)和延迟期(化疗第2~5 d)分别做评估,同时对影响恶心和呕吐症状的危险因素进行了调查。
1 材料与方法
1.1 研究对象
本实验选择了40例接受包含顺铂(>=60 mg/m2)为主的化疗方案,这些患者在2014年1月到2016年4月期间,在江苏省肿瘤医院住院治疗的肺癌,食管癌,生殖系统肿瘤患者,细胞学或者病理确诊,中位年龄52岁,男21例,女19例,所有患者均接受顺铂>=60 mg/m2以及其他化疗药物联合化疗方案治疗,年龄15~75岁,体力评分0~2分,至少接受1 d的顺铂治疗。排除标准:排除在抗肿瘤治疗前有恶心呕吐症状的患者,排除不能接受口服药的患者,不能正确回答问题的患者,对阿瑞吡坦过敏以及不适合这项研究的患者。
1.2 实验方法
所有患者都使用高致吐性顺铂方案化疗,同时予以止吐治疗,随机分为两组,合并实验组20例,使用阿瑞吡坦联合帕洛诺司琼联合地塞米松,单独组20例仅使用帕洛诺司琼联合地塞米松止吐治疗。合并实验组阿瑞吡坦给药125 mg,第1 d化疗前30 min,80 mg,第2 d和第3 d早晨口服阿瑞吡坦,顺铂化疗前30 min,使用帕洛诺司琼0.25 mg静脉推注,地塞米松化疗过程中5 mg静滴每日1次。比较两组使用后恶心呕吐的发生率以及生活质量、消化道反应情况。评估患者在整个治疗过程中达到CR(患者完全没有恶心呕吐)和CC(完全控制率)的百分比。
1.3 检测指标
为了观察患者化疗后的恶心呕吐反应,根据MASCC指南制作了一个量表,详见表1,观察患者从顺铂给药第1 d到第5 d的恶心呕吐反应,记录患者变化,每日向病人询问。急性呕吐期指患者化疗后24 h内发生的恶心呕吐,延迟性呕吐指患者化疗后第2 d至第5 d发生的恶心呕吐,恶心症状用一个数字化的量表进行划分(NRS, 0代表无恶心,10代表很差的不能忍受的恶心),结果进行了分类,其中0~2代表无症状或者症状轻微,3~6代表中等症状,7~10代表症状严重,关于呕吐的症状,呕吐次数包括干呕根据NCI-CTCAE ver.4.0标准进行评估,选择在一天的化疗后呕吐大于5 min的次数进行分别标识,1表示没有发现呕吐,2表示呕吐1~2次,3表示呕吐3~5次,4表示呕吐超过6次,没有任何恶心呕吐症状的病人被认为疗效评价达到CR,即为完全缓解,没有呕吐或者干呕,没有恶心或者有轻微的恶心感觉的患者我们认为疗效评价CC,即为基本控制,同时研究了年龄,性别,是否长期吸烟,阿片类药物的使用,是否容易情绪波动,是否长期饮酒,以及女性患者既往妊娠后呕吐史这些曾有文献记录的危险因素[16]。对两组中度以及重度恶心呕吐症状患者不同的危险因素进行评估。

表1 化疗药物所致呕吐程度的分级
2 结果与分析
2.1 CC和CR结果
CC和CR结果如图1所示,在使用强致吐药物顺铂化疗的过程中,急性期(化疗第1 d)使用三联疗法止吐药的合并实验组达到CR的患者有30个,占患者总人数的75%,未使用阿瑞吡坦的单独组达到CR的患者有20个,占总人数的50%,是有统计学差异的(P<0.05),而延迟期(化疗后第2~5 d)合并实验组达到CR的患者有28个,占总人数的70%,单独组达到CR的患者有14个,占35%,有显著统计学差异(P<0.05),急性期(化疗第1 d)合并实验组达到CC的患者有32个,占总人数的80%,单独组达到CC的患者有28个,占总人数的70%,无明显统计学差异(P>0.05)。延迟期(化疗后第2~5 d)合并实验组达到CC的患者有32个,占总人数的80%,单独组达到CC的患者有16个,占总人数的40%,有明显统计学差异(P<0.05)。以上结果提示阿瑞吡坦在恶心呕吐急性期和延迟期都有明显的抑制恶心呕吐作用,在延迟期作用更强。
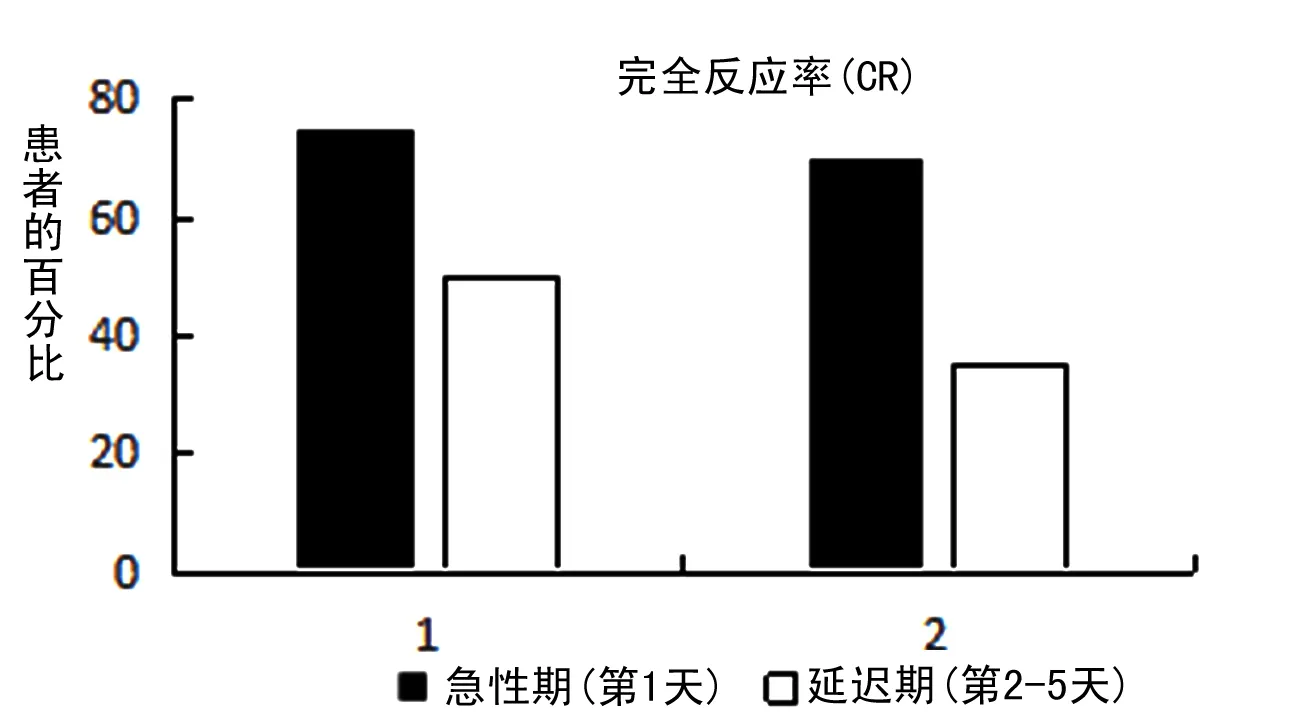

图1 合并实验组和单独组CC和CR比较
2.2 危险因素分析结果
Takeshi[22]等研究发现女性、非老年人、既往对抗肿瘤药物有呕吐史、没有饮酒史,情绪容易激动的患者都是能影响止吐治疗的危险因素,故选择了一些可能影响止吐治疗的危险因子,观察在恶心呕吐剧烈的患者中的变化,多种危险因素的分析结果表明,单因素方差分析中性别(P=0.085)和怀孕期间妊娠反应大(P=0.056)以及情绪容易波动(P=0.054)三种因素接近于统计学差异,但是在多因素方差分析中没有统计学差异(表2)。

表2 中度或者重度恶心呕吐反应的危险因素分析表
3 结论与讨论
恶心呕吐是临床上常见的症状之一,可由多种不同的疾病和病理生理机制引起,两者可相互伴随,姑息治疗、怀孕妊娠期、术后以及化疗的患者均有可能出现恶心呕吐症状,大约70 %~80 %的化疗患者有恶心呕吐风险,化疗早期有30 %的患者出现预期的恶心,有20 %的患者出现预期的呕吐,神经递质和存在于胃肠道的周围性神经受体或者存在于中枢神经系统的中枢性神经受体结合之后,触发脑干呕吐中枢感应呕吐反射,引起恶心呕吐。与恶心呕吐有关的神经递质有:非肽类神经递质(多巴胺,组胺,5-羟色胺,乙酰胆碱),神经肽类神经递质(阿片类,P物质,血管加压素)。引起恶心呕吐的化疗药物中顺铂为强致吐药物, 目前5-HT3受体拮抗剂联合地塞米松是防治化疗所致恶心呕吐的标准方案,但仍有一部分患者在化疗过程中出现严重的恶心、呕吐而不能耐受[18]。
帕洛诺司琼是高选择性5-HT3受体拮抗剂,可结合周围神经系统内5-HT3受体,阻断呕吐反射过程中神经介质的化学传递,从而对化疗引起的恶心呕吐起到防治作用,较其他5-HT3受体拮抗剂来说其具有半衰期长亲和力高的特点。阿瑞吡坦通过在中枢神经系统抑制P物质和NK-1受体结合,通过血脑屏障,从而抑制恶心呕吐反应,具有选择性和高亲和性,对迟发性恶心呕吐疗效显著[19]。对于目前顺铂化疗后急性以及延迟性呕吐来说,阿瑞吡坦三联疗法优于不用阿瑞吡坦仅使用帕洛诺司琼和地塞米松方案,一个日本的2期临床试验表明使用了高剂量的顺铂(>=70 mg/m2)联合5 d阿瑞吡坦止吐治疗的CR率高于安慰剂[17],目前譬如说肺癌的治疗方案中,一线的治疗方案包括培美曲塞二钠(500 mg/m2)联合顺铂(75 mg/m2)的方案化疗治疗。对于肺癌患者来说,顺铂为第一选择。阿瑞吡坦是细胞色素P4503A4(CYP3A4)的剂量依耐性中度抑制剂和诱导剂,阿瑞吡坦对CYP3A4有抑制作用[20],皮质激素为CYP3A4的作用底物,故阿瑞吡坦与皮质激素等联用理论上可增加用药时曲线下面积[21]。因此,阿瑞吡坦联合5-HT3拮抗剂、地塞米松具有协同作用,可更好地控制高致吐性化疗引起的恶心、呕吐发生率。
本实验表明使用阿瑞吡坦后急性期和延迟期恶心以及呕吐反应的CC和CR均有上升,并且具有统计学差异,与文献报道的结果一致。本实验亦表明危险因素分析中性别、既往怀孕妊娠反应大以及情绪波动大也可能是诱发恶心呕吐反应的诱因之一,避免情绪波动,转移注意力,适当自我调节也是有止呕作用的。
[1]BOWEN J M, ELAD S, HUTCHINS R D, et al. Methodology for the MASCC/ISOO mucositis clinical practice guidelines update[J]. Supportive Care in Cancer, 2013, 21(1): 303-308.
[2]BASCH E, PRESTRUD A A. Hesketh PJ,et al. antiemetics:American society of clinical oncology clinical practice guideline update[J]. Journal of Clinical Oncology, 2011(29): 4189-4198.
[3]WOOD D E. National comprehensive cancer network (NCCN) clinical practice guidelines for lung cancer screening[J]. Thoracic Surgery Clinics, 2015, 25(2): 185.
[4]ROILA F, HESKETH P J, HERRSTEDT J, et al. Prevention of chemotherapy- and radiotherapy-induced emesis: results of the 2004 Perugia International Antiemetic Consensus Conference[J]. Annals of Oncology, 2006, 17(1): 20-28.
[5]HERRSTEDT J, ROILA F. ESMO guidelines working group chemotherapy-induced nausea and vomiting:ESMO clinical recommendations for prophylaxis[J]. Annals of Oncology, 2008(19): 110-112.
[6]OHMATSU H, EGUCHI K, SHINKAI T, et al. A randomized crossover study of high-dose metoclopramide plus dexamethasone versus granisetron plus dexamethasone in patients receiving chemotherapy with high-dose cisplatin[J]. Japanese Journal of Cancer Research : Gann, 1994(85): 1151-1158.
[7]TATTERSALL F D, RYCROFT W. Francis B, et al. tachykinin NK1 receptor antagonists act centrally to inhibit emesis induced by the chemotherapeutic agent cisplatin in ferrets[J]. Neuropharmacology, 1996(35): 1121-1129.
[8]HUSKEY S E, DEAN B J. Bakhtiar R, et al. brain penetration of aprepitant,a substance P receptor antagonist,in ferrets[J]. Drug Metabolism and Disposition, 2003(31): 785-791.
[9]HESKETH P J, VAN BELLE S. AaproM, et al. differential involvement of neurotransmitters through the time course of cisplatin induced emesis as revealed by therapy with specific receptor antagonists[J]. European Journal of Cancer, 2003(39): 1074-1080.
[10]RUPNIAK N M. New insights into the antidepressant actions of substance P(NK1 receptor)antagonists[J]. Canadian Journal of Physiology&Pharmacology, 2002, 80(5): 489-494.
[11]HESKETH P J, GRUNBERG S M. Gralla RJ, et al. the oral neurokinin-1 antagonist aprepitant for the prevention of chemotherapy-induced nausea and vomiting:a multinational,randomized,double-blind,placebo-controlled trial in patients receiving high-dose cisplatin-the aprepitant protocol 052 study group[J]. Journal of Clinical Oncology, 2003(21): 4112-4119.
[12]BASCH E, PRESTRUD A A, HESKETH P J, et al. American society of clinical oncology antiemetics:American society of clinical oncology clinical practice guideline update[J]. Journal of Clinical Oncology, 2011(29): 4189-4198.
[13]SAITO H, YOSHIZAWA H, YOSHIMORI K, et al. Efficacy and safety of single-dose fosaprepitant in the prevention of chemotherapy-induced nausea and vomiting in patients receiving high-dose cisplatin: a multicentre, randomised, double-blind, placebo-controlled phase 3 trial[J]. Annals of Oncology, 2013, 24(4): 1067-1073.
[14]SAITO M, AOGI K, SEKINE I, et al. Mitsuhashi S palonosetron plus dexamethasone versus granisetron plus dexamethasone for prevention of nausea and vomiting during chemotherapy:a double-blind,double-dummy,randomised,comparative phase III trial[J]. Lancet Oncology, 2009(10): 115-124.
[15]UCHINO J, HIRANO R, TASHIRO N, et al. Efficacy of aprepitant in patients with advanced or recurrent lung cancer receiving moderately emetogenic chemotherapy[J]. Asian Pacific Journal of Cancer Prevention, 2012, 13(8): 4187-4190.
[16]KOELLER J M, AAPRO M S, GRALLA R J, et al. Antiemetic guidelines: creating a more practical treatment approach[J]. Supportive Care in Cancer, 2002, 10(7): 519-522.
[17]TAKAHASHI T, HOSHI E. Takagi M, et al. multicenter,phase II,placebo-controlled,double-blind,randomized study of aprepitant inJapanese patients receiving high-dose cisplatin[J]. Cancer Science, 2010(101):2455-2461.
[18]GRUNBERG S M, DEUSON R R, MAVROS P, et al. Incidence of chemotherapy-induced nausea and emesis after modernantiemetics[J]. Cancer, 2004, 100(10): 2261-2268.
[19]NAVARI R M. Aprepitant:a neurokinin-1 receptor antagonist for the treatment of chemotherapy-induced nausea and vomiting[J]. Expert Review of Anticancer Therapy, 2004, 4(5): 715-724.
[20]SANCHEZ R I, WANG R W, NEWTON D J, et al. Cytochrome P450 3A4 is the major enzyme involved in the metabolism of the substance P receptor antagonist aprepitant[J]. Drug Metabolism and Disposition, 2004, 32(11): 1287-1292.
[21]MCCREA J B, MAJUMDAR A K, GOLDBERG M R, et al. Effects of the neurokin in 1 receptor antagonist aprepitant on the pharmacokinetics of dexamethasone and methylprednisolone[J]. Pharmacology & Therapeutics, 2003, 74(1): 17-24.
[22]KITAZAKI T, FUKUDA Y, FUKAHORI S, et al. Usefulness of antiemetic therapy with aprepitant, palonosetron, and dexamethasone for lung cancer patients on cisplatin-based or carboplatin-based chemotherapy[J]. Supportive Care in Cancer, 2015, 23(1): 185-190.
(责任编辑:马世堂)
Aprepitant Triple Therapy to Prevent and Improve the Clinical Curative Effect of Cisplatin on Nausea and Vomiting
HE Yong-ming,YU Chen*,LI Wei-bing
(Integrated TCM & Western Medicine Department, Jiangsu Cancer Hospital, Nanjing 210009,China)
Objective: To investigate the aprepitant triple therapy in the prevention and improvement of curative effect of cisplatin chemotherapy which leads to nausea and vomiting.Methods:Patients with lung cancer, esophageal cancer, and with genital tumors in 40 patients were randomly divided into single group and combined group, using high dose cisplatin (60 mg/m2) Fagafaga Palo Nor granisetron combined with dexamethasone and antiemetic therapy, while the observation group were treated with high dose cisplatin (60 mg/m2) and chemotherapy oral aprepitant, for 3 d, while giving palonosetron and dexamethasone, and the incidence of gastrointestinal reactions and quality of life of nausea and vomiting between the two groups after use. Evaluation of patients reached CR in the whole course of treatment (with no nausea and vomiting) and CC (complete control rate) percentage, in which no vomiting or retching, no nausea or slight nausea patients we all think efficacy evaluation for CC in acute period (first days of therapy) and delayed phase (the chemotherapy 2~5 day) respectively have been evaluated, the factors that influence the risk of nausea and vomiting were investigated. Results: 40 patients in acute stage, chemotherapy, combined group can reach CR in 30, reached 75%, and a separate group of patients was 20, reached 50%, there was significant difference (P<0.05); and in the delay period, the combined group can reach CR in 28 patients, single group only 14, the combined group of most patients can eat normally after the chemotherapy and chemotherapy process, assessed risk factors for single factor variance analysis showed that gender and pregnancy pregnancy reaction and emotional volatility close to have statistical significance, but there were no significant variance analysis. Conclusion: in the course of chemotherapy in patients with malignant tumor, a large dose of cisplatin chemotherapy, aprepitant combined palonosetron and dexamethasone triple therapy is better than the single use of palonosetron and dexamethasone, triple therapy for cisplatin chemotherapy drugs is the advantages and development prospects.
Cisplatin Nausea and vomiting; High induced vomiting; Aprepitant; Complete response rate
2016-06-10
国家自然科学基金(81503526);江苏省干部保健科研课题(BJ15028)。
何永明(1975-),男,甘肃省永靖县人,博士,副主任医师,主要从事中西医结合肿瘤防治研究;*通讯作者:俞晨,主治医师,E-mail:41186709@qq.com。
R969.4
A
1673-8772(2016)05-0030-06

