菜芙蓉总黄酮纯化及其体内抗氧化性
仇 燕 ,李俊英,刘 畅,王志新,王申林
(河北科技大学生物科学与工程学院,河北石家庄 050018)
菜芙蓉总黄酮纯化及其体内抗氧化性
仇 燕 ,李俊英,刘 畅,王志新,王申林
(河北科技大学生物科学与工程学院,河北石家庄 050018)
为研究菜芙蓉总黄酮(TFA)的纯化条件及体内抗氧化性,采用AB-8大孔树脂静态吸附-洗脱工艺,控制纯化条件为上样液质量浓度0.1 g/mL,pH值为3.5,解吸液乙醇体积分数为70%,解吸液体积与树脂质量比为20∶1(mL/g)。在最优纯化条件下,黄酮的质量分数提高到48.50%;与正常对照组相比,实验组小鼠器官指数无显著差异(P>0.05);小鼠血清和肝组织中MDA含量显著低于正常对照组(P<0.05),而CAT,GSH-Px和SOD活性均高于正常对照组且具有明显的量效关系。实验结果表明,TFA具有良好的体内抗氧化效果。
中药学其他学科;菜芙蓉; 总黄酮; 纯化; 体内抗氧化性
Purification of total flavonoids ofAbelmoschusmanihot(L.)
菜芙蓉(Abelmoschusmanihot(L.)Medic),为锦葵科秋葵属一年生草本植物,主产于河北、河南、甘肃、山东等地。菜芙蓉花具有通淋、消肿、解毒等功效,是中国典籍记载的传统药食两用植物[1]。近年来的研究表明,菜芙蓉花提取物能够降低由CCl4诱导的肝脏损伤程度[2],降低脂肪细胞中甘油三酯的积累[3],保护肾小球。植物化学研究表明,菜芙蓉富含天然黄酮类化合物、还原糖类、鞣酸类及长链烃类化合物[4-5],其中菜芙蓉花中的生物黄酮含量达干重的5.63%[6],是目前已报道的黄酮类化合物含量最高的植物,具有很高的开发价值。过量的活性氧能够破坏生物大分子(如脂类、DNA及蛋白),诱发癌症、心血管疾病及其他疾病[7-9]。植物类黄酮是天然抗氧化剂,能够抑制氧化,降低体内自由基浓度,螯合金属离子,阻止脂质过氧化[10]。可见,富含天然抗氧化剂的食物对于维持身体健康至关重要,越来越受到人们的关注。

1 材料与仪器
1.1 试药与试剂
药品制备:菜芙蓉花,产自河北井陉县,于8月到10月早晨盛花时采摘,去掉花托后于2 h内进行微波干燥。将干燥至恒重的菜芙蓉干花粉碎,过150 μm(100目)筛。用体积分数为80%的乙醇于90 ℃回流提取2次[12],第1次以料液比15∶1(mL/g,下同)提取2 h,第2次以料液比7.5∶1提取1 h,合并抽滤得到滤液。将滤液经12 000 r/min离心15 min,真空减压浓缩,得到粗制的菜芙蓉花总黄酮粗提物浸膏,冷冻干燥后得到菜芙蓉总黄酮粗提物。将此菜芙蓉总黄酮粗提物溶于水,配置成不同浓度的上样液用于AB-8树脂吸附。将吸附后的树脂用一定体积分数的乙醇解吸液解吸,经真空减压浓缩至无醇味后冷冻干燥,得到TFA精制物,用于体内抗氧化实验。
动物分组:试验选用昆明种健康小鼠(清洁级),购于河北医科大学实验动物中心,体重20~25 g,雌性。将小鼠随机分为4组:正常对照组;TFA低剂量组(黄酮浓度为40 mg/(kg bw));TFA中剂量组(黄酮浓度为80 mg/(kg bw);TFA高剂量组(黄酮浓度为160 mg/(kg bw)。正常对照组灌胃同体积的生理盐水,试验组灌胃TFA。每组10只小鼠,连续灌胃42 d,每5天称重一次,依据每次称重的小鼠体质量调整给药剂量。
试剂:AB-8 大孔吸附树脂,天津光复精细化工研究所提供;芦丁标准品、金丝桃苷、槲皮素、杨梅素标准品,中国药品生物制品检定所提供;谷胱甘肽过氧化物酶测试盒、超氧化物歧化酶测试盒、过氧化氢酶测试盒、丙二醛测试盒,全部购于南京建成生物科技有限公司;乙腈、甲醇为色谱纯,其他试剂均为分析纯。
1.2 主要仪器
RE-52旋转蒸发器,上海亚荣生化仪器厂提供;Avanti J-26贝克曼高速离心机,美国贝克曼公司提供;UV-2000分光光度计,尤尼柯(上海)有限公司提供;Waters1525高效液相色谱仪(配有Waters2998二极管阵列检测器和Breeze2色谱工作站),美国Waters公司提供;SpectraMax plus384光吸收酶标仪,美国美谷分子公司提供。
2 试验方法
2.1 AB-8 大孔吸附树脂吸附条件的优化
用蒸馏水将菜芙蓉粗提物B溶解,配制成不同浓度的上样液。称取2 g预处理后并抽干的湿树脂,置于10 mL不同浓度的上样液中,于28 ℃,55 r/min 恒温摇床振荡吸附12 h后过滤,将滤液用蒸馏水定容至10 mL,测定滤液中菜芙蓉总黄酮浓度。分别考察上样液质量浓度(0.05, 0.1, 0.15, 0.2, 0.25 g/mL)和pH值(1, 1.5, 3.5, 5.5, 7.5)对 AB-8大孔吸附树脂吸附TFA的影响。
2.2 AB-8大孔吸附树脂解吸附条件的优化
称取2 g预处理后并抽干的湿树脂,分别置于pH值为3.5、质量浓度为0.2 g/mL的上样液中,振荡吸附12 h后过滤,用蒸馏水冲洗数次直至与Al(NO3)3反应无荧光显示。再加入30 mL不同体积分数的乙醇解吸液,于28 ℃,55 r/min恒温摇床振荡解吸附4 h后过滤。将滤液用原乙醇定容至30 mL,测定滤液中菜芙蓉总黄酮的浓度。分别考察解吸液乙醇体积分数(50%, 60%,70%, 80%, 90%)及解吸液乙醇体积与树脂质量比(5∶1, 10∶1, 15∶1, 20∶1, 25∶1 mL/g)对解吸TFA的影响。
2.3 菜芙蓉总黄酮吸附率和解吸率的测定
参照文献[13],测定黄酮浓度。于508 nm 处测定吸光度, 通过最小二乘法作线性回归, 得到标准曲线方程为y=14.154x-0.001 1(x为芦丁质量浓度,y为吸光度), 相关系数r=0.999 6。
取一定体积的待测液样,放入10 mL容量瓶中,用体积分数为80%的乙醇水溶液补加至5 mL,按上述方法测定吸光度值,重复3次取平均值,由回归方程计算总黄酮含量。吸附量(Q)、吸附率(A)、解吸率(D)按式(1)—式(3)计算:

(1)

(2)

(3)
式中:m为树脂质量,g;C1,C2,C3分别为上样液、滤液和洗脱液的黄酮质量浓度,mg/mL;V1,V2,V3分别为上样液、滤液和洗脱液的体积,mL。
2.4 高效液相色谱法检测菜芙蓉总黄酮
取一定量的原料液及在最佳纯化条件下试验得到的洗脱液。将原料液和洗脱液分别冷冻干燥后,取一定量冻干品用甲醇溶解,0.45 μm滤膜过滤后经高效液相色谱仪分析,以金丝桃苷为标准品。色谱条件如下:色谱柱为Waters Symmetry C18(4.6 mm×250 mm,5 μL);流动相为乙腈-0.4%磷酸水溶液;洗脱程序为0~40 min,乙腈体积分数为10%~15%;40~60 min,乙腈体积分数为15%~40%;检测波长为360 nm;柱温为室温;流速为1.0 mL/min;进样量为20 μL;理论塔板数不低于3 000。
2.5 小鼠肝和血清中CAT,SOD ,MDA及 GSH-Px的测定
将各组小鼠于第42天末次给药后禁食12 h,从其眼眶取血,3 500 r/min离心15 min,分离血清,在24 h内检测血清的CAT,SOD,MDA及GSH-Px活性。解剖小鼠,迅速取出脾、肾、肝、心,用4 ℃ 生理盐水冲净表面残血,滤纸吸干水分,称重,计算脏器指数。
脏器指数=脏器质量/小鼠体质量。
取1.0 g 肝组织,剪碎后置于玻璃匀浆器中,加9倍4 ℃生理盐水,制成10%(质量分数)的肝组织匀浆,于4 000 r/min离心10 min。取上清液测定肝脏的CAT,SOD,MDA及GSH-Px活性,分别严格按试剂盒操作程序测定。
2.6 统计分析
实验数据以(x±s)表示,用SPSS19.0软件包进行统计分析,并进行Duncan多重比较分析。
3 试验结果
3.1 上样液质量浓度和pH值对AB-8大孔吸附树脂吸附黄酮的影响
由图1可知,随着上样液中菜芙蓉花总黄酮质量浓度的增加,AB-8树脂吸附量逐渐上升,而吸附率却不断下降。当上样液质量浓度为0.2 g/mL时,AB-8大孔吸附树脂的吸附量最高为40.19 mg/g,吸附率为71.02%,而后随着上样液浓度的增加,树脂吸附量、吸附率均呈下降趋势。这可能是由于高质量浓度的上样液中含多糖和蛋白质等杂质较多,这些杂质与黄酮类化合物竞争AB-8树脂的吸附位点,导致吸附率降低,并且高质量浓度上样液条件下由于树脂吸附饱和,故而对总黄酮的吸附量也降低。因此,选择上样液粗提物的质量浓度为0.2 g/mL较为适宜。
由图2可知,pH值在3.5时,吸附率最高达89.74%;而当pH值为7.5时,吸附率迅速下降到56.67%。这是因为黄酮类化合物含有较多的酚羟基,呈弱酸性,酸性条件下可使其保持分子状态,有利于AB-8大孔吸附树脂对其吸附。试验过程中发现,pH值在1~1.5时的上样液颜色变化明显,与骆党委等[14]报道一致,所以选取上样液最佳pH 值为3.5。
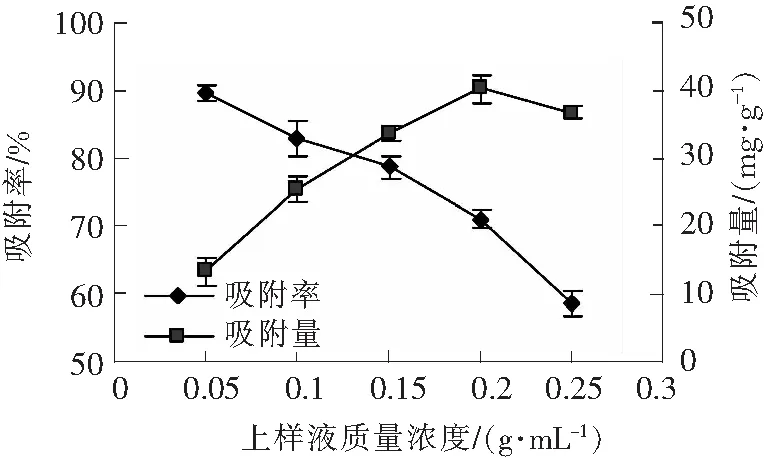
图1 上样液质量浓度对AB-8大孔树脂 吸附总黄酮的影响Fig.1 Effects of sample solution concerntration on AB-8 maroporous resin absorbing total flavonoids

图2 pH值对AB-8大孔树脂吸附总 黄酮的影响Fig.2 Effects of pH value on AB-8 maroporous resin absorbing total flavonoids
3.2 解吸液体积分数、体积与树脂质量比对AB-8树脂解吸总黄酮的影响
由图3可知,解吸率随着解吸液体积分数的增大而增大。当解吸液乙醇体积分数为50%~70%时,解吸液体积分数与解吸率呈显著的正相关;当解吸液体积分数为70%时,解吸率为89.39%;解吸液浓度继续增大时,解吸率增加不显著(P>0.05),因此选择解吸液的适宜体积分数为70%。
由图4可知,随着解吸液体积与树脂质量之比增大,解吸率不断上升。当解吸液体积与树脂质量之比为5∶1~20∶1时,解吸率随着解吸液体积与树脂质量之比的上升而增大;当解吸液体积与树脂质量之比为20∶1 时,解吸率为92.42%;进一步增大解吸液体积与树脂质量之比,解析率增加缓慢,故选择20∶1为最佳解吸液体积与树脂质量之比。

图3 解吸液乙醇体积分数对AB-8大孔 树脂解吸总黄酮的影响Fig.3 Effects of alcohol concerntration on AB-8 maroporous resin desorbing total flavonoids
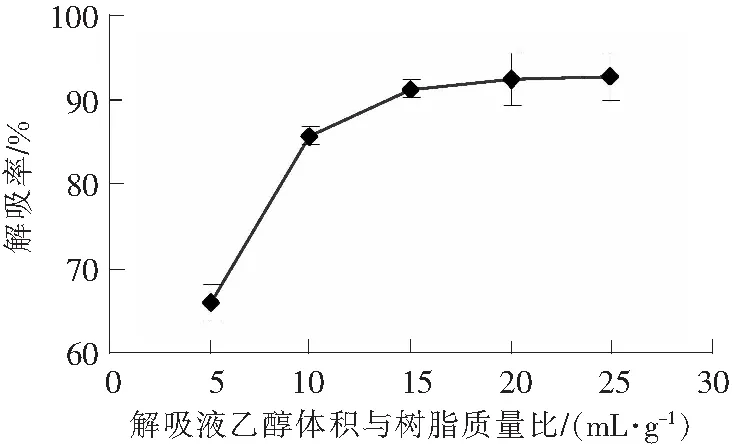
图4 解吸液体积与树脂质量比对AB-8 大孔树脂解吸总黄酮的影响Fig.4 Effects of volume-to-mass ratio on AB-8 maroporous resin desorbing total flavonoids
3.3 高效液相色谱测定纯化前后TFA
金丝桃苷标准品A的保留时间为42.7 min,其他5种物质均有黄酮特征吸收峰。由纯化前粗提物B和纯化后精制物C的液相色谱图(图5)可知:杂质大大减少(箭头所示),黄酮类化合物特征峰面积提高,AB-8大孔树脂对菜芙蓉粗提物中黄酮类物质有一定的富集作用。AB-8大孔树脂纯化3次试验分别得到精制物,采用高效液相色谱法,菜芙蓉总黄酮纯度分别为50.70%,46.54%,48.27%(以金丝桃苷计),取其平均值为48.50%,RSD值为4.30%,是纯化前粗提物总黄酮纯度(8.71%±0.34%)的5.57倍,达到了纯化总黄酮的目的,可用于后续体内抗氧化性试验。
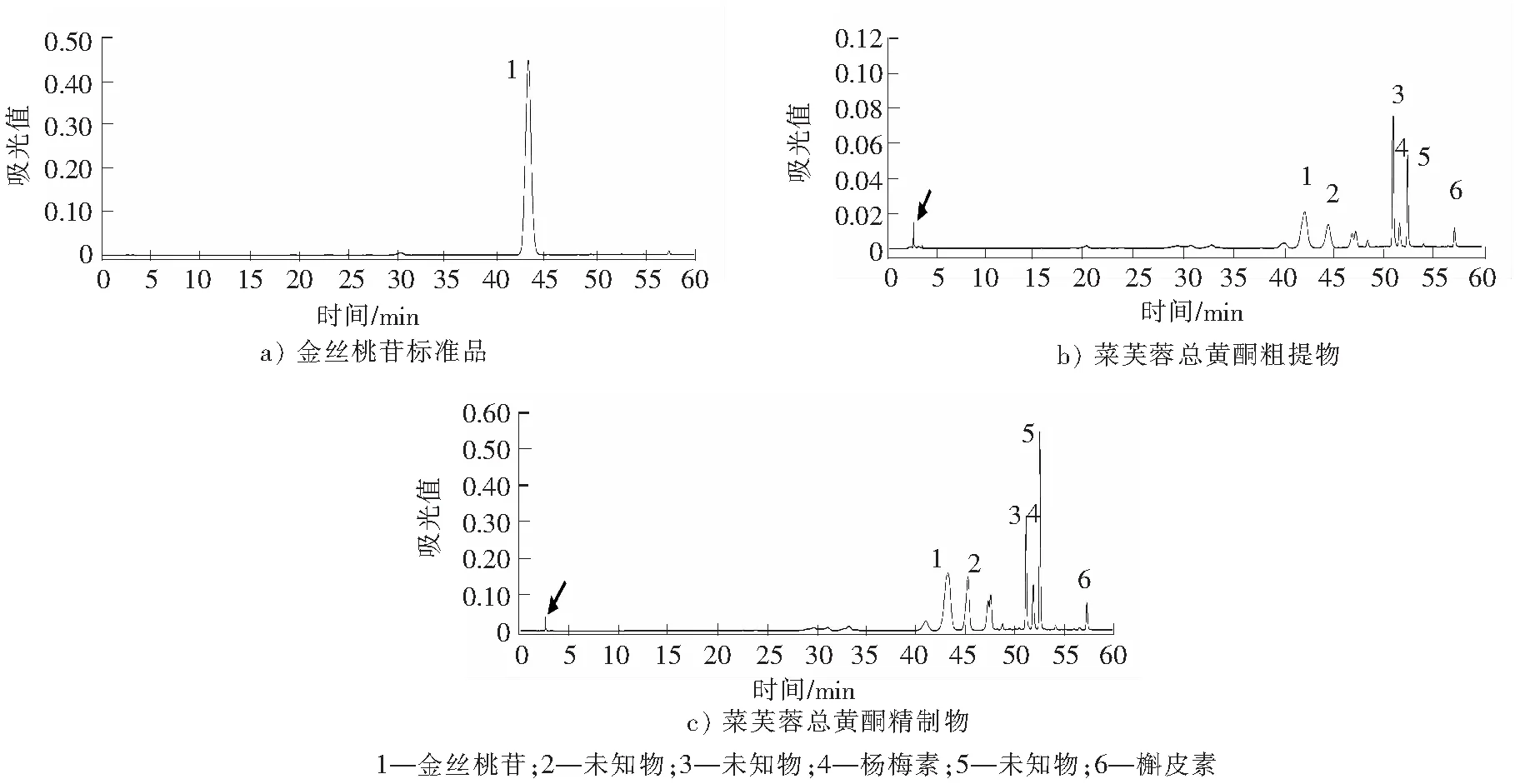
图5 HPLC检测菜芙蓉黄酮类化合物Fig.5 Determination of total flavonoids compounds by HPLC
3.4 菜芙蓉总黄酮体内抗氧化性研究
3.4.1 TFA对小鼠脏器指数的影响
内脏器官的大小在一定程度上能够反映出黄酮对于小鼠生长的影响,脏器指数可以在一定程度上反映出小鼠的发育情况。对小鼠脾、肾、肝和心脏的脏器指数进行分析,见表1。由表1可知,与对照组相比,菜芙蓉高、中、低3个剂量组的小鼠器官指数均有变化,但无统计学显著差异(P>0.05),这表明低、中、高剂量TFA均未对小鼠的器官造成损伤性的影响。
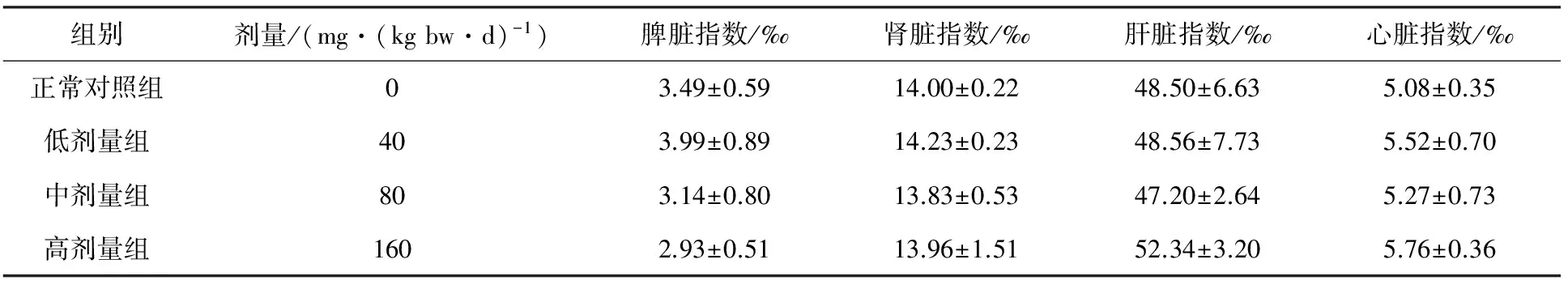
表1 TFA对小鼠脏器指数的影响 (n=10)
注:同列数据无肩标表示差异不显著(P>0.05)。
3.4.2 TFA对小鼠血清和肝脏中MDA含量,CAT,SOD及GSH-Px活力的影响
TFA对小鼠血清和肝脏中MDA含量的影响见表2,小鼠血清和肝脏中MDA生成量均随着TFA浓度的增加而逐渐下降。血清和肝脏中正常对照组与试验组MDA含量差异显著(P<0.05),表明TFA能一定程度抑制小鼠血清和肝脏中MDA的产生,降低脂质过氧化程度,且在一定浓度范围内表现为剂量效应关系。
TFA对小鼠血清和肝脏中CAT,SOD和GSH-Px活力的研究(见表2)表明,各个试验组中小鼠血清和肝脏中CAT,SOD和GSH-Px活力均高于对照组,且随着TFA浓度的增大而加大,表现为一定的剂量效应关系。与正常对照组相比,中、高剂量组小鼠肝脏CAT活力显著增加(P<0.05)。 小鼠血清 TFA各剂量组SOD活力均显著高于正常对照组(P<0.05),肝脏中的高剂量组SOD活力显著高于对照组(P<0.05),这表明适当剂量的TFA能提高小鼠血清和肝脏中的SOD活性,对小鼠体内自由基具有抑制作用;中、高剂量组血清和肝脏GSH-Px活力显著高于正常对照组(P<0.05)。
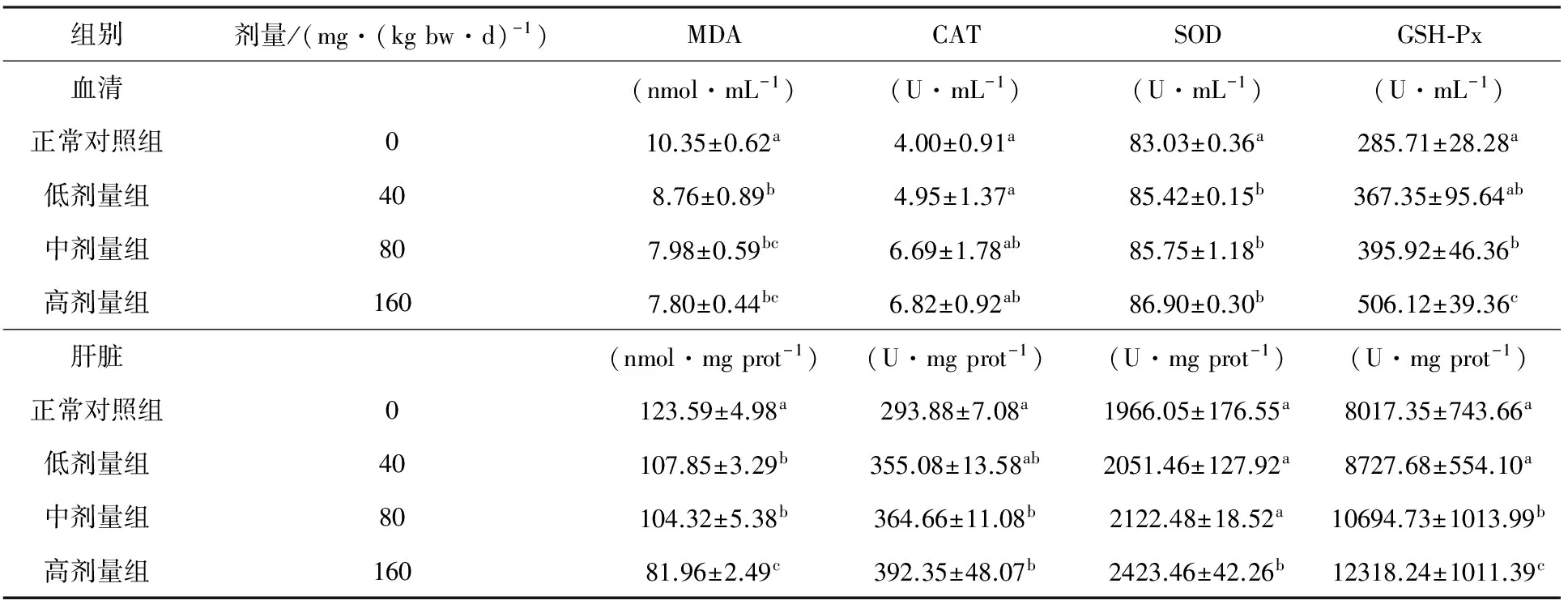
表2 TFA在小鼠血清和肝脏中的抗氧化活性
注:同列数据肩标有不同英文小写字母表示组间差异显著(P<0.05);标有相同字母者表示组间差异不显著(P>0.05)。
4 讨 论
上样液质量浓度影响菜芙蓉总黄酮的吸附量和吸附率,当上样液质量浓度低于0.2 g/mL时,AB-8大孔吸附树脂有足够吸附总黄酮的活性位点,此时总黄酮吸附率会随着样品质量浓度的增高而上升;随着上样液总黄酮质量浓度的不断增大,杂质含量增加,会与菜芙蓉黄酮竞争吸附活性位点,导致总黄酮吸附量和吸附率降低。选用AB-8树脂的粒径范围为0.3~1.25 mm,动态吸附法会随着上样液质量浓度的增加发生多分子层吸附,进而降低吸附速度。而本试验采用静态吸附法,在恒温振荡的条件下,树脂表面可充分发挥吸附作用而避免了此现象的发生。黄酮类化合物含有酚羟基,呈弱酸性,在酸性条件下可使黄酮类化合物保持分子状态,有利于大孔吸附树脂对其吸附。由于黄酮类化合物与树脂之间的范德华力随着2种物质的极性越相近而增大,所以随着解吸液乙醇体积分数的增大,解吸率不断上升。AB-8大孔吸附树脂为弱极性树脂,其吸附的黄酮极性较小,故乙醇体积分数越高即极性越小则洗脱效果越明显。采用AB-8大孔树脂静态吸附-洗脱单因素试验筛选TFA纯化条件,最佳纯化条件为上样液质量浓度为0.2 g/mL,pH值为3.5,解吸液乙醇体积分数为70%,解吸液体积与树脂质量比为20∶1(mL/g)。HPLC结果显示,纯化TFA杂质含量大大降低,而黄酮化合物纯度提高至48.50%。该方法成本低,易操作,纯化效果好。

近年来, 越来越多的中药被认为是外源性的“天然自由基清除剂”,研究人员开展了各种清除自由基的试验[21]。菜芙蓉总黄酮被证明可以直接清除自由基,本试验结果表明它还可以增强内源性氧自由基清除酶的活性,为应用其在动物体内的抗氧化应激作用开发功能性食品提供了理论依据。
[1] WANG Zhiyuan, WANG Shaotang. Natural Nutritional Supplementary Food ofAbelmoschusManihot(LINN.) Medius [P]. US:12T/739406,2010-12-02.
[2] AI Guo, LIU Qingchuan, HUA Wei, et al. Hepatoprotective evaluation of the total fiavonoids extracted from fiowers ofAbelmoschusmanihot(L.) Medic: In vitro and in vivo studies[J]. Journal of Ethnopharmacology, 2013,146:794-802.
[3] AN Y, ZHANG Y, LI C, et al. Inhibitory effects of fiavonoids fromAbelmoschusmanihotfiowers on triglyceride accumulation in 3T3-L1 adipocytes[J]. Fitoterapia,2011,82:595-600.
[4] 赖先银,赵玉英,梁鸿. 黄蜀葵化学成分的研究[J].中国中药杂志,2006,31(19):1597-1600. LAI Xianyin, ZHAO Yuying, LIANG Hong. Studies on chemical consistuents in flower ofAbelmoschusmanihot[J]. China Journal of Chinese Materia Medica, 2006,31(19):1597-1600.
[5] LAI Xianyin, LIANG Hong, ZHAO Yuying, et al. Simultaneous determination of seven active fiavonols in the fiowers ofAbelmoschusmanihotby HPLC [J]. Journal of Chromatographic Science, 2009, 47: 206-210.
[6] 仇燕. 菜芙蓉花中总黄酮的提取及含量测定[J]. 河北师范大学学报(自然科学版), 2006,30(6):713-715. QIU Yan. Extraction and determination of total flavones content inHibiscusmanihotflower[J]. Journal of Hebei Normal University (Natural Science Edition), 2006,30(6):713-715.
[7] TEMPLE N J. Antioxidant and disease: More question than answers [J]. Nutrition Research, 2000,20(3): 449-459.
[8] AMES B N, SHIGENAGA M K, GOLD L S. DNA lesion, inducible DNA repair, and cell division: The three key factors in mutagenesis and carcinogenesis [J]. Environmental Health Perspectives, 1993, 101(5): 35-44.
[9] WAGNER J R, HU C, AMES B N. Endogenous oxidative damage of deoxycytidine in DNA [J]. Proceedings of the National Academy of Science of the United States of America, 1992, 89(8): 3380-3384.
[10]PIENIZ S, COLPO E, OLIVEIRA V R, et al. Avaliacao in vitro do potencial antioxidantede frutase hortalifias[J]. Ciênciae Agrotecno-logia, 2009, 33(2): 552-559.
[11]仇燕,宋建军,王少杰. 菜芙蓉花乙醇提取物抗氧化性及抑制Hela细胞生长的研究[J]. 食品科学,2011, 32(19): 209-213. QIU Yan, SONG Jianjun, WANG Shaojie. Antioxidant activity ofAbelmoschusmanihotflower ethanolic extract and its inhibitory effect on the growth of hela cells [J]. Food Science, 2011,32(19):209-213.
[12]GUO J, XUE C, DUAN J. Anticonvulsant, antidepressant-like activity ofAbelmoschusmanihotethanol extract and its potential active components in vivo [J]. Phytomedicine, 2011, 18 (14): 1250-1254.
[13]仇燕,仇彦博. 柚皮总黄酮超声波辅助提取工艺的研究[J].河北科技大学学报,2010,31(4):330-333. QIU Yan, QIU Yanbo. Ultrasonication-assisted extraction of total flavonoids from fruit peels of guanxi pomelo [J]. Journal of Hebei University of Science and Technology, 2010,31(4):330-333.
[14]骆党委,叶静,黄雅燕,等. AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J].食品科学,2014,35(6): 30-35. LUO Dangwei, YE Jing, HUANG Yayan, et al. Purification of total flavonoids extracted from Ponkan (CitrusreticulataBlancocv. Ponkan) peel by AB-8 macroporous adsorption resin and separation of flavonoid constituents[J]. Food Science,2014,35(6):30-35.
[15]RIO D D, STEWART A J, PELLEGRINI N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2005,15:316-328.
[16]CHENG N, REN N, GAO H. Antioxidant and hepatoprotective effects of Schisandra chinensis pollen extract on CCl4-induced acute liver damage in mice [J]. Food and Chemical Toxicology,2013,55:234-240.
[17]罗开梅,张国广,陈凡,等. 紫背天葵黄酮的体内外抗氧化作用[J]. 精细化工,2012, 29(10):937-941. LUO Kaimei, ZHANG Guoguang, CHEN Fan, et al. Antioxidant activity of the flavonoids of in vitro and in vivo [J]. Fine Chemicals, 2012,29(10):937-941.
[18]WALTON P A, PIZZITELLI M. Effects of peroxisomal catalase inhibition on mitochondrial function[J]. Frontiers in Physiology, 2012,3:108-110.
[19]AI Guo, LIU Qingchuan, HUA Wei, et al. Hepatoprotective evaluation of the total flavonoids extracted from flowers ofAbelmoschusmanihot(L.) Medic: In vitro and in vivo studies[J]. Journal of Ethnopharmacology,2013,146: 794-802.
[20]王常青,任海伟,王海风,等. 黑豆多肽对D-半乳糖衰老小鼠抗氧化能力的影响[J]. 食品科学,2010,31(3):262-266. WANG Changqing, REN Haiwei, WANG Haifeng, et al. Antioxidant function of black soybean peptide inD-galactose-induced senescent mice[J]. Food Science, 2010,31(3):262-266.
[21]郭少英,程发峰,钟相根,等.黄芩苷的体外抗氧化研究[J]. 时珍国医国药,2011,22(1):9-11. GUO Shaoying, CHENG Fafeng, ZHONG Xianggen, et al. Antioxidative effects of Baicalin in vitro [J]. Lishizhen Medicine and Materia Medica Research, 2011,22(1):9-11.
Medic and its antioxidant properties in vivo
QIU Yan, LI Junying, LIU Chang, WANG Zhixin, WANG Shenlin
(School of Bioscience & Bioengineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
In order to optimize the purification conditions and the antioxidant properties in vivo of total flavonoids fromAbelmoschusmanihot(L.) Medic, AB-8 macroporous resin is used for static adorption and elution. The optimum purification conditions are as follows: Sample solution concerntration of 0.1 g/mL, pH 3.5, 70% ethanol as eluant, 20∶1(mL/g) of eluant volum to resin weight ratio. The results in the optimum purification conditions show that the purity of TFA reaches 48.50%. There are no significant difference in indexes of mice organs between experimental groups and normal control group (P>0.05). MDA content exhibits a significant decrease both in serum and liver of mice (P<0.05). While the level of CAT, GSH-Px and SOD activities in serum and liver are higher in experimental groups than those in normal control group showing dose-response relationship. These results indicate that TFA has good antioxidant properties in vivo.
other disciplines of Chinese materia medica;Abelmoschusmanihot(L.) Medic; total flavonoids(TFA); purification; antioxidant properties
1008-1542(2016)06-0587-07
10.7535/hbkd.2016yx06010
2016-07-13;
2016-08-13;责任编辑:张士莹
河北省自然科学基金(C2014208084,C2014208137); 河北省高层次人才资助项目(C2015005013)
仇 燕(1977—),女,河北石家庄人,副教授,博士,主要从事植物次生代谢物及其生理活性方面的研究。
E-mail:qiuyan2015@126.com
TQ461;Q819;R284.2
A
仇 燕,李俊英,刘 畅,等.菜芙蓉总黄酮纯化及其体内抗氧化性[J].河北科技大学学报,2016,37(6):587-593. QIU Yan, LI Junying, LIU Chang, et al.Purification of total flavonoids ofAbelmoschusmanihot(L.) Medic and its antioxidant properties in vivo[J].Journal of Hebei University of Science and Technology,2016,37(6):587-593.

