CX3CR1对缺血性白质的损伤作用
苗 晶, 于雪凡, 张 颖, 冯加纯
CX3CR1对缺血性白质的损伤作用
苗 晶, 于雪凡, 张 颖, 冯加纯
目的 明确CX3CR1在缺血性白质中的分布与表达及与缺血性白质损伤的关系。方法 将150只成年雄性Wistar大鼠随机分为正常组、假手术组及缺血组,采用双侧颈总动脉永久结扎法制备缺血性白质损伤模型,造模28 d后Morris水迷宫观察学习记忆功能,同时于术后1 d、3 d、7 d、14 d、28 d观察胼胝体、内囊及视神经的病理学变化和CX3CR1表达量的变化。结果 (1)造模后28 d,逃避潜伏期、探索路径长度及跨越平台次数缺血组较正常组和假手术组明显增加,有显著性差异(P<0.01);(2)随着缺血时间的延长,Luxol Fast Blue (LFB)染色可见髓鞘崩解范围扩大,分层明显,部分髓鞘空泡状;CX3CR1表达量逐渐增加,与CD11b标记的小胶质细胞数目逐渐增多相一致且高于正常组和假手术组。结论 CX3CR1通过介导小胶质细胞的变化对缺血性白质产生损伤,进而影响空间学习记忆功能。
脑缺血; 白质; CX3CR1; 学习记忆
慢性脑缺血是缺血性卒中、Bingswanger病、血管性痴呆、Alzheimer病等多种疾病发生、发展过程的一个重要环节,其中白质的改变,尤其是脑室周围和额叶皮质下的白质损伤与认知功能障碍有着密切的联系。已有研究报道,在急性缺血、创伤、感染等疾病中,CX3CR1表达上调对机体发挥炎性损害作用[1,2],但其在引起白质病变的研究中尚未见报道。本研究通过双侧颈总动脉永久结扎法制备缺血性白质损伤模型,观察CX3CR1在缺血性白质中的表达,探讨其与缺血性白质损伤的关系。
1 材料和方法
1.1 实验动物及模型制备 健康雄性Wistar大鼠150只,3~4月龄,质量250~280 g,吉林大学基础医学院动物实验室提供,清洁级大鼠。按随机数字法将大鼠随机分为正常组、假手术组、缺血组,每组50只,各组再按时间分为缺血1 d(n=10)、3 d(n=10)、7 d(n=10)、14 d(n=10)、28 d(n=10)。采用双侧颈总动脉永久结扎法制备缺血性白质损伤模型。具体方法如下:大鼠术前12 h禁食,4 h禁水。10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,仰卧位固定,颈部皮肤消毒去毛,颈部正中切口,分离双侧颈总动脉后用“0”号线分别结扎其远、近端,并从中间剪断,以确保阻断颈总动脉供血,术后缝合切口放回笼中饲养。假手术组除不结扎、不剪断双侧颈总动脉外,其余过程与手术组相同。
1.2 空间记忆能力测定 造模前及造模后28 d,采用Morris水迷宫法进行空间记忆能力的测定。测试程序为定位航行试验(place navigation):每天训练一次,历时5 d,将大鼠面向池壁分别从4个入水点随机放入水中,记录其在90 s内寻找到并爬上平台的时间和路程,即逃避潜伏期(escape latency)。如果大鼠在90 s内未找到平台,则由实验者用手牵引其至平台上,让大鼠停留10 s,再放回笼中,潜伏期记为90 s。空间探索试验(spatial probe):在定位航行试验后去除平台,任选一个入水点,将大鼠放入池中,记录其在90 s内跨越原平台的次数。最后计算平均成绩。
1.3 组织病理学观察 每个时间点(各组随机取出5只)用10%水合氯醛(0.3 ml/100 g)进行腹腔麻醉,取视交叉至小脑前的脑组织,用10%中性福尔马林进行固定,常规脱水、二甲苯透明、石蜡包埋、连续冠状切片,厚度4 μm,Olympus光镜下观察胼胝体、内囊、视束并记录以下指标:行LFB染色,观察白质形态学变化。激光共聚焦显微技术观察CX3CR1与CD11b的分布及表达情况;行CD11b免疫组化染色,光镜下随机选取5个视野记录上述部位阳性小胶质细胞数目。
1.4 Western blot蛋白印迹 每个时间点5只造模动物进行腹腔麻醉后,断头,冰上小心分离脑白质,进行蛋白抽提,根据Brad-ford法对蛋白质进行定量分析,测定蛋白浓度、蛋白裂解液加入4X凝胶上样缓冲液进行SDS-聚丙烯酰胺凝胶电泳。PVDF转膜、以含5%小牛血清的PBS-T室温封闭1 h,然后用相应的抗体(用含5%小牛血清的PBS-T配制)4 ℃孵育过夜,PBS-T洗膜3次,每次15 min。再用相应的碱性磷酸酶标记的IgG(用含5%小牛血清的PBS-T配制)室温反应1 h,PBS-T洗膜3次,每次15 min,然后进行碱性磷酸酶显色反应,应用凝胶成像分析系统对电泳条带的灰度进行扫描分析。
2 结 果
2.1 行为学分析 造模前逃避潜伏期、探索路径长度和跨越平台次数,组间比较无统计学意义(P>0.05);造模后28 d上述指标,缺血组较正常组比较明显增加(P<0.01),假手术组较正常组比较无明显变化(P>0.05)(见表1)。
2.2 组织病理学分析
2.2.1 LFB染色显示脑白质髓鞘病理改变 同一时间点的正常组、假手术组髓鞘清晰分布于胼胝体、内囊、外囊、扣带回、视神经等区域,髓鞘排列整齐,无水肿、分层、断裂及空泡形成;在缺血组,随着缺血时间的延长,髓鞘崩解范围逐渐扩大,部分出现空泡样变化,其中缺血14 d时视神经,缺血28 d时胼胝体及内囊髓鞘分层、空泡化较明显(见图1)。
2.2.2 Western blot 结果 正常组及假手术组可以表达少量的CX3CR1;缺血组,随着缺血时间的延长,CX3CR1表达量在28 d内持续增加,表现为:1 d时略有增加;3 d时可见增加趋势;14 d时较明显(P<0.01);28 d时更加显著(P<0.01),组间比较,存在明显差异(见图2、图3)。
2.2.3 免疫组化结果 CX3CR1主要表达于细胞膜表面,此类细胞能同时在膜上表达小胶质细胞标记物CD11b(见图4)。同一时间点的正常组及假手术组在胼胝体、内囊、视束可见少量小胶质细胞,胞体较小,没有突起;缺血组中,随着缺血时间的延长,不同区域小胶质细胞数目逐渐增加,且胞体变大,出现较长突起,14 d时增加明显(P<0.05),28 d时更趋显著(P<0.01),组间比较,细胞总数存在显著性差异(见表2)。其中,缺血14 d时视神经改变较明显(P<0.05),缺血28 d时胼胝体改变明显(P<0.01),28 d时内囊也可见较明显变化(见表3)。
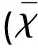
表1 各组大鼠28 d空间学习记忆功能检测结果±s)
与正常组比较*P<0.01
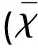
表2 各组不同时间点小胶质细胞总数目±s)(单位:个/视野)
与正常组比较*P<0.05,**P<0.01
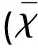
表3 缺血组不同时间点不同部位小胶质细胞数目±s)(单位:个/视野)
同一部位组内比较*P<0.05,**P<0.01
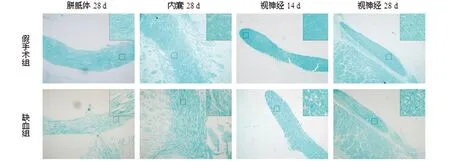
图1 缺血后白质不同区域髓鞘病理变化
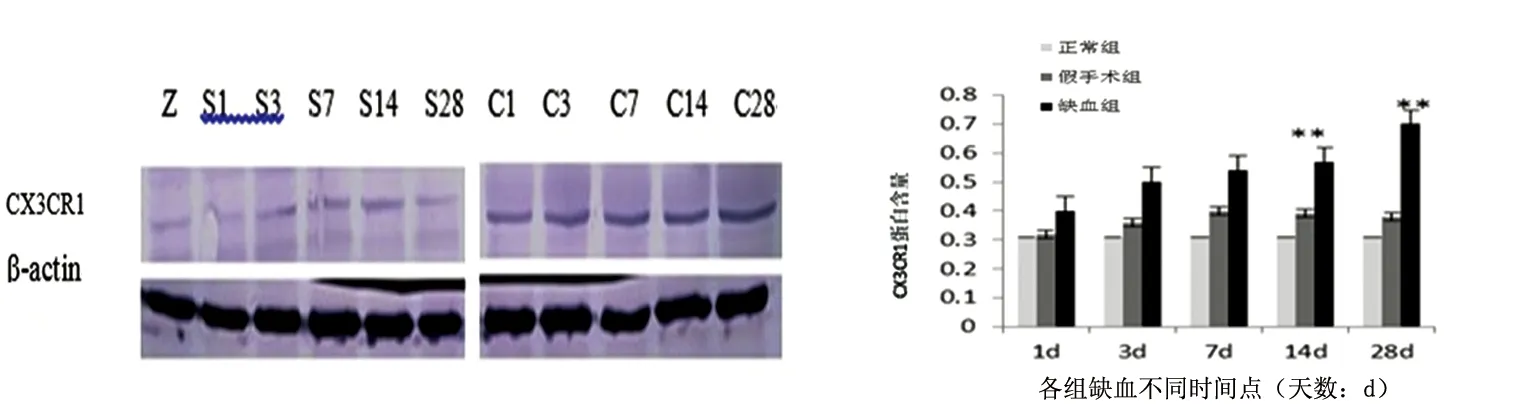
图2 各组不同时间点CX3CR1蛋白蛋白质印迹检测结果(注:Z为正常组,S为假手术组,C为缺血组);图3 各组不同时间点CX3CR1蛋白表达量(注:与正常组比较**P<0.01)
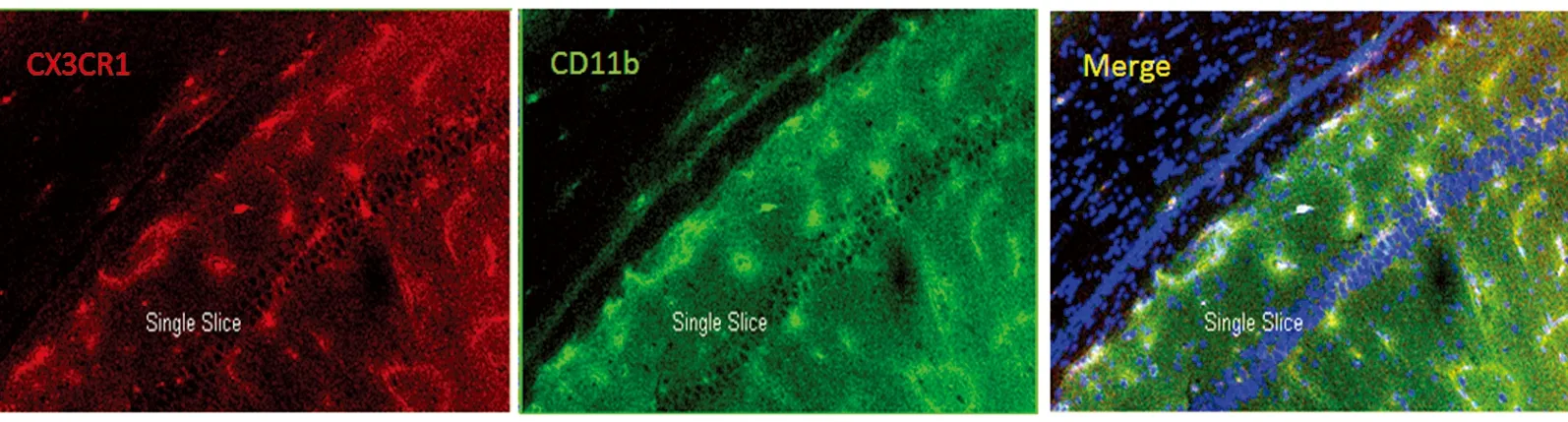
图4 红色荧光为CX3CR1;绿色荧光为CD11b;黄色荧光为二者共同表达于细胞膜上(×400)
3 讨 论
近年来随着影像学的发展,人们逐渐认识到脑白质疏松不仅是衰老过程中的部分表现,而且可以使脑卒中发生的危险性增加。因此,缺血性白质损伤成为血管性痴呆的又一个独立危险因素。双侧颈总动脉永久性闭塞可引起白质病变,在阻塞的急性期,脑血流立即下降,并在很低的水平持续2~3 d,形成了缺血-缺氧模型。该模型在术后2.5 h可以使胼胝体的血流减少到正常的48.8%,7 d之后,血流减少到60%~75%,并在这一低水平持续很长时间[3],同时由于大鼠Wills环发达、代偿好,并没有导致任何一个脑区血流灌注完全停止,因而在一定程度上造成脑低灌注。综上,本研究应用双侧颈总动脉永久结扎法这一经典模型制备缺血性白质损伤模型较可靠。
CX3CR1曾被称为V28孤儿受体,现被认为是七次跨膜G蛋白偶联受体,当与其配体Fractalkine结合后可被激活,通过调控细胞内信号途径发挥炎性作用[4]。Yeo等人对癫痫持续状态大鼠脑室注射抗CX3CR1抗体,发现CX3CR1与癫痫状态引起的炎性环境相关[5]。Clark等研究发现,CX3CR1可以通过增加突触后膜兴奋性导致慢性疼痛[2]。Shan 等通过单侧黑质内注射MPP形成帕金森病模型,观察到CX3CR1与该疾病引起的炎症反应有关[6]。综上,CX3CR1与多种疾病如创伤、感染、变性疾病引起的炎性机制相关,但目前关于CX3CR1与慢性缺血引起的白质损伤国内外尚无报道。本研究结果显示,CX3CR1与缺血性白质损伤密切相关,脑组织慢性缺血后,其主要表达于小胶质细胞膜表面,且随着缺血时间的延长,表达量逐渐增加。Jolivel等发现,在局灶性大脑中动脉闭塞模型中,cx3cr1基因敲除小鼠较杂合型小鼠梗死体积减小,血脑屏障破坏减轻[1]。Cipriani等发现替代基因cx3cr1后,急性缺血引起的脑组织损害减轻[7],提示CX3CR1参与急性缺血引起脑组织变性坏死过程。本研究不仅发现CX3CR1与缺血相关,而且发现在尚未形成明显坏死病灶前,与缺血引起的脑白质改变密切相关,这与病理形态学观察结果及行为学改变相一致,可为临床干预缺血性白质病变提供理论依据。
同时,本研究还发现随着缺血时间的延长,表面标记CD11b的小胶质细胞数目在增加,与CX3CR1表达含量增加相一致。我们推测CX3CR1引起缺血后白质损伤的机制可能如下:Fractalkine主要表达于神经元,是在正常脑组织内唯一出现的化学趋化因子,特异性与受体CX3CR1结合抑制小胶质细胞过度激活,使其处于静息状态[8];在缺血等炎性刺激时,CX3CR1表达增加会激活小胶质细胞、促进actin蛋白重聚、形态改变进而使小胶质细胞具有趋化活性,释放炎性因子[5];CX3CR1能作用与NF-κB产生Toll-4发挥炎性作用[7];小胶质细胞是脑内主要的免疫细胞,CD11b标记的小胶质细胞细胞是产生IL-1β的主要的细胞,IL-1β在正常水平时,对于形成长时程增强及维持记忆功能很重要,若过度表达则可加重记忆损害[9]。因而,CX3CR1可能在缺血条件下激活小胶质细胞从而介导脑白质损伤,出现认知功能障碍,但其具体机制有待于进一步研究。此外,本研究主要观察了CX3CR1在缺血28 d内与白质损伤的关系,至于其在缺血后期如何变化及与白质改变的关系将是我们下一步将要深入研究的课题。
[1]Jolivel V,Bicker F,Biname F,et al.Perivascular microglia promote blood vessel disintegration in the ischemic penumbra[J].Acta Neuropathol,2015,129(2):279-295.
[2]Clark AK,Gruber-Schoffnegger D,Drdla-Schutting R,et al.Selective activation of microglia facilitates synaptic strength[J].J Neurosci,2015,35(11):4552-4570.
[3]Huang Y,Zhang W,Lin L,et al.Is endothelial dysfunction of cerebral small vessel responsible for white matter lesions after chronic cerebral hypoperfusion in rats[J].J Neurol Sci,2010,299(1/2):72-80.
[4]Arnoux I,Audinat E.Fractalkine signaling and microglia functions in the developing brain[J].Neural Plast,2015,2015:689404.
[5]Yeo SI,Kim JE,Ryu HJ,et al.The roles of fractalkine/CX3CR1 system in neuronal death following pilocarpine-induced status epilepticus[J].J Neuroimmunol,2011,234(1~2):93-102.
[6]Shan S,Hong-Min T,Yi F,et al.New evidences for fractalkine/CX3CL1 involved in substantia nigral microglial activation and behavioral changes in a rat model of Parkinson’s disease[J].Neurobiol Aging,2011,32(3):443-58.
[7]Cipriani R,Villa P,Chece G,et al.CX3CL1 is neuroprotective in permanent focal cerebral ischemia in rodents[J].J Neurosci,2011,31(45):16327-16335.
[8]Ryu J,Lee CW,Hong KH,et al.Activation of fractalkine/CX3CR1 by vascular endothelial cells induces angiogenesis through VEGF-A/KDR and reverses hindlimb ischaemia[J].Cardiovasc Res,2008,78(2):333-340.
[9]Williamson LL,Sholar PW,Mistry RS,et al.Microglia and memory: modulation by early-life infection[J].J Neurosci,2011,31(43):15511-15521.
The harmful effect of CX3CR1 on white matter lesions in ischemia
MIAO Jing,YU Xuefan,ZHANG Ying,et al.
(Department of Neurology,The First Hospital of Jilin University,Changchun 130021,China)
Objective To explore the distribution and expression of CX3CR1 in ischemic white matter and the relationship between it and white matter damaging.Methods Ischemia white matter lesions (WMLs) can be introduced experimentally by permanent,bilateral common carotid artery’s occlusion( 2VO) of rats to cause chronic cerebral ischemia.150 rats were randomly divided into three groups which included normal,vehicle and ischemia groups. Their spatial learning and memory abilities were assessed using the Morris water maze on the 28th day after operation.After 1 d,3 d,7 d,14 d and 28 d for surgery,rats were sacrificed.Coronal sections in corups callosum,capsula interna and optic nerves were stained with Luxol Fast Blue (LFB) and labeled with CX3CR1 and CD11b antibodies.Expression of CX3CR1 were assessed by Western blot.Results The ischemia groups increased escape latency and swimming distance of 2VO rats from 28 d in maze tests,together with the percent time in the target quadrant (P<0.01).Coronal sections showed vacuole-shape and breakdown of myelin by LFB at corups callosum,capsula interna and optic nerves where common labeled of CX3CR1 and CD11b were observed.Expression of CX3CR1 is increasing with the ischemic time prolong.Conclusion CX3CR1 may have an effect on the ischemia brain white matter by the changing of microglia,which results in dysmnesia.
Cerebral ischemia; White matter lesions; CX3CR1; Learning and memory
1003-2754(2016)06-0536-04
2016-04-09;
2016-05-30
(吉林大学白求恩第一医院神经内科和神经科学中心,吉林 长春 130021)
冯加纯,E-mail:fengjcfrank@qq.com
R743.3
A

