MiR-615-5p缓解Aβ25-35诱导的APOE4+/-型海马细胞的凋亡和变性
姚 婕, 马巧亚, 阎丽萍, 张红梅, 姬文涛
MiR-615-5p缓解Aβ25-35诱导的APOE4+/-型海马细胞的凋亡和变性
姚 婕, 马巧亚, 阎丽萍, 张红梅, 姬文涛
目的 探讨miR-615-5p对人海马细胞的凋亡和变性的影响及潜在机制。方法 运用实时定量PCR检测正常、家族性AD和散发性AD老年人血液中miR-615-5p的表达水平,以及APOE4+/-型人胚海马细胞和Aβ诱导的APOE4+/-海马细胞中miR-615-5p的表达水平;在Aβ预处理的APOE4+/-型海马细胞中分别转染miR-615-5p mimic和inhibitor后检测细胞凋亡、氧化应激标志物含量和突触生长标志蛋白的表达水平;运用生物学信息分析和荧光素酶报告基因技术预测并验证mir-615-5p对APOE基因的靶定调控关系。结果 散发性AD患者和细胞模型中miR-615-5p的表达水平显著下调;过表达miR-615-5p显著抑制海马细胞的凋亡和细胞内氧化应激,并促进细胞内突触生长蛋白的表达,而沉默miR-615-5p则作用相反;mir-615-5p可靶定结合APOE mRNA,并下调APOE4+/-海马细胞中APOE4蛋白的表达。结论 mir-615-5p通过靶向调节APOE,缓解Aβ25-35诱导的APOE4+/-型海马细胞的凋亡和变性。
mir-615-5p; 阿尔茨海默病; 载脂蛋白4; 细胞凋亡; 氧化应激
阿尔茨海默病(Alzheimer’s disease,AD)是一种严重危害老年人身心健康的神经系统退行性疾病,从最初的记忆减退,到失语、失聪、失用、失明,乃至最终的人格和行为完全改变[1]。我国人口日趋老龄化,AD造成的家庭负担和社会负担也随之凸显。近年来,大量临床和基础研究表明β-淀粉样蛋白(amyloid β-protein,Aβ)在脑内的进行性沉积是AD的一项重要病理特征[2~5]。Aβ由淀粉样蛋白前体蛋白(Amyloid precursor protein,APP)基因的编码产物经β-或γ-分泌酶水解而成,经运输进入脑脊液或脑间质液中[2,3]。载脂蛋白E(apolipoprotein E)是机体内运输脂蛋白和多种多肽的重要功能蛋白[6,7]。APOE的等位基因ε4编码的蛋白APOE4与Aβ有高度的亲和性,在Aβ运输进入脑脊液的过程中发挥重要作用[6,8,9]。现有研究表明,APOE4表达个体比非APOE4表达个体的AD患病风险至少高4倍,APOE4已成为散发性AD的重要标志物和治疗靶点[4,10,11]。
MiR-615-5p是近年来新发现抑癌miRNA,对多种组织器官的癌变细胞的生长和转移具有抑制作用[12,13]。
最近,有报道显示miR-615在运动神经元中的表达水平显著高于脊髓源性神经干细胞[14],提示其在神经细胞分化和功能形成过程中发挥潜在作用。本研究对比正常、家族性AD和散发性AD老年人血液中miR-615-5p的表达水平,发现miR-615-5p散发性AD老年患者血液中表达水平显著降低;进一步在APOE4+/-型人胚海马细胞中探索miR-615-5p对Aβ25-35诱导的海马神经元的凋亡和功能的影响,以期为散发性AD的治疗提供参考。
1 材料和方法
1.1 材料 磷酸缓冲盐溶液PBS、青-链霉素购自天津宝鑫生物;Hoechst33258细胞凋亡染色剂、Aβ25-35、Aβ1-42、荧光素酶报告基因检测试剂盒、胆碱乙酰转移酶活性CAT检测试剂盒、丙二醛MDA含量测定试剂盒、活性氧ROS含量测定试剂盒、表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)购自美国Sigma公司;脂质体3000转染试剂、DMEM/F12培养基、N2、B27、胎牛血清 (FBS)、胶原酶I、胰蛋白酶等购自Invitrogen公司;RNA提取试剂盒、总蛋白提取试剂盒和BCA蛋白定量试剂盒购自北京天根生化科技公司;实时定量PCR试剂盒购自大连TaKaRa公司;PVDF膜、ECL蛋白发光检测试剂盒购自美国Millipore公司;兔抗小鼠caspase-3抗体、兔抗小鼠caspase-9抗体、兔抗小鼠GAP-43抗体、兔抗小鼠Syn抗体、兔抗小鼠APOE4抗体、兔抗小鼠Aβ抗体和兔抗小鼠β-tululin抗体、HRP标记的山羊抗兔IgG购自英国Abcam公司;细胞培养板、培养瓶和其他细胞培养耗材购自南京赛业公司;miR-615-5p反转录试剂盒(含特异性反转录引物)和miR-615-5p实时定量试剂盒(含miR-615-5p上下游检测引物和内参基因U6 RNA引物)由广州锐博生物技术有限公司提供;2’-甲氧基修饰的单链miR-615-5p 模拟寡核苷酸(mimic)、抑制寡核苷酸(inhibitor)和阴性对照寡核苷酸NC由瑞士Roche公司设计、合成并进行有效性检测(最适浓度为60 nmol);其他试剂均为进口或国产分析纯。Bio-Rad实时定量PCR仪、凝胶成像系统购自美国Bio-Rad公司。
1.2 方 法
1.2.1 伦理学声明 本研究的方案经由西安交通大学伦理学委员会审核并批准。受试患者和志愿者均被告知详细情况,并由本人/监护人签订书面协议。
1.2.2 血液样本采集 本研究受试者包括18名非AD志愿者、25名家族性AD患者和25名散发性AD患者。各组受试者年龄在55~70岁之间,平均年龄63岁左右,受试者中无脑部或全身感染、各类肿瘤、脑部外伤、卒中、癫痫等疾患,无过度瘦弱和过度肥胖者。受试者血液样本由技术熟练的老年科住院部护士采集,采血在气温适宜的早晨(进食前)进行,于每个受试者前臂静脉采集5 ml左右血液样本,4 ℃保存备用。
1.2.3 APOE4+/-型人胚海马细胞的分离培养 APOE4+/-型海马细胞来源于2012年-2015年间本院的3例稀有病例,12~14 w流产、基因型为APOE4+/-的胚胎。分离双侧海马, 无血清DMEM/F12培养液清洗后,剔除血管和脑膜后剪成1 mm3左右的小块,0.125%胰酶、37 ℃消化10~12 min,加入少量含血清培养液终止消化。800 r/min离心 5 min,弃上清;加入适量培养基,800 r/min离心 5 min,弃上清,加入适量DMEM/F12培养液(添加1% N2、2% B27、20 ng/ml bFGF和20 ng/ml EGF)重悬沉淀,接种于细胞培养板上,置 CO2于37 ℃、95%湿度、5%CO2条件的培养箱中培养。1 h后吸取未贴壁神经元,计数后接种105个细胞于6孔培养板中。培养 24 h后更换新培养液,之后每2~3次半量换液,观察神经元形态和生长情况。培养至10 d左右的细胞用于后续研究。
1.2.4 血液和海马细胞中miR-615-5p表达水平的检测 用血液总RNA提取试剂盒和细胞总RNA提取试剂盒分别提取血液样本和海马细胞中的总RNA,运用miR-615-5p反转录试剂盒合成cDNA,定量试剂盒检测miR-615-5p表达水平。反应体系为25 μl体系,包括2 μl的cDNA模板(含500 ng cDNA)、上下游定量引物各0.5 μl(终浓度为0.5 μmol/L)、12.5 μl反应缓冲液和9.5 μl超纯水。反应条件如下:95 ℃预变性1 min,以95 ℃变性15 s、60 ℃退火延伸60 s的条件扩增35个循环,Bio-Rad实时定量PCR仪自带IQ5软件分析计算扩增循环数Ct值,相对表达量用2-ΔΔCt法计算。
1.2.5 Hoechst 33258染色检测海马细胞凋亡 对照和各处理以4%甲醛溶液固定1 h,以预冷的PBS溶液洗涤两次,添加5 μg/ml Hoechst 33258染液覆盖细胞样品,室温染色4 min。PBS洗涤3次,每次3 min,在荧光显微镜下观察(340 nm激发光)。结果判定标准:活细胞呈弥散、均匀荧光,凋亡内可见浓染、致密的荧光颗粒,有3个或以上的DNA荧光碎片的细胞为凋亡细胞,Epies (R) Porfile Analyzer细胞自动计数软件对正常细胞和凋亡细胞进行计数,然后计算凋亡细胞比例。
1.2.6 Western印迹法检测蛋白表达水平 收集各组细胞,总蛋白提取试剂盒提取细胞中总蛋白,BCA法测定蛋白含量;配制SDS-PAGE凝胶,每个胶孔上样50 ng蛋白样品进行电泳;2.5 h后湿转法转膜;室温下用5%脱脂奶粉缓冲液封闭转有蛋白的PVDF膜1 h,分别加入兔抗小鼠caspase-3抗体(1∶400)、兔抗小鼠caspase-9抗体(1∶400)、兔抗小鼠GAP-43抗体(1∶300)、兔抗小鼠Syn抗体(1∶300)、兔抗小鼠APOE4抗体(1∶200)、兔抗小鼠Aβ抗体(1∶200)和兔抗小鼠β-tululin抗体(1∶800),4 ℃孵育过夜;TBST缓冲液清洗PVDF膜3次,每次10 min;加HRP标记的山羊抗兔IgG(1∶1000),室温孵育2 h;TBST清洗4次,每次8 min,孵育ECL发光液,于凝胶成像系统中曝光显影、采集图像, Quantity One软件进行条带分析,重复3次以上。
1.2.7 CAT活性、ROS和MDA水平的检测 收集各组细胞,离心弃上清,分别运用胆碱乙酰转移酶活性CAT检测试剂盒、丙二醛MDA含量测定试剂盒、活性氧ROS含量测定试剂盒检测细胞中CAT的活性及ROS、MDA的含量,按照试剂盒说明书进行逐步操作。
1.2.8 荧光素酶报告基因技术验证miR-615-5p对APOE基因的靶定 扩增APOE mRNA的3’非翻译区(3’untranslated region,3’UTR)全长,连接于pGL3双荧光素酶报告基因载体上;将构建好的载体单独或与miR-615-5p mimic共同转染于APOE4+/-型人胚海马细胞中,孵育72 h,按荧光素酶报告基因分析试剂盒中所述步骤进行操作,以多功能酶标仪检测荧光素酶活性。
2 结 果
2.1 散发性AD患者血液中miR-615-5p的表达水平显著下调 实时定量PCR检测18名非AD志愿者、25名家族性AD患者和25名散发性AD患者血液中miR-615-5p的表达水平,结果显示家族性AD患者血液中miR-615-5p的表达水平与非AD志愿者基本一致(P>0.05),散发性AD患者血液中miR-615-5 p的表达水平显著低于非AD志愿者(P<0.01)(见图1A)。
2.2 Aβ处理降低AD细胞模型中miR-615-5 p的表达水平 分别以50 mmol KCl、10 μmol Aβ1-42、10 μmol Aβ25-35和等体积PBS(作为对照)处理APOE4+/-型人胚海马细胞(见图1B),Hoechst 33258染色结果所示,对照组中部分细胞内呈现浓染致密颗粒块状荧光(指示凋亡细胞),KCl 处理后细胞内多呈弥散均匀荧光,而Aβ1-42 或Aβ25-35处理后致密颗粒块状荧光增多(见图1B)。同时实时定量PCR分析结果显示,KCl处理促进细胞中miR-615-5p的表达水平,而Aβ处理降低细胞中miR-615-5p的表达水平(见图1C)。
2.3 miR-615-5p抑制Aβ诱导的APOE4+/-型海马细胞凋亡 在Aβ预处理的APOE4+/-型海马细胞中分别转染miR-615-5p mimic和inhibitor,mimic转染组细胞中miR-615-5 p的表达水平提高至4倍以上(P<0.05),inhibitor转染组细胞中miR-615-5 p的表达水平下降至30%左右(P<0.05,见图2A)。细胞凋亡检测结果显示,mimic转染组凋亡细胞的比例显著下降,而inhibitor转染组凋亡细胞的比例显著上升(P<0.05,见图2B);凋亡关键基因表达检测结果显示,mimic转染抑制半胱氨酸蛋白酶caspase-3和9的表达,而inhibitor转染则促进caspase-3和9的表达(见图2C)。
2.4 miR-615-5p缓解Aβ诱导的APOE4+/-型海马细胞氧化应激、促进突触生长 分别检测转染后各组细胞中氧化应激标志物水平,结果(见表1),miR-615-5p mimic转染提高APOE4+/-海马细胞中胆碱乙酰转移酶(Choline acetyltransferase,CAT)的活性(P<0.05),减少活性氧(Reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)的产生(P<0.05),有助于缓解细胞内氧化应激。此外,免疫印迹定量检测发现miR-615-5p mimic促进突触生长标志因子GAP-43(生长相关蛋白-43,growth associated protein)和Syn(突触素,synaptophysin)的表达(P<0.05)。miR-615-5p inhibitor的作用则与miR-615-5p mimic相反(见表2)。
2.5 miR-615-5p靶向结合并抑制APOE4+/-型海马细胞中APOE4蛋白的表达 我们运用靶基因预测软件TargetScan和miRDB预测到mir-615-5p可结合APOE mRNA的3’UTR区域,随后运用荧光素酶报告基因分析验证二者的结合,转入mir-615-5p mimic后荧光素酶活性降低(见图3A),表明APOE4是mir-615-5p的靶基因。在APOE4+/-型海马细胞中转染mir-615-5p mimic后,APOE4蛋白表达水平下降,Aβ含量也下降;mir-615-5p inhibitor转染则促进APOE4蛋白的表达,增加Aβ含量(见图3B)。
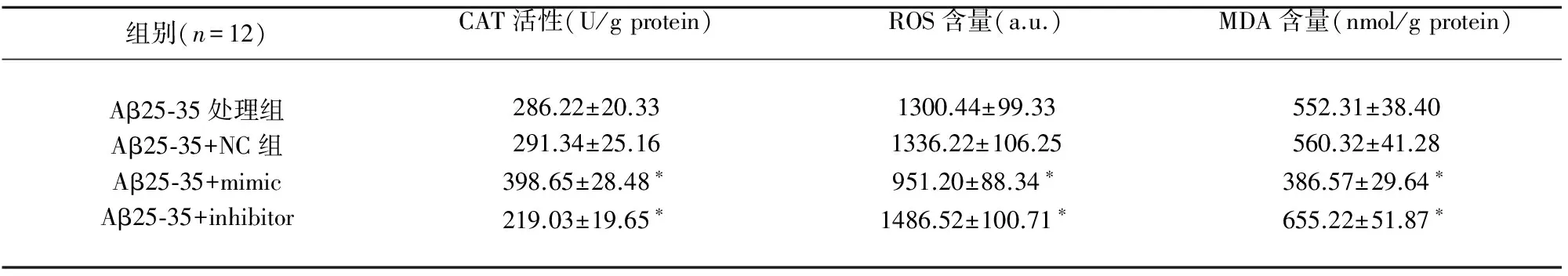
表1 miR-615-5p表达变化对Aβ25-35预处理的APOE4+/-型人胚海马细胞氧化应激水平的影响
与对照组(Aβ25-35处理组)比较*P<0.05

表2 miR-615-5p表达变化对APOE4+/-型人胚海马细胞突触生长标志因子表达水平的影响
与对照组(Aβ25-35处理组)比较*P<0.05
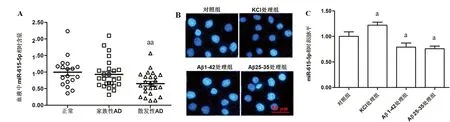
A.18名非AD志愿者、25名家族性AD患者和25名散发性AD患者血液中miR-615-5p的表达水平对比;B.50 mmol KCl、10 μmol Aβ1-42和10 μmol Aβ25-35分别处理APOE4+/-型人胚海马细胞24 h后Hoechst 33258染色;C.50 mmol KCl、10 μmol Aβ1-42和10 μmol Aβ25-35分别处理APOE4+/-型人胚海马细胞24 h后miR-615-5p的表达水平变化.与正常(对照)组比较aP<0.05,aaP<0.01
图1 AD患者血液及散发性AD细胞模型中miR-615-5p表达水平的检测
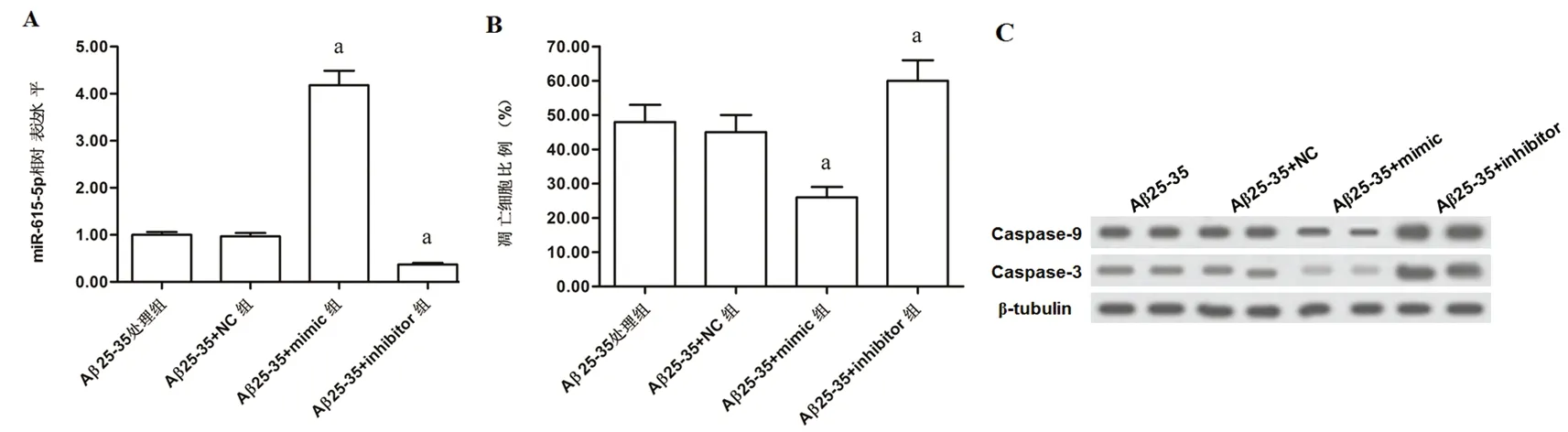
A.60 nmol miR-615-5p mimic和inhibitor分别转染Aβ25-35预处理的APOE4+/-型人胚海马细胞72 h后miR-615-5p的表达水平变化;B.miR-615-5p mimic和inhibitor转染对细胞凋亡的影响;C.miR-615-5p mimic和inhibitor转染后细胞凋亡蛋白caspase-9和caspase-3的水平变化.与 Aβ25-35处理组比较aP<0.05
图2 miR-615-5p对Aβ预处理的APOE4+/-型海马细胞的凋亡的影响
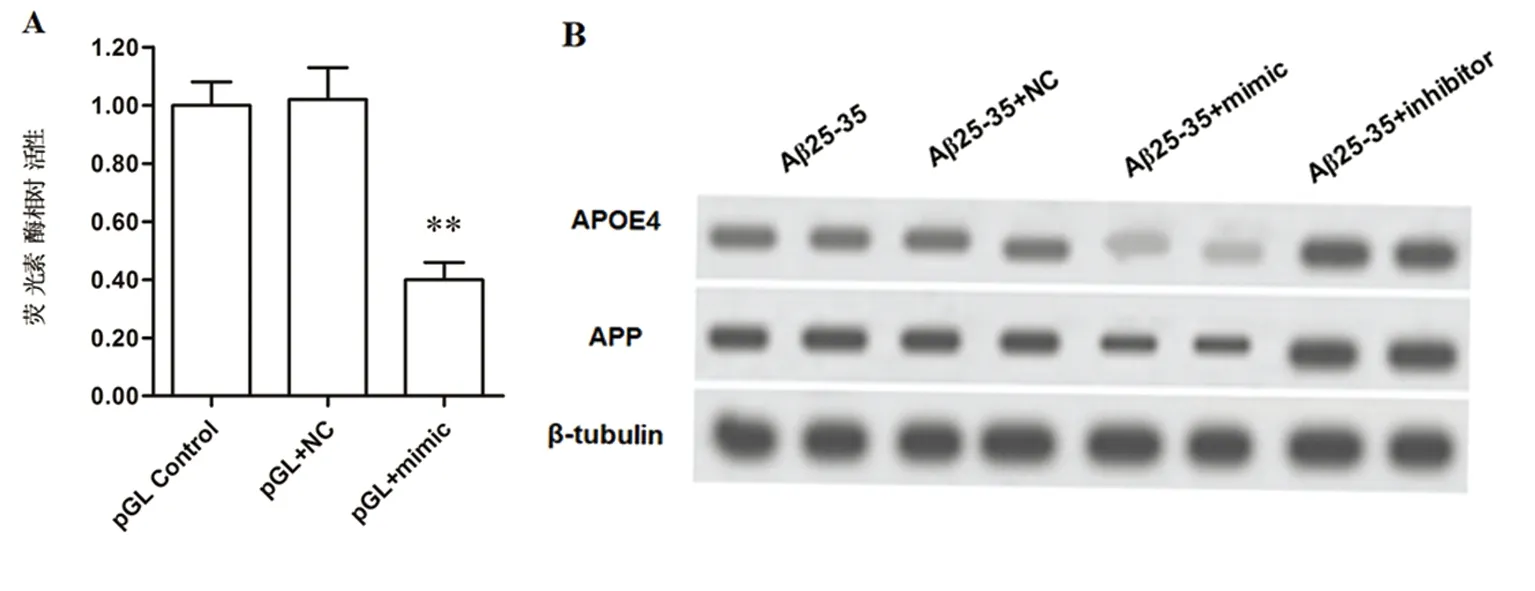
A.荧光素酶报告基因技术验证miR-615-5p与APOE基因的靶定结合;B.miR-615-5p mimic和inhibitor转染后APOE4+/-型海马细胞中APOE4蛋白和Aβ含量变化
图3 miR-615-5p靶定APOE基因并抑制APOE4+/-型海马细胞中APOE4的表达
3 讨 论
自2007发现迄今,miR-615-5p功能报道多见于内脏癌组织细胞的生长和转移的研究中,被鉴定为具有抑癌作用的miRNA。索耀君等首次探讨miR-615在脊髓源性神经干细胞与运动神经元间的表达特征[14],发现miR-615在分离的运动神经元中显著高表达,揭开了miR-615在神经系统功能和发育调控研究的序幕。本研究以AD患者和散发性AD细胞模型为研究对象,检测并对比正常、家族性AD和散发性AD老年人血液中miR-615-5p的表达水平,以及APOE4+/-型海马细胞和Aβ诱导的APOE4+/-海马细胞中miR-615-5p的表达水平,散发性AD患者和细胞模型中miR-615-5p的表达水平显著下调,提示miR-615-5p在散发性AD进程中可能发挥调控作用。
AD发病机制在细胞和分子水平主要体现为Aβ等大量积累引起的细胞凋亡增加、氧化应激和炎症水平剧增和神经突触生长抑制[15~17]。在Aβ预处理的APOE4+/-型海马细胞中以转染miR-615-5p mimic和inhibitor的方式过表达或沉默miR-615-5p,发现过表达miR-615-5p显著抑制海马细胞的凋亡和细胞内氧化应激,并促进细胞内突触生长标志因子的表达,而沉默miR-615-5p则对细胞凋亡、氧化应激和突触生长因子表达有相反的结果。因此,本文从正反两方面表明miR-615-5p对散发性AD细胞模型就有保护作用。
众所周知,miRNA的生物学作用由其靶定基因的生物学功能决定。在肝癌细胞中,miR-615-5p通过靶定调节胰岛素样生长因子2抑制癌细胞的增殖和转移[18];在胰腺癌中和乳腺癌中,miR-615-5p的作用靶点为促进细胞增殖的Akt2基因[12];最近一项关于非小细胞肺癌的研究证实miR-615-5p可靶定结合并抑制肿瘤坏死因子相关蛋白4基因从而抑制肺癌细胞增殖[19]。APOE4是散发性AD的重要标志,APOE4高表达会加速Aβ进入脑脊液的运输过程,从而加速AD的进程[9,20,21]。本研究以APOE4等位基因为靶点,通过生物信息学工具对miR-615-5p和APOE的调控关系进行预测,TargetScan和miRanda的输出结果均表明APOE是miR-615-5p的潜在靶基因,随后荧光素酶报告基因检测和过表达后APOE4表达检测结果也都证实APOE是miR-615-5p的靶基因,这也揭示了miR-615-5p能够缓解APOE4+/-海马细胞氧化应激和细胞凋亡,并促进细胞突触生长蛋白表达的原因。
综上所述,miR-615-5p在散发性AD患者和细胞模型中表达水平显著下调,可靶定结合并抑制APOE基因表达,从而缓解Aβ25-35诱导的APOE4+/-型海马细胞的凋亡和变性。
[1]Vinters HV.Emerging concepts in Alzheimer’s disease[J].Ann Rev Pathol,2015(10):291-319.
[2]Baranello R,Bharani K,Padmaraju V,et al.Amyloid-beta protein clearance and degradation (ABCD) pathways and their role in Alzheimer’s disease[J].Current Alzheimer Res,2015,12(1):32-46.
[3]Jucker M,Walker LC.Neurodegeneration:Amyloid-beta pathology induced in humans[J].Nature,2015,525(7568):193-194.
[4]Karch CM,Goate AM.Alzheimer’s disease risk genes and mechanisms of disease pathogenesis[J].Biologic Psychiat,2015,77(1):43-51.
[5]Hampel H,Schneider LS,Giacobini E,et al.Advances in the therapy of Alzheimer's disease:targeting amyloid beta and tau and perspectives for the future[J].Expert Rev Neurotherapeutic,2015,15(1):83-105.
[6]Lim Y,Villemagne V,Laws S,et al.APOE and BDNF polymorphisms moderate amyloid β-related cognitive decline in preclinical Alzheimer’s disease[J].Molecular Psychiat,2015,20(11):1322-1328.
[7]Bonet-Costa V,Herranz-Perez V,Blanco-Gandia M,et al.Clearing Amyloid-β through PPARγ/ApoE activation by genistein is a treatment of experimental alzheimer’s disease[J].J Alzheimer’s Dis,2016(Preprint):1-11.
[8]Daianu M,Mezher A,Jahanshad N,et al.Spectral graph theory and graph energy metrics show evidence for the Alzheimer’s disease disconnection syndrome in APOE-4 risk gene carriers[J].Proc IEEE Int Symp Biomed Imaging,2015,4:458-461.
[9]Boehm-Cagan A,Johansson JO,Bielicki JK,et al.Correction of ApoE4 dysfunction and reversal of Alzheimer’s disease phenotype and cognition in ApoE4 target replacement mice by cogpepb,an abca1 agonist peptide derived from the lipid binding segment of ApoE[J].Alzheimer’s & Dementia,2015,11(7):611-612.
[10]Goodenowe DB,Senanayake V,Chitou B,et al.Relation of plasmalogens,ApoE genotype,and Alzheimer’s disease pathology to cognition:A post-mortem analysis[J].Alzheimer’s & Dementia,2015,11(7):865-866.
[11]Hanson J,Craft AS,Banks A W.The APOE genotype:modification of therapeutic responses in Alzheimer’s disease[J].Current Pharmaceutic Design,2015,21(1):114-120.
[12]Gao W,Gu Y,Li Z,Cai H,et al.miR-615-5p is epigenetically inactivated and functions as a tumor suppressor in pancreatic ductal adenocarcinoma[J].Oncogene,2015,34(13):1629-1640.
[13]Sun Y,Zhang T,Wang C,et al.MiRNA-615-5p functions as a tumor suppressor in pancreatic ductal adenocarcinoma by targeting AKT2[J].PloS one,2015,10(4):e0119783.
[14]索耀君,王春芳.MiR-615 在平行培养的神经干细胞与运动神经元的表达比较[J].中国组织化学与细胞化学杂志,2012,21(2):152-156.
[15]De Strooper B,Karran E.The cellular phase of Alzheimer’s disease[J].Cell,2016,164(4):603-615.
[16]Heneka MT,Carson MJ,El Khoury J,et al.Neuroinflammation in Alzheimer’s disease[J].Lancet Neurol,2015,14(4):388-405.
[17]Heneka MT,Golenbock DT,Latz E.Innate immunity in Alzheimer’s disease[J].Nature immunology,2015,16(3):229-236.
[18]El Tayebi H,Hosny K,Esmat G,et al.miR-615-5p is restrictedly expressed in cirrhotic and cancerous liver tissues and its overexpression alleviates the tumorigenic effects in hepatocellular carcinoma[J].FEBS letters,2012,586(19):3309-3316.
[19]陈 刚,王国栋,王乃辉.mir-615-5p 通过靶向调节癌基因 TRAF4 抑制非小细胞肺癌细胞的增殖[J].中国生物化学与分子生物学报,2016,32(2):184-190.
[20]王 浩,杜贯涛,刘广军,等.血脑屏障 RAGE/LRP1 转运体及神经血管单元与阿尔茨海默病关系的研究进展[J].神经药理学报,2015,5(2):38-45.
[21]Oliveira MM,Lourenco MV.Integrated stress response:connecting ApoE4 to memory impairment in Alzheimer’s disease[J].J Neurosci,2016,36(4):1053-1055.
MiR-615-5p alleviates the apoptosis and degeneration of Aβ25-35-induced APOE4+/-hippocampus cells
YAO Jie,MA Qiaoya,YAN Liping,et al.[the First Ward of Cadre Ward
(Department of Aged Neurology),the Second Affiliated Hospital of Xi’an Jiao Tong University,Xi’an 710004,China]
Objective Apolipoprotein E4 (apoE4) to explore the regulatory role and mechanism of miR-615-5p in the apoptosis and function of human hippocampus cells.Methods Expression of blood miR-615-5p were detected with real-time qPCR in familial Alzheimer’s disease (AD) patients,sporadic AD patients and non-AD aged volunteers,as well as APOE4+/- human embryonic hippocampus cells and Aβ-pretreated APOE4+/-hippocampus cells;the mir-615-5p mimic or inhibitor was transfected into the Aβ-pretreated APOE4+/-hippocampus cells,and then cell apoptosis,oxidative stress level and synaptic growth protein expression were detected;bioinformatics and luciferase reporter gene analyses were applied to evaluate and validate the targeting relationship between miR-615-5p and APOE4.Results MiR-615-5p was significantly decreased in sporadic AD patients and Aβ-pretreated APOE4+/-hippocampus cells;mir-615-5p mimic transfection suppressed cell apoptosis and oxidative stress,and promoted the expression of synaptic growth proteins;in contrast,mir-615-5p inhibitor transfection had an opposite effect; APOE mRNA was targeted by mir-615-5p and APOE4 protein level in APOE4+/-hippocampus cells was suppressed by mir-615-5p mimic transfection.Conclusion MiR-615-5p alleviates the apoptosis and degeneration of Aβ25-35-induced APOE4+/-hippocampus cells.
miR-615-5p; Alzheimer’s disease; APOE4; Cell apoptosis; Oxidative stress
1003-2754(2016)06-0540-05
2016-04-06;
2016-05-30
[西安交通大学第二附属医院干部病房一病区(老年神经科),陕西 西安 710004]
马巧亚,E-mail:huiqingguohn@163.com
R734.2;Q752;Q291
A

