动脉瘤性蛛网膜下腔出血患者血清血管假性血友病因子、内皮素-1含量变化及与脑血管痉挛的关系
杨呈浩, 陈岷辉, 丁 昊
动脉瘤性蛛网膜下腔出血患者血清血管假性血友病因子、内皮素-1含量变化及与脑血管痉挛的关系
杨呈浩, 陈岷辉, 丁 昊
目的 检测动脉瘤性蛛网膜下腔出血患者血清中血管假性血友病因子浓度、内皮素-1含量的动态变化,分析二者与脑血管痉挛发生发展的关系,为aNSAH后CVS的发病机制及防治措施提供实验数据和理论依据。方法 实验组分别于入院时、术后3 d、术后1 w、术后2 w早晨抽取空腹血,并于当天进行TCD检查;对照组病例均静息30 min后抽取空腹血。分别采用ELISA法检测vWF浓度、放射免疫分析检测ET-1含量。结果 (1)术后1 w组与其他实验组vWF浓度、ET-1含量比较,差异均有统计学意义(P<0.05);而术后2 w血清vWF浓度、ET-1含量与术前相比较,差异均无统计学意义(P>0.05)。(2)术前CVS组和非CVS组血清vWF浓度与ET-1含量相比较差异均有统计学意义(P<0.01);术后CVS组与非CVS组血清vWF浓度与ET-1含量比较,差异也有统计学意义(P<0.01);术后CVS组vWF浓度、ET-1含量与术前CVS组相比有统计学意义(P<0.01)。(3)实验组中血清vWF、ET-1含量与脑血管痉挛程度正相关(vWF:r=0.78613,P<0.01;ET-1:r=0.61904,P<0.01)。(4)血清vWF浓度与ET-1含量呈正相关(r=0.496,P<0.01)。结论 血清vWF和ET-1可作为aNSAH后CVS的预防、疗效观察、判断预后的重要参考指标。
颅内动脉瘤; 蛛网膜下腔出血; 脑血管痉挛; 血管假性血友病因子; 内皮素-1
脑血管痉挛(cerebral vasospasm,CVS)是颅内动脉瘤(intracranial aneurysm,AN)破裂所导致的蛛网膜下腔出血(subarachnoid hemorrhage,SAH )的重要并发症之一,是蛛网膜下腔出血后颅底大动脉的延迟性缩窄,同时伴有受累动脉远端供应区脑灌注减少,CVS以及继发的脑缺血改变是导致病情加重甚至死亡的重要原因[1]。目前研究发现血管内皮细胞的损害在CVS发生中起到十分重要的作用[2,3]。vWF、ET-1作为内皮细胞受损的特异性标志物,其含量的增高能反映内皮细胞受损的程度。本研究通过对aNSAH患者血浆vWF和ET-1的动态检测,了解内皮细胞损伤相关因子vWF与ET-1在aNSAH后的变化,探讨二者是否在SAH后CVS发病机制中的发挥作用,为CVS的临床防治提供实验数据和理论依据。
1 研究方法
1.1 实验分组 该实验分为两组:实验组为2012年12-2014年12月间我院神经外科住院治疗的40例aNSAH患者,而对照组为门诊健康体检者28人。(1)病例纳入与排除标准:自发性蛛网膜下腔出血,Hunt-Hess分级Ⅰ~Ⅲ级;发病后24 h内收治入院作为研究对象;(2)临床资料:aNSAH患者40例,男22例,女18例,年龄36~59岁,平均年龄(47.23±4.47)岁。入院后行头部CT发现SAH;CT血管造影(computed tomographic angiography,CTA)、数字减影血管造影(digital substraction angiography,DSA)明确颅内动脉瘤诊断;经颅多普勒(transcranial doppler,TCD)检查诊断脑血管痉挛。所有患者发病后24 h内入院并且在入院后3 d内行开颅动脉瘤瘤颈夹闭术,术后立即给予钙离子拮抗剂(尼莫地平)治疗及增加血容量、提高脑灌注压、提高血液稀释度(3H)等治疗。根据患者入院的时间关系再将实验组分为4组:入院时组、术后3 d组、术后1 w组和术后2 w组。根据患者手术前及手术后有无发生脑血管痉挛又将实验组分为:术前痉挛组与术前非痉挛组;术后痉挛组与术后非痉挛组。按照患者脑血管痉挛的程度将脑血管痉挛病例分为:轻度痉挛组;中度痉挛组;重度痉挛组。
1.2 标本采样 所有实验组病例均在入院时、术后3 d、术后1 w、术后2 w于清晨同一时间段抽空腹静脉血两管,3 ml/(管·人次),分别用于检测vWF与ET-1。人vWF定量EIA试剂盒由上海西唐生物科技有限公司提供,CT-1采用碘125I内皮素放射免疫分析试剂盒由解放军总医院东亚免疫技术研究所提供。
1.3 脑血管痉挛的判断 实验组患者入院时和术后3 d、1 w、2 w抽血的同一天分别进行TCD检测脑血流速度来诊断脑血管痉挛。按照国际常用标准将术前和术后任何一次大脑中动脉血流速度(VMCA)>120 cm/s定为CVS[4],轻度痉挛为120~140 cm/s、中度痉挛为140~200 cm/s、重度痉挛>200 cm/s。
2 结 果
实验组中共有27例发生血管痉挛,其中14例术前发生脑血管痉挛、24例手术后发生脑血管痉挛,轻度血管痉挛15例,中度8例,重度4例。CVS在临床上主要表现为迟发性脑缺血所引起的神经功能缺损,比如SAH症状好转后又出现意识障碍加重、偏瘫、失语等,实验组中13例患者头痛加重伴轻微意识障碍,6例患者出现一过性失语,3例患者出现一过性的偏瘫,给予扩血管及3H治疗后,所有患者均治愈出院。实验组中各aNSAH患者的年龄、动脉瘤的大小、动脉瘤部位以及H&H级别临床资料之间的比较,各组差异均无统计学意义(P>0.05)。
2.1 vWF与ET-1标准曲线 根据实验得出的vWF与ET-1测量值绘制标准曲线(见图1、图2)。
2.2 实验组与对照组vWF、ET-1所测结果及比较 实验组入院时、术后3 d、术后1 w、术后2 w的血清vWF浓度、ET-1含量与对照组相比较,各实验组均高于对照组(P<0.01)。术后3 d患者血清各指标含量与术前血清各指标含量比较逐渐升高,并于术后1 w达到最高峰,于术后2 w有所下降。术后3 d血清各指标含量与术前相比较,差异有统计学意义(P<0.01);术后1 w血清各指标含量与入院时、术后3 d、术后2 w相比较,差异有统计学意义(P<0.05);术后2 w血清各指标含量与术前相比较,差异无统计学意义(P>0.05)(见表1、图3)。
2.3 CVS组和非CVS组血清vWF浓度、ET-1含量的关系 经TCD检测,手术前发生CVS后有14例,手术后发生CVS有24例发生CVS。CVS组患者血清各指标含量较高,术前CVS组与非CVS组相比较,差异具有统计学意义(P<0.01);术后CVS组与非CVS组相比较,差异具有统计学意义(P<0.01);术后CVS组与术前CVS组相比较,差异具有统计学意义(P<0.05)(见表2)。
2.4 血管痉挛程度与血清vWF浓度、ET-1含量的关系 实验组中27例发生CVS,轻度CVS15例,中度CVS8例,重度CVS4例。由于血管痉挛程度是等级资料,故应用Spearman等级相关分析。血清vWF浓度、ET-1含量与血管痉挛程度进行相关分析,其含量与脑血管痉挛程度呈正相关(vWF:r=0.78613,P<0.01;ET:r=0.61904,P<0.01)。
2.5 血清vWF浓度、ET-1含量的关系 绘制患者血清vWF浓度、ET-1含量的散点图,见散点有线性趋势,且二者变化呈同向变化,呈正相关。进一步对二者进行直线相关分析发现相关系数r=0.496,P=0.021,相关性具有统计学意义(P<0.05)(见图4)。
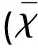
表1 各组血清vWF、ET-1水平的所测结果及比较±s)
入院时组与对照组比较*P<0.01;术后1 w组与入院时、术后3 d、术后2 w组比较△P<0.05;术后3 d组与入院时比较**P<0.01
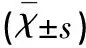
表2 血清vWF浓度、ET-1含量在CVS组和非CVS组中的比较
术前CVS组与非CVS组比较*P<0.01;术后CVS组与术前CVS组比较△P<0.05
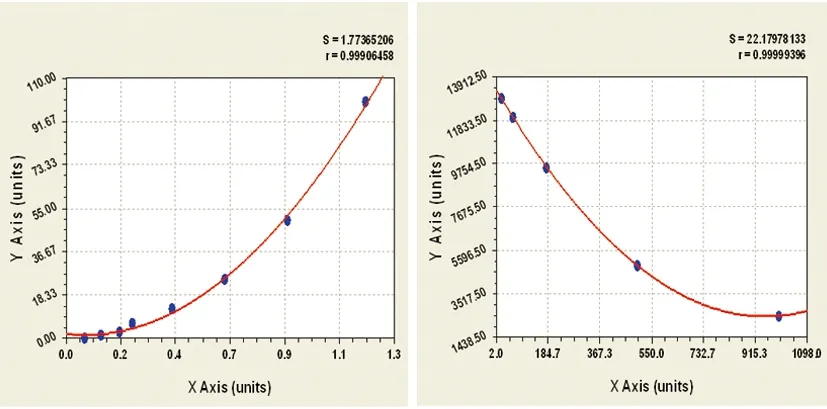
图1 vWF标准曲线 图2 ET-1标准曲线
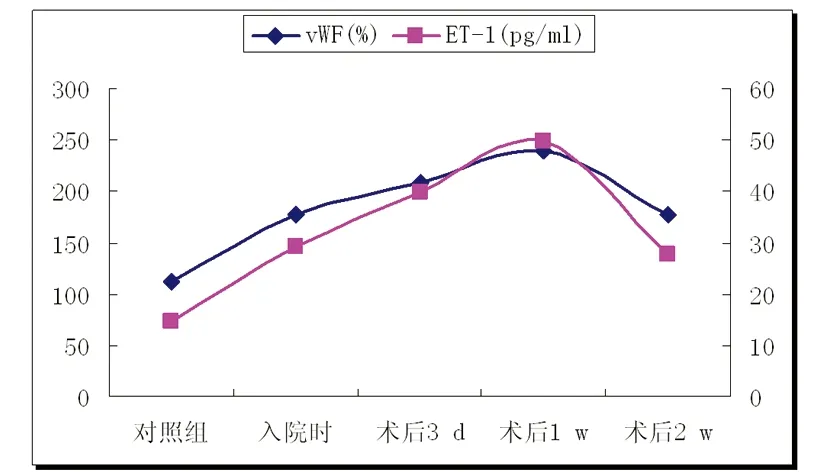
图3 实验各组与对照组vWF、ET-1含量比较曲线图
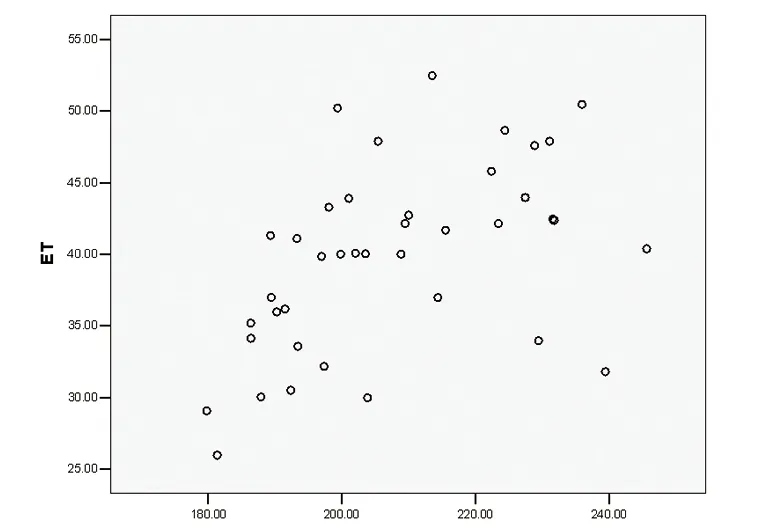
图4 vWF与ET-1散点图
3 讨 论
目前,脑血管痉挛诊断的金标准是DSA,但DSA为有创检查,而且血管造影检查不能发现轻度微小血管的痉挛,CVS后血管的病理解剖学可观察到血管平滑肌细胞发生形态学改变,因而CVS一旦发生,往往难于逆转,对血管扩张剂的反应性较差[5]。这个阶段用药物缓解脑血管痉挛相当困难,因此早期确诊是关键。
以往研究证实痉挛血管平滑肌细胞的坏死和内皮细胞的剥离是形成CVS的机制之一[2,3]。自从人们在SAH患者尸检和实验性SAH动物模型发现痉挛动脉存在明显的病理改变:内皮细胞变形肿胀、胞膜皱折及明显的超微结构改变后[6,7],对血管内皮细胞的研究逐渐的得到了重视。
vWF是由血管内皮细胞和巨噬细胞合成的一种多聚糖蛋白,有两个主要的生理功能:(1)调节血小板黏附,激活血小板,促进止血栓的形成;(2)携带血浆Ⅷ因子,稳定其活性[8]。在正常的血液循环中,vWF不具有活性,只有当血管内皮细胞受损时,vWF的合成增加并大量释放到内皮下和血管内,因此被公认为内皮细胞损伤及功能障碍的主要标志物[9]。ET-1是目前发现的缩血管作用最强的生物肽,主要在血管内皮细胞表达,参与各种疾病的病理生理过程,如高血压、SAH后的CVS等[10];曾有国外学者Beuth等[11]通过对蛛网膜下腔出血患者的血浆及脑脊液中vWF浓度的测定得出以下结论:在蛛网膜下腔出血早期,血浆vWF明显升高,SAH患者中的脑脊液有vWF表达,其表达水平的高低与神经功能情况呈正相关,vWF可以被用作预测脑血管痉挛和局部缺血症状的独立因子。
本方法测定了40例aNSAH患者发病时血清vWF、ET-1水平分别为(177.95±13.22)%、(29.24±4.53)pg/ml;正常人血清各指标分别为(111.28±16.46)%、(14.56±3.48)pg/ml,实验组与正常组相比较,差异有统计学意义(P<0.01),与国外报道一致[11]。
有研究发现vWF在急性心肌缺血的发病中具有重要作用[12],那么vWF与脑血管缺血有相关性吗?李明芬等人发现vWF水平升高,vWF-cp活性降低可能与急性脑梗死的发生、发展、内皮损伤有关[13]。袁加文同样发现vWF在脑梗死发生和进展中可能具有一定临床意义[14]。本实验40例动脉瘤性SAH患者中,发生CVS的患者血清vWF浓度、ET-1含量明显高于非CVS组(P<0.01),且CVS组患者血清vWF浓度、ET-1含量与血管痉挛程度呈正相关(vWF:r=0.78613,P<0.01;ET:r=0.61904,P<0.01),结果表明vWF、ET-1与CVS的程度血管内皮受损后,释放vWF,借以介导血小板与暴露的血管内皮细胞下胶原黏附,所以当颅内动脉瘤破裂后,可以通过vWF介导血小板聚集,迅速在蛛网膜下腔的受损的血管周围形成血凝块,并促进血小板活化,使血管发生强烈的收缩以及释放炎性因子。释放的炎性因子一方面可以直接刺激血管内皮细胞,使血管壁发生免疫性炎症反应,促进平滑肌的收缩;另一方面还可以刺激血管内皮细胞合成、释放ET-1,加剧血管的收缩。血管周围的血凝块既可以对血管壁直接产生机械性的牵拉作用,使血管收缩,又可以通过释放氧合血红蛋白作用于内皮细胞,间接促进血管的收缩,促进脑血管痉挛。vWF还可以通过促进血小板的聚集使得血管腔减小,导致血管痉挛的加强。这些变化在急性发病期并未对其症状产生太多影响,但在CVS治愈后会逐渐体现。Frijns等[15]研究也发现SAH患者早期的vWF浓度升高与不良的预后相关的,可能因为vWF是后期小血栓形成的诱因,从而导致缺血性改变。
关于vWF、ET-1是否能反映出SAH患者病情的演变,国外学者做了大量的研究。Mcgirt等[16]认为SAH后的脑血管痉挛的发生发展程度与血浆vWF、MMP-9、VEGF水平相关,血浆vWF、MMP-9和VEGF水平能准确的预测SAH后脑血管痉挛的发生。本组资料研究40例aNSAH患者入院时、术后3 d、术后1 w、术后2 w血清各指标含量的动态变化,发现各指标在术后3 d开始增高,并持续到术后1 w达到最高值,随后逐渐下降。这样的变化考虑与血管内皮细胞功能早期受损、后期功能有所恢复的病理生理过程有关。
本实验发现患者术后3 d各指标较术前升高,可能是因为手术过程中对血管造成机械性牵拉,导致血管内皮细胞受损,引起脑血管痉挛加重,内皮细胞标志物过度表达。因此,我们在行头部手术时应尽量减少对脑血管的机械性刺激,避免术后脑血管痉挛的发生。
因此,vWF与ET-1可作为SAH后CVS诊断的指标,根据患者的vWF或ET-1含量的高低来了解血管内皮细胞功能,及早的使用保护血管内皮细胞功能的药物,以改善SAH后CVS患者的预后。关于vWF与ET-1在CVS中是如何起作用的机制,还有待去进一步的研究探索。
[1]Levati A,Solaini C,Beselli L.Prevention and treatment of vasospasm[J].J Neurosurg Sci,1998,42(1):27-31.
[2]Frontera JA,Rundek T,Schmidt JM,et al.Cerebrovascular reactivity and vasospasm after subarachnoid hemorrhage:a pilot study[J].Neurology,2006,66(5):727-729.
[3]Vatter H,Weidauer S,Konczalla J,et al.Time course in the development of cerebral vasospasm after exprimental subarachnoid hemorrhage:clinical and neuroradiological assessment of the rat double hemorrhage model[J].Neurosurery,2006,58(6):1190-1197.
[4]Minhas PS,Menon DK,Smielewski P,et al.Positron emission tomographic cerebral perfusion disturbances and transcranial Doppler findings among patients with neurological deterioration after subarachnoid hemorrhage[J].Neurosurgery,2003,52(5):1022-1024.
[5]Mayberg MR.Cerebral vasospasm[J].Neurosurg Clin N Am,1998,9(3):615-627.
[6]Findlay JM,Weir BK,Kanamaru K,et al.Arterial wall changes in cerebral vasospasm[J].Neurosurgery,1989,25(5):736-745.
[7]Zubkov AY,Tibbs RE,Clower B,et al.Morphological changes of cerebral arteries in a canine double hemorrhage model[J].Neurosci Lett,2002,326(2):137-141.
[8]Fitzgerald DJ.Vascular biology of thrombosis:the role of platelet-vessel wall adhesion[J].Neurology,2001,57(2):S1-4.
[9]Heart Protection Study.Collaborative group.C-reactive protein concentration and the vascular benefits of statin therapy:an analysis of 20536 patients in the heart protection study[J].The Lancet,2011,377(9764):469.
[10]Lin CL,Jeng AY,Howng SL,et al.Endothelin and subarachnoid hemorrhage-induced cerebral vasospasm:pathogenesis and treatment[J].Curr Med Chem,2004,11(13):1779-1791.
[11]Beuth W,Kasprzak H,Woniak B,et al.Von Willebrand factor in patients with subarachnoid hemorrhage[J].Neurol Neurochir Pol,2001,35(5):130-134.
[12]张旭辉,童有福,朵 杰,等.老年不稳定性心绞痛患者血管假性血友病因子同可溶性血管细胞间粘附分子及心肌缺血的相关性分析[J].中华高血压杂志,2011,11(22):34-35.
[13]李明芬,黄晓琪,林英辉,等.急性脑梗死患者血小板活化与血管内皮损伤标志物检测及其临床意义[J].中国实验诊断学,2011,7(15):1119-1121.
[14]袁加文,赵玉武.血浆MMP-9活性变化与糖尿病合并急性脑梗死的相关性[J].中国神经免疫学和神经病学杂志,2013,1(20):34-40.
[15] Frijns CJ,Fijnheer R,van mourik JA,et al.Early circulating levels of endothelial cell activation markers in aneurysmal subarachnoid hemorrhage:associations with cerebral ischemic events and outcome[J].J Neurol Neurosurg Psychiatry,2006,77(1):77-83.
[16]McGirt MJ,Lvnch JR,Blessing R,et al.Serum von Willebrand factor,matrix metalloproteinase-1,and vascular endothelial growth factor levels predict the onset of cerebral vasospasm after aneurysmal subarachnoid hemorrhage[J].Neurosurgery,2002,51(5):1128-1134.
The change of serum von Willebrand factor,endtohelin-1 concentrations in patients with aneurysmal subarachnoid hemorhage,and the ralation to cerebral vasospasm after aneurysmal subarachnoid hemorrhage
YANG Chenghao,CHEN Minhui,DING Hao.
(Department of Neurosurgery,Zigong NO.4 People’s Hospital,Zigong 643000,China)
Objective To search for cerebral vasospasm’s pathogenesy after aneurysmal subarachnoid hemorrhage,and the relation of vWF and ET-1 with cerebral vasospasm,to provide the experimental data for us to treat and prevent the occurrence of cerebral vasospasm after aneurysmal subarachnoid hemorrhage.Methods Experiment group patients were taken suction blood and taken TCD on admission,3 d postoperation,1 w postoperation,2 w postoperation.The control group were taken suction blood after resting 30 minutes.We took ELISA to detect vWF concentrations and took radio-immunity to detect ET-1 concentrations.Results (1)Serum vwf and ET-1 concentration at 1 w postoperation compared with other group,the difference is was significant (P<0.05).Serum vwf and ET-1 concentration at 2 w postoperation compared with admission,the difference is was unsignificant (P>0.05).(2)Preoperative CVS vWF concentration is was higher than unCVS;preoperative CVS ET-1 concentration is was higher than unCVS.Postoperative CVS vWF concentration is was higher than unCVS (P<0.01);postoperative CVS ET-1 concentration is was higher than unCVS (P<0.01).Postoperative CVS vwf,ET-1 concentration is was higher than preoperative CVS (P<0.01).(3)Serum vwf,ET-1 concentration is was direct correlation with CVS level by spearman correlation analysis(vwf:r=0.78613,P<0.01;ET-1:r=0.61904,P<0.01).(4)Serum vWF concentration is was direct correlation with serum ET-1 concentration (r=0.496,P<0.01).Conclusion vWf and ET-1 concentration could be usede as the significance refrence index to prevent the CVS,observe curative effect,judge outcome.
Intracranial aneurysm; Subarachnoid hemorrhage; Cerebral vasospasm; von Willebrand factor; Endothelin-1
1003-2754(2016)06-0521-04
2016-02-02;
2016-05-29
(自贡市第四人民医院神经外科,四川 自贡 643000)
陈岷辉,E-mail:1142430890@qq.com
R743.35
A

