大负荷游泳运动后大鼠额叶神经元凋亡和线粒体形态变化及Drp1、Mfn2表达的研究
王 璐,邓文骞
大负荷游泳运动后大鼠额叶神经元凋亡和线粒体形态变化及Drp1、Mfn2表达的研究
王 璐,邓文骞
目的:通过观察一次性大负荷游泳运动后线粒体形态结构以及线粒体融合分裂基因及蛋白表达的动态变化,探讨一次性大负荷游泳运动引起大鼠额叶神经元凋亡发生发展的可能机制。方法:72只雄性SD大鼠随机分为对照组(C组,n=18),一次性大负荷游泳运动组(E组,n=54),再根据运动后取材时间的不同将E组分为:即刻组(E0组,n=18);24h组(E24组,n=18);48h组(E48组,n=18)。C组常规饲养,E组进行一次性大负荷游泳运动,无负重游泳4小时。用透射电镜观察额叶神经元及神经元线粒体的形态结构;用TUNEL法检测细胞凋亡指数(AI);检测线粒体融合分裂基因Drp1、Mfn2 mRNA转录及蛋白表达水平。结果:检测发现E组大鼠大脑额叶神经元发生了细胞凋亡,E组各组大鼠AI显著性高于C组(P<0.01),E组各时间点AI比较为:E24>E0> E48,各组间差异均具有显著性(P<0.05)。一次性大负荷运动后各时间点Drp1和Mfn2 mRNA转录和蛋白表达均高于C组(P<0.05),其中E24组大鼠大脑额叶Drp1和Mfn2 mRNA转录和蛋白的表达最强(P<0.01);与E24组比较,E48组大鼠大脑额叶Drp1 mRNA转录和蛋白的表达下调显著(P<0.05),而Mfn2 mRNA转录和蛋白的表达下调不明显(P>0.05)。结论:一次性大负荷游泳运动引起大鼠额叶神经元凋亡及神经元线粒体形态结构异常,该异常在运动后48h内呈现动态性变化,机体可能通过调节线粒体融合分裂基因Drp1、Mfn2表达,影响大鼠额叶线粒体的形态结构和功能,从而调控额叶神经元凋亡的发生和发展。
额叶;线粒体;游泳运动;Drp1;Mfn2
0 前言
脑作为机体中对低氧或缺氧非常敏感的器官,其耗氧量占机体总耗氧量的23%,当低氧或缺氧时,往往对脑造成比较严重的损伤[1]。大量研究表明,不适宜的运动对机体产生不良的影响,甚至造成机体的损伤,如:力竭运动或极限负荷运动造成大鼠大脑发生缺血缺氧性损伤[2-3],然而运动引起损伤的机制目前尚未十分明了。因此,研究运动性脑缺血缺氧损伤的应答机制具有十分重要的意义,也成为了运动医学关注的热点。
研究表明,线粒体是一种具有高度动态变化的细胞器,线粒体的形态、数量和质量,在细胞不同的生命时相、生理过程和环境条件下,具有高度可塑性,各种生理刺激都会调节线粒体的自噬[4-5]、分裂与融合[6-9]等。目前,已经发现了作用于线粒体融合的Mfn1/2和触发线粒体分裂的Drp1等基因,无论是短时间运动还是长期运动,均会通过调节肌细胞线粒体分裂融合基因Mfn1/2和Drp1的转录,对肌细胞内线粒体的分裂融合产生影响,提高能量代谢耦联效率,为适应骨骼肌对能量的需求作出应答。课题组的前期研究发现,一次性力竭游泳运动能引起大鼠脑细胞凋亡的发生[2-3]。也有研究表明Drp1对细胞凋亡存在调控作用,在凋亡刺激下线粒体总是从网格结构转变为分散状[10-11]。那么,脑作为对能量变化以及缺氧低氧极其敏感的器官,在运动中会受到能量代谢短缺以及缺血缺氧的双重影响,线粒体作为脑细胞主要耗氧和供能的细胞器,当经历一次性大负荷游泳运动刺激后,线粒体的形态结构是否会发生变化?是否会涉及线粒体融合与分裂的改变?目前少见报道。
有研究发现,Mfn1/2的表达在急性运动后24小时内显著上调趋势[12],也有研究报道,Mfn1/2 mRNA表达在一次性递增负荷急性运动后,恢复期出现了类似于超量恢复的时相性变化[13]。本实验建立SD大鼠一次性大负荷游泳运动模型,通过观察48h内大鼠额叶线粒体形态结构发展变化,检测大鼠额叶神经元细胞凋亡的发生发展,观察线粒体融合分裂相关因子Drp1、Mfn2的表达情况,探讨一次性大负荷游泳运动后48h内线粒体形态结构变化对脑细胞凋亡的影响及可能机制。
1 材料与方法
1.1 实验动物及分组
6周龄的SPF级雄性SD大鼠72只,体重(226±21)g。大鼠购于成都市达硕实验动物有限公司实验动物生产许可证号:SCXK(川)2013-24。使用许可证号:SCXK(川)2013-34,动物批号:20150328。饲养条件:实验室常规饲料,环境温度22℃左右,相对湿度50%-70%。将大鼠随机分组,分为空白对照组(C组,n=18),大负荷游泳运动组(E组),再根据一次性大负荷游泳运动后取材时间的不同(即刻、24h和48h),将大负荷运动组分为:大负荷游泳运动即刻组(E0组,n=18),大负荷游泳运动24h组(E24组,n=18),和大负荷游泳运动48h组(E48组,n=18)。
1.2 实验造模
C组:常规饲养;E组:前3天进行无负重10min适应性游泳,休息一天后,进行一次性大负荷游泳运动,运动方式为无负重游泳,水温31±1℃,如大鼠沉入水底则捞出休息5分钟后继续,总运动时间为4h。
1.3 实验取材
根据后期实验方法的不同要求,采用分别为断头处死取材和灌注取材两种取材方法。断头处死取材:E组进行一次性大负荷游泳运动。各组随机选取6只大鼠进行断头处死,处死后迅速破坏其头盖骨取出大脑组织,剥离出额叶部分,随即放入液氮中冷冻保存,备用。灌注取材:大鼠按2.3ml/kg体重腹腔注射刚配制的2%的戊巴比妥钠,进行麻醉。麻醉成功后,各组随机选取6只大鼠进行4%多聚甲醛灌注,6只进行2.5%戊二醛灌注。随后剥离出大脑额叶分别放入装有4%多聚甲醛固定液和2.5%戊二醛固定液的小瓶中浸泡固定,4℃冰箱贮存,备用。C组大鼠按以上方法提前一天取材。
1.4 TUNEL法检测方法
从4℃冰箱中取出蜡块,制成4μm额状切片,每个额叶标本取4张切片。脱蜡去水;用Proteinase K工作液处理标本;封闭液中室温封闭10min;加100μl TdT酶反应液避光,放入37℃孵箱60min;用SSC终止反应;用0.3%H2O2/PBS封闭内源性过氧化物酶活性;加100μl Streptavidin-HRP工作液避光,放入37℃孵箱60min;加90μl DAB显色液显色;不复染,脱水,中性树胶封片,显微镜下观察计数,拍照。
TUNEL法结果判断方法:整个细胞核被标记为黄褐色的细胞,或者是胞浆中整个凋亡小体被标记为黄褐色的细胞,则可视为凋亡细胞。选取每张切片5-10个视野,在400倍镜下,计数每个视野的100个细胞中,凋亡细胞和凋亡小体数目,取其平均值作为凋亡指数(apoptosis index,AI)。
1.5 透射电镜检测方法
取出2.5%戊二醛固定大鼠额叶标本,将制备好的标本电镜切片用,醋酸铀及枸橼酸铅双重染色,然后用透射电镜进行观察、拍片。透射电镜检测于四川大学华西医院病理科电镜室完成。
1.6 Real-Time PCR 检测方法
取部分液氮保存额叶组织,按60-100 mg/ml Trizol剂量加入Trizol提取总RNA。采用紫外分光光度计测定RNA含量、纯度;采用Thermo Scientific RevertAid First Strand cDNA Synthesis Kit逆转录试剂盒进行逆转录得到cDNA;采用Thermo Scientific SYBR-Green PCR mix进行Real-time PCR。引物序列:Drp1(扩增长度222bp)上游:5′-gtg ggaagagct cag tgctggaaa gc-3′,下游:5′-ctt gtcgaattt catcaaaatctgtgtaaa g-3′;Mfn2(扩增长度135 bp)上游:5′-gat gtcaccacg gag ctg ga-3′,下游:5′-aga gacgctcactcactt tg-3′;β-actin(扩增长度200bp)上游:5′-cac ccgcgagtacaacct tc-3′,下游:5′-ccc ata ccc accatcaca cc-3′。待PCR扩增结束后,观察溶解曲线是否为单一峰,以确定PCR扩增产物的特异性;查看Drp1、Mfn2和β-actin标准曲线的扩增效率E是否接近1。用Bio-Rad CFX Manager system自动处理分析出数据,采用2-△△CT(Livak)方法进行数据处理,根据Ct值,计算Drp1、Mfn2基因的相对表达量。
1.7 Western blotting 检测方法
取部分液氮保存的额叶组织,80μl的裂解液(1mlRIPA裂解液+10μlPMSF溶液)中(蛋白裂解液购自北京百泰克生物试剂公司),加入4mg组织样本,混合后加到玻璃匀浆管中充分匀浆至组织块完全碎裂,再用超声破膜,大约10s,然后静止于冰上40min,使其充分裂解。放入到4℃低温离心机中14 000rcf离心5min,取上清,分装于EP管中,-80℃保存,待用。
采用碧云天BCA 蛋白定量试剂盒定量检测各标本总蛋白浓度和胞浆蛋白浓度。各标本取20 μg总蛋白加入上样缓冲液后于热板上煮10min,随后进行SDS-PAGE 电泳,电泳后转至PVDF 膜,X 线胶片曝光进行免疫印记信号检测。Western blotting所用抗体:鼠单克隆一抗(英国Abcam公司),山羊抗大鼠lgG/辣根酶(英国Abcam公司)。电泳结果采用Quantity One 图像分析软件进行定量分析。
1.8 统计学分析
实验数据均用SPSS13.0进行统计学分析。实验结果的数据均以“平均值±标准差”的形式进行表示,用T检验组间差异。统计学分析差异性,用P<0.01表示非常显著性差异,用P<0.05表示显著性差异。
2 实验结果
2.1 TUNEL法结果
2.1.1 TUNEL法染色结果
在400倍光镜下观察各组大鼠额叶TUNEL法切片:与C组相比较,E组各时相的额叶中,均可见多数神经元胞核和胞浆中凋亡小体被标记呈黄褐色,而C组几乎没有;E组组内各时相比较发现,以24h这个时相的额叶中,胞核和胞浆中凋亡小体被标记呈黄褐色的凋亡神经元最多,48h时胞核和胞浆中凋亡小体被标记呈黄褐色凋亡神经元有所减少(见图1)。
2.1.2 细胞凋亡指数(AI)检测结果
与C组比较:E0组和E24组大鼠额叶的AI非常显著性上调(P<0.01,P<0.01);E48组大鼠额叶的AI显著性上调(P<0.05)。
E组内各时相比较:E24组大鼠额叶的AI较E0组显著升高(P<0.05),E48组较E0组和E24组显著下降(P<0.05,P<0.05)。(图2)

图1 各组大鼠额叶TUNEL法染色结果(×40)
Figure 1 The TUNEL results of rats’ loubus fromatis in groups(×40)
注:图中整个细胞核被标记,或者是胞浆中整个凋亡小体被标记呈黄褐色的细胞为TUNEL法的阳性反应,即为凋亡细胞;1-C组;2-E0组;3-E24组;4-E48组。
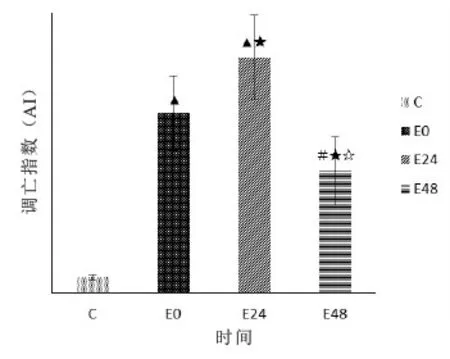
图2 各组大鼠额叶AI比较示意图
Figure 2 The AIof rats’ loubus fromatis in groups
注:▲P<0.01,与C组比较;#P<0.05,与C组比较;★P<0.05,与E0;☆P<0.05,与E24比较。(下同)
2.2 大鼠额叶超微结构
通过透射电镜对大鼠额叶进行观察,发现C组大鼠额叶的神经元形态正常,细胞核大且圆;细胞质均匀,细胞内细胞器较丰富,可见线粒体、核糖体、内质网等多种细胞器;线粒体形态结构正常,分布均匀。E0组和E24组大鼠额叶的神经元形态出现不规则;细胞质出现大量空泡;细胞质中可见多数线粒体肿胀变形明显,嵴结构模糊或断裂,甚至产生空泡状,线粒体的完整性遭到破坏(详见图 3箭头所示)。E48组大鼠额叶的神经元形态和细胞核基本恢复正常结构和形态;细胞质较为均匀,细胞内细胞器较丰富,可见线粒体、核糖体、内质网等多种细胞器;且线粒体形态结构正常,数量较多,分布不太均匀(详见图3箭头所示)。
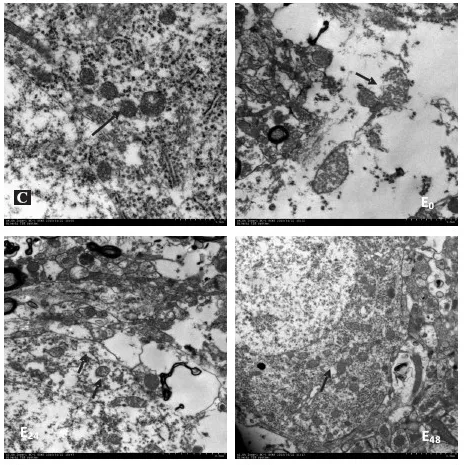
图3 各组大鼠额叶神经元和线粒体透射电子显微镜结果
Figure 3 The TEM results of rats’ loubus fromatis neurons and mitochondria in groups
2.3 Drp1和Mfn2 mPNA转录Peal-time PCR检测结果
与C组比较:E0组和E24组大鼠额叶的Drp1和Mfn2mRNA转录水平非常显著性上调(P<0.01,P<0.01,P<0.01,P<0.01);E48组大鼠额叶的Drp1和Mfn2mRNA转录水平显著性上调(P<0.05,P<0.05)。
E组内各时相比较:E24组大鼠额叶的Drp1 mRNA转录水平较E0组显著升高(P<0.05),E48组较E0组和E24组显著下降(P<0.05,P<0.05)。E24组大鼠额叶的Mfn2 mRNA转录水平在48h内维持在一个较高的水平,各时间点不具有显著性差异(P>0.05)。(见图4)
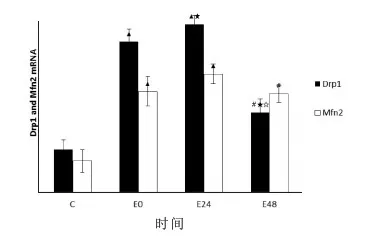
图4 各组大鼠额叶Drp1和Mfn2 mRNA
转录水平比较示意图
Figure 4 The comparison of Drp1 and Mfn2 mRNA of rats’ loubus fromatis in groups
2.4 Drp1和Mfn2蛋白表达Western-blotting检测结果
与C组比较:E0组和E24组大鼠额叶的Drp1和 Mfn2蛋白表达水平非常显著性上调(P<0.01,P<0.01,P<0.01,P<0.01);E48组大鼠额叶的Drp1和Mfn2蛋白表达水平显著性上调(P<0.05,P<0.05)。
E组内各时相比较:E24组大鼠额叶的Drp1蛋白表达水平较E0组显著升高(P<0.05),E48组较E0组和E24组显著下降(P<0.05,P<0.05);而E24组Mfn2的蛋白表达水平与E0组比较有上升趋势,但不具有显著性差异(P>0.05),E48组较E0组和E24组有所下降,但不具有显著性差异(P>0.05,P>0.05)。(详见图5)
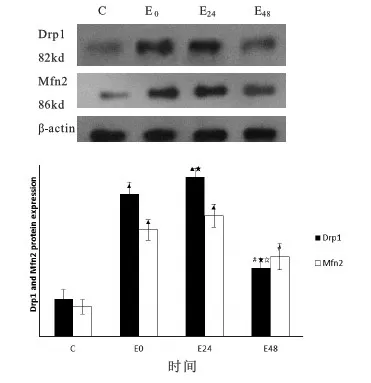
图5 各组大鼠额叶Drp1和Mfn2蛋白表达量比较示意图
Figure 5 The schematic diagram of the express quantity of Drp1 and Mfn2proteinof rats’ loubus fromatis in groups
3 讨论
研究表明,适宜的运动增进健康,预防疾病的发生发展,延年益寿;而过度剧烈运动或力竭运动,则会引起机体不适,甚至造成机体的损伤。前期研究表明,一次性力竭运动能引起的大鼠大脑皮质和海马细胞凋亡的发生,对神经系统造成伤害[2-3],然而其中的机制尚未阐明。本实验对SD大鼠采取4小时的无负重大负荷游泳运动,并持续观察运动结束后48小时内细胞凋亡指数(AI)的变化情况。检测发现,E组一次性大负荷游泳运动后大鼠额叶AI,较C显著增加(P<0.05),提示一次性大负荷游泳运动造成了大鼠的额叶损伤。在一次性大负荷游泳运动后的3个时相:即刻、24h和48h,检测发现:AI在24h这个时相增加最为显著。提示:一次性大负荷游泳运动造成的脑损伤存在一定的延迟性,且在48小时时逐渐好转。
近期研究发现线粒体是具有高度动态变化的细胞器,当受到外界刺激,易出现超微结构上的异常改变[14]。研究表明在急性低氧和运动性缺氧条件下,电镜观察发现细胞的染色质凝集、边缘化,线粒体肿胀变形,嵴结构模糊,线粒体的完整性遭到损伤,电子传递链上的电子漏增加[15-16];在低氧的环境下或者是运动造成运动性缺氧都会损伤大鼠大脑神经元,甚至影响线粒体的超微结构,造成线粒体电子传递链结构的不完整,从而使线粒体的呼吸功能下降,导致能量代谢障碍。本实验结果提示:线粒体形态结构的破坏和恢复,与大负荷游泳运动后大鼠额叶神经元细胞凋亡的发生发展趋势具有一致性。研究表明:线粒体形态结构的变化深刻影响其功能,线粒体形态结构是其功能可见的外在表现形式,本实验中一次性大负荷运动破坏了线粒体形态结构的完整性,势必会影响线粒体的功能,从而造成额叶神经元的功能障碍,这提示线粒体形态结构的完整性关系着细胞的功能状况。
线粒体的形态变化受控于保守的蛋白装置[17-18],分别为作用于线粒体外膜融合的Mfn1/2,和作用于线粒体内膜融合的OPA1;触发线粒体分裂的Fis1和Drp1。近期研究表明,线粒体的形态变化在不同运动方式和运动强度中做出不同的应答反应。Cartoni等[12]发现,一次中等强度运动可增加人体骨骼肌线粒体融合基因的转录及其蛋白表达水平。研究表明:急性运动会引起线粒体移动增加,以满足运动中对能量需求的急剧变化;并推测这种移动可能是由线粒体分裂与融合mRNA所致,促进线粒体网格结构趋于分裂,利于线粒体在细胞内重新分布[19]。Mfn1/2 mRNA表达水平在运动后24小时显著上调[12]。Mfn1/2 mRNA表达在一次递增负荷急性运动中和运动后恢复期,呈现类似超量恢复的时相性变化[13]。长期有氧训练可以提高骨骼肌线粒体的氧化磷酸化能力,以及促进调控线粒体形态变化的Mfn2和Drp1的表达[20]。漆正堂等[21]研究表明,大强度间歇性运动可能通过调控Mfn2、Drp1 mRNA与蛋白表达水平,影响骨骼肌线粒体的融合与分裂;而长时间低强度耐力运动,可能通过调控Mfn1 mRNA发挥类似作用。本研究发现,一次性大负荷游泳运动上调Drp1和Mfn2的表达,使线粒体分裂融合增加,以满足运动中机体对能量的需求和对运动性低氧的适应;然而Drp1的表达过度增加,则会使线粒体分裂融合平衡紊乱,导致线粒体形态结构异常,引发功能障碍。本研究发现E24组Drp1的表达上调非常显著,从而打破了线粒体分裂融合的平衡。同时,研究表明Drp1对细胞凋亡的有调控作用,在凋亡刺激下线粒体总是从网格结构转变为分散状[10]。线粒体的分裂是在细胞凋亡过程中不断发生的事件[11]。也有研究认为细胞凋亡是分裂事件引发的下游事件[22]。推测,一次性大负荷游泳运动引起细胞凋亡的发生,可能是通过核基因上调Drp1的表达所引起的。
而运动结束后48h内Mfn2表达一直保持在一个较高的水平,特别是E48组Mfn2表达下降不显著,有效缓解了细胞凋亡的继续发生,促进了线粒体的自我修复。推测运动诱导了Mfn2表达的增加,一方面是线粒体网格化程度增加,加强了线粒体与线粒体之间的交流,提高线粒体能量代谢效率,有利于能量和信息在不同线粒体中传递,线粒体内容物及mtDNA交换互补[23],另一方面,Mfn1/2的高表达有利于抑制细胞凋亡的发生[24]。
4 结论
一次性大负荷游泳运动后48h内,机体通过调节线粒体融合分裂基因Drp1、Mfn2 mRNA和蛋白表达,影响大鼠额叶线粒体的形态结构和功能,从而调控额叶神经元凋亡过程的发生发展;融合分裂基因Drp1、Mfn2还可能与大负荷游泳运动后脑组织能量代谢调节及脑缺氧耐受过程有关,具体机制有待进一步研究。
[1] Witt,KA Mark KS,HomS,et. al.Effects of hypoxia-reoxygenation on rat blood-brainbarrier permeability and tight junctional protein expression[J].Am J Physiol Heart Circ Physiol,2003, 285(6):H2820-2831.
[2] 王璐,袁琼嘉.运动预处理对力竭运动诱导的大鼠海马细胞凋亡的影响[J].体育科学,2009, 29 (3):52-57.
[3] 王璐,邓文骞,袁琼嘉.运动预处理对力竭运动诱导的大鼠大脑皮质细胞凋亡的影响[J].中国运动医学杂志,2012,31(7):602-606;622.
[4] Ji LL. DickmanJR,KangC,et. al.Exercise-inducedhormesis May Help Healthy Aging[J]. Dose-Response,2010,8(1):73-79.
[5] LemastersJJ.Selective Mitochondrial Autophagy, or Mitophagy, as A Targeted Defense Against Oxidative Stress, Mitochondrial Dysfunction, and Aging[J].Rejuvenation Res,2005 Spring;8(1):3-5.
[6] Ming Zhan,CraigBrooks,FuyouLiu,et. al.Mitochondrialdynamics:Regulatory Mechanisms and Emerging Role in Renal Pathophysiology[J].Kidney Int,2013,83(4):568-581.
[7] Detmer SA and Chan DC.Functions and Dysfunctions of Mitochondrial Dynamics[J].Nat Rev Mol Cell Biol,2007,8(11):870-879.
[8] HoppinsS,LacknerL,and NunnariJ.The Machines That Divide and Fuse Mitochondria[J]. Annu Rev Biochem,2007,76(1):751-780.
[9] Arnold Y Seo,Anna-Maria Joseph,DebapriyaDutta,et al.New Insights into the role of Mitochondria in Aging: Mitochondrial Dynamics and More[J].J Cell Sci,2010,123(15): 2533-2542.
[10] Frank S,GaumeB,Bergmann-LeitnerES,et. al.The Role of Dynamin-related Protein 1,A Mediator of Mitochondrial Fission,Inapoptosis[J].Dev Cell,2001,1(4):515-525.
[11] Laura M Westrate, Jeffrey A Drocco, Katie R Martin,et. al.Mitochondrial Morphological Features are Associated with Fission and Fusion Events[J].PLoS One,2014, 9(4): e95265:1-15 .
[12] CartoniR,LegerB,HockMB,et. al.Mitofusins1/2 and Erralpha Expression are Increased in Human Skeletal Muscle After Physical Exercise[J].J Physiol,2005, 567(Pt1): 349-358.
[13] 孙卫东,丁虎,刘晓然,等.骨骼肌线粒体对细胞能量需求的快速应答:mfn1/2与fis1基因在急性运动中的动态表达[J].中国运动医学杂志,2008,27(5):544-550.
[14] Clara De Palma, Federica Morisi, Sarah Pambianco,et. al. Deficient Nitric Oxide Signalling Impairs Skeletal Muscle Growth and Performance: Involvement Of Mitochondrial Dysregulation[J]. Biochem.Skelet Muscle, 2014, 4(1): 22-23.
[15] 吴伟奋,陈春美,苏德炎,等.不同运动强度影响大鼠脑缺血后神经功能修复机制的研究[J].中国医药导报,2013,10(10):19-22.
[16] 李海英,苗卫国,马静芬,等.线粒体自噬在运动预适应抗急性低压低氧大鼠脑海马损伤中的作用.中国运动医学杂志,2014,33(6):524-529.
[17] Giovanni BENARD and MariuszKARBOWSKI.Mitochondrial Fusion and Division: Regulation and Role in Cell Viability[J]. Semin Cell Dev Biol, 2009,20(3): 365-374.
[18] Jiang HK, Wang YH, Sun L,et. Al.Aerobic Interval Training Attenuates Mitochondrial Dysfunction in Rats Post-Myocardial Infarction: Roles of Mitochondrial Network Dynamics[J]. Int J Mol Sci,2014,15(4):5304-5322.
[19] 刘慧君,姜宁,赵斐,等.急性运动中骨骼肌线粒体移动相关基因表达与线粒体动力学的关系[J].天津体育学院学报,2010,25(2):118-121.
[20] GarnierA,FortinD,ZollJ,et. al.Coordinated Changes in Mitochondrial Function and Biogenesis in Healthy and Diseased Human Skeletal Muscle[J].FASEB J,2005,19(1):43-52.
[21] 漆正堂,郭维,张媛,等.不同运动方式对大鼠骨骼肌线粒体融合分裂基因及Mfn2、Drp1蛋白表达的影响[J].中国运动医学杂志,2011,30(2):143-148.
[22] Arnold Y Seo,Anna-Maria Joseph, DebapriyaDutta,et. al. New Insights into the Role of Mitochondria In Aging: Mitochondrial Dynamics and More[J]. J Cell Sci,2010,123(15): 2533-2542.
[23] Gilad Twig and Orian S. Shirihai. The Interplay Between Mitochondrial Dynamics and Mitophagy[J]. Antioxid Redox Signal, 2011, 14(10): 1939-1951.
[24] Hidenori Otera and Katsuyoshi Mihara .Mitochondrial Dynamics:Functional Link with Apoptosis[J]. International Journal of Cell Biology,2012,1(1):821676:1-10.
(编辑 孙君志)
Research onthe Frontal Neurons Apoptosis of Rats and the Mitochondrial Morphology and Expression of Drp1, Mfn2 after Overload Swimming
WANG Lu,DENG Wenqian
Objective: This study was designed to discuss the relationship between cell apoptosis of the frontal lobe induced by one-time overload exercise and the changes of mitochondrial morphology in rats,as well as the expression of Drp1、Mfn2, which are associated with mitochondrial fusion and division. Methods:48 male SD rats were randomly divided into control group(group C,n=18),one-time overload exercise group(group E,n=54). Group E was divided again into different groups based on time(immediately,24h and 48h),named group E0,E24 and E48, with 18 rats in each group.Group E: carried out one-time exhaustive swimming for 4 hours.The morphological structure of the loubusfromatis neurons and mitochondria were observed by using transmission electron microscopy, the apoptosis index (AI) detected by TUNEL method, and the mRNA and protein level of Drp1 and Mfn2 detected.Results:the rats’ frontal lobe neurons and mitochondrial appeared irregular after one-time overload exercise,but this exception returned to normal in 48hours. There was a significant reduction of AI in group E, when compared with group C(P<0.01).When compared with the AI at different time points in group E,we can see that E24>E0>E48(P<0.05). The transcription and protein expression of Drp1 and Mfn2 were significantly increased after one-time exhaustive exercise, when compared with group C(P<0.05).The Drp1 transcription and protein expression of group E48 decreased significantly (P<0.05),and the Mfn2 transcription and protein expression decreased slighter (P>0.05), when compared with group E24.Conclusion: Suggest that one-time overload movement cause an abnormal mitochondria morphology and induce cell apoptosis of the loubus fromatis. But in 48 hours tissue damage of the loubus fromatis can be reduced, or even recovery. The expression of Drp1 and the loubus fromatis cell apoptosis induced by exhaustion exercise were closely related. However, the increased expression of Mfn2 could ameliorate the development of the loubus fromatis cells apoptosis caused by exhaustion movement.
FrontalLobe;Mitochondrion;Swimming;Drp1;Mfn2
G804.7 Document code:A Article ID:1001-9154(2016)04-0076-06
四川省体育局项目“线粒体形态变化与细胞凋亡在大鼠极限负荷运动中的相关性研究”(13STK18);四川省教育厅项目“线粒体形态功能在大鼠一次性力竭运动后动态变化的研究”(14ZB0262);成都体育学院青年基金项目“线粒体自噬在运动预处理减轻一次性力竭运动引起的大鼠大脑损伤的作用”(15YJQN07)。
王璐,讲师,研究方向:运动与健康。E-mail:21379183@qq.com。
成都体育学院,四川 成都 610041 Chengdu Sports Institute,Chengdu 610041,China
2016-02-14
2016-05-11
G804.7
A
1001-9154(2016)04-0076-06

