大剂量N-乙酰半胱氨酸改善特发性肺间质纤维化的机制研究
陈利玲, 黄 江, 唐 燕
(1. 四川省广元市第四人民医院, 呼吸科, 四川 广元, 628001; 2. 四川省人民医院, 呼吸科, 四川 成都, 610072)
大剂量N-乙酰半胱氨酸改善特发性肺间质纤维化的机制研究
陈利玲1, 黄 江2, 唐 燕1
(1. 四川省广元市第四人民医院, 呼吸科, 四川 广元, 628001; 2. 四川省人民医院, 呼吸科, 四川 成都, 610072)
N-乙酰半胱氨酸; 肺间质纤维化; 炎症反应; 肺功能
特发性肺间质纤维化是临床上的常见病症,多发于50岁以上患者,临床表现为干咳、呼吸困难等[1-3]。特发性肺间质纤维化患者肺功能异常,多表现为中度或重度限制性通气障碍或弥散性功能障碍[4-5]。特发性肺间质纤维化可由多种原因引起,如药物、吸入有害气体或有机尘埃、感染或者放射性损伤[6-7]。本研究对大剂量N-乙酰半胱氨酸改善特发性肺间质纤维化的效果及其机制进行研究,现报告如下。
1 资料与方法
1.1 一般资料
选取2010年4月—2014年4月诊治的特发性肺间质纤维化患者90例,男46例,女44例,年龄53~66岁,平均年龄62.3±6.8岁。所有患者均经过CT诊断符合寻常型间质性肺炎,且经皮肺活检或纤维支气管镜活检排除其他原因。所有患者双肺底可闻及吸气相爆裂音,肺活量小于预计值的80%。
1.2 治疗方法
90例患者随机分为泼尼松组、小剂量N-乙酰半胱氨酸组和大剂量N-乙酰半胱氨酸组各30例。3组患者年龄、性别比例及疾病的严重程度方面无显著差异(P>0.05)。泼尼松组患者给予泼尼松0.5 mg/kg口服治疗4周, 0.25 mg/kg口服治疗8周, 0.125 mg/kg口服治疗8周;小剂量N-乙酰半胱氨酸组在常规泼尼松治疗的基础上给予小剂量N-乙酰半胱氨酸200 mg治疗,3次/d; 大剂量N-乙酰半胱氨酸组在常规泼尼松治疗的基础上给予大剂量量N-乙酰半胱氨酸600 mg治疗, 3次/d。
1.3 检测指标
所有患者治疗前后抽取静脉血, 3 000 r/min离心15 min分离上层血清待用。检测TNF-α、TGF-β及白细胞介素水平,检测试剂盒购自美国OMEGA公司,所有操作均严格按照说明书进行。观察患者治疗前后肺活量和6 min步行试验距离的变化。
1.4 统计学处理
应用SPSS 19.0统计软件对数据进行统计学分析,计量资料用均数±标准差表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
治疗后,3组患者肺活量、6 min步行试验距离较治疗前显著改善(P<0.05或P<0.01), 且大剂量N-乙酰半胱氨酸组显著优于小剂量N-乙酰半胱氨酸和泼尼松组(P<0.05), 见表1。治疗后, 3组患者TNF-α、TGF-β水平较治疗前显著改善(P<0.05或P<0.01), 且大剂量N-乙酰半胱氨酸组显著优于小剂量N-乙酰半胱氨酸和泼尼松组(P<0.05), 见表2。治疗后, 3组患者IL-2、IL-6、IL-10水平较治疗前显著改善(P<0.05或P<0.01), 且大剂量N-乙酰半胱氨酸组显著优于小剂量N-乙酰半胱氨酸和泼尼松组(P<0.05), 见表3。
3 讨 论
特发性肺间质纤维化是临床上常见的疾病,但是其确切的发病原因尚不明确。临床上常见的抗肿瘤药物和抗菌药物如博来霉素、环磷酰胺、青霉素类和四环素类等都可以引起特发性肺间质纤维化。同时,吸入硝酸、硫酸、毒气、溶剂气体等也可能引起特发性肺间质纤维化的发生。临床上尚无特效的特发性肺间质纤维化治疗药物,目前多采用激素治疗和抗炎治疗[8-9]。本研究在对大剂量N-乙酰半胱氨酸改善特发性肺间质纤维化机制进行研究时也发现,泼尼松组、小剂量N-乙酰半胱氨酸组和大剂量N-乙酰半胱氨酸组患者治疗后肺功能均有明显的改善,且血清中TNF-α、TGF-β及IL-2、IL-6和IL-10的水平明显降低。大剂量N-乙酰半胱氨酸能有效改善特发性肺间质纤维化,其可能机制是抑制患者体内炎症反应。
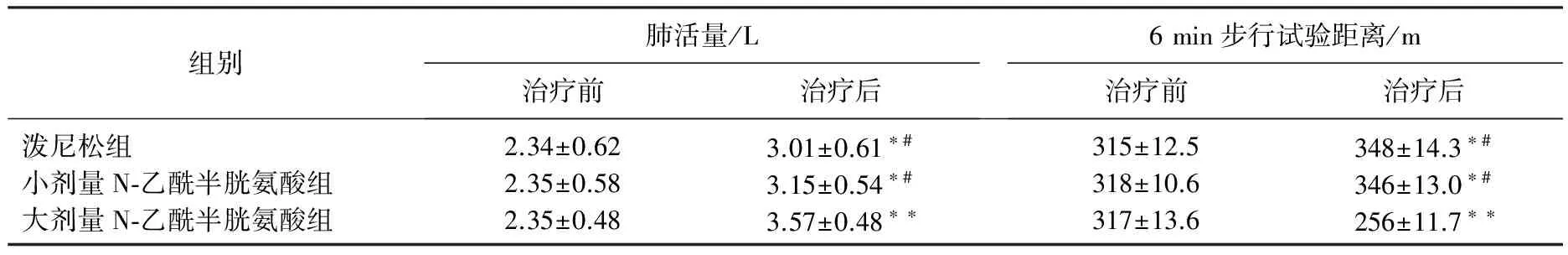
表1 3组患者治疗前后肺活量、6 min步行试验距离变化比较
与治疗前相比, *P<0.05, **P<0.01; 与大剂量N-乙酰半胱氨酸组相比, #P<0.05。
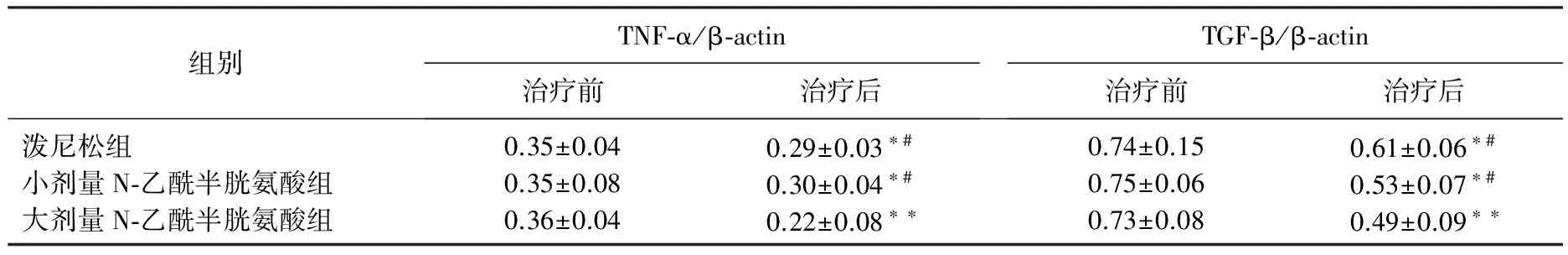
表2 3组患者治疗前后血清TNF-α、TGF-β水平变化比较
与治疗前相比, *P<0.05, **P<0.01; 与大剂量N-乙酰半胱氨酸组相比, #P<0.05。

表3 3组患者治疗前后血清IL-2、IL-6和IL-10水平比较
与治疗前相比, *P<0.05, **P<0.01; 与大剂量N-乙酰半胱氨酸组相比, #P<0.05。
炎症反应参与了多种呼吸系统疾病和肺损伤过程[10]。在对慢性阻塞性肺疾病并发肺动脉高压与炎症反应的相关性研究中证实, COPD并发肺动脉高压患者血清中炎症因子CRP、IL-6、TNF-α及BNP比单纯COPD肺动脉压正常患者高,提示炎症反应是慢性阻塞性肺疾病患者形成肺动脉高压的重要因素[11]。在对基于肺泡上皮细胞A549中NF-κB信号通路调控的调补肺肾三方对炎症反应机制的影响的研究中也发现,补肺健脾方、补肺益肾方和益气滋肾方中补肺益肾方主要通过下调细胞因子水平及抑制炎症相关蛋白的表达来实现。本研究在分析大剂量N-乙酰半胱氨酸调节特发性肺间质纤维化患者血清IL-2、IL-6和IL-10水平时也证实,药物治疗能有效降低患者血清中IL-2、IL-6和IL-10水平;同时,大剂量的N-乙酰半胱氨酸治疗效果明显优于小剂量N-乙酰半胱氨酸和泼尼松组,表明大剂量的N-乙酰半胱氨酸也是通过抑制炎症因子IL-2、IL-6和IL-10水平发挥改善特发性肺间质纤维化患者的症状。
[1] 王楠, 刘超. 特发性肺间质纤维化相关性肺动脉高压的研究进展[J]. 中华全科医学, 2015, 12(4): 644-646.
[2] 张蕾. 干扰素γ-1b对特发性肺间质纤维化疗效分析[J]. 医药导报, 2015, 8(4): 480-483.
[3] 常彩虹, 高毅英, 高玉林. 老年特发性肺间质纤维化与肺纤维化和肺气肿综合征的临床特征比较[J]. 临床荟萃, 2015, 3(1): 44-47.
[4] 吴晓华, 马大庆, 张淑红, 等. 特发性肺间质纤维化的早期HRCT表现及其病理基础探讨[J]. 医学影像学杂志, 2014, 12(10): 1734-1738.
[5] 周明萍, 赵艳, 林文燕. 补肺益肾法治疗特发性肺间质纤维化所致慢性呼吸衰竭[J]. 中国实验方剂学杂志, 2014, 9(4): 192-195.
[6] 陈恒屹, 康军, 崔社怀, 等. 特发性肺间质纤维化合并肺气肿的临床特征分析[J]. 中华肺部疾病杂志: 电子版, 2014, 6(1): 7-11.
[7] 赵静, 刘瑞娟. 特发性肺间质纤维化的相关研究进展[J]. 山东医药, 2014, 7(7): 88-90.
[8] 朱毅. 从细胞角度理解特发性肺间质纤维化的发病机制[J]. 中华肺部疾病杂志: 电子版, 2014, 11(4): 444-447.
[9] 陈云凤, 刘洪, 李群英, 等. 补肺益肾、化瘀通络法治疗特发性肺间质纤维化的临床研究[J]. 中华中医药杂志, 2014, 24(9): 3030-3032.
[10] 刘明伟, 王忠平. 百草枯中毒肺损伤与全身炎症反应[J]. 临床肺科杂志, 2010, 16(12): 1779-1781.
[11] 李雅敏, 刘双, 米玉红, 等. 慢性阻塞性肺疾病并发肺动脉高压与炎症反应的相关性研究[J]. 心肺血管病杂志, 2013, 7(2): 174-178.
2016-09-09
R 563
A
1672-2353(2016)23-154-02
10.7619/jcmp.201623056

