运动通过提高DNA甲基化水平改善阿尔茨海默病小鼠空间学习记忆能力
何 标,徐 波,张宪亮
●博士(生)论坛Doctor Forum
运动通过提高DNA甲基化水平改善阿尔茨海默病小鼠空间学习记忆能力
何标1,2,徐波1,2,张宪亮3
目的:探讨DNA甲基化在运动缓解阿尔茨海默病中的作用。方法:选3月龄APP/PS1转基因小鼠24只,随机分为转基因运动组(TE,n= 12)和转基因对照组(TC,n=12),选同系野生型小鼠作为正常对照组(C,n=12)和运动对照组(E,n=12)。E组和TE组给予10周的跑台运动,C组和TC组安静饲养。运动结束后Morris水迷宫检测小鼠学习记忆能力,水迷宫试验后取海马组织,RT-PCR法检测小鼠海马甲基化转移酶DN⁃MT1、DNMT3a、DNMT3b mRNA表达水平,Western Blot检测小鼠海马APP、PS1、Aβ42蛋白表达情况。结果:与C组相比,TC组小鼠海马DN⁃MT1mRNA表达水平显著降低(P<0.01),DNMT3a mRNA表达水平显著降低(P<0.05),DNMT3b mRNA表达水平显著降低(P<0.05),APP蛋白表达水平显著增加(P<0.01),PS1蛋白表达水平显著增加(P<0.01),Aβ42蛋白表达水平显著增加(P<0.01),学习记忆能力显著降低(P<0.05)。与TC组相比,TE组小鼠海马DNMT1mRNA表达水平显著增加(P<0.05),DNMT3a mRNA表达水平显著增加(P<0.05),DNMT3b mRNA表达水平显著增加(P<0.05),APP蛋白表达水平显著降低(P<0.05),PS1蛋白表达水平显著降低(P<0.05),Aβ42蛋白表达水平显著降低(P<0.05),空间记忆能力显著增强(P<0.05)。结论:10周的跑台运动通过增加AD小鼠海马DNMT表达水平,提高海马DNA甲基化水平,抑制APP、PS1蛋白表达,减少Aβ 42的生成,提高AD小鼠的学习记忆能力。
跑台运动;阿尔茨海默病;表观遗传;DNA甲基化;学习记忆
1 材料及方法
1.1实验动物及分组
从南京大学动物研究所选购3月龄雄性APP/PS1转基因小鼠24只。将APP/PS1转基因小鼠随机分为转基因运动组(TE,n= 12)和转基因对照组(TC,n=12),选同系野生型小鼠作为正常对照组(C,n=12)和运动对照组(E,n=12)。常规分笼饲养,实验动物置于标准动物房,自由饮食进水,自然光照(鉴于该种系小鼠死亡率高,为防止实验过程中小鼠死亡,实际购置的小鼠多于24只)。
1.2运动方案
小鼠置于标准动物房适应性喂养2周,然后进行一周的适应性跑台训练:先将E组TE组小鼠置于静止的跑台上适应2天,每天30 min,第3天开始进行15 min的跑台训练,第4天进行30 min的跑台训练,第5天进行45 min的跑台训练,第6、第7天休息,随后,E组和TE组小鼠进行10周的跑台运动,每周5次,每次训练持续时间45 min,速度为9 m/min,每天下午4点进行跑台训练,训练强度参照文献[12]进行,运动强度为小鼠最大摄氧量的45%~55%。第11周进行水迷宫测试,水迷宫测试共6天:前5天为定位航行实验,第6天进行空间探索实验。水迷宫实验仪器由上海吉量公司提供。
1.3取材
水迷宫实验结束后,禁食12 h,将实验小鼠麻醉、断颈处死,取海马组织,置-80℃冰箱,待测。所有操作均在冰上进行。
1.4实时荧光定量RT-PCR实验
采用RT-PCR技术对实验小鼠海马DNMT1、DNMT3a、DNMT3b mRNA表达情况进行检测,实验操作步骤按照文献[13]进行,具体如下:取适量的海马组织,用Trizol法提取小鼠海马内总的RNA,以20 μL逆转录反应体系,通过37℃,15 min,95℃,5 min进行PCR反应,经逆转录得到稳定的cDNA。按要求设计合成引物,引物序列见表1。根据RT-PCR试剂盒说明,进行如下操作:加入10 μL SYBR green PCR Master Mix,2 μLcDNA,上下游引物各0.04 μL,补充ddH2O至20 μL。按照RT-PCR扩增循环参数:预变性95℃,1 min;以95℃,15s;60℃,30 s;72℃,45 s,45个循环。为建立溶解曲线,扩增结束后,再通过95℃,60 s;60℃,60 s;95℃,15 s;从60℃到95℃,每升高1℃收集一次荧光,记录Ct值。根据2-△△Ct法计算相对表达量。

表1 引物序列一览表Tab.1 Primer sequence of gene
1.5Western Blot检测实验小鼠海马APP、PS1和Aβ42蛋白表达情况
取20~30 mg海马组织,按照1∶7的比例加入混有PMSF的裂解液,重复均浆3~4次,12 000g低温离心5 min,取上清,用BCA试剂盒测定蛋白浓度,置于-80℃冰箱待测。用SDS-PAGE进行凝胶电泳,并进行PVDF转膜,然后孵一抗,4℃摇床过夜,次日孵二抗,室温孵育2 h,TBST摇床洗3次,于暗室用ECL显影,用AIpha成像系统曝光,ImageJ1.46进行灰密度值分析,将目的蛋白与内参平均密度的比值作为目的蛋白的相对表达量。
1.6数据统计
运用SPSS17.0软件对所获数据进行统计分析,所有实验数据均用平均数±标准差(M±SD)表示,采用单因素分析法(One-Way ANOVA),事后检验采用LSD法。以P<0.05为显著性差异,以P<0.01为极显著性。
2 结 果
2.1跑台运动对Tg APP/PS1小鼠海马DNMT1、DNMT3a、DNMT3b mRNA表达的影响
RT-PCR结果显示,TC组小鼠海马DNMT1 mRNA表达水平显著低于C组和E组,差异均具有极显著性(P<0.01),TE组小鼠海马DNMT1 mRNA表达水平显著高于TC组,差异具有显著性(P<0.05),E组小鼠海马DNMT1 mRNA表达水平稍高于C组,但差异不具显著性(P>0.05)。TC组小鼠海马DNMT3a mRNA表达水平显著低于C组和E组,差异均具有显著性(P< 0.05),TE组小鼠海马DNMT3a mRNA表达水平显著高于TC组,差异具有显著性(P<0.05),E组小鼠海马DNMT3a mRNA表达水平稍高于C组,但差异不具显著性(P>0.05)。TC组小鼠海马DNMT3b mRNA表达水平显著低于C组,差异具有显著性(P<0.05),TC组小鼠海马DNMT3b mRNA表达显著低于E组,差异具有极显著性(P<0.01),TE组小鼠海马DNMT3b mRNA表达显著高于TC组,差异具有显著性(P<0.05),E组小鼠海马DNMT3b mRNA表达水平稍高于C组,但差异不具显著性(P> 0.05)。结果提示,10周的跑台运动显著提高Tg APP/PS1小鼠海马DNMT1、DNMT3a、DNMT3b mRNA表达水平,提高AD小鼠海马DNA甲基化水平(见图1)。

图1 DNMT1、DNMT3a、DNMT3b mRNA表达情况(n=12)Figure.1 mRNA expression of DNMT1、DNMT3a、DNMT3b gene
2.2跑台运动对Tg APP/PS1小鼠海马APP、PS1、Aβ42蛋白表达的影响
Western Blot实验结果显示,与C组(0.91±0.49)相比,TC组小鼠海马APP蛋白表达水平(2.10±0.84)显著增加,差异具有极显著性(P<0.01),TE组小鼠海马APP蛋白表达水平(1.45±0.59)显著低于TC组,差异具有显著性(P<0.05)。与C组相比,E组小鼠海马APP蛋白表达水平(0.85±0.38)呈下降趋势,但差异不具显著性(P>0.05)。与C组(0.73±0.38)相比,TC组小鼠海马PS1蛋白表达水平(1.76±0.94)显著增加,差异具有极显著性(P< 0.01),TE组小鼠海马PS1蛋白表达水平(1.14±0.48)显著低于TC组,差异具有显著性(P<0.05)。与C组相比,E组小鼠海马PS1蛋白表达水平(0.65±0.28)呈下降趋势,但差异不具显著性(P>0.05)。与C组(0.59±0.80)相比,TC组小鼠海马Aβ42蛋白表达水平(1.50±0.74)显著增加,差异具有极显著性(P<0.01),TE组小鼠海马Aβ42蛋白表达水平(0.93±0.66)显著低于TC组,差异具有显著性(P<0.05)。与C组相比,E组小鼠海马Aβ42蛋白表达水平(0.42±0.17)呈下降趋势,但差异不具显著性(P> 0.05)(见图2)。
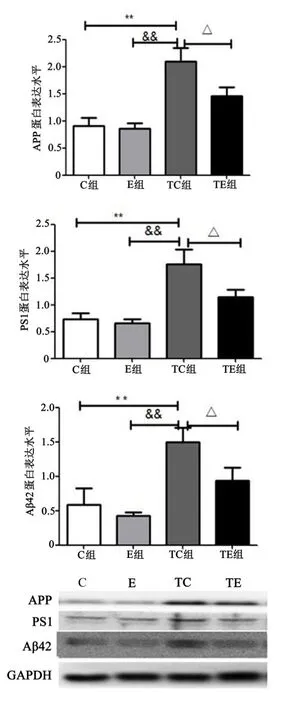
图2 APP、PS1、Aβ42蛋白表达(n=12)Figure.2 protein expression of APP、PS1、Aβ42
2.3跑台运动对Tg APP/PS1小鼠学习记忆能力的影响
Morris水迷宫实验结果显示,第1天各组小鼠潜伏期虽然没有显著性差异,但其运动组潜伏期呈现减少的趋势。除第1天外,第2、3、4和5天运动组潜伏期均显著少于同天对照组。与C组相比,TC组小鼠第2、3、4和5天潜伏期显著大于C组,差异具有显著性(P<0.05);与C组相比,E组小鼠第2天潜伏期著性少于C组,差异具有显著性(P<0.05);与TC组小鼠相比,TE组小鼠第2、3、4和5天潜伏期均显著小于TC组,差异具有显著性(P<0.05)(见图3-1)。
空间探索实验发现,E组小鼠穿越平台次数显著多于C组,差异具有显著性(P<0.05),TC组小鼠穿越平台次数显著少于C组,差异具有显著性(P<0.05),与TC组相比,TE组小鼠穿越平台次数显著增加,差异具有显著性(P<0.05)(见图3-2)。

图3-1 小鼠水迷宫潜伏期Figure.3-1 escape latency in water maze test

图3-2 小鼠穿越平台次数Figure.3-2 times across platform in water maze test
3 分析讨论
3.1DNA甲基化与AD
AD是一种多发于老年期的神经退行性疾病,发病机制尚未明确,普遍认为是遗传和环境等因素共同作用的结果,是因机体衰老而导致的神经退行性病变。有研究证实,AD可能源于生命的早期[14]。表观遗传修饰和表观调节作用可能在中枢神经系统疾病以及认知功能下降等疾病过程中起到重要作用[15]。有研究[16]证实,AD脑区存在表观遗传修饰的改变,与正常大脑相比较,AD脑内甲基化模式发生了显著变化,DNA甲基化对突触可塑性、精神行为及学习记忆均产生一定的影响。DNA甲基化主要发生在CpG双核苷酸序列的胞嘧啶上,成簇的CpG形成CpG岛,CpG岛与基因启动子有着密切的联系,在哺乳动物体内,DNMTs家族的成员主要包括DNMT1、DNMT2、DNMT3a和DNMT3b4种亚型。在成体细胞中,DNA甲基化主要是在DNMT1的作用下实现的,DNMT1对维持基因组甲基化水平至关重要,DNMT2仅能使天冬氨酸tRNA进行甲基化,而DNMT3a和DNMT3b则主要是在细胞分化发育的早期发挥作用,使细胞发育、分化得以正常进行[17]。
Tg APP/PS1小鼠过表达突变的人类早老素(Ps1)和人淀粉样前体蛋白(APPswe)融合体,6~7月龄Tg APP/PS1小鼠脑内形成明显的Aβ沉积,海马神经元丢失增多,学习记忆能力下降,是研究AD较为理想的转基因动物模型[18]。本实验结果显示,7月龄Tg APP/PS1小鼠空间记忆能力和海马DNMT1、DNMT3a和DNMT3b表达水平显著低于正常对照组,而APP、PS1和Aβ42蛋白表达水平显著增加,提示Tg APP/PS1小鼠海马总DNA甲基化水平降低,脑内Aβ42含量增加,学习记忆能力下降。DNA甲基化可以直接影响基因的表达并调控细胞的生长和分化[19]。海马神经元DNMT1的表达高于其他组织[20]。
AD常伴有高同源型HCY和低维生素B12和低叶酸症状,老年人DNA甲基化水平普遍低于青年人,老年人总基因组甲基化程度降低,但是局部的CpG岛出现异常的高甲基化,这个现象为AD发生的重要特征之一,提示AD脑内甲基化模式发生显著性变化[21]。SIEGMUND等人[22]对AD患者大脑尸检也发现,AD患者大脑皮层DNA甲基化程度显著降低,同时还发现AD患者大脑皮层PS1基因表达也显著增加,提示大脑皮层DNA甲基化水平的降低可能是诱导AD发生的主要病因。MASTROENI等人[16]检测了AD患者大脑皮层DNA甲基化标记物和DNA甲基化相关酶的表达水平发现,AD大脑神经元DNMT1和多种表观遗传学标记物显著降低,而且这种降低伴有神经原纤维缠结尤其显著。而在AD细胞((N2a-APP)实验中发现DNMT1表达显著降低,而叶酸可以通过提高N2a-APP细胞DNMT1、DNMT3a和DNMT3b表达水平,减少Aβ的生成[23]。
Aβ是APP在β-分泌酶和γ-分泌酶的作用下生成的,正常情况下,β-分泌酶和γ-分泌酶启动子区受DNA甲基化的调节,机体通过DNA甲基化作用对ɑ-分泌酶、β-分泌酶和γ-分泌酶实现精确的调控,而在AD海马,这种调控作用出现异常,导致Aβ细胞外聚集增多[24]。AD患者大脑皮层APP启动子区低甲基化导致Aβ的生成显著增加[25]。SCARPA等人[26]的研究也证实,β-分泌酶和γ-分泌酶表达水平受DNA甲基化的调节,DNA低甲基化导致海马PS1和BACE基因过表达,并最终使Aβ的生成增多。但也有截然不同的研究结果,研究[27]证实,AD患者大脑APP启动子区甲基化水平与正常对照组没有显著性差异,并认为APP启动子区DNA甲基化水平对调节APP基因的表达没有产生影响。COPPIETERS等人[28]对13名AD患者大脑额中回和29名AD患者颞中回DNA甲基化水平检测后发现,AD患者颞中回DNA甲基化水平显著上升,AD患者颞中回DNA甲基化水平与Aβ和Tau蛋白水平存在正相关。导致上述研究结果不一致的原因可能是个体差异及AD发病程度的不同导致的,而不同的测试区域,所得实验结果可能也会存在差异。而DNA甲基化水平存在显著的个体差异,AD患者大脑PS1、载脂蛋白E、亚甲基四氢叶酸还原酶启动子区甲基化程度发生显著变化[29]。叶酸缺乏诱导的DNA低甲基化提高BACE和PS1的基因表达水平,导致海马神经元Aβ的生成显著增多,而补充SAM可以降低BACE和PS1基因表达水平,减少Aβ的生成[30]。动物实验[31]证实,叶酸缺乏提高APP转基因小鼠PS1和BACE蛋白表达水平,导致Aβ生成增加,加速了Aβ细胞外聚集速度。参与成人海马突触可塑性的reelin和脑源性生长因子启动子区DNA甲基化状态在DNMT的活性被抑制后,呈现快速老化的状态,抑制DNMT活性阻断了突触诱发的长时程增强[32]。敲除DNMT1和DNMT3a基因导致小鼠海马长时程可塑性出现异常,导致小鼠出现学习和空间记忆障碍,推测DNMT1和DNMT3a是突触可塑性和学习记忆形成过程中所必须的[33]。
3.2运动对AD空间学习记忆的影响
体育锻炼对成年和衰老大脑的神经发生具有重要的调节作用,体育活动和持续的身体锻炼可以代偿性的延缓增龄性神经疾病的发生[34]。本实验结果显示,10周的跑台运动显著降低Tg APP/PS1小鼠海马APP、PS1和Aβ42蛋白表达水平,水迷宫实验结果显示,TE组小鼠在第3、第4和第5天的潜伏期显著低于同天TC组,穿越平台次数显著多于TC组,提示运动通过降低Aβ42蛋白表达水平,提高Tg APP/PS1小鼠学习记忆能力。ADLARD等人[35]的研究发现,5个月的自主跑轮运动使Tg CRND8小鼠大脑额叶皮层、皮层及海马区Aβ的含量分别下降了38%、53%和40%,酶联免疫实验结果显示,5个月的自主跑轮运动使TgCRND8小鼠大脑皮层Aβ1-40和Aβ1-42含量分别降低了35%和22%,水迷宫实验结果显示,运动组在第1天、第2天和第3天的逃避潜伏期显著低于安静组,提示自主跑轮运动通过降低Tg CRND8小鼠大脑额叶皮层、皮层及海马区Aβ的含量,提高Tg CRND8小鼠学习记忆能力。CHO等人[36]的研究也证实,与安静组相比,16周的跑台运动显著降低13月龄NSE/ APPsw小鼠大脑Aβ42的含量,降低NSE/APPsw小鼠潜伏期,提示16周的跑台运动通过降低大脑Aβ42的含量,提高AD小鼠的学习记忆能力。LIU等人[37]的研究发现,5个月的跑台运动显著降低Tg APP/PS1小鼠海马Aβ的沉积速度,提高Tg APP/PS1小鼠学习记忆能力。但也有学者认为运动对AD脑内Aβ含量作用不明显,KEHC等人[38]的研究发现,持续3周的中小强度的跑台运动对7~8月龄和24月龄Tg APP/PS1小鼠海马Aβ斑块没有产生显著的影响。导致上述研究结果不一致的原因可能是实验动物的模型、运动持续的时间以及运动强度不同等因素造成的。
3.3运动与DNA甲基化
表观遗传和基因是控制成年细胞增值和神经发生的2个主要因素,有研究证实[39-41],体育锻炼能够促进海马神经发生,增加海马树突BDNF的表达水平。积极的身体运动通过改变生长因子和神经营养因子(如VEGF、IGF-1、BDNF)的转录模式,发挥神经生理学功能,提高大脑血管功能和神经可塑性[42]。GOMEZ等人[43]的研究证实,7天的自主跑轮运动使3月龄SD大鼠海马BDNF启动子区DNA去甲基化作用增强,提高小鼠海马BDNF mRNA的表达水平,提示运动可以通过调节小鼠海马DNA甲基化水平,促进海马神经发生。目前关于运动调节AD海马DNA甲基化的研究成果较少,本实验结果显示,10周的跑台运动显著提高Tg APP/PS1小鼠海马DNMT1、DNMT3a和DNMT3b mRNA表达水平,提高Tg APP/PS1小鼠海马DNA甲基化水平,降低Tg APP/PS1小鼠海马APP、PS1和Aβ42蛋白表达水平,提高Tg APP/PS1小鼠学习记忆能力。DNMT1、DNMT3a和DNMT3b在DNA甲基化过程中的作用不同,在DNA甲基化过程中,DNMT3a和DNMT3b首先建立DNA甲基化模式,随后,DNMT1保持DNA甲基化模式,在衰老及增龄性疾病过程中,表现出明显的全基因组低甲基化和部分基因启动子区的高甲基化特征[44]。ABEL等人[8]的研究发现,1周的自主跑轮运动显著改变8周龄C57小鼠海马DNA甲基化水平,跑轮运动显著降低C57小鼠海马和皮层DNMT1、DNMT3a和DNMT3b蛋白表达水平,运动诱导的海马DNA甲基转移酶表达减少的同时伴随着BDNF蛋白表达的显著增加。衰老的过程伴随着DNA甲基化的变化,而不同的运动形式对DNA甲基化修饰可能产生不一致的结果,运动诱导的DNA甲基化的改变受运动形式和动物年龄等因素的影响,VIVIANE等人[45]研究了单次跑台运动对3月龄和20月龄Wistar大鼠海马DNMT1和DNMT3b表达的影响,结果发现,20月龄大鼠海马DNMT1表达显著低于3月龄组,而单次跑台运动后1 h,3月龄大鼠DNMT1和DNMT3b的表达显著低于安静对照组,运动后18 h,3月龄大鼠DNMT1和DNMT3b水平均有下降,但差异不显著,而20月龄大鼠海马DNMT1和 DNMT3b水平在运动后1 h和18 h有所增加,但差异不显著,提示,运动对不同月龄小鼠海马DNA甲基化的影响是不一样的。行为学实验和生物化学实验证实,针对同一运动刺激,不同年龄的小鼠其产生的生理反应也是不同的[46]。本实验结果与上述结果不一致,可能的原因是选择的实验动物模型不同导致的,前者的实验动物为8周龄C57小鼠,而本实验为Tg APP/PS1转基因小鼠,该小鼠在6-7月龄即表现出明显的空间记忆障碍和脑内Aβ含量显著增加,出现较为明显的AD病理特征和行为学特征。
4 结论
10周的跑台运动提高TgAPP/PS1小鼠空间学习记忆能力,推测可能是运动增加了Tg APP/PS1小鼠海马DNMT1、DNMT3a和DNMT3b表达水平,提高了AD小鼠海马DNA甲基化水平,抑制了APP和PS1蛋白表达水平,减少了Aβ42生成,从而提高了AD小鼠空间记忆能力。
[1]GOLDBERG A D,ALLIS C D,BERNSTEIN E.Epigenetics:a land⁃scape takes shape[J].Cell,2007,128(4):635-638.
[2]AKBARIAN S,BEERI M S,HAROUTUNIAN V.Epigenetic determi⁃nants of healthy and diseased brain aging and cognition[J].JAMA Neu⁃rol,2013,70(6):711-718.
[3]STEEN E,TERRY B M,RIVERA E J,et al.Impaired insulin and in⁃sulin-like growth factor expression and signaling mechanisms in Al⁃zheimer's disease--is this type 3 diabetes?[J].J Alzheimers Dis,2005,7(1):63-80.
[4]CHEN Y,DENG Y,ZHANG B,et al.Deregulation of brain insulin sig⁃naling in Alzheimer's disease[J].Neurosci Bull,2014,30(2):282-294.
[5]CHOW V W,MATTSON M P,WONG P C,et al.An overview of APP processing enzymes and products[J].Neuromolecular Med,2010,12(1):1-12.
[6]LISTA S,GARACI F G,TOSCHI N,et al.Imaging epigenetics in Al⁃zheimer's disease[J].Curr Pharm Des,2013,19(36):6393-6415.
[7]CREWS D.Epigenetics,brain,behavior,and the environment[J].Hor⁃mones(Athens),2010,9(1):41-50.
[8]ABEL J L,RISSMAN E F.Running-induced epigenetic and gene ex⁃pression changes in the adolescent brain[J].Int J Dev Neurosci,2013,31(6):382-390.
[9]BERCHTOLD N C,CASTELLO N,COTMAN C W.Exercise and timedependent benefits to learning and memory[J].Neuroscience,2010,167(3):588-597.
[10]GARCIA-CAPDEVILA S,PORTELL-CORTES I,TORRAS-GAR⁃CIA M,et al.Effects of long-term voluntary exercise on learning and memory processes:dependency of the task and level of exercise[J].Be⁃hav Brain Res,2009,202(2):162-170.
[11]HOVEIDA R,ALAEI H,ORYAN S,et al.Treadmill running im⁃proves spatial memory in an animal model of Alzheimer's disease[J].Behav Brain Res,2011,216(1):270-274.
[12]BAKER E J,GLEESON T T.The effects of intensity on the energetics of brief locomotor activity[J].J Exp Biol,1999,202(Pt 22):3081-3087.
[13]张宪亮,徐波,范庆磊.自主跑轮运动对小鼠空间记忆能力及海马NCAM、SCF基因表达的影响[J].西安体育学院学报,2015(1):82-88.
[14]LAHIRI D K,MALONEY B.The"LEARn"(Latent Early-life Associ⁃ated Regulation)model integrates environmental risk factors and the developmental basis of Alzheimer's disease,and proposes remedial steps[J].Exp Gerontol,2010,45(4):291-296.
[15]PELEG S,SANANBENESi F,ZOVOILIS A,et al.Altered histone acetylation is associated with age-dependent memory impairment in mice[J].Science,2010,328(5979):753-756.
[16]MASTROENI D,GROVER A,DELVAUX E,et al.Epigenetic chang⁃es in Alzheimer's disease:decrements in DNA methylation[J].Neurobi⁃ol Aging,2010,31(12):2025-2037.
[17]FENG J,ZHOU Y,CAMPBELL S L,et al.Dnmt1 and Dnmt3a main⁃tain DNA methylation and regulate synaptic function in adult forebrain neurons[J].Nat Neurosci,2010,13(4):423-430.
[18]KE H C,HUANG H J,LIANG K C,et al.Selective improvement of cognitive function in adult and aged APP/PS1 transgenic mice by con⁃tinuous non-shock treadmill exercise[J].Brain Res,2011,1403:1-11.
[19]LISTER R,PELIZZOLA M,DOWEN R H,et al.Human DNA methy⁃lomes at base resolution show widespread epigenomic differences[J]. Nature,2009,462(7271):315-322.
[20]GOTO K,NUMATA M,KOMURA J I,et al.Expression of DNA methyltransferase gene in mature and immature neurons as well as pro⁃liferating cells in mice[J].Differentiation,1994,56(1-2):39-44.
[21]ROSS M G,DESAI M,KHORRAM O,et al.Gestational program⁃ming of offspring obesity:a potential contributor to Alzheimer's dis⁃ease[C].2007:213-217.
[22]SIEGMUND K D,CONNOR C M,CAMPAN M,et al.DNA methyla⁃tion in the human cerebral cortex is dynamically regulated throughout the life span and involves differentiated neurons[J].PLoS One,2007,2(9):e895.
[23]LI W,JIANG M,ZHAO S,et al.Folic Acid Inhibits Amyloid beta-Peptide Production through Modulating DNA Methyltransferase Activi⁃ty in N2a-APP Cells[J].Int J Mol Sci,2015,16(10):25002-25013.
[24]SCARPA S,FUSO A,D'ANSELMI F,et al.Presenilin 1 gene silenc⁃ing by S-adenosylmethionine:a treatment for Alzheimer disease?[J]. FEBS Lett,2003,541(1-3):145-148.
[25]TOHGI H,UTSUGISAWA K,NAGANE Y,et al.Reduction with age in methylcytosine in the promoter region-224 approximately-101 of the amyloid precursor protein gene in autopsy human cortex[J].Brain Res Mol Brain Res,1999,70(2):288-292.
[26]SCARPA S,CAVALLARO R A,D'ANSELMI F,et al.Gene silenc⁃ing through methylation:an epigenetic intervention on Alzheimer dis⁃ease[J].J Alzheimers Dis,2006,9(4):407-414.
[27]BROHEDE J,RINDE M,WINBLAD B,et al.A DNA methylation study of the amyloid precursor protein gene in several brain regions from patients with familial Alzheimer disease[J].J Neurogenet,2010,24(4):179-181.
[28]COPPIETERS N,DIERIKS B V,LILL C,et al.Global changes in DNA methylation and hydroxymethylation in Alzheimer's disease hu⁃man brain[J].Neurobiol Aging,2013.
[29]WANG S C,OELZE B,SCHUMACHER A.Age-specific epigenetic drift in late-onset Alzheimer's disease[J].PLoS One,2008,3(7):e2698.
[30]FUSO A,SEMINARA L,CAVALLARO R A,et al.S-adenosylmethi⁃onine/homocysteine cycle alterations modify DNA methylation status with consequent deregulation of PS1 and BACE and beta-amyloid pro⁃duction[J].Mol Cell Neurosci,2005,28(1):195-204.
[31]FUSO A,NICOLIA V,CAVALLARO R A,et al.B-vitamin depriva⁃tion induces hyperhomocysteinemia and brain S-adenosylhomocyste⁃ine,depletes brain S-adenosylmethionine,and enhances PS1 and BACE expression and amyloid-beta deposition in mice[J].Mol Cell Neurosci,2008,37(4):731-746.
[32]LEVENSON J M,QIU S,WEEBER E J.The role of reelin in adult synaptic function and the genetic and epigenetic regulation of the ree⁃lin gene[J].Biochim Biophys Acta,2008,1779(8):422-431.
[33]FENG J,ZHOU Y,CAMPBELL S L,et al.Dnmt1 and Dnmt3a main⁃tain DNA methylation and regulate synaptic function in adult forebrain neurons[J].Nat Neurosci,2010,13(4):423-430.
[34]VAN PRAAG H.Neurogenesis and exercise:past and future directions [J].Neuromolecular Med,2008,10(2):128-140.
[35]ADLARD P A,PERREAU V M,POP V,et al.Voluntary exercise de⁃creases amyloid load in a transgenic model of Alzheimer's disease[J].J Neurosci,2005,25(17):4217-4221.
[36]CHO J Y,UM H S,KANG E B,et al.The combination of exercise training and alpha-lipoic acid treatment has therapeutic effects on the pathogenic phenotypes of Alzheimer's disease in NSE/APPsw-trans⁃genic mice[J].Int J Mol Med,2010,25(3):337-346.
[37]LIU H L,ZHAO G,ZHANG H,et al.Long-term treadmill exercise inhibits the progression of Alzheimer's disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice[J].Behav Brain Res,2013,256:261-272.
[38]KE H C,HUANG H J,LIANG K C,et al.Selective improvement of cognitive function in adult and aged APP/PS1 transgenic mice by con⁃tinuous non-shock treadmill exercise[J].Brain Res,2011,1403:1-11.
[39]KEMPERMANN G.Why new neurons Possible functions for adult hip⁃pocampal neurogenesis[J].J Neurosci,2002,22(3):635-638.
[40]PIETROPAOLO S,FELDON J,ALLEVA E,et al.The role of volun⁃tary exercise in enriched rearing:a behavioral analysis[J].Behav Neu⁃rosci,2006,120(4):787-803.
[41]VAN PRAAG H,SHUBERT T,ZHAO C,et al.Exercise enhances learning and hippocampal neurogenesis in aged mice[J].J Neurosci,2005,25(38):8680-8685.
[42]TREJO J L,LLORENS-MARTIN M V,TORRES-ALEMAN I.The ef⁃fects of exercise on spatial learning and anxiety-like behavior are medi⁃ated by an IGF-I-dependent mechanism related to hippocampal neuro⁃genesis[J].Mol Cell Neurosci,2008,37(2):402-411.
[43]GOMEZ-PINILLA F,ZHUANG Y,FENG J,et al.Exercise impacts brain-derived neurotrophic factor plasticity by engaging mechanisms of epigenetic regulation[J].Eur J Neurosci,2011,33(3):383-390.
[44]JOHNSON A A,AKMAN K,CALIMPORT S R,et al.The role of DNA methylation in aging,rejuvenation,and age-related disease[J]. Rejuvenation Res,2012,15(5):483-494.
[45]ELSNER V R,LOVATEL G A,Moyses F,et al.Exercise induces age-dependent changes on epigenetic parameters in rat hippocampus:a preliminary study[J].Exp Gerontol,2013,48(2):136-139.
[46]BUCHANAN J B,SPARKMAN N L,Chen J,et al.Cognitive and neu⁃roinflammatory consequences of mild repeated stress are exacerbated in aged mice[J].Psychoneuroendocrinology,2008,33(6):755-765.
Exercise Improve Spatial Learning Memory Abilities in Alzheimer's Disease Mice by Increasing Methylation Level of DNA
HE Biao1,2,XU Bo1,2,ZHANG Xianliang3
(1.Key Laboratory of Adolescent Health Assessment and Exercise Intervention of Ministry of Education,East China Normal University,Shanghai 200241,China;2.School of PE and Health Care,East China Normal University,Shanghai 200241,China.3.School of PE,Shandong University,Jinan 251016,China)
This experiment is to investigate the effect and mechanism of DNA methylation on exercise which can alleviate Alzheimer's disease.Methods:3 months old APP/PS1 transgenic mice were divided into transgenic exercise group(TE,n=12)and transgenic control group(TC,n=12)randomly.Wild type mice were chose as normal control group(C,n=12)and exercise group(E,n=12).Group E and group TE was given 10 weeks treadmill,group C and group TC were sec.Morris water maze test mice space memory ability after 10 weeks exercise,all mice were killed to obtain hippocampus,gene expression of DNMT1,DNMT3a and DNMT3b was detected by real time RT-PCR,protein expression levels of APP,PS1 and Aβ42 in mice hippocampus was detected by Western Blot.Results:Compared with group C,mRNA expression level of DNMT1 was significantly lower in TC group(P<0.01),mRNA expression level of DNMT3a was significantly lower in TC group(P<0.05),mRNA expression level of DNMT3b was significantly lower in TC group(P<0.05),protein expression level of APP was significantly higher(P<0.01),protein expression level of PS1 was significantly higher(P<0.01),protein expression level of Aβ42was significantly higher(P<0.01),spatial memory ability was significantly lower than normal control group(P<0.05).compared with group TC,mRNA expression level of DN⁃MT1 was significantly higher(P<0.05),mRNA expression level of DNMT3a was significantly higher(P<0.05),mRNA expression level of DNMT3b was signif⁃icantly higher(P<0.05),protein expression level of APP was significantly lower in TE group(P<0.05),protein expression level of PS1 was significantly lower in TE group(P<0.05),protein expression level of Aβ42 was significantly lower in TE group(P<0.05),spatial memory ability is significantly higher in TE group compare to TC group(P<0.05).Conclusions:10 weeks treadmill increased DNMT expression level and DNA methylation level in AD mice hippocampus. It also inhibited APP and PS1 protein expression level,reducing Aβ42 generation and finally improve AD mice spatial learning and memory ability.
treadmill;Alzheimer's disease;Epigenetic;DNA methylation;learning and memory
10.13297/j.cnki.issn1005-0000.2016.04.011
G 804.7
A
1005-0000(2016)04-333-07
2015-11-24;
2016-05-04;录用日期:2016-05-06
国家自然科学基金项目(项目编号:31571225)
何标(1982-),男,安徽淮北人,讲师,在读博士研究生,研究方向为体育学习与身心健康;通信作者:徐波(1963-),男,山东烟台人,教授,博士生导师,研究方向为体育运动与身心健康。
1.“青少年健康评价与运动干预”教育部重点实验室华东师范大学,上海200241;2.华东师范大学体育与健康学院,上海200241;3.山东大学体育学院,山东济南251016。
表观遗传学是指在DNA序列没有发生改变的情况下,由于受其他因素(环境、辐射、药物)影响而导致的基因表型或基因表达发生变化,并能够在亲代与子代间发生遗传传递现象的一门科学[1]。机体的衰老伴随表观遗传修饰的改变,表观遗传的改变将导致许多增龄性疾病的发生[2]。阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性、进行性中枢神经系统疾病,伴有持续的记忆力减退和认知功能障碍[3]。AD主要以细胞外老年斑(senile plaques,SPs)、细胞内神经纤维缠结(neurofibrillary tangles,NFTs)和以胆碱能神经元的变性和突触丢失为主要病理特征[4]。大量研究认为,淀粉样前体蛋白(APP)在β-分泌酶和γ-分泌酶的作用下产生的Aβ在细胞外异常聚集是AD的主要病因[5]。AD是一种复杂的神经退行性疾病,表观遗传机制可能在AD发生和发展过程中起着至关重要的作用[6]。DNA甲基化是表观遗传研究的一个重要方面,DNA甲基化是指磷酸胞苷酰双核苷中的胞嘧啶在甲基化转移酶(DNA methyltransferase,DNMTs)和甲基供体S-腺苷甲硫氨酸(SAM)的作用下,把一个甲基添加在DNA分子片段上形成5甲基胞嘧啶(5mC)。甲基化主要发生在真核生物转录起始区域一段富含GC序列的CpG岛上,其作用是导致基因失活,一般情况下,DNA甲基化程度越高,相应的DNA被转录翻译为功能蛋白质的可能性越小[7]。有研究[8]证实,运动通过调节小鼠海马DNA甲基转移酶的表达水平改变小鼠海马DNA甲基化水平。大量研究[9-11]证实,体育锻炼对学习记忆产生积极的促进作用,并对神经退行性疾病具有一定的预防和缓解作用。目前,DNA甲基化在运动预防AD发病中的作用机制尚不清楚,为此,本研究探讨运动诱导的小鼠海马DNA甲基化的改变在预防AD发病中的作用及机制。

