急性递增负荷运动对小鼠骨骼肌SOD同工酶活性和mRNA表达的影响
王 平,LI Chunguang,漆正堂,丁树哲
急性递增负荷运动对小鼠骨骼肌SOD同工酶活性和mRNA表达的影响
王 平1,LI Chunguang2,漆正堂3,4,丁树哲4
目的:通过建立急性递增负荷小鼠运动模型,探讨小鼠急性跑台运动后骨骼肌抗氧化防御系统的反应。方法:30只6周龄清洁级雄性ICR小鼠,体重20.81±2.31g,随机分为安静对照组(C组,6只)、急性递增负荷运动45min组(E1组,6只)、90min组(E2,6只)、120min组(E3组,6只)和150min组(E4组,6只)组。正式运动按以下程序:第1 级负荷:0°,8.2m/min(相当于53%VO2max),15min;第2 级负荷:5°,15m/min(相当于64%VO2max),15min;第3 级负荷:10°,19.3m/min(相当于76%VO2max)。各组分别运动至所设相应时间及安静对照组,取出左、右侧腓肠肌,采用硝酸还原酶法测定线粒体NO含量,采用化学比色法测定eNOS活性,采用黄嘌呤氧化酶法测定线粒体MnSOD、CuZnSOD的活性;实时荧光定量PCR(Real-time PCR)检测骨骼肌MnSOD、CuZnSOD基因表达水平。结果:(1)与安静对照组相比,小鼠骨骼肌线粒体NO含量在急性递增负荷运动45min、90min、120min和150min均出现显著增加(P<0.05),且90min达到峰值(P<0.01);小鼠骨骼肌线粒体eNOS活性在急性递增负荷运动45min、90min和120min均出现显著增加(P<0.05),且90min达到峰值(P<0.01),但150min未出现显著性变化(P>0.05);(2)线粒体MnSOD活性在急性运动45min后明显增加(P<0.05),急性运动90、120min和150min均出现极显著增加(P<0.01),且在120min达到峰值;(3)与安静对照组相比,MnSODmRNA在急性运动45min出现显著性增加(P<0.05),急性运动90min、120min和150min均出现极显著性增加(P<0.01),且在150min达到峰值(P<0.01)。结论:线粒体MnSOD对急性递增负荷运动具有较好的应答反应,是运动刺激-反应-适应的主要SOD机制。
急性递增运动;骨骼肌;NO;eNOS;MnSOD;CuZnSOD
关于肌肉自由基理论的研究始于20世纪50年代[1],Koren等人证实肌肉在反复收缩时自由基含量会显著增加[2]。Davies等人证实大鼠进行一次性力竭性运动后,骨骼肌自由基明显增加[3]。在过去30多年来,国内外许多学者认为自由基对机体是有害的,但现在越来越多的研究证实在运动适应过程中肌肉收缩产生的活性氧具有生理性的作用,机体细胞在面对自由基攻击时,会做出相应的反应,激发产生抗氧化防御系统诸如超氧化物歧化酶、过氧化物酶等[4]。因此,对于活性氧的正常产生机体细胞能够做出很好的应对反应。
目前越来越多的研究表明,低浓度的活性氧可诱导机体抗氧化酶和其他防御系统的表达,这种现象可以用毒物兴奋效应概念解释,从这一点看,自由基是有益的。最近此理论被延伸到运动源性活性氧效应中[5-6]。在运动过程中,毒素是活性氧的形成,活性氧触发细胞具体的适应反应,如抗氧化防御系统酶活性的增加,抵抗氧化应激,氧化损伤减小[7]。耐力训练可使大鼠线粒体MnSOD和谷胱甘肽过氧化酶显著增加[8]。但目前关于急性运动后机体的一氧化氮(NO)含量、内皮型一氧化氮合酶(eNOS))活性、抗氧化酶活性和其基因的表达情况如何,研究的还不充分,本研究建立急性递增负荷跑台运动小鼠模型,检测骨骼肌线粒体一氧化氮(NO)含量、内皮型一氧化氮合酶(eNOS)活性、CuZnSOD和MnSOD活性和基因表达的时相性变化情况,探讨急性跑台运动诱导小鼠骨骼肌抗氧化防御系统的分子机制,也为科学合理进行运动训练提供一些理论依据。
1 材料与方法
1.1 实验动物与分组
清洁级6周龄雄性ICR小鼠30只,由上海斯莱克实验动物有限责任公司提供,许可证号为SCXK(沪)2007-0005,体重20.81±2.31g,所有小鼠进行每笼5只的干笼饲养,自由进食、饮水,以国家标准啮齿类动物常规饲料喂养,饲料和垫料均由上海生工生物技术有限公司提供,动物房温度维持在18℃-24℃,相对湿度为45%-55%,自然光照。实验动物随机分为安静对照组(C),急性递增负荷运动45min组(E1),急性递增负荷运动90min组(E2),急性递增负荷运动120min组(E3)和急性递增负荷运动150min组(E4),共5组,每组6只。
1.2 运动方案
实验前所有动物均未进行过跑台运动,小鼠进行正式实验之前进行3天适应性跑台训练,坡度为0°,速度5m/min,持续时间5min。正式实验参照Bedford据鼠体重/摄氧量回归方程所建立的递增运动负荷训练方案[9],按以下程序运动:第1 级负荷:0°,8.2m/min(相当于53%VO2max),15min;第2 级负荷:5°,15m/min(相当于64%VO2max),15min;第3 级负荷:10°,19.3m/min(相当于76%VO2max),各组分别运动至所设相应时间。
1.3 取材
各组小鼠运动至对应时间,即刻断头迅速取出左、右侧腓肠肌,称湿重。左侧腓肠肌加入预冷的匀浆介质抽提线粒体,右侧腓肠肌至于液氮中,然后转入-80°冰箱保存,待测,安静对照组与运动组同时取材。
1.4 线粒体NO含量和eNOS活性的测定
NO和eNOS试剂盒均购自南京建成生物试剂公司,NO测试方法采用硝酸还原酶法,eNOS测试方法采用化学比色法,均采用TECAN infinite M200型号酶标仪置于测试版中进行测定。
1.5 线粒体CuZnSOD、MnSOD活性的测定
线粒体提取的方法采用差速离心法,其具体制备过程参照[10]。CuZnSOD、MnSOD活性测定采用黄嘌呤氧化酶法,蛋白定量采用BCA法,采用TECAN infinite M200型号酶标仪测定,单位U/mgprot。
1.6 Real time PCR检测CuZnSOD、MnSOD基因表达水平
冰上取腓肠肌约40mg,采用Invitrogen Trizol法提取总RNA,参照试剂盒说明书进行,紫外分光光度法计算OD260/OD280比值,选取符合Real-time PCR要求的RNA进行反转录(RT);RT使用ReverTra Ace qPCR RT Kit,条件为15℃,5min;37℃,15min;98℃,5min,合成第一链cDNA;cDNA的PCR使用2×SYBR green PCR Master Mix反应体系,反应条件为预变性(95℃,1min);35个PCR循环(95℃,15s;61℃,30s;72℃,45s,收集荧光)。扩增反应结束后,建立PCR产物的熔解曲线。当熔解曲线只显示一个主波峰时,说明PCR扩增特异性较高,反应结束后,PCR仪给出各反应孔的Ct值,以β-actin基因为内参,根据公式2-ΔCt计算各样品目的基因的相对表达量。
各基因引物序列如下:
CuZnSOD: Forward5’-agatgacttgggcaaaggtg-3’,Reverse 5’-tctccatcagctgtcattgc-3’;
MnSOD: Forward5’-gccccctgagttgttgaata-3’,Reverse5’-gccccctgagttgttgaata-3’;
β-actin: Forward 5’-tgttaccaactgggacgaca-3’, Reverse 5’-ctatgggagaacggcagaag-3’。
上述引物序列查自NCBI数据库,由上海生工生物技术有限公司合成。
1.7 数据统计处理
2 实验结果
2.1 急性递增负荷跑台运动对小鼠骨骼肌线粒体NO含量的影响
从表1显示,与对照组相比,小鼠骨骼肌线粒体NO含量在急性递增负荷运动45min、90min、120min和150min均出现显著增加(P<0.05),且90min达到峰值(P<0.01)。
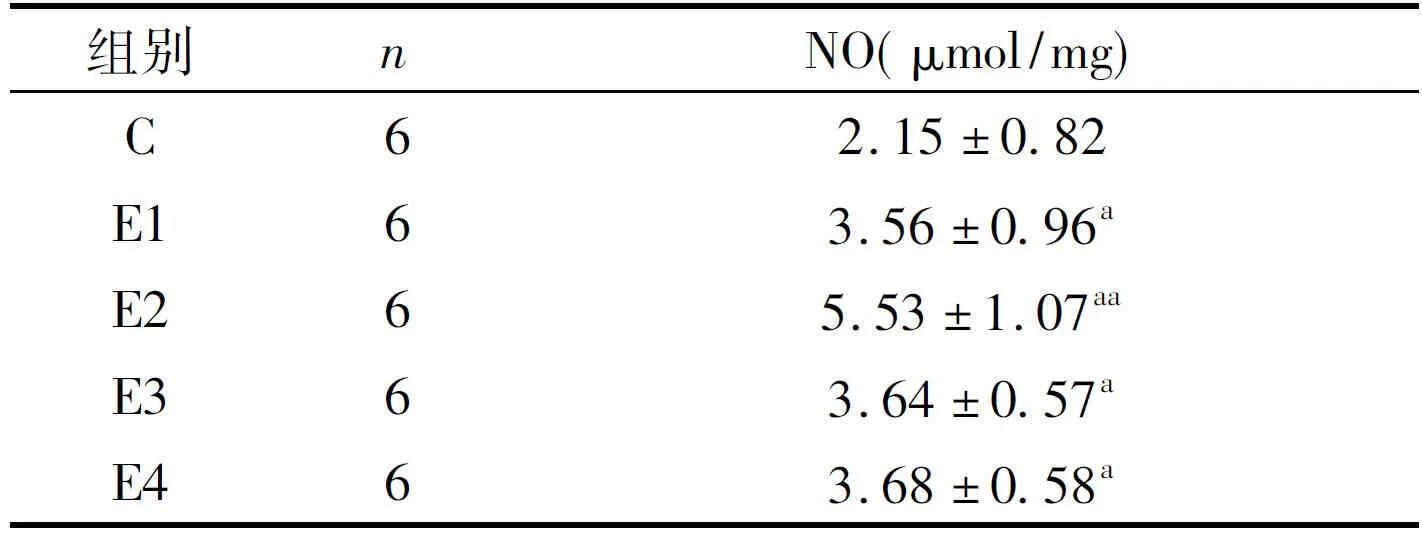
表1 急性递增负荷跑台运动对小鼠骨骼肌线粒体NO的影响Table1 Effect of Acute Incremental Treadmill Exercise on Mitochondrial NO Content in Skeletal Muscle of Mice
2.2 急性递增负荷跑台运动对小鼠骨骼肌线粒体eNOS活性的影响
从表2显示,与对照组相比,小鼠骨骼肌线粒体eNOS活性在急性递增负荷运动45min、90min和120min均出现显著增加(P<0.05),且90min达到峰值(P<0.01),但150min未出现显著性变化(P>0.05)。

表2 急性递增负荷跑台运动对小鼠骨骼肌线粒体eNOS活性的影响Table2 Effect of Acute Incremental Treadmill Exercise on Mitochondrial eNOS Content in Skeletal Muscle of Mice
2.3 急性递增负荷跑台运动对小鼠骨骼肌线粒体CuZnSOD和MnSOD的影响
从表3显示,与对照组相比,小鼠骨骼肌线粒体MnSOD的活性在急性递增负荷运动45min开始显著增加(P<0.05),运动至90min、120min和150min出现极显著增加(P<0.01),且120min达到峰值;但CuZnSOD活性在急性递增负荷运动45min、90min、120min和150min(P>0.05)。

表3 急性递增负荷跑台运动对小鼠骨骼肌线粒体CuZnSOD和MnSOD的影响Table3 Effect of Acute Incremental Treadmill Exercise on Mitochondrial CuZnSOD and MnSOD in Skeletal Muscle of Mice
2.4 急性递增负荷跑台运动对小鼠骨骼肌CuZnSODmRNA和MnSODmRNA表达的影响
从表4显示,与对照组相比,小鼠急性运动45min时,MnSODmRNA表达显著增加(P<0.05),当运动到90min、120min、150min时,出现极显著增加(P<0.01),且150min达峰值;但CuZnSOD mRNA表达在运动45min、90min、120min和150min均未出现显著性差异(P>0.05)。
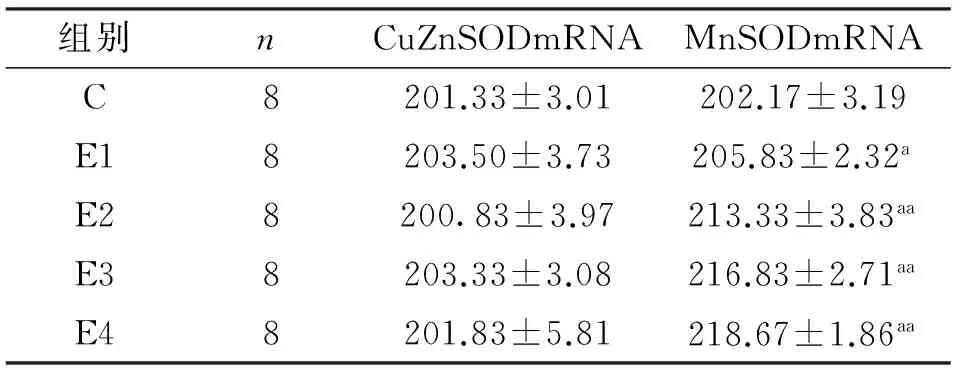
表4 急性递增负荷运动对小鼠骨骼肌CuZnSODmRNA和MnSODmRNA表达的影响Table4 Effect of Acute Incremental Treadmill Exercise on Mitochondrial CuZnSODmRNA and MnSODmRNA in Skeletal Muscle of Mice
3 分析与讨论
我们的研究发现,急性运动明显增加骨骼肌线粒体NO含量,NO含量的变化基本呈时间依赖性(45-150min),在运动90分钟时达到峰值,提示急性运动引起骨骼肌线粒体NO的形成可能与运动过程关系密切。耐力运动导致老年大鼠骨骼肌NO含量增加[11],90分钟和150分钟游泳增加血清NO含量[12],提示运动源性NO含量的增加有助于心脏输出量和骨骼肌血流量的增加[13]。
NOS有三种同分异构体,分别是神经元型NOS(nNOS)、内皮型NOS(eNOS)和诱生型NOS(iNOS)[14]。nNOS和eNOS在骨骼肌中含量丰富,nNOS主要存在于肌纤维膜中,eNOS主要存在于线粒体中[15]。iNOS主要在骨骼肌炎症阶段表达[16]。我们的研究结果发现,骨骼肌线粒体eNOS活性呈时间依赖性增加(运动45min到120min),运动90分钟达到峰值,与NO含量变化趋势基本一致,提示适宜运动可以提高骨骼肌线粒体eNOS活性,推测,NO含量的变化极有可能与eNOS活性增加有关。我们的研究结果与以前的研究结果报道一致,他们研究发现,耐力运动明显提高骨骼肌eNOS的表达和活性[17]。也有人报道运动通过增加骨骼肌血流量、剪切力甚至某种特定的细胞信号转导途径诸如磷脂酶C、钙离子等使血管内皮细胞eNOS表达和活性明显增加[18]。
N0可调控运动性线粒体生物发生、抗氧化还原等生物学作用[19]。已有研究证实,NO的产生可调控骨骼肌靶基因转录水平和翻译水平的表达,也可改变细胞内氧化还原信号状态[20]。NO信号途径的变化与运动性骨骼肌内皮功能的适应密切相关[21]。耐力运动通过NO信号途径增加老年大鼠骨骼肌GPx-1和SOD的含量,减少血管紧张素II的释放[22]。NO也可调控骨骼肌PI3K/Akt和MnSOD信号途径[21]。因此,NO也有可能作为信号分子调节骨骼肌运动性氧化应激[23]。
细胞抗氧化防御系统对于需氧生物的生存至关重要。针对哺乳动物,SOD在清除体内自由基,维护骨骼肌功能方面起着决定性作用[24]。SOD按其所含金属辅基不同,其同工酶主要分为两种,一种是CuZnSOD(含Cu、Zn金属辅基),特性非常稳定,以前认为主要存在于细胞浆,目前有研究证实线粒体中也有CuZnSOD[25];另一种是MnSOD(含锰Mn金属辅基),主要存在于线粒体基质中[24]。重组人SOD研究发现,CuZnSOD半衰期较短,只有6-10分钟,而MnSOD半衰期较长,约5-6小时[26]。两种类型的SOD活性和基因相对表达量与骨骼肌的抗氧化能力密切相关[27]。
目前比较一致的观点是耐力运动明显增加骨骼肌MnSOD活性[28-29]。但关于急性运动对CuZnSOD和MnSOD活性和基因相对表达的报道还不是很一致,本研究结果显示,MnSOD活性在急性运动45分钟开始明显增加,随后90min、120min、150min均出现极显著增加,在120min达到峰值,但CuZnSOD活性在急性运动45min、90min、120min和150min均未发生明显变化。与Higuchiet al 等人[30]的研究结果一致,他们的研究发现,运动训练使MnSOD活性增加,CuZnSOD活性没有发生显著变化。
但也有不一致的报道,HollanderJ等人报道,一次性力竭运动(25 m/min,5% grade,力竭时间大约1hr)并没有使大鼠股外侧深肌和股外侧浅肌的CuZnSOD和MnSOD活性发生显著变化[31]。Ishi OS等人也报道急性运动(15-20 m/min, 10 min/day for 3 days)对大鼠比目鱼肌CuZnSOD和MnSOD活性均未发生显著变化,而9周耐力运动显著增加大鼠比目鱼肌MnSOD和CuZnSOD的活性。分析其原因可能与鼠龄、鼠的饮食、运动方式、运动强度、运动持续时间、肌纤维类型、试剂盒使用的方法不同等因素[29],当然最重要的可能与此酶的基因调控复杂性有关,并且骨骼肌属于高度异质性组织,每种肌纤维类型各自的新陈代谢特性、氧化能力和抗氧化防御能等因素力有关,但是具体作用机制仍然需要进一步深入研究。
为了进一步了解急性运动对抗氧化防御系统影响涉及到的分子机制,我们还检测了MnSODmRNA和CuZnSODmRNA表达,结果发现,MnSODmRNA和CuZnSODmRNA表达变化趋势与活性变化基本一致,MnSODmRNA在急性运动45分钟开始明显增加,随后90min、120min、150min均出现极显著增加,且在150min达到峰值,但CuZnSODmRNA在急性运动45min、90min、120min和150min均未发生明显变化。与Hollander J等人的报道一致,他们发现急性运动使大鼠股外侧深肌MnSOD mRNA表达显著增加,这种状态一直持续到运动后2小时,而CuZnSODmRNA表达未见明显变化[31]。分析其原因可能是由于MnSOD主要位于线粒体,MnSOD基因的启动子上具有活性氧(包括过氧化氢)的结合位点,前期研究结果已经证实急性运动引起小鼠腓肠肌线粒体过氧化氢含量显著增加[32],过氧化氢的增加激活转录因子NF-kB和转录激活因子AP-1的结合,然后通过顺式作用元件(cis-acting element)影响基因表达活性的DNA序列,从而增加MnSOD基因转录水平[31]。的确,在哺乳动物MnSOD基因的启动子上具有NF-kB 和AP-1的结合位点,且氧化应激可上调MnSOD的基因表达[30,33],也可能与NO含量的增加有关,它作为信号分子激活MnSOD的表达和增加酶的活性。而CuZnSOD基因启动子上没有上述结合位点,它在运动过程中的基因表达水平不能通过NF-kB或AP-1途径活化。故不同的启动子序列也许是导致运动引起2种SOD同工酶不同反应的真正原因[30]。
但也有相反的报道,Ishi SO等人报道,一次性力竭运动并没有使大鼠比目鱼肌MnSOD mRNA和CuZnSODmRNA[34]。HollanderJ报道耐力运动(27 m/min ,12% grade for 2 h/day, 5 days/w for 10 w)未见大鼠比目鱼肌、股外侧深肌和股外侧浅肌MnSODmRNA和CuZnSODmRNA的表达发生显著变化,一次性运动也未见大鼠股外侧浅肌MnSODmRNA发生变化。因此,这也是急性运动对MnSOD和CuZnSOD基因表达进行深入研究的原因之一。
4 结论
急性运动没有引起小鼠骨骼肌线粒体CuZnSOD含量和CuZnSODmRNA表达的显著变化,提示CuZnSOD基因可能不含有能够使自由基激活的转录因子和转录激活因子相结合的位点,而急性运动引起的MnSOD含量和MnSOD mRNA表达的增加,可能是急性运动引起NO、过氧化氢增加激活MnSOD基因上的启动子促进基因转录,增加MnSOD的活性,从而增强骨骼肌抗氧化防御能力。
[1] Commoner B, Townsend J, Pake GE. Free radicals in biological materials [J]. Nature, 1954,174(4432) :689-691.
[2] Koren A, Sauber C, Sentjurc M, Et AL.Free radicals in tetanic activity of isolated skeletal muscle[J].Comp BiochemPhysiol B, 1983,74(3):633-635.
[3] Davies KJ, Quintanilha AT, Brooks GA, Et AL.Free radicals and tissue damage produced by exercise[J]. BiochemBiophys Res Commun, 1982,107(4):1198-1205.
[4] Zsolt R, Hae YC, Sataro G, Et AL.Systemic adaptation to oxidative challenge induced by regular exercise [J].Free Radical Biology & Medicine, 2008,44(1):153-159.
[5] Radak Z, Chung HY, Goto S. Exercise and hormesis: oxidative stress related adaptation for successful aging [J]. Biogerontology,2005,6(1):71-75.
[6] Ji LL, Gomez MC, Vina J. Exercise and hormesis: activation of cellular antioxidant signaling pathway [J]. Ann N Y Acad Sci,2006,1067(5):425-435.
[7] Radak Z, Chung HY, Goto S. Systemic adaptation to oxidative challenge induced by regular exercise [J].Free Radical Biology & Medicine, 2008, 44(2) :153-159.
[8] Salminen A, Vihko V. Lipid peroxidation in exercise myopathy [J]. ExpMolPathol, 1983,38(3):380-388.
[9] Bedford TG, Tipton CM, Wilson NC,Et AL.Maximum Oxygen Consumption of Rats and Its Changes with Various Experimental Procedures [J]. J Appl Physiol Respir Environ Exerc Physiol, 1979, 47(6): 1278-1283.
[10] Fernández VE, Ferrín G, Pérez MA, Et AL.Isolation of Mitochondri for Biogenetical Studies: an Update [J]. Mitochondrion, 2010,10(3):253-262.
[11] Pan SY, Wang R.Effect of Nitric Oxide (NO) Content and Nitric Oxide Synthase (NOS)Activity on Serum Rats of Chronic Hypoxia and Exercise[J]. Journal of Xi’an Institute of Physical Education,2005,22(1): 83-85.
[12] Djordjevic D, Jakovljevic V, Cubrilo D, Et AL.Coordination Between Nitric Oxide and Superoxide Anion Radical during Progressive Exercise in Elite Soccer Players[J].Open Biochem J, 2010, 4(1): 100-106.
[13] 任文君,张斌南,宇文展,等.不同运动方式对大鼠骨骼肌NO含量及NOS活性的影响[J].2009,29(1):66-71.
[14] 徐飞.运动时骨骼肌内一氧化氮信号传递途径及一氧化氮对骨骼肌摄取葡萄糖的调节作用[J].首都体育学院学报, 2008,20(3):48-51.
[15] Jackson MJ. Reactive oxygen species and redox-regulation of skeletal muscle adaptations to exercise[J].Philos Trans R Soc Lond B Biol Sci, 2005, 360(1464):2285-2291.
[16] Tell G,Damante G, Caldwell D, Et AL.The Intracellular localization of APE1/Ref-1: more than a Passive Phenomenon[J]. Antioxid Redox Signal, 2005 7 (3-4):367-384.
[17] Stamler JS, Meissner G. Physiology of Nitric Oxide in Skeletal Muscle[J].Physiol Rev, 2001,81(1):209-237.
[18] Zou GM, Luo M, Reed HA, Et AL.Ape1 Regulates Hematopoietic Differentiation of Embryonic Stem Cells through its Redox Functional Domain[J]. Blood, 2007, 109( 5):1917-1922.
[19] Park Y, Prisby RD, Behnke BJ, Et AL. Effects of aging, TNF-alpha, and Exercise Training on Angiotensin II-induced Vasoconstriction of Rat Skeletal Muscle Arterioles[J].J Appl Physiol 2012,113(7):1091-1100.
[20] Jackson MJ, Jones DA, Edwards RH. Vitamin E and skeletal muscle[J].Ciba Found Symp, 1983, 101(2)224-239.
[21] Spier SA, Delp MD, Meininger CJ, Et AL. Effects of ageing and exercise training on endothelium-dependent vasodilatation and structure of rat skeletal muscle arterioles[J].J Physiol, 2004, 556( Pt 3):947-95.
[22] Sakellariou GK,Jackson MJ, Vasilaki A.Redefining the major contributors to superoxide production in contracting skeletal muscle. The role of NAD(P)H oxidases[J].Free Radic Res, 2014, 48(1):12-29.
[23] Shen W,Zhang X,Zhao G,Et AL. Nitric oxide production and NO synthase gene expression contribute to vascular regulation during exercise.Med Sci Sports Exerc, 1995, 27(8):1125-1134.
[24] Ji LL.Modulation of skeletal muscle antioxidant defense by exercise: Role of redox signaling [J]. Free Radical Biology & Medicine,2008, 44(2):142-152.
[25] Fridovich I. Superoxide radical and superoxide dismutases[J].Annu Rev Biochem, 1995,64(1): 97-112.
[26] Gorecki M, Beck Y, Hartman JR.,EtAL.Recombinant human superoxide dismutases: production and potential therapeuticuses [J]. Free Radic Res Commun,1991,12-13(Pt 1):401-410.
[27] Ji LL. Antioxidantenzymeresponse to exercise and aging [J].Med Sci Sports Exerc,1993, 25(2):225-231.
[28] Ji LL, Stratman FW, Lardy HA.Antioxidant enzyme systems in rat liver and skeletal muscle: influences of selenium deficiency, acute exercise and chronic training[J]. Arch. Biochem.Biophys, 1988,263(1): 150-160.
[29] Powers SK, Criswell D, Lawler J, Et AL. Influence of exercise and fiber type on antioxidant enzyme activity in rat skeletal muscle [J].Am J Physiol,1994,266(2 Pt 2):R375-380.
[30] Higuchi M, Cartier LJ, Chen M, Holloszy JO.Superoxide dismutase and catalase in skeletal muscle: adaptive response to exercise [J]. J Gerontol,1985,40(3):281-286.
[31] Hollander J, Fiebig R, Gore M, Et AL. Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle [J]. Pflugers Arch,2001,442(3):426-434.
[32] Wang P, Li CG,Qi Z, Et AL.Acute exercise induced mitochondrial H2O2 production in mouse skeletal muscle: association with p(66Shc) and FOXO3a signaling and antioxidant enzymes [J].Oxid Med Cell Longev, 2015;2015:536456.
[33] Ho YS, Howard AJ, Crapo JD.Molecular structure of a functional rat gene for manganese-containing superoxide dismutase [J]. Am J Respir Cell MolBiol ,1991,4(3):278-286.
[34] Ohishi S, Kizaki T, Nagasawa, J, Et AL. Effects of endurance training on superoxide dismutase content and mRNA expression in rat muscle [J]. Clinical and Experimental Pharmacology and Physiology, 1997, 24(5):326-332.
(编辑 孙君志)
Effect of Acute Incremental Load Exercise on SOD activity and mRNA in Skeletal Muscle of Mice
WANG Ping1, LI Chunguang2, QI Zhengtang3,4, DING Shuzhe4
To investigate the changes of the content of NO and activity of eNOS,the mRNA expression and the activity changes of MnSOD and CuZnSOD on acute incremental exercisein skeletal muscle of mice and explore the effects of antioxidant defense system. Methods: thirty male ICR mice were randomly divided into control group (C), 45min exercise group (E1,n=6), 90min exercise group (E2,n=6), 120min exercise group (E3,n=6) and 150min exercise group (E4,n= 6). Mice in exercise groups were trained through treadmill exercise (0°grade, 5m/min, 5min/day) for 3 days. After adaptation, mice in exercise groups underwent treadmill exercise to the corresponding time set up. Exercise patterns are as follows: First, 8.2m/min, 0 grade, 15min; second, 15m/min, 5% grade, 15min; third, 19.3m/min,10% grade. At the end of exercise, all mice were killed and their gastrocnemius muscle were obtained. Left one was used as mitochondria extraction, right one was measured by Real-time PCR. Results: (1) Compared with control group,NO content significantly increased after 45min exercise (P<0.05), 90min((P<0.01)), 120min and 150min (P<0.05) and reached the peak at 90 min. eNOS activity significantly increased after 45min exercise (P<0.05), 90min(P<0.01), 120min (P<0.05) and reached the peak at 90min.But the eNOS activity didn’t increase in 150min group significantly (P<0.05);(2) MnSOD activity was significantly increased after 45min exercise (P<0.05), 90min, 120min and 150min (P<0.01) and reached the peak at 120min.But the CuZnSOD activity didn’t increase in all exercise groups significantly (P<0.05); (3) Compared with control group, MnSOD mRNA significantly increased after 45min exercise (P<0.05), 90min, 120min and 150min (P<0.01) and reached the peak at 150min.But the CuZnSOD mRNA didn’t increase in all exercise groups significantly (P<0.05).Conclusion: MnSOD is the key SOD enzyme in response to the acute incremental exercise, which forms a protective cycling mechanism in acuteskeletal muscle exercise.
AcuteIncrementalExercise;SkeletalMuscle;NO;eNOS;MnSOD;CuZnSOD
G804.7 Document code:A Article ID:1001-9154(2016)03-0111-05
国家自然科学基金资助项目“线粒体蛋白输入(PIM)的运动适应与调控机制研究”(31171142);浙江省教育厅资助项目“运动诱导自噬信号通路调控骨骼肌质量变化研究”(Y201328990);杭州师范大学博士启动金“运动诱导自噬信号通路调控骨骼肌质量变化研究”(PE13002004028)。
王平,副教授,博士后,主要研究方向:骨骼肌运动适应与信号调控。E-mail:wppa7476@163.com。
1.杭州师范大学体育与健康学院,浙江 杭州 311121;2. National Institute of Complementary Medicine, University of Western Sydney, Penrith, New South Wales 2751, Australia;3.华东师范大学青少年健康评价与运动干预教育部重点实验室,上海 200241;4.华东师范大学体育与健康学院,上海 200241 1. School of Physical Education and Health,Hangzhou Normal University,Hangzhou Zhejiang 311121;2. National Institute of Complementary Medicine, University of Western Sydney, Penrith, New South Wales 2751, Australia;3.Key Laboratory of Adolescent Health Assessment and Exercise Intervention Ministry of Education,East China Normal University,Shanghai 200241;4.School of Physical Education and Health,East China Normal University, Shanghai 200241
2015-09-24
2016-03-11
G804.7
A
1001-9154(2016)03-0116-06

